三角帆蚌Hyriopsis cumingii隶属于蚌科Unionidae、珠蚌亚科Unioninae、帆蚌属Hyriopsis,是中国特有种,也是中国主要的淡水优质育珠蚌之一[1]。三角帆蚌钩介幼虫的变态发育需要寄生到合适的寄主鱼上,从寄主鱼体摄取营养物质变态发育成稚蚌,脱落后营底栖生活[2-3]。研究表明,三角帆蚌钩介幼虫在黄颡鱼Pelteobagrus fulvidraco[4]、草鱼Ctenopharyngodon idellus[5]、尼罗罗非鱼Oreochromis niloticus[6]上的寄生效果较好。
Reuling[7]研究指出,寄主鱼的血液营养成分和机体免疫反应可能是钩介幼虫能否变态成功的决定性因素。在钩介幼虫寄生过程中,寄主鱼的蛋白质、脂肪和碳水化合物对其发育起到非常重要的作用[8]。对淡水蚌类钩介幼虫变态发育的寄主特异性已有较多研究[9-10],寄生对寄主鱼营养指标的研究仅见本课题组对三角帆蚌钩介幼虫寄生对罗非鱼血浆生化指标的研究[6],初步揭示了寄主鱼血浆的主要营养成分变化规律,以及对三角帆蚌钩介幼虫寄生胁迫对黄颡鱼耗氧率和排氨率的影响进行过研究[11],结果表明,寄生胁迫对黄颡鱼耗氧率未产生显著影响,而寄主鱼排氨率显著增加,且钩介幼虫寄生数量与排氨率的增加存在正相关性,表明寄生导致寄主鱼含氮物质代谢增加。
基于以上研究,本研究中用三角帆蚌钩介幼虫感染黄颡鱼,测定寄主鱼血浆、肝脏和肌肉组织中糖原、游离脂肪酸、总蛋白、总游离氨基酸的变化,探索钩介幼虫寄生对寄主鱼营养指标的影响,为筛选幼虫变态发育关键营养因子提供理论参考。
1 材料与方法
1.1 材料
2014年9月于江苏太湖采集三角帆蚌亲本500只,暂养于淡水渔业研究中心试验池塘,从3月中旬开始每10 d检查雌蚌外鳃丝是否有成熟钩介幼
虫。试验用寄主鱼为黄颡鱼,取自江阴市申港三鲜养殖公司,选择规格相似、体格健壮、体表无伤的鱼作为试验材料,体质量为(60.9±2.7)g。寄生前在循环控温养殖系统中暂养1 周,养殖用水为充分曝气的自来水,养殖系统水温为(24.0±0.5) ℃,每日早中晚各投喂黄颡鱼配合饲料一次,每晚用虹吸法将底部污物吸出,试验前停喂24 h。
1.2 方法
1.2.1 寄生处理 挑选成熟的孕育蚌30只,清洗蚌壳表面的青苔和污物后,按照白志毅等[5]的方法采苗寄生。取120尾黄颡鱼随机平分为对照组和寄生组,每组设3个重复,每个重复20尾,对照组不感染钩介幼虫,寄生组感染钩介幼虫。分别放入循环控温养殖系统50 L的玻璃缸中暂养,每天观察黄颡鱼的存活情况,发现死鱼及时清理。试验开始后在寄生前期(2 d)、寄生中期(5 d)和稚贝脱落后(12 d),从每个重复随机取3尾鱼,每组共9尾鱼,分别从尾静脉采血,用肝素(Heparin)抗凝,将血液在4 ℃下以2500 r/min 离心15 min,取上清液于-70 ℃下保存待测,同时取肝脏和背部肌肉,于-70 ℃下冷冻保存。以不感染钩介幼虫的黄颡鱼组作空白对照,与寄生组平行取样。
1.2.2 主要营养指标的测定 取各时间点血浆、肝脏、肌肉样品,测定糖原(glycogen,Gn)、游离脂肪酸(free fatty acid,NEFA)、总蛋白(total protein,TP)和总游离氨基酸(total amino acid,T-AA)含量,Gn(A043)、NEFA(A042)、TP(A045-1)、T-AA(A026),均采用南京建成生物工程研究试剂盒进行测定。
1.3 数据处理
试验数据运用 SPSS 11.0软件进行单因素方差分析,采用Independent-samples T test法进行两组间比较,采用LSD法进行组间多重比较。
2 结果与分析
2.1 钩介幼虫寄生对鱼组织糖原的影响
从表1可见:在黄颡鱼肝脏中,对照组糖原含量在寄生中期(5 d)、寄生后期(12 d)显著低于寄生前期(2 d)(P<0.05),寄生中期与寄生后期间无显著性差异(P>0.05);寄生组在寄生中期、寄生后期显著低于寄生前期(P<0.05),且寄生后期显著低于寄生中期(P<0.05);寄生组与对照组在3个时间点糖原含量均无显著性差异(P>0.05),推测对照组与寄生组肝脏中糖原降低的原因可能是饥饿导致。在肌肉中,寄生组糖原含量与对照组均无显著性差异(P>0.05)。
表1 钩介幼虫寄生对黄颡鱼肝脏和肌肉中糖原含量的影响
Tab.1 Impact of parastic stress by glochidia on glycogen content in liver and muscle in yellow catfish Pelteobagrus fulvidraco
mg/g
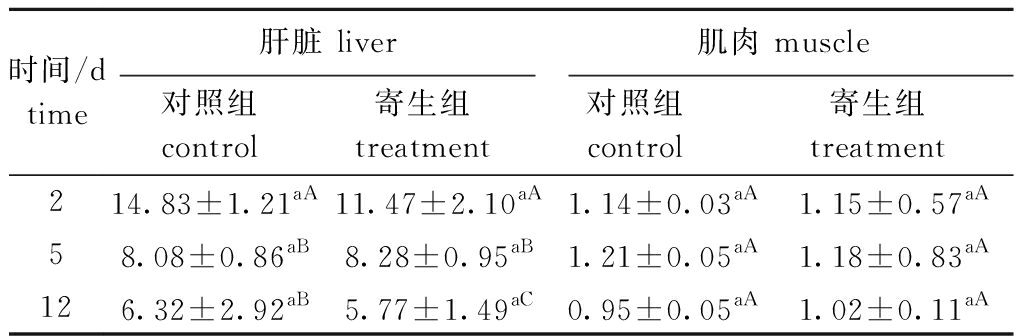
时间/dtime肝脏 liver肌肉 muscle对照组 control寄生组 treatment对照组 control寄生组 treatment214.83±1.21aA11.47±2.10aA1.14±0.03aA1.15±0.57aA58.08±0.86aB8.28±0.95aB1.21±0.05aA1.18±0.83aA126.32±2.92aB5.77±1.49aC0.95±0.05aA1.02±0.11aA
注:同列中标有不同大写字母者表示组间有显著性差异(P<0.05),同行中标有不同小写字母者表示组间有显著性差异,(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different capital letters within the same column are significantly different in the groups (P<0.05),the means with different letters within the same line being significantly different in the groups(P<0.05), and the means with the same letters are not significant differences in the groups(P>0.05), et sequentia
2.2 钩介幼虫寄生对鱼组织游离脂肪酸的影响
从表2可见:在黄颡鱼血浆中,对照组和寄生组游离脂肪酸含量无显著性差异(P>0.05);在肝脏中,对照组游离脂肪酸含量在寄生中期、寄生后期显著增加(P<0.05),但这两个时期之间无显著性差异(P>0.05),而寄生组游离脂肪酸含量在寄生中期显著增加(P<0.05),寄生后期则无明显变化(P>0.05),寄生后期对照组游离脂肪酸含量显著高于寄生组(P=0.022),推测钩介幼虫寄生可能导致肝脏中游离脂肪酸分解加快,含量降低;在肌肉中,寄生组游离脂肪酸含量与对照组均无显著性差异(P>0.05)。
2.3 钩介幼虫寄生对鱼组织总蛋白的影响
从表3可见:在黄颡鱼血浆中,寄生组与对照组总蛋白含量均无显著性差异(P>0.05);在肝脏中,寄生组、对照组总蛋白含量在寄生中期、寄生后期显著下降(P<0.05),但这两个时期间无显著性差异(P>0.05),同一时间点下寄生组与对照组间无显著性差异(P>0.05);在肌肉中,寄生组总蛋白含量与对照组均无显著性差异(P>0.05)。
2.4 钩介幼虫寄生对鱼组织游离氨基酸的影响
从表4可见:在黄颡鱼血浆中,对照组、寄生组总游离氨基酸含量在寄生中期、寄生后期均显著高于寄生前期(P<0.05),而寄生组寄生前期与对照组无显著性差异(P>0.05),寄生中期、寄生后期均显著低于对照组(P<0.05);在肝脏中,对照组、寄生组在不同时间点游离氨基酸含量均无显著性差异(P>0.05),寄生组在寄生前期、中期与对照组间无显著性差异(P>0.05),寄生后期则显著低于对照组(P<0.05);在肌肉中,寄生组游离氨基酸含量与对照组无显著性差异(P>0.05)。
表2 三角帆蚌钩介幼虫寄生对黄颡鱼血浆、肝脏和肌肉游离脂肪酸含量的影响
Tab.2 Effect of parastic stress by glochidia on levels of free fatty acids in plasma,liver and muscle in yellow catfish Pelteobagrus fulvidraco
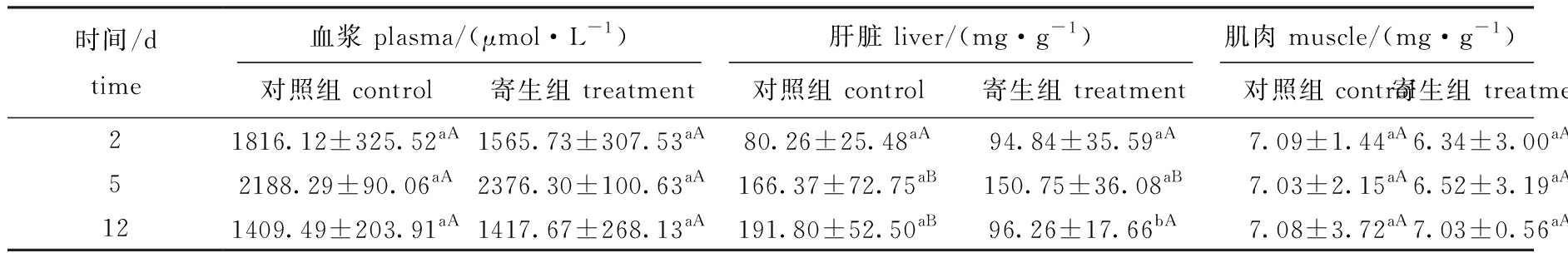
时间/dtime血浆 plasma/(μmol·L-1)肝脏 liver/(mg·g-1)肌肉 muscle/(mg·g-1)对照组 control寄生组 treatment对照组 control寄生组 treatment对照组 control寄生组 treatment21816.12±325.52aA1565.73±307.53aA80.26±25.48aA94.84±35.59aA7.09±1.44aA6.34±3.00aA52188.29±90.06aA2376.30±100.63aA166.37±72.75aB150.75±36.08aB7.03±2.15aA6.52±3.19aA121409.49±203.91aA1417.67±268.13aA191.80±52.50aB96.26±17.66bA7.08±3.72aA7.03±0.56aA
表3 三角帆蚌钩介幼虫寄生对黄颡鱼血浆、肝脏和肌肉中总蛋白含量的影响
Tab.3 Effect of parastic stress by glochidia on total protein level in plasma,liver and muscle in yellow catfish Pelteobagrus fulvidraco
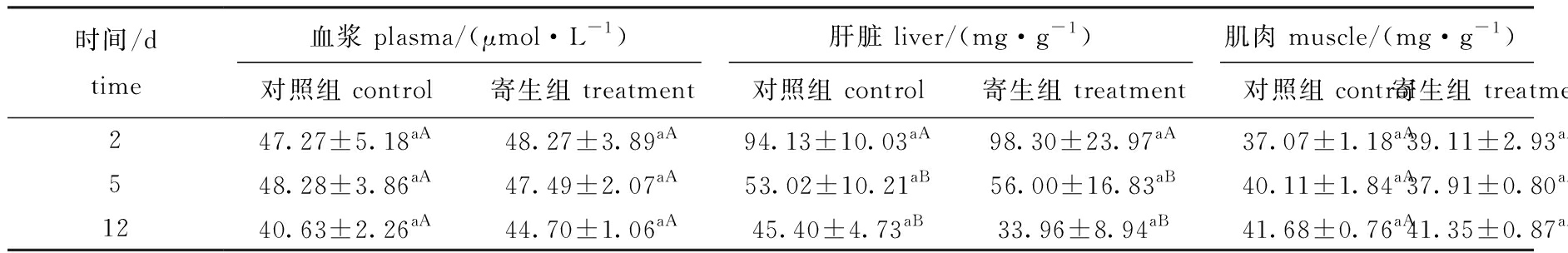
时间/dtime血浆 plasma/(μmol·L-1)肝脏 liver/(mg·g-1)肌肉 muscle/(mg·g-1)对照组 control寄生组 treatment对照组 control寄生组 treatment对照组 control寄生组 treatment247.27±5.18aA48.27±3.89aA94.13±10.03aA98.30±23.97aA37.07±1.18aA39.11±2.93aA548.28±3.86aA47.49±2.07aA53.02±10.21aB56.00±16.83aB40.11±1.84aA37.91±0.80aA1240.63±2.26aA44.70±1.06aA45.40±4.73aB33.96±8.94aB41.68±0.76aA41.35±0.87aA
表4 三角帆蚌钩介幼虫寄生胁迫对黄颡鱼血浆、肝脏和肌肉中游离氨基酸含量的影响
Tab.4 Effect of parastic stress by glochidia on total amino acid level in plasma,liver and muscle in yellow catfish Pelteobagrus fulvidraco
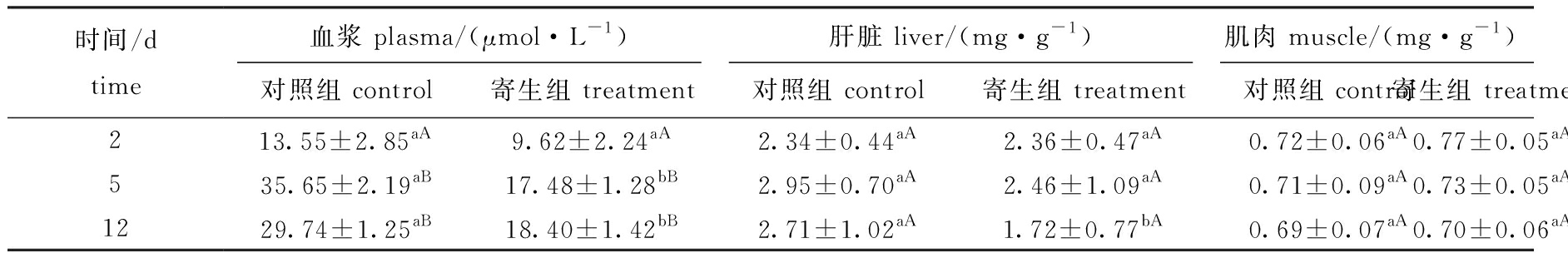
时间/dtime血浆 plasma/(μmol·L-1)肝脏 liver/(mg·g-1)肌肉 muscle/(mg·g-1)对照组 control寄生组 treatment对照组 control寄生组 treatment对照组 control寄生组 treatment213.55±2.85aA9.62±2.24aA2.34±0.44aA2.36±0.47aA0.72±0.06aA0.77±0.05aA535.65±2.19aB17.48±1.28bB2.95±0.70aA2.46±1.09aA0.71±0.09aA0.73±0.05aA1229.74±1.25aB18.40±1.42bB2.71±1.02aA1.72±0.77bA0.69±0.07aA0.70±0.06aA
3 讨论
3.1 钩介幼虫寄生对寄主鱼肝脏、肌肉中糖原的影响
鱼类体内的碳水化合物主要以糖原形式存在于肝脏和肌肉中,测定肝糖原与肌糖原的变化能够反映鱼体的能量代谢规律及自身能源物质的利用情况[8]。研究表明,鱼类在饥饿时其糖原分解代谢明显提高[12]。肝脏是中间代谢的主要器官,在饥饿条件下,肝脏内储藏的脂肪和糖原被消耗,导致肝脏的体积和重量减小,肝指数下降[13-14]。许氏平鲉Sebastes schlegeli幼鱼饥饿10~15 d后,肝糖原极显著下降,同时肌糖原也出现相似的变化,下降明显[15]。本试验中,寄生组与对照组在寄生中期(5 d)、寄生后期(12 d)肝糖原显著下降,但在同一取样时间两组无显著性差异,表明寄生胁迫未对寄主鱼肝糖原和肌糖原含量产生显著影响,而肝糖原显著下降,可能与试验鱼在饥饿胁迫下的能量供给有关。
3.2 寄主鱼血浆、肝脏、肌肉中游离脂肪酸的变化
当肌肉活动所需能源肝糖消耗量较大时,组织中脂肪会分解中性脂肪成为游离脂肪酸来充当能源使用[16]。国内外学者对寄生虫寄生寄主后,寄主血浆游离脂肪酸的变化研究较少,而对脂类代谢中甘油三酯(Triacylglycerol,TAG)、胆固醇及高密度脂肪酸和低密度脂肪酸的研究较多[16-17]。以甘油三酯形式存储的脂肪酸是禁食鱼类能量需求的主要来源之一[18]。闻海波等[6]研究显示,钩介幼虫寄生导致罗非鱼血浆中甘油三酯显著下降,并推测可能是分解为甘油和脂肪酸。Gatenby等[19]认为,影响刚脱落稚贝成活率的限制因子可能是多不饱和脂肪酸。本试验结果显示,在寄生后期,寄生组肝脏中游离脂肪酸显著低于对照组,血浆与肌肉中无显著变化,推测寄主鱼肝脏中游离脂肪酸被分解转运至血液中,保持血液中较高浓度,从而满足钩介幼虫寄生变态发育营养需求。游离脂肪酸可能是钩介幼虫变态发育的关键因子之一。这与马学艳[20]的研究结果一致。
3.3 寄主鱼血浆、肝脏、肌肉中总蛋白、游离氨基酸的变化
蛋白质为生物大分子,不能被寄生的钩介幼虫变态、发育直接利用。寄主鱼体内蛋白要先分解为短肽或氨基酸,才能继续氧化分解、转化或被寄生的钩介幼虫摄取[21]。氨基酸的最大吸收率与血液中氨基酸的浓度有关[22]。通过研究3种寄生蜂:澳洲赤眼蜂Trichogramma confusum Viggiani、松毛虫赤眼蜂T.dendrolimi Matsumura和玉米螟赤眼蜂T.ostriniae寄生对米娥卵Corcyra cephalonica Stainton氨基酸含量的影响,表明未被寄生的米娥卵内游离氨基酸总量是逐渐降低的,而被寄生的卵则出现先上升后下降的变化[23]。菜蛾盘绒茧蜂Cotesia vestalis寄生小菜蛾Plutella xylostella之后,经离子色谱法测定菜蛾血淋巴中游离氨基酸的变化,结果表明,小菜蛾幼虫血淋巴中游离氨基酸总量显著增加,推测是由菜蛾盘绒茧蜂寄生诱导所致[24]。本试验结果表明,血浆及肌肉中总蛋白含量无显著变化,肝脏中总蛋白含量在寄生中期显著减少,血浆中游离氨基酸含量显著增加,但同一时间寄生组显著低于对照组,而对照组肝脏中游离氨基酸含量在寄生后期显著降低,这表明钩介幼虫在寄生期间从寄主鱼血浆中摄取大量的游离氨基酸。因此,推测蛋白分解产物(短肽或氨基酸)是钩介幼虫变态发育必需的营养因子。但本试验中未对血浆中游离氨基酸的种类进行定量分析,究竟哪些氨基酸是幼虫变态发育的限制因子还有待进一步研究。
3.4 寄主鱼能量代谢规律
鱼体在单位时间内消耗氧气的摩尔数除以排出氨氮的摩尔数值定义为O∶N,能够反映鱼体生命过程中的能量来源情况[25]。Mayzand[26]认为,完全以蛋白质氧化供能时O∶N值为7~10;Iieda[27]认为,以蛋白质和脂肪供能时O∶N值为24左右,随着脂类和碳水化合物被利用比例的增高,其O∶N值逐渐增大[28]。根据杜兴伟等[11]研究结果,未寄生组O∶N值介于49.82~72.52之间,轻度寄生组与重度寄生组在幼虫脱落前,O∶N值均显著下降至最低,分别为29.64、27.22,接近于蛋白质和脂肪功能的比值24。本试验结果显示,寄生胁迫导致黄颡鱼肝脏游离脂肪酸含量显著下降,肝脏总蛋白、血浆及肝脏中游离氨基酸含量显著降低,表明寄生胁迫会消耗鱼体部分蛋白质、脂肪,这可能是导致寄生组鱼O∶N值比对照组低的原因,本试验结果进一步验证了呼吸代谢变化规律。