海藻营养物质丰富,是人类重要的食物来源之一,因其含有的色素、脂肪酸、多糖、酚等活性物质具有抗氧化、抗菌、免疫调节等多种生物学功能,已成为生产保健食品、水产饲料及药品等重要的天然原材料[1-5]。中国海域广阔,海藻资源丰富,现已形成包括水产养殖、藻胶工业、化工医药生产及化肥饲料工业等在内的海藻生物技术产业链[6]。目前,中国海藻产品总产量快速增长,生产结构正从品种单一向品种多样化转变,但其中仍是海带产品“一家独大”,其次是江蓠、裙带菜、紫菜,而其产量均远低于海带[7]。从海藻产业发展来看,还需在品种多样性、产品功能性等方面深入开发,以促进产业结构的调整与升级。
游离氨基酸(free amino acids,FAA)以游离态形式存在于生物体中,是海藻重要的营养成分之一,也是海藻呈现独特风味的重要评价指标[8-11]。除了常规氨基酸种类外,海藻中还含有微量游离态的牛磺酸、γ-氨基丁酸、羟(基)脯氨酸、瓜氨酸等非蛋白质氨基酸活性成分[12]。有研究表明,游离氨基酸作为金属自由离子的螯合剂为胁迫条件下的海藻提供保护[13]。游离氨基酸虽有着重要的生物学功能,但与海藻总氨基酸含量相比,这一营养指标经常被忽略,从而影响对海藻营养的全面评价。绿藻(石莼Ulvalactuca)、红藻(日本马泽藻Mazzaella japonica、石花菜Gelidium amansii)和褐藻(海蒿子Sargassum pallidum),是黄渤海沿岸常见的野生海藻种类,其中,石莼和海蒿子主要用于饲料、肥料、药用和工业原料等,石花菜则是制造琼胶的主要原料,日本马泽藻可作为蔬菜食用[14]。本研究中,对这4种野生海藻游离氨基酸进行分析评价,旨在为反映其食用品质与商业价值,以及为海藻新经济种类开发提供基础营养学数据。
1 材料与方法
1.1 材料
试验用海藻样品均于2015年7月初采自山东
省荣成市宁津镇楮岛湾海域,海蒿子(整株粉碎,包含多年木质茎和新生藻体)、日本马泽藻和石花菜采自潮间带,石莼采自海带养殖筏架上。样品经过表面清理、晾晒、烘干、粉碎,过120目筛待用。
三氯乙酸、磷酸氢二钠、氢氧化钠、乙腈和甲醇等试剂购自国药集团药业股份有限公司,前3种为分析纯,后2种为色谱级;氨基酸标准品、OPA购自安捷伦公司,色谱级。
1.2 方法
1.2.1 样品处理 游离氨基酸样品处理参照 GB/T22729.5—2008的方法[15]。称取0.2~0.4 g海藻样品,加入10 mL 5%三氯乙酸摇匀,静置2 h,加水定容至25 mL,混匀后取部分上清液于10 mL离心管,加入少许活性炭脱色,以12 000 r/min离心10 min,经0.22 μm微孔滤膜过滤,置于棕色进样瓶中,用于游离氨基酸的检测。
1.2.2 游离氨基酸的高效液相色谱(HPLC)分析 色谱柱为 Agilent ZORBAX Eclipse AAA 4.6 ×150 mm;柱温为40 ℃;荧光检测器激发波长为340 nm,检测波长为450 nm;流动相A,40 mmol/L Na2HPO4用10 mol/L NaOH溶液调节pH至7.8;流动相B,CH3CN∶MeOH∶H2O=45∶45∶10(体积比);流速为2 mL/min。采用Agilent 1260HPLC自动进样器,对氨基酸标准品和样品中的氨基酸进行OPA在线衍生,采用安捷伦公司提供的快速、准确、灵敏、重现性好的HPLC氨基酸分析方法,对标准品及样品进行16种氨基酸的检测。每个样品平行测定3次。
1.3 数据处理
本试验中所有测定数据均以平均值±标准差表示。采用SPSS 15.0软件进行单因素方差分析(One-way ANOVA)和Tukey多重比较,显著性水平设为0.05。
2 结果与分析
2.1 海藻游离氨基酸含量比较
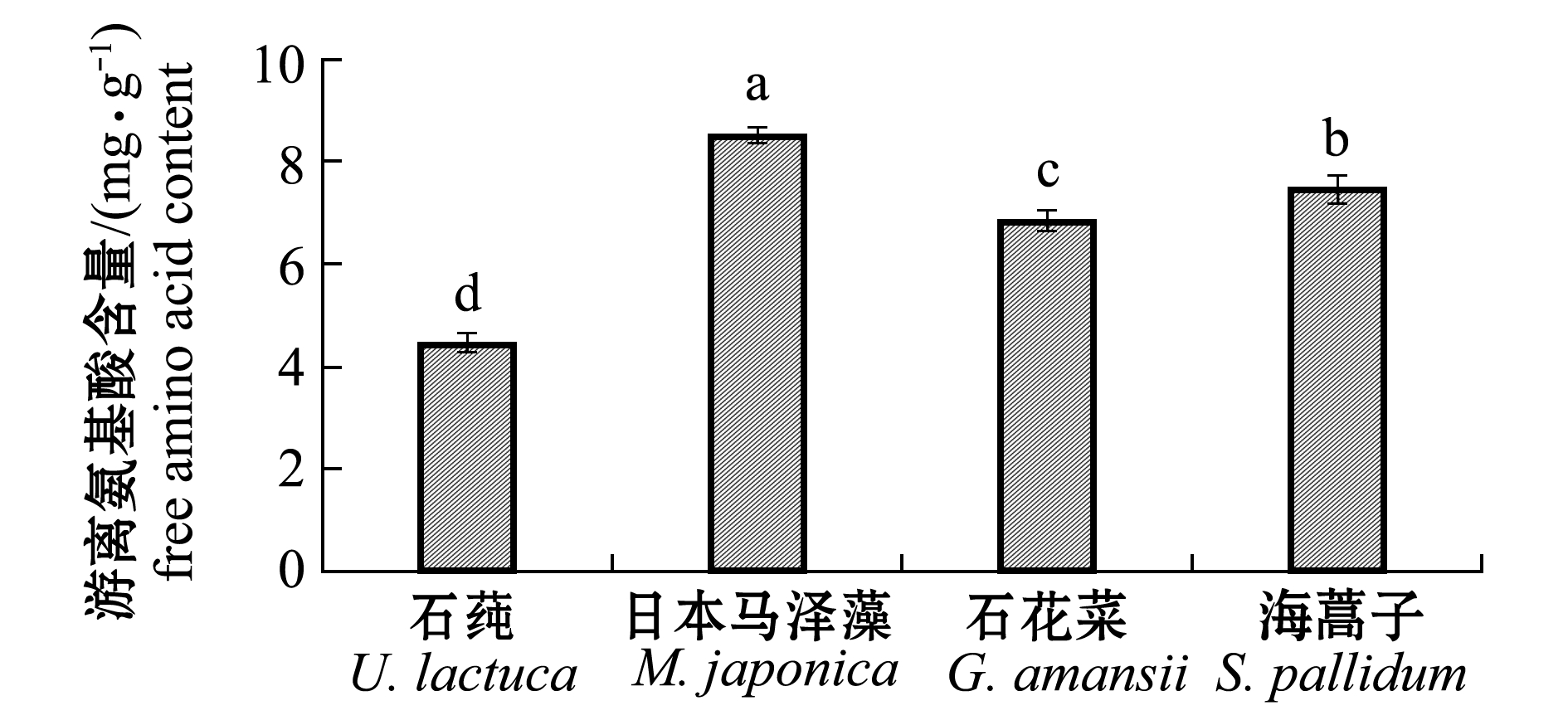
本研究中检测到的海藻氨基酸种类包括苏氨酸(Thr)、缬氨酸(Val)、蛋氨酸(Met)、苯丙氨酸(Phe)、赖氨酸(Lys)、异亮氨酸(Ile)和亮氨酸(Leu) 7种必需氨基酸(essential amino acids,EAA),以及组氨酸(His)、精氨酸(Arg)、天门冬氨酸(Asp)、谷氨酸(Glu)、酪氨酸(Tyr)、丝氨酸(Ser)、甘氨酸(Gly)、丙氨酸(Ala)和胱氨酸(Cys)9种非必需氨基酸(non-essential amino acids,NEAA)。由于方法的限制未能检出色氨酸(Try),氨基酸的HPLC分析图谱见文献[16]。游离氨基酸含量(FAA)以16种氨基酸的总和计。4种野生海藻游离氨基酸含量比较见图1。游离氨基酸含量排序以日本马泽藻最高(8.50 mg/g),其次是海蒿子(7.45 mg/g)和石花菜(6.84 mg/g),石莼最低(4.45 mg/g)。4种海藻的游离氨基酸含量相互间有显著性差异(P<0.05)。
注:标有不同小写字母者表示海藻间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters are significant differences among seaweeds at the 0.05 probability level, and the means with the same letters are not significant differences among seaweeds, et sequentia
图1 4种海藻的游离氨基酸含量
Fig.1 Contents of free amino acids in four species of wild seaweeds
2.2 海藻游离氨基酸组成分析
从图2可见:4种海藻的游离氨基酸组成明显不同,石莼、日本马泽藻和石花菜分别以His、Ala和Glu为主,占游离氨基酸的比例分别为55.77%、67.66%、54.93%;Glu在石莼、日本马泽藻中的含量也较丰富,比例分别为15.68%和15.39%,除Glu外,石花菜中Asp和Ala含量也较高,其比例分别为14.85%和11.93%;不同于其他3种海藻以单一氨基酸为主,海蒿子的Glu、Asp和Ala的比例分别为28.12%、26.46%、19.82%;其余氨基酸在4种海藻中所占比例均较低,其中,Val和Phe在石莼中,Phe在石花菜中未被检出。
2.3 海藻呈味氨基酸组成特征
游离氨基酸是海藻重要的风味物质。对4种海藻的呈味氨基酸分析结果表明:日本马泽藻呈味氨基酸以甜味氨基酸(Ser+Gly+Ala)为主,其他3种藻均以鲜味氨基酸(Glu+Asp)为主(图3)。日本马泽藻呈味氨基酸的含量最高(7.60 mg/g),且显著高于其他3种海藻(P<0.05);石花菜和海蒿子的含量分别为6.14、5.75 mg/g,二者无显著性差异(P>0.05),石莼仅为1.40 mg/g。
就呈味氨基酸占游离氨基酸的比例而言,红藻日本马泽藻和石花菜呈味氨基酸的比例分别高达89.37%、89.71%,显著高于海蒿子(77.13%)和石莼(31.53%)(P<0.05)(表1)。

图2 4种海藻的游离氨基酸组成
Fig.2 Compositions of free amino acids in four species of wild seaweeds
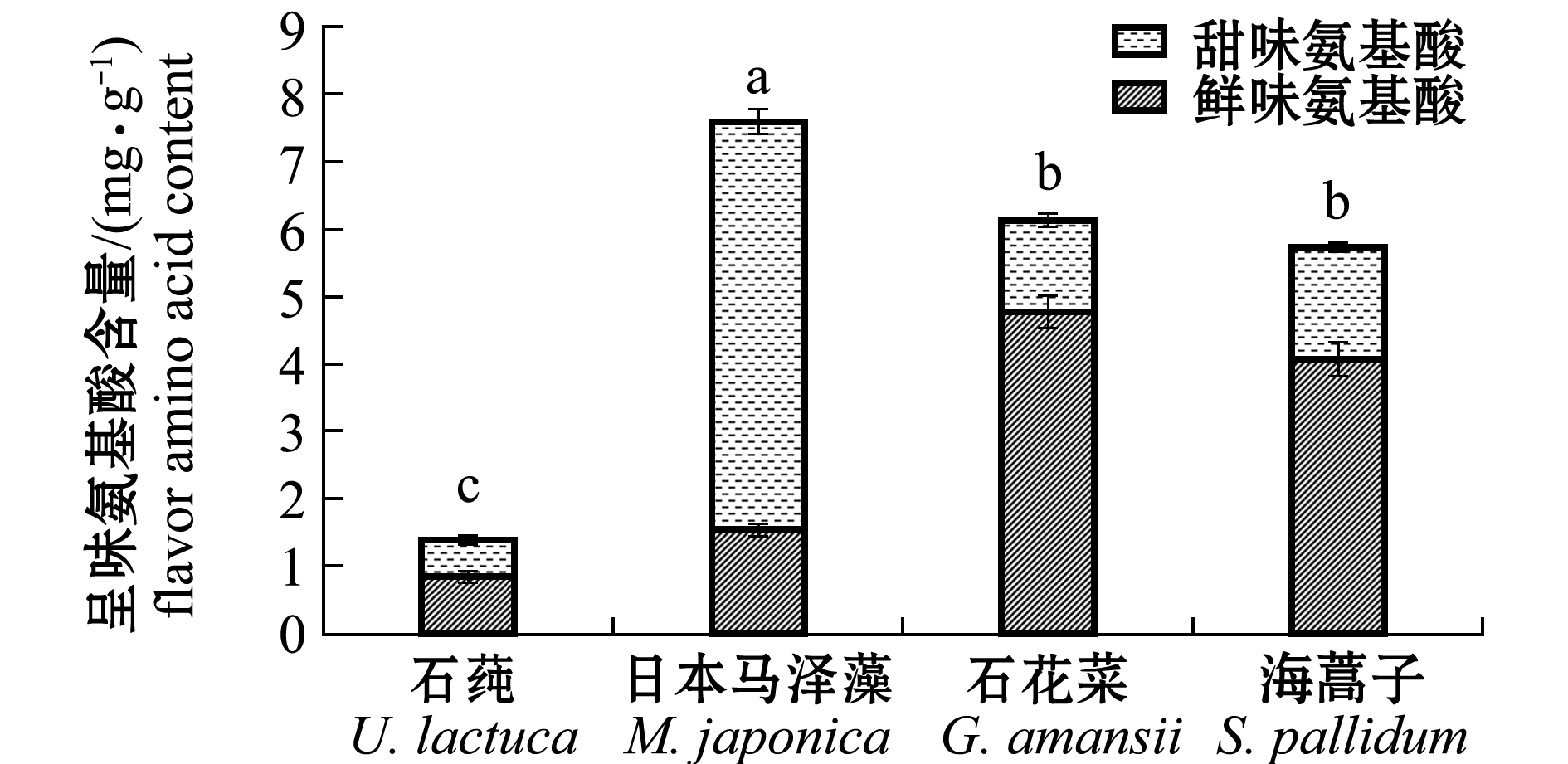
图3 4种海藻呈味氨基酸含量
Fig.3 Contents of flavor amino acids in four species of wild seaweeds
2.4 海藻游离必需氨基酸组成特征
从图2可见,4种海藻的游离必需氨基酸含量较低,且组成明显不同。石莼以Met和Thr为主,二者占必需氨基酸的比例为77.65%;日本马泽藻中Val、Met和Thr丰富,其比例分别为24.14%、23.80%、20.56%;石花菜中Met占必需氨基酸的比例为50.50%,Thr占24.49%;海蒿子中游离必需氨基酸以Leu最为丰富(29.29%),其次是Val(26.39%)和Met(25.09%)。4种海藻游离Lys含量较丰富。游离必需氨基酸含量以日本马泽藻最高(0.78 mg/g),海蒿子次之(0.69 mg/g),石莼最低(0.34 mg/g),海藻间含量差异较大。但必需氨基酸占总游离氨基酸的比例无显著性差异(P>0.05)(图4)。

图4 4种海藻必需氨基酸含量占游离氨基酸的比例
Fig.4 Contents of free EAA and percentages in free amino acids in four species of wild seaweeds
3 讨论
3.1 海藻游离氨基酸的影响因子
游离氨基酸是海藻中的重要风味物质和生物活性成分,发挥着重要的生物学功能。从海藻游离氨基酸比较结果(表1)来看,不同海藻的游离氨基酸含量差异较大,即使是同一种海藻,如海蒿子和羊栖菜,因采样点等因素不同其含量相差可达到1个数量级[12]。除了物种本身带来的游离氨基酸含量差异外,还有季节变化、海水营养条件和氨基酸分析方法等多种因素造成海藻间游离氨基酸的差异。如在海带和条斑紫菜中发现,生长月份和采收时间不同使其游离氨基酸含量和组成明显差异[16-17];低氮、磷胁迫会使坛紫菜叶状体的游离氨基酸含量明显降低,氨基酸种类组成显著变化[18],反之,培养基增加氮+磷营养盐或深海水明显促进条斑紫菜和孔石莼游离氨基酸含量的增加[19-20];有效样品处理方法与分析方法也会促进海藻中色氨酸、牛磺酸、γ-氨基丁酸、瓜氨酸等游离态氨基酸的检出[11-12,21],提高氨基酸营养评价的可靠度。
3.2 海藻游离氨基酸组成的比较
对游离氨基酸组成以及呈味氨基酸、必需氨基酸所占比例(表1)分析发现,海藻间的游离氨基酸组成差异明显。从游离氨基酸组成来看,Glu、Ala是主要组成种类,Asp、Pro和Arg的比例在一些海藻中也较高,这是海藻呈现独特风味的重要原因;此外,有些藻类游离氨基酸中必需氨基酸或半必需氨基酸的含量也较丰富,如本研究中石莼的His比例达到55.77%,Lys在本次采集的4种海藻和野生坛紫菜[23]中含量丰富,Phe在V.lanosa、海蒿子、鼠尾藻等藻中占有较高的比例[11-12]。从分类氨基酸的比例来看,绿藻、红藻和褐藻中除少量样品其呈味游离氨基酸的含量较低外,海藻中呈味氨基酸是游离氨基酸的主要组成部分,但鲜味氨基酸和甜味氨基酸的比例因藻而异。相反,必需氨基酸在海藻游离氨基酸中的比例普遍较低,但在海带、海蒿子、羊栖菜、鼠尾藻和野生坛紫菜等海藻样品中比例较高,最高比例占游离氨基酸量的一半以上[12]。研究表明,海藻的游离必需氨基酸组成存在明显的差异,而且许多海藻存在某些必需氨基酸种类缺乏甚至游离必需氨基酸全部未检出的现象[11]。
表1 不同海藻游离氨基酸组成的比较
Tab.1 Comparison of free amino acid composition in different species of seaweeds
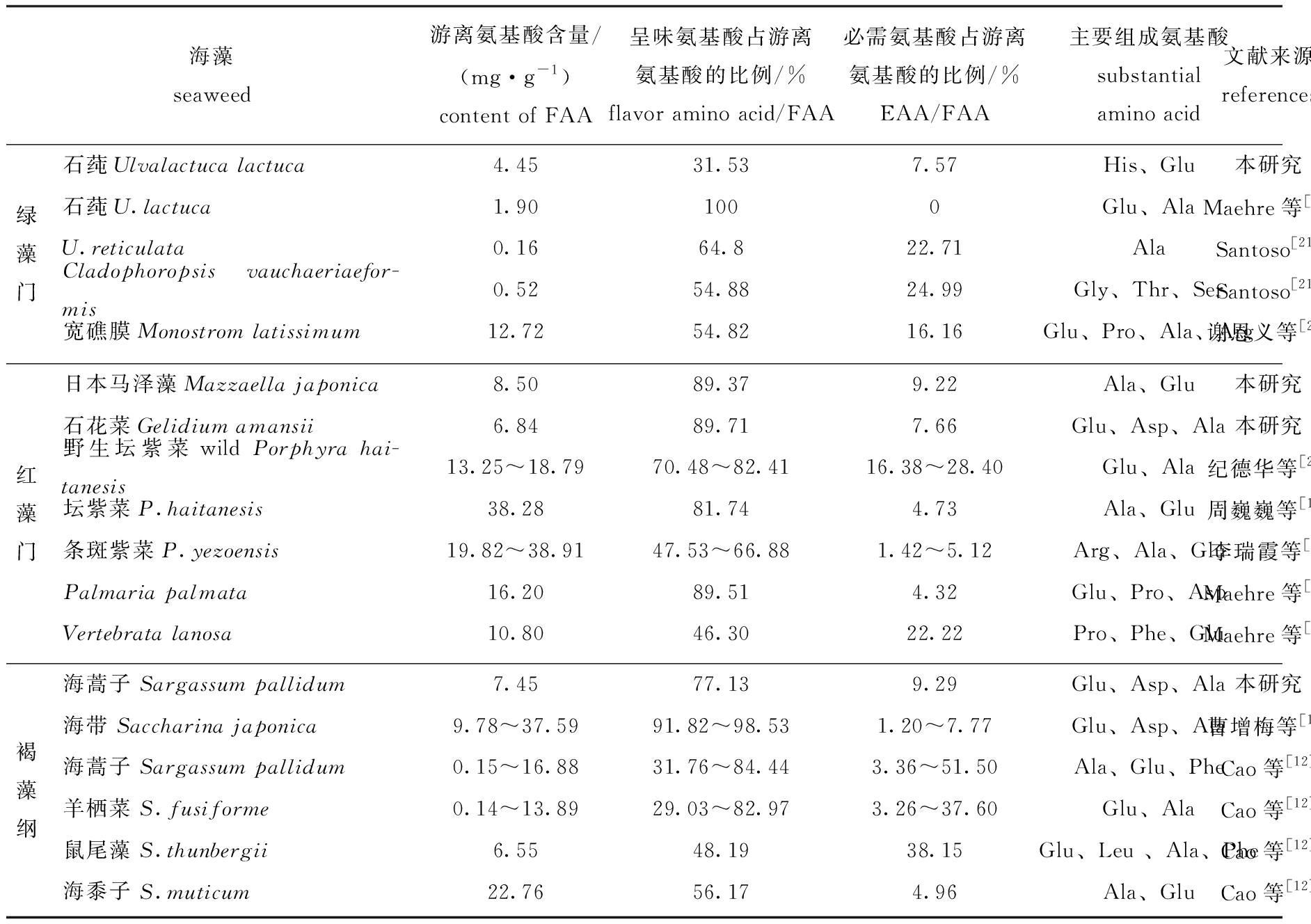
海藻seaweed游离氨基酸含量/(mg·g-1)content of FAA呈味氨基酸占游离氨基酸的比例/%flavor amino acid/FAA必需氨基酸占游离氨基酸的比例/%EAA/FAA主要组成氨基酸substantial amino acid文献来源references绿藻门石莼Ulvalactuca lactuca4.4531.537.57His、Glu本研究石莼U.lactuca1.901000Glu、AlaMaehre等[11]U.reticulata0.1664.822.71AlaSantoso[21]Cladophoropsis vauchaeriaefor-mis0.5254.8824.99Gly、Thr、SerSantoso[21]宽礁膜Monostrom latissimum12.7254.8216.16Glu、Pro、Ala、Arg谢恩义等[22]红藻门日本马泽藻Mazzaella japonica8.5089.379.22Ala、Glu本研究石花菜Gelidium amansii6.8489.717.66Glu、Asp、Ala本研究野生坛紫菜wild Porphyra hai-tanesis13.25~18.7970.48~82.4116.38~28.40Glu、Ala纪德华等[23]坛紫菜P.haitanesis38.2881.744.73Ala、Glu周巍巍等[18]条斑紫菜P.yezoensis19.82~38.9147.53~66.881.42~5.12Arg、Ala、Glu李瑞霞等[8]Palmaria palmata16.2089.514.32Glu、Pro、AspMaehre等[11]Vertebrata lanosa10.8046.3022.22Pro、Phe、GluMaehre等[11]褐藻纲海蒿子 Sargassum pallidum7.4577.139.29Glu、Asp、Ala本研究海带 Saccharina japonica9.78~37.5991.82~98.531.20~7.77Glu、Asp、Ala曹增梅等[16]海蒿子 Sargassum pallidum0.15~16.8831.76~84.443.36~51.50Ala、Glu、PheCao等[12]羊栖菜 S.fusiforme0.14~13.8929.03~82.973.26~37.60Glu、AlaCao等[12]鼠尾藻 S.thunbergii6.5548.1938.15Glu、Leu 、Ala、PheCao等[12]海黍子 S.muticum22.7656.174.96Ala、GluCao等[12]
综上所述,针对海藻游离氨基酸的营养价值应用有几方面值得注意:首先,除海带、紫菜等藻类的游离氨基酸含量较高外,海藻中的含量普遍较低,影响其后续开发利用;其次,海藻中的游离氨基酸多以呈味氨基酸为主,必需氨基酸的含量低或者缺乏某些氨基酸种类势必会影响海藻的营养评价;最后,海藻游离氨基酸的含量与组成受到多种因素的复杂影响。基于游离氨基酸的营养价值和重要生物学功能,高游离氨基酸含量和全面均衡营养将是海藻新经济品种开发的一个重要方向。