虹鳟Oncorhynchus mykiss为鲑科Salmonidae、大麻哈鱼属Oncorhynchus的冷水性鱼类,具有生长快、肉质鲜美、营养全面等特点,是联合国粮农组织向世界各国推广的优质养殖品种之一。中国自1959年开始养殖虹鳟,目前,养殖范围已扩大到20多个省、自治区和直辖市,发展十分迅速,随着虹鳟养殖规模的不断扩大,加之养殖户对水质综合调控的重视程度不够,养殖环境条件日趋恶化,各种病害问题接踵而至,严重影响了虹鳟养殖产业的健康发展。
疖疮病(Funmculosis)是鲑鳟养殖过程中常见细菌病之一,鲑鳟疖疮病可分为急性型、亚急性型、慢性Ⅰ型和慢性Ⅱ型,虹鳟患此病时多表现为慢性型或亚急性型[1],患病鱼通常表现为体色发黑、食欲不振、鳍基部充血、皮肤溃疡等症状。疖疮病的病原为杀鲑气单胞菌Aeromonas salmonicida,该菌属气单胞菌科Aeromonadaceae、气单胞菌属Aeromonas[2],是一种不能运动、兼性厌氧的革兰氏阴性菌,其最适生长温度为22~25 ℃,35 ℃以上不生长。该菌地理分布、宿主范围广泛,除鲑科鱼类以外,还能够感染鲤Cyprinus carpio、河鲈Perca fluviatilis、六线鱼Hexagrammos otakii、大菱鲆Scophthalmus maximus、大西洋鳕Gadus morhua、裸盖鱼Anoplopoma fimbria等[3]。目前,国内学界对杀鲑气单胞菌的研究主要集中在杀鲑气单胞菌的分离鉴定、致病性、生长模型、药敏特性等方面[4-6],随着大西洋鲑Salmo salar养殖的兴起,对于杀鲑气单胞菌与宿主间的作用机理和免疫防病基
础理论的研究也逐步开展[7-8]。
2016年6月,山东潍坊某虹鳟养殖场暴发了一起虹鳟皮肤溃疡病,主要外观症状表现为体色发黑、体表溃烂,鳍基部充血发红,少数肛门红肿突出,肠道充血、出血,肾脏肿大。本研究中,从患病鱼病灶处分离获得1株优势菌株,利用常规生理生化和分子生物学方法进行了菌种鉴定,验证了其致病性,并检测分析了其胞外产物特性以及毒力基因的携带情况,旨在为杀鲑气单胞菌的鉴定及其致病机理研究提供参考,并为虹鳟杀鲑气单胞菌病的防控积累数据。
1 材料与方法
1.1 材料
患病虹鳟取自潍坊某虹鳟养殖场,体质量为(160±5)g,体长为(26±2)cm。健康虹鳟取自山东省日照市万泽丰渔业有限公司,体质量为(105±5)g,体长为(20±2)cm。
细菌培养基胰蛋白胨大豆琼脂培养基(Tryptic Soy Agar,TSA)和血平板均购自青岛海博生物有限公司,疖疮病培养基(Furunculosis Agar,FA)购自英国Microgen公司;生理生化鉴定管购自杭州微生物试剂有限公司,细菌快速鉴定板购自美国Biolog公司,细菌DNA提取和PCR试剂盒购自大连宝生物工程有限公司;其他化学试剂和引物均购自上海生工生物工程股份有限公司。
1.2 方法
1.2.1 病原菌的分离 取症状典型的濒死病鱼,无菌条件下从体表肌肉溃疡处、肾脏、肠道等病灶处挑取部分组织,划线于TSA平板上,28 ℃下培养24 h,挑取形态一致的优势菌落进行纯化培养,直至获得纯培养菌,并将培养菌置于超低温冰箱(-80 ℃)中冻存备用。
1.2.2 细菌鉴定
(1)形态学观察。将分离获得的纯培养菌接种于TSA平板和FA平板上,于28 ℃下培养,观察菌落形态和色素产生;挑取处于活跃生长期的单菌落涂片,酒精灯上干燥固定后,进行革兰氏染色,在光学显微镜油镜下观察;同时,取少量菌落, 用25 g/L磷钨酸负染,在透射电镜下观察细菌形态。
(2)常规生理生化鉴定。无菌操作挑取适量菌接种于生理生化鉴定管中,于28 ℃下培养24 h,观察结果。测定的生理生化指标包括氧化酶、精氨酸、赖氨酸、七叶灵、硫化氢、吲哚、V-P试验、甘露醇、肌醇、水杨苷、葡萄糖产气、阿拉伯糖、蔗糖、麦芽糖、半乳糖、β-半乳糖苷酶、NaCl浓度和动力试验等。
(3)Biolog GENⅢ鉴定板。按照说明书要求,将调整好浓度的菌液接种于Biolog GENⅢ鉴定板,于28 ℃下培养48 h,观察结果。
(4)16S rDNA序列分析和系统发育树的构建。挑取单一菌落悬浮于无菌去离子水中,100 ℃下水浴5 min,冷却后在4 ℃条件下以10 000 r/min离心10 min,上清液即为PCR扩增反应的模板。用于16S rDNA基因PCR扩增的引物为通用引物27F和1492R。PCR反应体系(共50 μL):Premix TaqTM (Ex TaqTM Version 2.0 plus dye)25 μL,正、反向引物(10 μmol/L)各2 μL,模板1 μL,ddH2O 20 μL。PCR反应条件为:94 ℃下预变性4 min;94 ℃下循环变性30 s,55 ℃下退火复性30 s,72 ℃下延伸60 s,共进行30个循环;最后在72 ℃下再延伸6 min。PCR产物经琼脂糖电泳确定特异条带后,直接交由上海生物工程技术股份有限公司进行PCR产物的纯化和序列测定。参考陆梦莹等[9]的方法,将测得的序列通过Blast检索和ClustalX 1.8软件比对分析,采用Mega 2.1邻位相连法构建系统发育树,通过自举分析进行置信度检测,自举数集1000次。
1.2.3 人工感染试验
(1)接种菌液的制备。试验菌株于28 ℃下培养24 h后,用0.9%无菌生理盐水洗脱,共洗2次,然后以6000 r/min离心10 min,将沉淀重悬后,细菌浓度为1.5×109 CFU/mL,10倍系列稀释菌悬液至浓度为1.5×108、1.5×107、1.5×106 CFU/mL。
(2)回归感染。试验用健康虹鳟每组10尾,按不同菌悬液浓度分为4个试验组,并设生理盐水对照组,每组设3个重复。养殖水温为(17±1)℃,全天充气,每天换水50%。暂养7 d后,给试验组每尾鱼腹腔注射0.1 mL不同浓度的菌悬液,给对照组每尾鱼注射同体积的0.9%无菌生理盐水。定时观察记录,取濒死鱼的病灶及内脏器官进行细菌再分离和鉴定。按改进的寇氏法计算该菌株的半致死浓度。
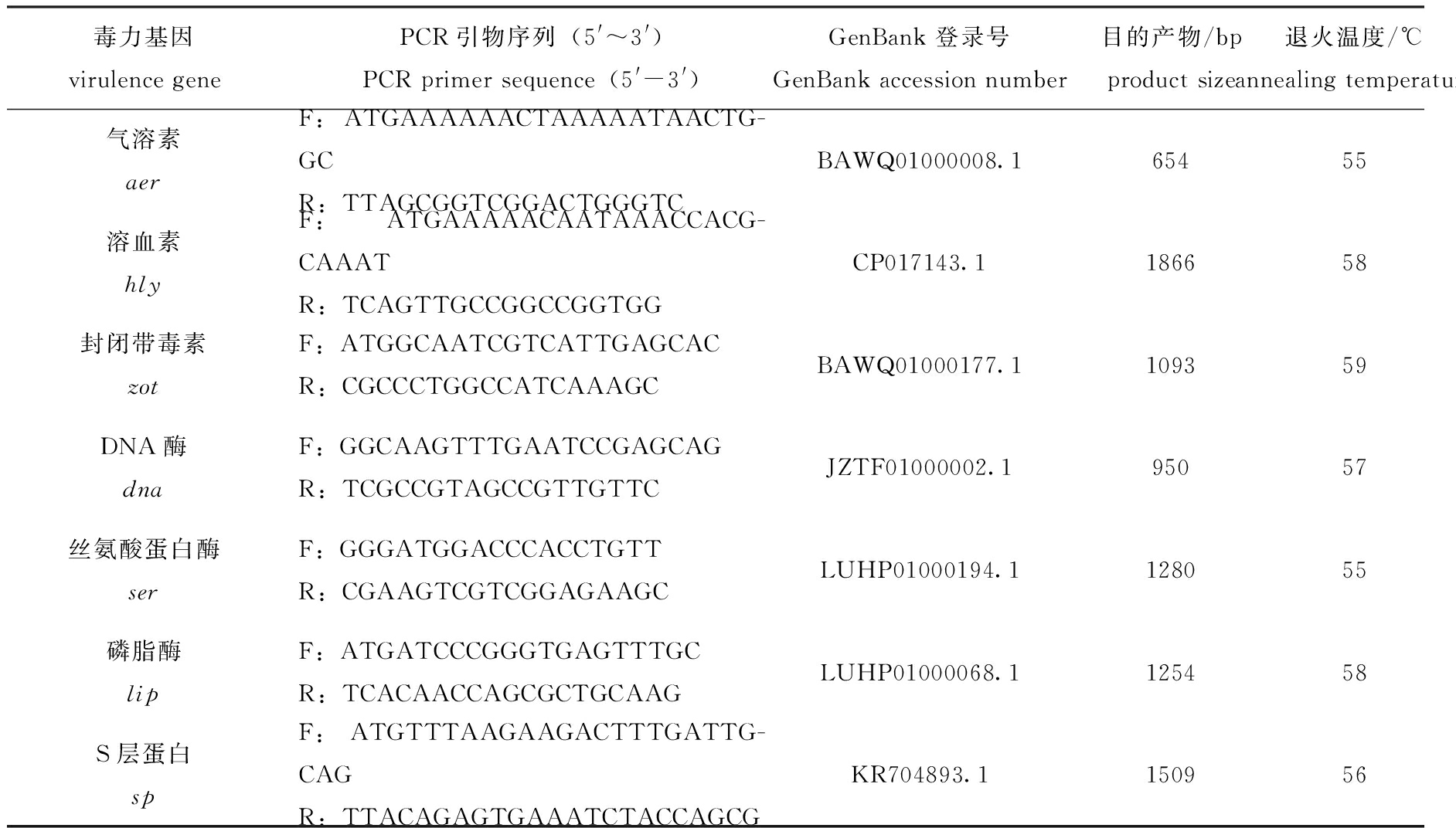
1.2.4 菌株RBWF-1毒力基因检测 采用TaKaRa试剂盒方法提取细菌基因组DNA。参照Reith 等[10]对杀鲑气单胞菌基因组信息中毒力基因的分析,根据GenBank上登录的相应基因序列,分别设计并合成扩增气溶素(aer)、溶血素(hly)、封闭带毒素(zot)、DNA酶(dna)、丝氨酸蛋白酶(ser)、磷脂酶(lip)和S层蛋白(sp)共7种毒力基因的引物,利用PCR检测分离株RBWF-1的毒力基因携带情况,引物序列、扩增基因片段预计大小和退火温度见表1。PCR反应体系(共20 μL):Premix TaqTM (Ex TaqTM Version 2.0 plus dye)10 μL,正、反向引物(10 μmol/L)各1 μL,模板1 μL,ddH2O 7 μL。PCR反应条件为:94 ℃下预变性5 min;94 ℃下变性1 min,55~59 ℃下复性1 min,72 ℃下延伸1.5 min,共进行30个循环;最后在72 ℃下再延伸10 min。用琼脂糖凝胶电泳检测PCR 扩增结果,扩增产物由上海生物工程技术股份有限公司进行TA克隆和测序。
表1 毒力基因检测引物、退火温度和目的产物大小
Tab.1 Primer sequences, annealing temperature and product sizes of virulence genes
毒力基因virulence genePCR引物序列(5'~3')PCR primer sequence(5'-3')GenBank 登录号GenBank accession number目的产物/bpproduct size退火温度/℃annealing temperature气溶素aerF:ATGAAAAAACTAAAAATAACTG-GCR:TTAGCGGTCGGACTGGGTCBAWQ01000008.165455溶血素hlyF:ATGAAAAACAATAAACCACG-CAAATR:TCAGTTGCCGGCCGGTGGCP017143.1186658封闭带毒素zotF:ATGGCAATCGTCATTGAGCACR:CGCCCTGGCCATCAAAGCBAWQ01000177.1109359DNA酶dnaF:GGCAAGTTTGAATCCGAGCAGR:TCGCCGTAGCCGTTGTTCJZTF01000002.195057丝氨酸蛋白酶serF:GGGATGGACCCACCTGTTR:CGAAGTCGTCGGAGAAGCLUHP01000194.1128055磷脂酶lipF:ATGATCCCGGGTGAGTTTGCR:TCACAACCAGCGCTGCAAGLUHP01000068.1125458S层蛋白spF:ATGTTTAAGAAGACTTTGATTG-CAGR:TTACAGAGTGAAATCTACCAGCGKR704893.1150956
1.2.5 胞外产物(ECP)活性分析 利用平板玻璃纸法制备ECP。将菌株RBWF-1划线接种于预先铺好无菌玻璃纸的TSA平板上,于28 ℃下培养24 h,然后用无菌生理盐水清洗菌体,4 ℃条件下以6000 r/min离心20 min,收集上清液,用0.22 μmol/L微孔滤膜过滤后,置于冷冻干燥机内冻干,收集冻干粉末并用适量生理盐水重悬,利用BSA法测定蛋白浓度,用生理盐水调整到浓度为1 mg/mL备用。
参考贺扬等[11]的方法分别制备脱脂奶平板(5%脱脂奶粉)、兔血平板(5%脱纤维兔血)、淀粉平板(0.2%可溶性淀粉)、尿素平板(2%尿素及0.2%酚红)、吐温80(1%吐温80)平板和DNA平板(0.2%DNA及0.01%甲苯胺蓝),采用牛津杯法将制备的ECP分别接种于以上平板,每孔200 μL,于28 ℃下培养24 h 后,观察透明圈产生情况,判断ECP中蛋白酶、溶血素、淀粉酶、脲酶、脂酶和DNA酶产生情况。
2 结果与分析
2.1 病原菌的分离鉴定
2.1.1 病原菌的分离和形态学观察 从濒死病鱼的病灶处,分离获得1株形态、大小一致的优势菌,命名为RBWF-1,其在TSA平板上生长菌落形态为圆形、灰白色,且湿润、细小、边缘光滑,直径约为2 mm;在含0.1%考马斯亮蓝的TSA上为深蓝色菌落;在FA平板上培养48 h以上不产生棕色色素;革兰氏染色鉴定为短杆状、两端钝圆、革兰氏阴性菌(图1-A);扫描电镜下观察,细菌呈短杆状,有的成对或多个成串,无鞭毛,菌体周围生有许多细小的菌毛(图1-B)。
2.1.2 菌株RBWF-1的生理生化特性 常规生理生化测定结果显示:分离菌株RBWF-1呈氧化酶阳性;能利用葡萄糖、蔗糖、麦芽糖、阿拉伯糖、半乳糖、甘露醇、七叶灵、精氨酸和赖氨酸,不能利用肌醇和N-乙酰葡萄糖胺;发酵葡萄糖产酸不产气;吲哚、V-P试验、ONPG试验阳性;不产硫化氢; 加入0、10、30 g/L NaCl菌株生长,加入60、80、100 g/L NaCl菌株不生长,无动力。根据《伯杰氏系统细菌学手册(第九版)》[12]及《鱼类及其他水生动物细菌实用鉴定指南》[12],各项指标经对比,与杀鲑气单胞菌杀日本鲑亚种Aeromonas salmonicida subsp.masoucida相近(表2)。
表2 菌株RBWF-1的生理生化特征
Tab.2 Physiological and biochemical characteristics of strain RBWF-1

特征characteristics菌株RBWF-1strain RBWF-1动力motility -氧化酶oxidase+棕色水溶性色素 brown diffusible pigment-水解七叶灵 esculin hydrolysis+吲哚indole+精氨酸双水解酶 arginine dihydrolase+V-P Voges-Proskauer+葡萄糖产酸glucose-acid+葡萄糖产气glucose-gas-蔗糖sucrose+麦芽糖maltose+水杨苷salicin+D-半乳糖D-galactose+D-甘露醇D-mannitol+L-阿拉伯糖L-arabinose+肌醇inositol-N-乙酰葡萄糖胺 N-acetyl glucosamine assimi-lation-赖氨酸脱羧酶 lysine decarboxylase+硫化氢H2S -β-半乳糖苷酶ONPG+0、10、30 g/L NaCl+60、80、100 g/L NaCl-
注:+为阳性;-为阴性
Note:+, positive;-, negative
利用Biolog自动微生物鉴定系统测定结果显示:菌株可利用的唯一碳源有糊精、甘油、明胶、L-天门冬氨酸、L-谷氨酸、L-组氨酸、D-葡萄糖酸和甲酸;当pH为5及加入40 g/L以上的NaCl时,菌株不生长;菌株对1%乳酸钠、林可霉素、万古霉素、萘啶酸、亚利福霉素、亚碲酸钾不敏感,对盐酸胍、丁酸钠、溴酸钠敏感。系统鉴定该菌株为杀鲑气单胞菌杀日本鲑亚种Aeromonas salmonicida subsp.masoucida,相似度(SIM)为0.516,位距(DIST)为7.223。
2.1.3 16S rDNA基因序列分析与系统发育树构建 扩增获得菌株RBWF-1的16S rDNA基因序列长度为1445 bp,测序后通过NCBI上Blast进行同源性检索,发现其与杀鲑气单胞菌杀日本鲑亚种标准菌株NBRC 13748及杀鲑气单胞菌无色亚种标准菌株NCIMB 1110的16S rDNA基因序列同源性最高,一致性均为99.6%。系统发育树显示,菌株RBWF-1与杀鲑气单胞菌杀鲑亚种、杀日本鲑亚种、无色亚种和史氏亚种聚为一个分支(图2)。结合生理生化各项分类指标测定结果,将菌株RBWF-1鉴定为杀鲑气单胞菌杀日本鲑亚种。
2.2 人工感染试验
将不同浓度的菌液腹腔注射到健康虹鳟体内,在感染2 d后,注射菌液浓度为1.5×109 CFU/mL和1.5×108 CFU/mL的鱼开始出现死亡,感染7 d后死亡率达到100%(表3)。被感染鱼体腹鳍基部充血发红、肛门突出、肌肉出血、肠道出血,与原始发病鱼体症状一致(图3),而对照组未表现出任何症状。从人工感染发病濒死虹鳟的肾脏处重新分离菌株,其形态和生理生化鉴定结果与菌株RBWF-1一致,因此,认为分离菌株RBWF-1是虹鳟皮肤溃疡病的致病菌。根据寇氏法测定其半数致死浓度(LD50),其计算公式为
lg(LD50)=Xk-d(∑Pi-0.5)。
其中:Xk为最大剂量对数;d为相邻两组剂量对数之差数;Pi为死亡率,i为组号。经计算:
lg(LD50)=lg(1.5×109)-1×(1+1+0.633+
0.3-0.5)=6.743,
LD50=5.5×106 CFU/mL。
这表明,RBWF-1为较强毒力的菌株。
2.3 菌株RBWF-1 毒力基因的 PCR检测
依据GenBank上登录的杀鲑气单胞菌主要毒力基因序列,设计并合成了扩增aer、hly、zot、dna、ser、lip和sp 7种毒力基因的引物,以提取的菌株RBWF-1基因组DNA为模板,进行PCR扩增,经琼脂糖电泳结果显示,RBWF-1中携带以上7种毒力基因,产物大小分别为654、1866、1093、950、1280、1254、1503 bp,除了sp产物片段与预期目的片段大小相差6个碱基外,其他产物片段均与目的基因片段大小一致(图4)。将TA克隆测序获得的序列通过Blast比对,发现这7种毒力基因与杀鲑气单胞菌(菌株S68、S121和A449)序列一致性为99%~100%。

注:A为革兰氏染色照片;B为扫描电镜照片
Note: A, gram staining micrograph; B, scanning electron micrography
图1 菌株RBWF-1形态观察
Fig.1 Morphological observation of strain RBWF-1

图2 基于16S rDNA序列构建的系统发育树
Fig.2 Phylogenetic tree of Aeromonas species based on 16S rDNA sequences
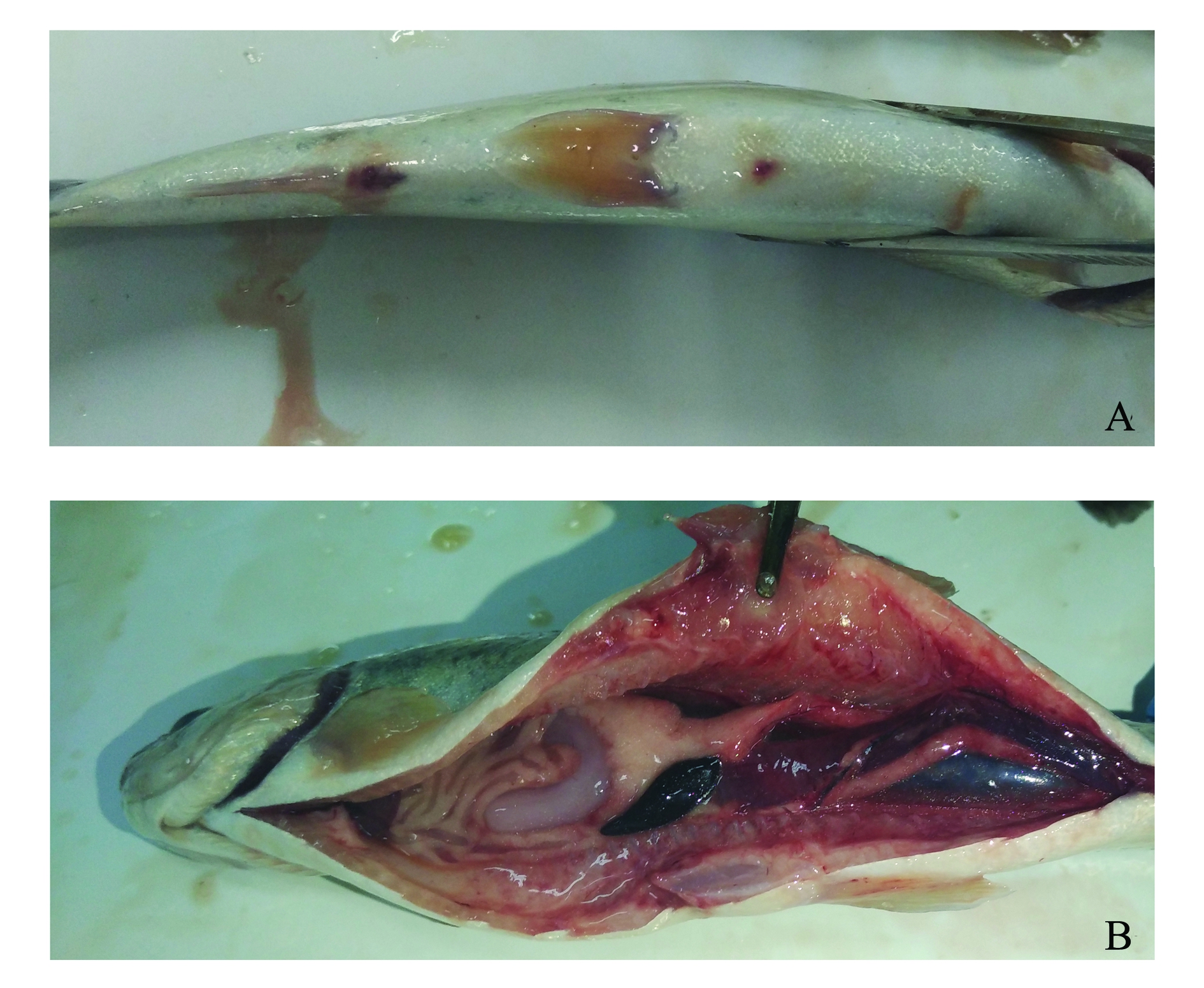
注:A为外观症状;B为内脏器官症状
Note:A,exterior symptoms;B,symptoms of visceral organs
图3 虹鳟感染杀鲑气单胞菌菌株RBWF-1后的外观及内脏器官症状
Fig.3 Symptoms of exterior and visceral organs of rainbow trout Oncorhynchus mykiss infected with Aeromonas salmonicida strain RBWF-1
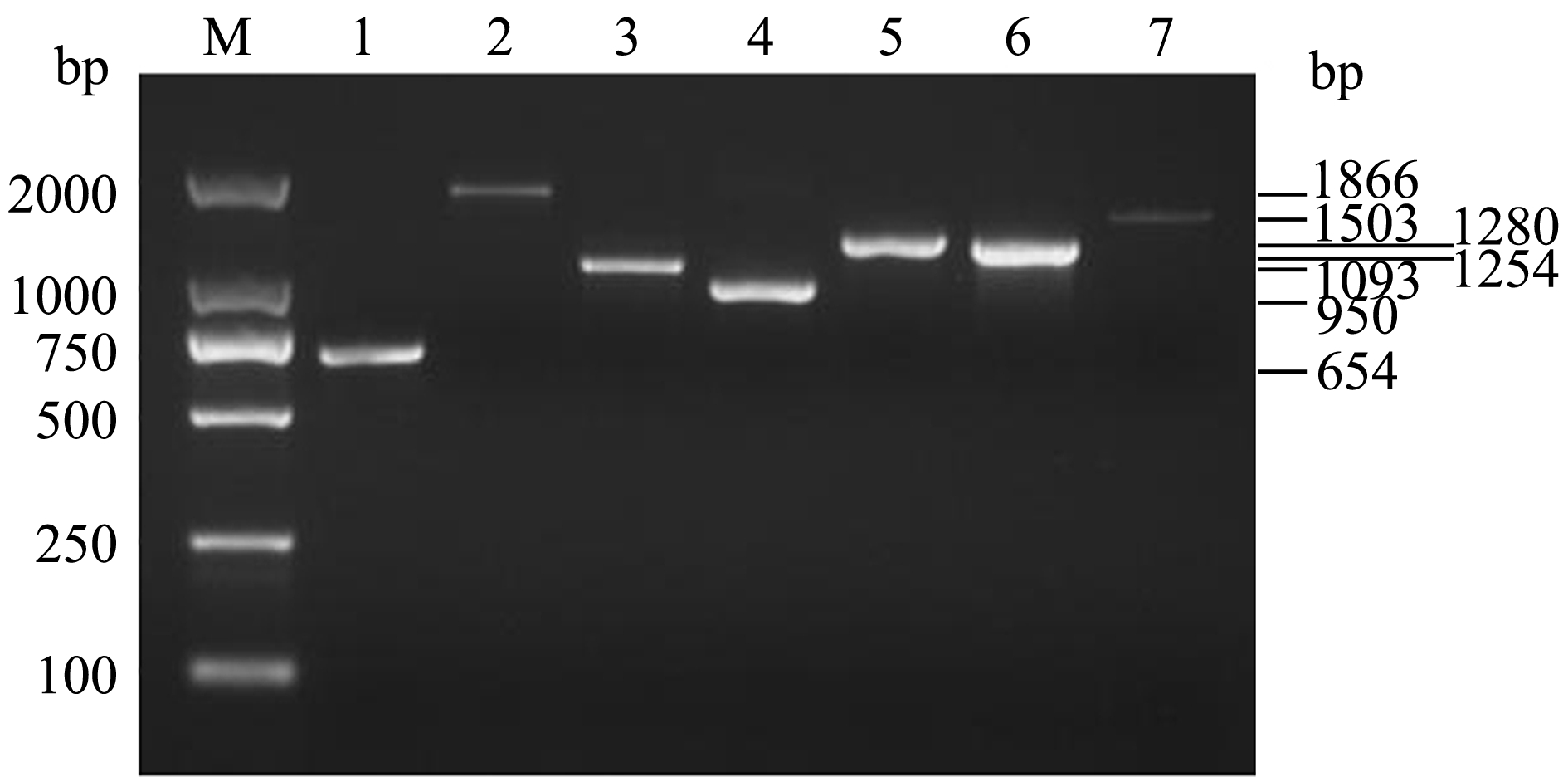
注:M为DL2000 DNA Market;1为气溶素基因;2为溶血素基因;3为封闭带毒素基因;4为DNA酶基因;5为丝氨酸蛋白酶基因;6为磷脂酶基因;7为S层蛋白基因
Note:M,DL2000 DNA Marker; 1,aer gene; 2,hly gene; 3,zot gene; 4, dna gene; 5,ser gene;6,lip gene;7,sp gene
图4 杀鲑气单胞菌菌株RBWF-1毒力基因PCR检测结果
Fig.4 PCR amplification of virulence genes in Aeromonas salmonicida strain RBWF-1
表3 人工感染试验结果
Tab. 3 Results of the artificial infection test
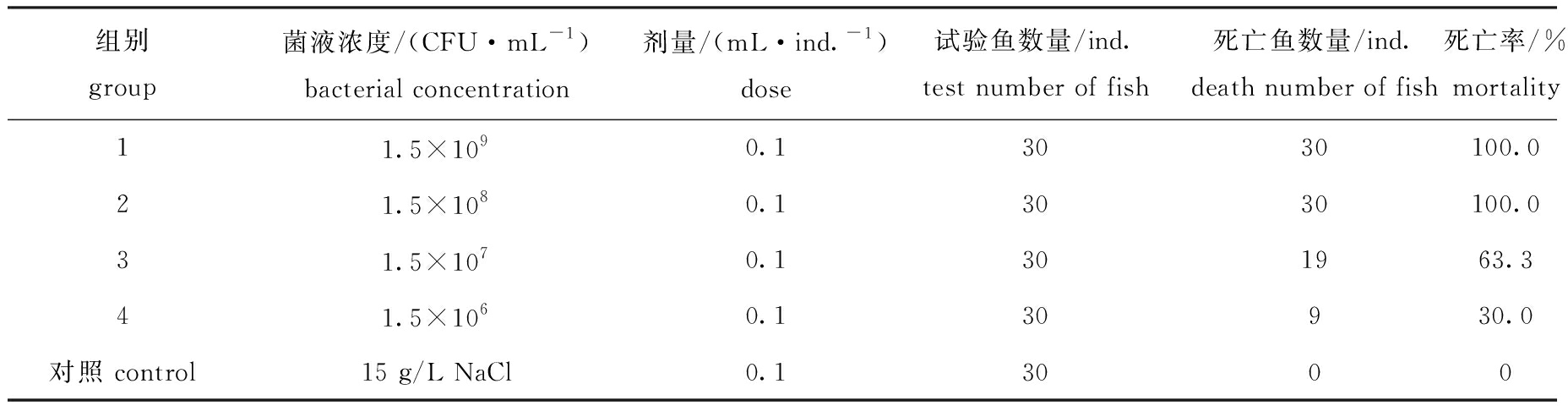
组别group菌液浓度/(CFU·mL-1)bacterial concentration剂量/(mL·ind.-1)dose试验鱼数量/ind.test number of fish死亡鱼数量/ind.death number of fish死亡率/%mortality11.5×1090.13030100.021.5×1080.13030100.031.5×1070.1301963.341.5×1060.130930.0对照 control15 g/L NaCl0.13000
2.4 胞外产物(ECP)活性分析
利用牛津杯法测定菌株RBWF-1胞外产物酶活性,结果发现,脱脂奶平板、DNA平板和吐温80平板上牛津杯周围形成透明圈,淀粉平板滴加Lugol氏碘液后牛津杯周围颜色未变紫色,兔血平板出现β-溶血环,尿素平板未变色,说明ECP中检出蛋白酶、溶血素、淀粉酶、脂酶和DNA酶,未检出脲酶(表4)。
表4 杀鲑气单胞菌菌株RBWF-1毒力基因及胞外产物检测结果
Tab.4 Detection and extracellular product activities in virulence genes of Aeromonas salmonicida strain RBWF-1

毒力基因 virulence gene检测结果detection result胞外产物extracellular product activi-ty检测结果detection result溶血素 hly+溶血活性 hemolytic activity +丝氨酸蛋白酶 ser+蛋白酶 serine protease+磷脂酶 lip+脂酶 lipase+DNA酶 dna+DNA酶 DNase+气溶素 aer+淀粉酶 amylase+封闭带毒素 zot+脲酶 urease-S层蛋白 sp+
注:+为阳性;-为阴性
Note:+, positive;-, negative
3 讨论
3.1 致病性杀鲑气单胞菌的分离鉴定
杀鲑气单胞菌是一种嗜冷无动力的气单胞菌,广泛分布于海淡水中,曾给世界主要鲑鳟养殖区带来严重的经济损失,目前,仍是鲑鳟养殖过程中需重点防控的病原之一。伯杰氏细菌鉴定手册中将杀鲑气单胞菌分为5个亚种:杀鲑亚种A.salmonicida subsp.salmonicida、无色亚种A.salmonicida subsp. achromogenes、杀日本鲑亚种A.salmonicida subsp. masoucida、史氏亚种A.salmonicida subsp.smithia和溶果胶亚种A.salmonicida subsp.pectinolytica [12]。根据其形态学和生理生化特征,如褐色色素产生、溶血性、蔗糖发酵、菌落大小等,将杀鲑亚种称为典型株(typical),其他亚种及不符合5种亚种特征的菌株均归为非典型株(atypical)[13]。与杀鲑亚种主要引起鲑科鱼类典型的疖疮病不同,非典型株宿主范围更广,发病症状也以皮肤溃疡或非典型疥疮为主[14]。本研究中从患皮肤溃疡病的虹鳟体内分离获得1株优势菌RBWF-1,通过人工感染试验发现,该菌株能引起鱼体体色发黑、体表溃烂、鳍条发红、肠道充血等症状,与原始病鱼症状相同。该菌株形态学、生理生化、动力鉴定结果显示,其与杀鲑气单胞菌杀日本鲑亚种最接近,但不发酵葡萄糖产气、不产硫化氢,这与伯杰氏手册中参考菌株存在差异,分析可能是由于菌株宿主来源、生长环境、菌株自身变异等不同因素造成。BiologGenIII微孔板可对细菌进行94种表型测试,其中包括71种碳源利用测试以及23种化学敏感性测试。细菌在测试板上所显示出的“表型指纹”被用来在种水平上鉴定该微生物。本研究中利用Biolog微孔板对分离菌鉴定的结果与生理生化鉴定结果一致,说明该微孔板可用于杀鲑气单胞菌各个亚种间的鉴定。另外,本研究中通过16S rDNA基因序列分析与系统发育树构建发现,菌株RBWF-1与杀鲑气单胞菌的16S rDNA基因序列同源性最高,其在系统发育树中与杀鲑气单胞菌杀日本鲑亚种、无色亚种和史氏亚种聚为一个分支,且与杀日本鲑亚种和无色亚种进化距离最接近。由此可见,16S rDNA序列在杀鲑气单胞菌中高度保守,适用于种的鉴定,但是对于亚种的鉴别,只能作为参考,还必须结合生理生化各项分类指标测定结果判定。随着杀鲑气单胞菌宿主范围的扩大,目前已报道的杀鲑气单胞菌,特别是非典型株生化特征呈现出较高的多样性,但其中与公认的5个亚种完全吻合的较少[15],随着分类学的进一步发展,该问题会得到解决和补充完善。
3.2 杀鲑气单胞菌毒力因子的检测
细菌毒力因子是决定其致病力的重要因素之一。杀鲑气单胞菌的毒力因子按照功能可分为7大类,包括外毒素、胞外酶、黏附因子、分泌系统、Fe摄取系统、抗药基因和群体效应[10]。其中,气溶素(aerolysin)[16]、溶血素(hemolysin)[17]、蛋白酶(protease)[18]、表面阵列蛋白(surface layer)[19]、菌毛(pilus)[20]、Ⅲ型分泌系统(T3SS)[21]、Fe载体(siderophore)[22]和群体效应激活受体[23]等为已报道的杀鲑气单胞菌主要毒力因子。本研究中从毒力基因和胞外产物特性两个方面研究了杀鲑气单胞菌RBWF-1的毒力因子,并选取7种主要毒力基因aer、hly、zot、dna、ser、lip和sp进行PCR检测,均成功扩增并经测序验证,同时,收集胞外产物进行了溶血性及蛋白酶、脂酶、核酸酶、淀粉酶和脲酶的体外活性测定,除脲酶活性未检出外,其他均为阳性结果。其中,溶血素、蛋白酶、脂酶、核酸酶在基因和蛋白水平的检测结果一致,说明胞外产物的生物活性可能与菌株携带的毒力基因相关,同时也暗示了分离菌株RBWF-1具有较强的致病力。
研究表明,气单胞菌的致病性并非由单一毒力因子所完成,而是由多种毒力因子共同作用,且毒力基因的种类及数量在不同菌株间存在差异。毒力因子的种类不同导致不同菌株间致病力的差异[24-26]。王一娟[27]通过毒力基因型的比较发现,在未发病池塘菌株中多以单独的毒力基因存在为主,分析这可能就是环境菌株不能致病的原因之一。本研究中所检测的毒力因子中,气溶素和溶血素是气单胞菌重要的毒力因子,气溶素兼有溶血性、肠毒性和细胞毒性,可用于初步判定气单胞菌的致病性[28];蛋白酶、脂酶、核酸酶、淀粉酶、封闭带毒素和S层蛋白,在细菌黏附、侵染、增殖以及毒素分泌、释放过程中发挥着重要作用,能够增强气单胞菌的毒性[10,29];通过体外感染发现,菌株RBWF-1的致病力较强,分析可能与其含有多种毒力因子有关。
开展对细菌毒力因子的研究,对于细菌检测及免疫防控技术的建立具有十分重要的意义。首先,将细菌保守的毒力基因作为特异性检测的靶基因,可以建立相应的分子生物学快速检测方法。Kong等[30]以气溶素基因aero、侵袭性质粒抗原H基因ipaH、侵袭性质粒抗原B基因ipaB、黏附侵袭位点基因ail、肠毒素胞外分泌蛋白基因epsM及16S-23S rDNA 间隔区Vpara为检测靶基因,建立了包括嗜水气单胞菌在内的6种常见病原菌的多重PCR检测方法,进一步提高了病原检测效率与准确性;Gustafson等[31]和刘帅等[32]分别依据编码杀鲑气单胞菌表面阵列蛋白基因vapA和Fe载受体基因fstA,建立了杀鲑气单胞菌PCR和实时荧光定量PCR检测方法。其次,细菌毒力因子是研制细菌亚单位疫苗和减毒疫苗的重要依据。气单胞菌的基因工程亚单位疫苗一直是研究的热点并积累了丰硕的研究成果,主要集中在对外毒素、外膜蛋白等毒力因子的重组表达技术及其作为候选疫苗组分在抗感染免疫中发挥的免疫保护作用研究[33-35],例如Marana等[36]根据杀鲑气单胞菌菌株A449基因组信息,从潜在保护性抗原中筛选出RTX 蛋白、铁载体、菌毛蛋白、鞭毛蛋白、丁质酶、胶原酶等14种蛋白进行体外重组表达,研制出3种亚单位疫苗,通过体内攻毒试验和体外ELISA方法研究了3种亚单位疫苗的免疫保护作用,并对各组分所发挥的作用进行了分析。另外,以不同毒力基因缺失突变体为基础研制出的细菌减毒疫苗也显示了较强的免疫保护力,为细菌疫苗的研制提供了数据和参考[37-40]。因此,开展细菌毒力因子研究,对于探明细菌致病机理,建立有效防控技术意义重大。
综上所述,本研究中利用微生物学和分子生物学方法,对患皮肤溃疡病的虹鳟进行了病原菌的分离和鉴定,并对其致病性及毒力因子进行了检测分析,研究结果可为中国虹鳟养殖过程中杀鲑气单胞菌的感染特征、分类鉴定及疫苗研制提供数据和参考依据。