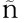嗜水气单胞菌Aeromonas hydrophila为革兰氏阴性短杆菌,隶属于弧菌科、气单胞菌属[1]。该菌在水产养殖过程中可导致鱼、虾等多种水生生物感染,是一类发病率高、危害极其严重的水生生物病原菌。感染该菌后可引发水生动物的败血症,患病鱼的临床症状为胸鳍、尾鳍、腹鳍充血,体表溃烂,内脏充血,体色发黑,出现腹水等[2-5]。
大菱鲆Scophthalmus maximus (L.)隶属于鲽形目Pleuronectiformes、鲆科Bothidae、菱鲆属Scophthalmus[6],是中国北方工厂化养殖的主要鱼类,近年来,随着养殖规模和密度的不断扩大,以及缺乏对疾病的有效控制等,使得一些病原细菌广为散播,导致鱼类大量发病和死亡[7]。感染嗜水气单胞菌的患病大菱鲆主要表现为摄食下降、活力减弱、体色变黑、腹部膨胀,各鳍基部、口部均有出血,病鱼在水体中行动迟缓[8]。笔者经过一年多的时间,对辽宁省葫芦岛市养殖大菱鲆感染嗜水气单胞菌的情况进行了调查,本研究中对分离菌株毒力进行了分析,并结合ERIC-PCR指纹图谱,以期确定该病原菌的基因型及其与致病性的关系,为临床病情防控提供理论依据。
1 材料与方法
1.1 材料
患病大菱鲆体长为10~20 cm,取自葫芦岛兴城市4个养殖场和绥中县5个养殖场,取样时间为2014年1月—2015年4月,每月定期采样,共获得135尾病鱼,其中从兴城共获得78尾病鱼,从绥中共获得57尾病鱼。患病大菱鲆主要症状为红嘴及溃疡,鱼体腹部、鳍基部和体侧部存在不同程度的充血。
1.2 方法
1.2.1 细菌分离 从患病大菱鲆心脏、肝脏、嘴、鳃、尾鳍处分离细菌,无菌条件下采用平板菌落划线法接种在胰蛋白胨大豆琼脂(TSA)培养基上,于28 ℃下培养48 h,挑选优势菌进一步纯化、保种。
1.2.2 细菌鉴定 采用水煮法提取细菌DNA[9],
所用引物为细菌16S rDNA通用引物,引物序列如表1所示。PCR产物送往北京华大基因研究中心进行测序,测序结果通过Blast软件进行比对。
参照王友娟等[10]的方法,采用嗜水气单胞菌的特异性引物和气溶素基因(aerA毒素)引物进行双重PCR检测,引物序列如表1所示。反应体系(共25 μL):10×PCR buffer(含Mg2+) 2.5 μL,dNTP Mix 2 μL,正、反向引物(10 pmol/μL)各0.5 μL,模板(40~80 ng)1 μL,Taq DNA Polymerase(BBI)0.125 μL,用ddH2O补足至25 μL。双重PCR反应条件:94 ℃下预变性5 min;94 ℃下变性30 s,50 ℃下退火30 s,72 ℃下延伸1 min,共进行30个循环;最后在72 ℃下再延伸10 min,取出后置4 ℃下保存备用。
表1 所用引物序列
Tab.1 Sequences of the primers used in the experiment

引物 primer序列(5'~3') sequence(5'-3')扩增产物/bp size of products16S rRNAF:AGAGTTTGATCCTGGR:GGTTACCTTGTTACGACTT1465 嗜水气单胞菌特异性引物F:GAAAGGTTGATGCCTAAT-ACGTAR:CGTGCTGGCAACAAAGGA-CAG685 嗜水气单胞菌气溶素基因引物F:GCAGAACCCATCTATCCA GR:TTTCTCCGGTAACAGGATTG252 嗜水气单胞菌ERIC-PCR引物F:ATGTAAGCTCCTGGGGAT-TCACR:AAGTAAGTGACTGGGGT-GAGCG
1.2.3 嗜水气单胞菌人工感染试验 选取健康的大菱鲆(体长为10 cm,体质量为30 g),在规格为60 cm×40 cm×30 cm的水槽中暂养7 d,养殖用水为大连市黑石礁海域沙滤海水,养殖期间盐度为30,水温为15~16 ℃,24 h不间断充氧。试验前将大菱鲆随机分为8组,每组15尾鱼。取嗜水气单胞菌分离株,活化培养后制成浓度为1.0×108 cells/mL的菌悬液,腹腔注射,每尾注射0.2 mL[5,11-12],对照组注射等量生理盐水。连续观察14 d,每天换水并记录死亡情况。
1.2.4 ERIC-PCR分型 ERIC-PCR引物参照 Maiti等[13]的方法,引物序列如表1所示。反应体系(共25 μL):10×PCR buffer(含Mg2+)2.5 μL,dNTP Mix 2 μL,正、反向引物(10 pmol/μL)各1 μL,模板(40~80 ng)2 μL,Taq DNA Polymerase(BBI)0.125 μL,用ddH2O补足至25 μL。PCR反应条件: 94 ℃下预变性7 min;94 ℃下变性30 s,52 ℃下退火1 min,65 ℃下延伸8 min,共进行40个循环;最后在65 ℃下再延伸16 min。
2 结果与分析
2.1 大菱鲆感染气单胞菌的症状及产地
2014年1月—2015年4月,从患病大菱鲆心脏、肝脏、嘴、鳃、尾鳍处共分离到98株优势菌,经16S rRNA基因鉴定,共有13株优势菌与气单胞菌属一致性达100%,编号为AP40301、AP40302、AP40303、AP40716、AP40719、AP40720、AP- 40721、AP40401、AP40402、AP40403、AP40501、AP40502和AP40503,感染气单胞菌鱼的症状及产地如表2所示。
表2 感染气单胞菌鱼的症状及产地
Tab.2 Symdrome of the diseased fish and sources of Aeromonas hydrophila
编号No.症状symptom产地areaAP40301鳃盖出血、溃疡、尾鳍出血、腹水、白便兴城AP40302鳃盖出血、溃疡、尾鳍出血、腹水、白便兴城AP40303肿嘴、围心腔积液兴城AP40401红嘴、红鳍、溃疡绥中AP40402红鳍、分叉、红嘴、突眼、溃疡绥中AP40403红嘴、溃疡、白便绥中AP40501 红嘴、红鳍、体表溃疡兴城AP40502红嘴、红鳍、体表溃疡兴城AP40503红嘴、红鳍、体表溃疡兴城AP40716红嘴、尾鳍溃烂、白便兴城AP40719红嘴、烂鳍、白便兴城AP40720红嘴、烂鳍、肠积水、白便绥中AP40721红鳍、体表溃烂绥中
2.2 嗜水气单胞菌的鉴定
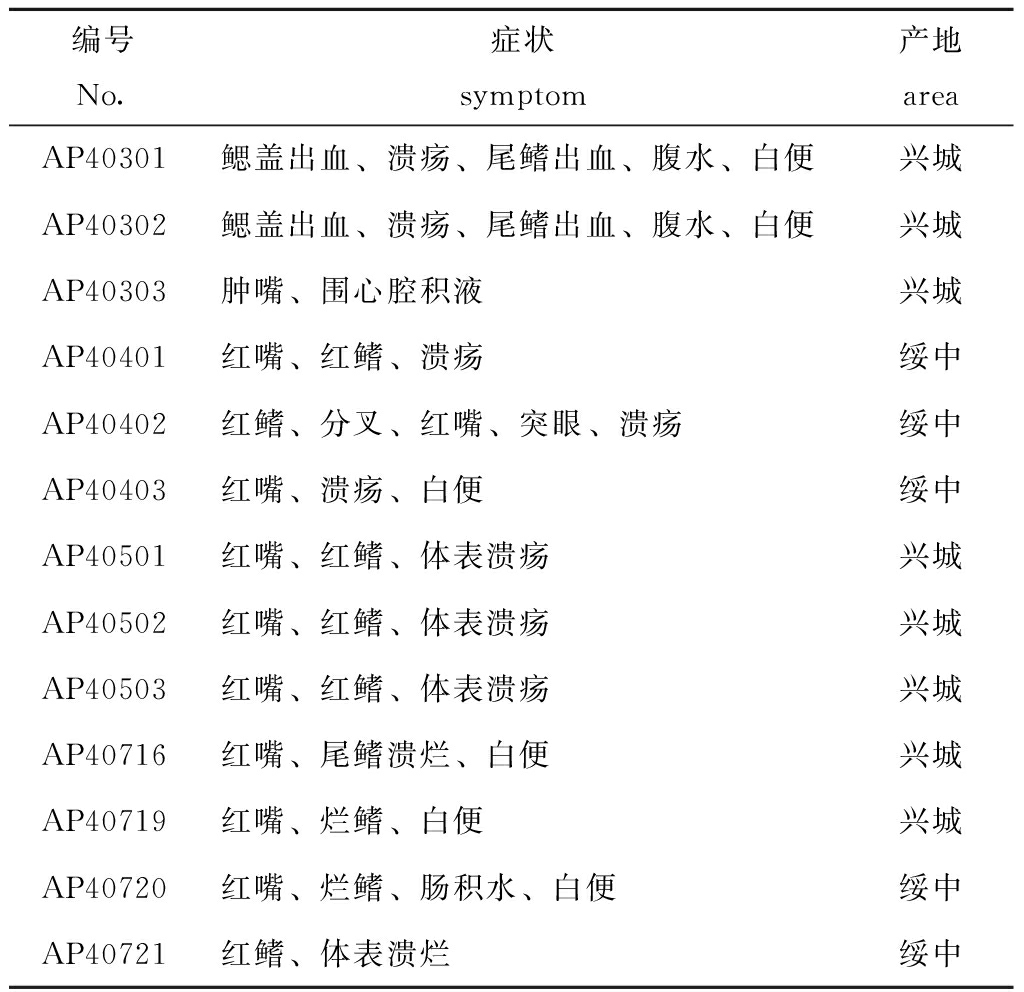
经嗜水气单胞菌特异性引物和气溶素基因双重PCR检测,发现13株优势菌中有7株在252 bp和685 bp处均出现清晰条带(图1),这表明,此7株分离株(AP40301、AP40401、AP40402、AP40403、AP40501、AP40502和AP40503)为嗜水气单胞菌Aeromonas hydrophila,并有潜在致病性。
2.3 嗜水气单胞菌人工感染试验
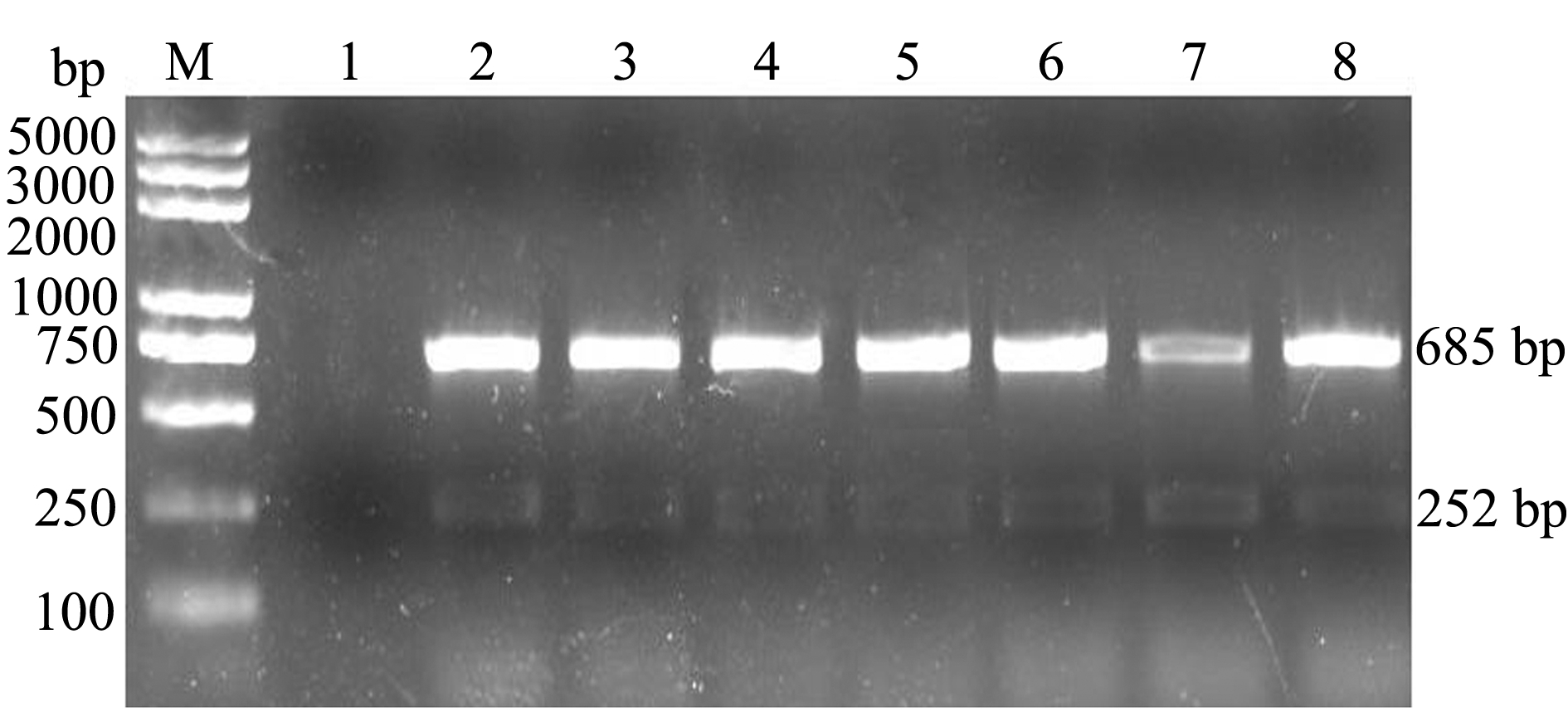
7株嗜水气单胞菌人工感染试验组,第3天便开始出现死亡,第4天出现死亡高峰期,6天内致死率为100%,表明这7个菌株毒力较强(图2);而对照组无死亡。人工感染试验组大菱鲆临床症状主要以躯干部肌肉充血发红为主,鱼鳍基部有血丝;剖检结果显示,肝脏呈土黄色,胆囊呈紫黑色,肠道出血发红,肠壁出现不同程度充血并伴随少量淡红色或浅黄色黏液。人工感染后的症状与大菱鲆自然发病症状相似(图3)。
注:M为DL5000 DNA Marker ;1为阴性对照组(迟缓爱德华菌ATCC15947);2~8分别为AP40301、AP40401、AP40402、AP40403、AP40501、AP40502和AP40503菌株
Note:M,DL5000 DNA Marker;1,negative control(Edwardsiella tarda ATCC15947);2-8,AP40301, AP40401, AP40402, AP40403,AP40501,AP40502 and AP40503 isolates,respectively
图1 嗜水气单胞菌分离菌株特异性基因的琼脂糖电泳结果
Fig.1 Agarose elelectrophoresis for detecting specificity genes of Aeromonas hydrophila isolated strains
图2 大菱鲆人工感染7株细菌的试验结果
Fig.2 Results of artificial infection tests of turbot challenged by Aeromonas hydrophila isolates
2.4 嗜水气单胞菌ERIC-PCR分型
7株嗜水气单胞菌经ERIC-PCR扩增表明,PCR产物包含2~7条带,有主带2~4条,大小为180~1500 bp(图4)。聚类分析显示,7株嗜水气单胞菌分为2种基因型,分别标记为Ⅰ和Ⅱ型(图5)。
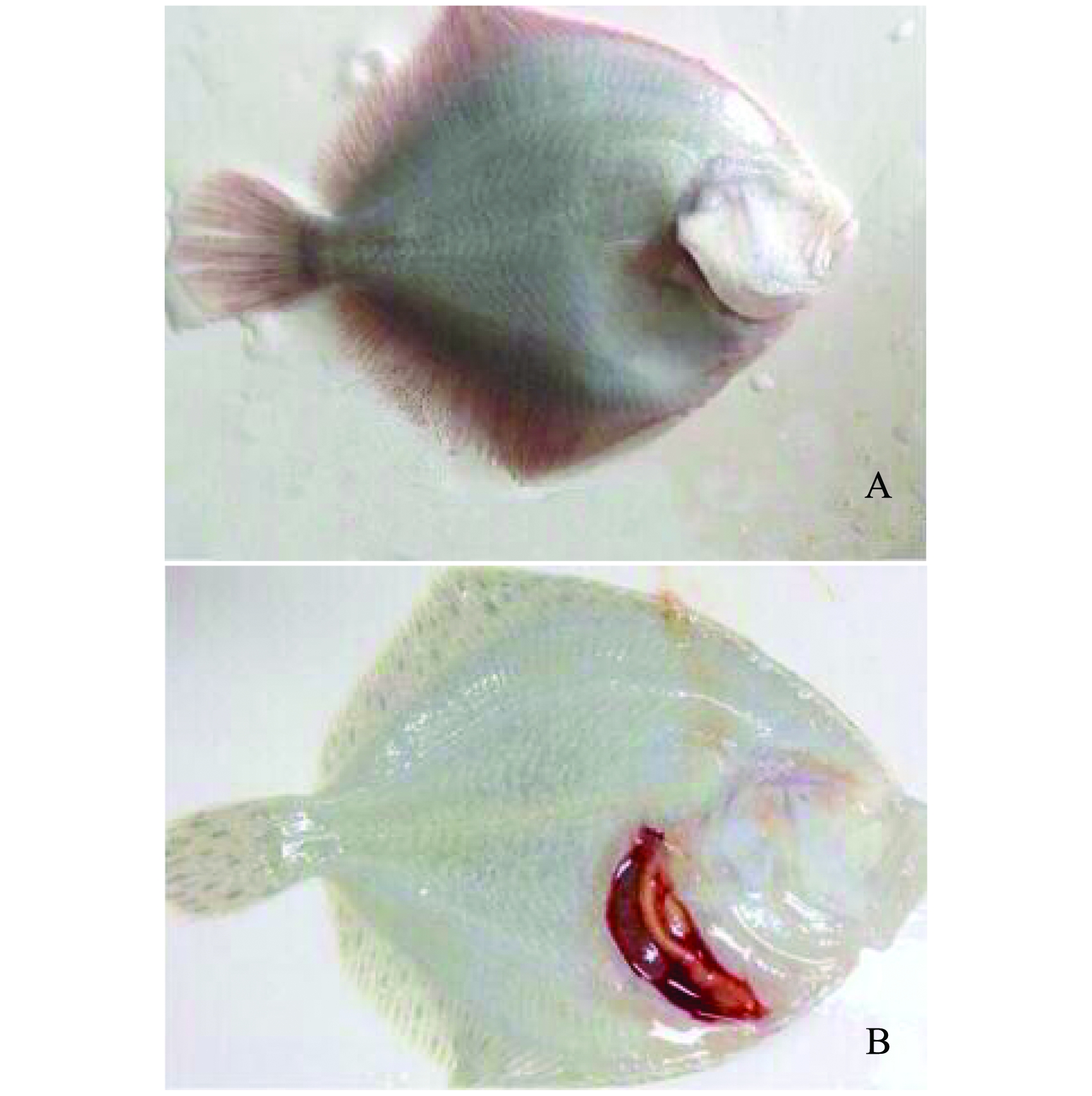
注:A为红鳍;B为内脏出血
Note:A,redfin;B,visceral hemorrhage
图3 人工感染大菱鲆的主要临床症状
Fig.3 Primary clinical symptoms of turbot in the artificial infection group

注:M为DL2000 DNA Marker;1~7分别为AP40301、AP40401、AP40402、AP40403、AP40501、AP40502、AP40503菌株
Note:M,DL2000 DNA Marker;1-7,AP40301,AP40401,AP40402,AP40403,AP40501,AP40502 and AP40503 isolates, respectively
图4 嗜水气单胞菌分离株ERIC-PCR指纹图
Fig.4 Fingerprint clustering analysis diagram of Aeromonas hydrophila isolates by ERIC-PCR
其中,Ⅰ型菌株为4株,Ⅱ型菌株3株。此外,不同地区分布的嗜水气单胞菌的聚类特征差异明显,Ⅰ型分离株中有3株来自绥中,1株来自兴城;Ⅱ型分离株3株均来自兴城。根据Hunter等[14]的计算方法,该分型方法的辨别指数值为87%。
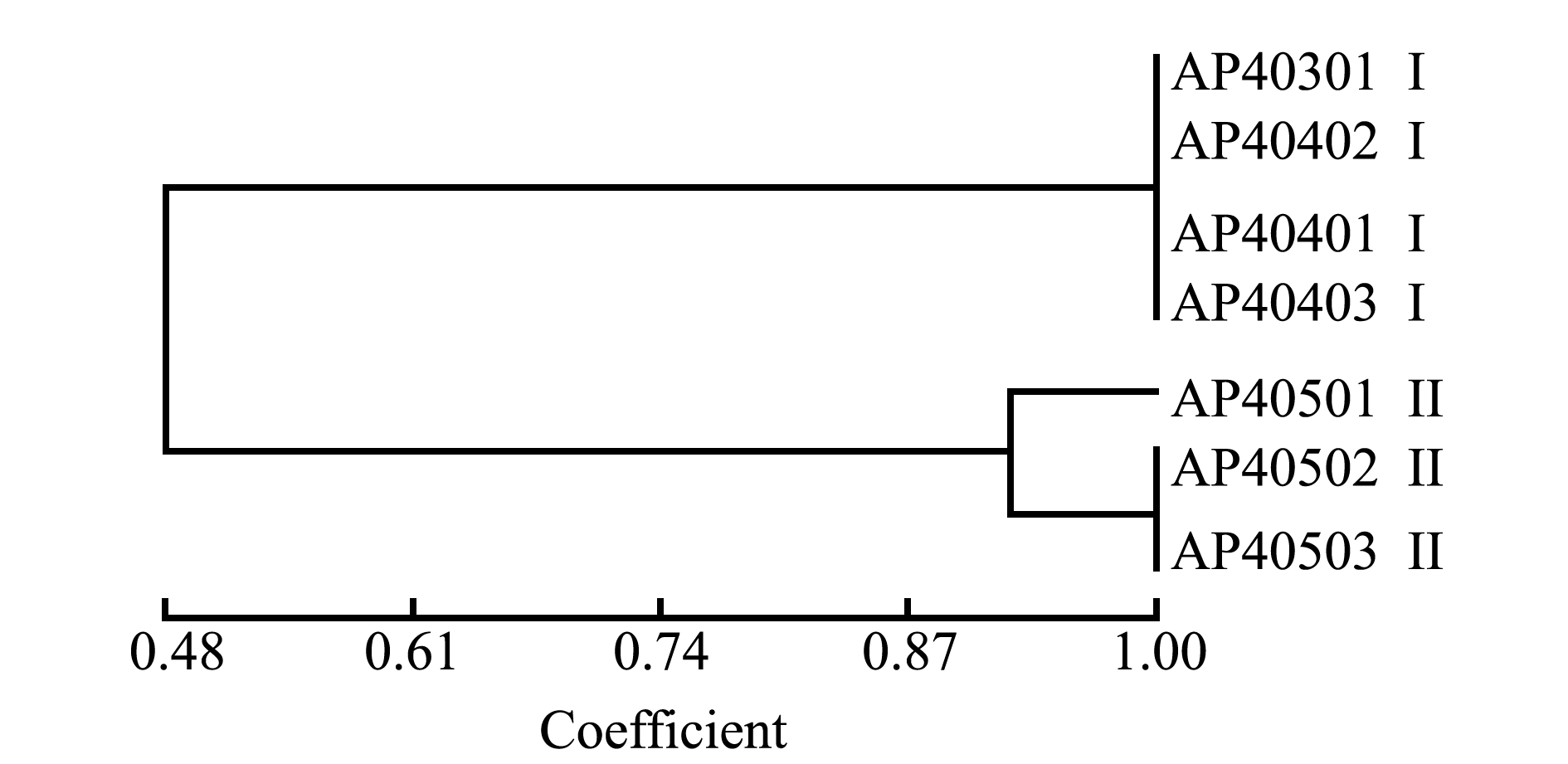
图5 嗜水气单胞菌分离株的系统进化树
Fig.5 Phylogenetic tree of Aeromonas hydrophila isolates
3 讨论
嗜水气单胞菌是水产养殖过程中的常见病菌,其主要感染对象包括淡水鱼、虾及其他水生动物。本研究中,对辽宁省葫芦岛市养殖大菱鲆全年感染嗜水气单胞菌的情况进行了调查,通过细菌分离共获得98株优势菌,其中,有7株属嗜水气单胞菌,占比约7%,说明嗜水气单胞菌已成为辽宁地区养殖大菱鲆病害中不可忽视的一种病原菌。
3.1 养殖大菱鲆感染嗜水气单胞菌的毒力分析
嗜水气单胞菌的主要毒力因子包括外毒素、蛋白酶、S蛋白、菌毛、外膜蛋白等[1],其中外毒素,即气溶素(aerA毒素),是目前公认的主要致病因子,在细胞内以气溶素前体的形式合成,N末端具有一个典型的23个氨基酸残基的信号序列,可引导无活性的气溶素前体透过细胞膜而分泌到胞外,C末端切去25个氨基酸残基后被激活,其作用机制是结合到真核细胞的专一受体后,该毒素即聚集成六聚体,并插入细胞的类脂双分子层,形成3 nm的通道[15]。
研究表明,含有气溶素的嗜水气单胞菌均有强致病性。朱建萍等[16]分离自感染症状严重的三角帆蚌Hyriopsis cumingii体内的5株嗜水气单胞菌携带气溶素基因。王友娟等[10]在对辽宁省不同地区、不同鱼类、不同症状病鱼的嗜水气单胞菌感染情况的研究中,分离得到26株嗜水气单胞菌,其中,有17株同时扩增出252 bp大小的气溶素基因。本研究结果证实,所获得的7株嗜水气单胞菌均含有气溶素基因,而且人工感染试验也证明其具有强致病性,这与前人的研究结果一致。本研究表明,辽宁地区患病大菱鲆分离的嗜水气单胞菌均含有气溶素基因,并具有高致病性,生产中须引起足够重视。
3.2 养殖大菱鲆感染嗜水气单胞菌的ERIC-PCR分型
由于嗜水气单胞菌存在多种基因型,导致其致病性普遍存在一些差异,因此,开展气单胞菌基因分型的研究势在必行[17]。传统细菌分型方法主要基于表型特征,但细菌表型特征受外界环境波动影响较大,致使分型结果不是非常可信[18]。目前,细菌基因分型方法较多,其中,脉冲场凝胶电泳法(PFGE) 精确度最高[19],但可操作性差,而ERIC-PCR法因操作简单且区分能力和重复性与PFGE法相近,更易于被普通实验室接受[20]。
本研究中ERIC-PCR结果显示,葫芦岛地区7株嗜水气单胞菌能扩增出2~7条带,条带大小为180~1500 bp,可分为2个基因型,同时,7株嗜水气单胞菌分别在约200 bp和600 bp处出现相同条带。而罗志飞等[21]对南方多省的嗜水气单胞菌进行分型时发现,菌株条带大小为500~3000 bp,与本研究结果有差异,说明不同地区、不同养殖水域同种细菌的ERIC-PCR结果存在一定差异。此外,Aguilera-Arreola等[22]通过ERIC-PCR证实, 宿主和环境相似的嗜水气单胞菌菌株有聚类趋势。然而,本试验结果显示,背景来源相似的嗜水气单胞菌却呈现两种基因型,这与其他研究结果有差异。通过与肖丹等[23]报道的嗜水气单胞菌ERIC-PCR指纹图谱进行对比,发现Ⅱ型嗜水气单胞菌是常见嗜水气单胞菌基因型,无明显的地域差异性,而Ⅰ型嗜水气单胞菌可能为辽宁葫芦岛地区独立的基因型。推测可能的原因是绥中、兴城两地的地理环境和水域环境存在着一定的差异。因此,在防控嗜水气单胞菌引起的流行性疾病时,有必要对地方性某些独立基因型按照其不同的流行规律制定相应的治病方案。