中间球海胆Strongylocentrotus intermedius又称虾夷马粪海胆,主要分布于日本北海道和俄罗斯远东海域[1],由于其性腺色泽好、品质佳,在国内外市场颇受欢迎,是可食用海胆中经济价值最高的种类之一。中间球海胆自1989年由大连海洋大学从日本引入中国后,随着人工育苗、中间育成等技术的研发成功,现已成为中国最重要的海胆养殖种类,在辽宁、山东等省沿海地区的养殖已经初具规模,2017年中国海胆养殖年产量已达10 054 t[2-3]。性腺作为海胆唯一可食用的部分,其品质好坏直接决定了海胆的经济价值和繁殖能力[4],性腺中的蛋白质、氨基酸、不饱和脂肪酸、类胡萝卜素和糖类等对海胆生长和生殖至关重要[5-7]。
在水产动物性腺发育过程中,总脂、甘油三酯、磷脂、不饱和脂肪酸的正常积累对性腺发育、胚胎发育和早期幼体的成长极为关键[8-9]。研究水产动物繁殖前后组织中脂类和脂肪酸组成的变化,有助于认识水产动物性腺发育期的脂类营养需求,从而为水产动物亲本的脂类营养强化提供理论依据和实践参考。近年来的相关研究中,吴旭干等[10]比较了瘤背石磺Onchidium struma产卵前后脂类和脂肪酸组成的变化,应雪萍等[11]比较了中华绒螯蟹Eriocheir sinensis成熟蟹、抱卵蟹、流产蟹肝胰腺脂肪酸的组成,汤辰婧等[12]对不同阶段中华绒螯蟹脂类含量及脂肪酸组成进行了分析,Shirai等[13]对日本鲶Silurus asotus在产卵前后卵巢中脂肪和脂肪酸组成进行了研究。
目前,有关人工饲料对海胆性腺脂类及脂肪酸组成影响的研究已有一些报道[14-18],研究表明,海胆性腺脂肪酸累积会跟其他动物一样受到饲料脂肪酸组成的影响。但是,对中间球海胆繁殖营养方面的研究较少,特别是有关海胆排精/卵前后性腺中脂类及脂肪酸含量变化的研究尚未见报道。本研究中,测定和比较了中间球海胆繁殖前后性腺中脂类和脂肪酸组成的变化,以期为海胆亲本营养繁殖学的研究提供理论依据。
1 材料与方法
1.1 材料
试验用海胆为大连海洋大学农业部北方海水增养殖重点实验室培育的2龄健康中间球海胆(壳径
为(56.69 ±1.56)mm,壳高为(31.30 ±1.87) mm,体质量为(54.27 ±3.71 g),试验前将30枚随机取样的个体暂养于实验室水槽(水温为18.0 ℃±1.3 ℃),暂养期间(7月)饱食投喂海带,每天吸底并全量换水1次。
1.2 方法
1.2.1 样品收集 试验开始时,将30枚备用海胆随机编号后分别用游标卡尺(Mahr16ER)和电子天平(G&GJJ100)测量其壳径(mm)、壳高(mm)和体质量(g)。排精/卵前后分别取样。
(1) 7月对中间球海胆随机进行解剖,取性腺组织,在显微镜下辨别雌、雄后,分别取3枚雌性、3枚雄性个体的性腺,用电子天平称量后,将所有性腺组织在液氮中快速冷冻6 h后转移至超低温冰箱(-80 ℃)中保存备用。
(2) 随机选取中间球海胆注射1 mL 0.5 mol/L KCl,分别用干净培养皿和装有过滤海水的塑料瓶收集3枚雄性和雌性个体的精卵,待海胆精子和卵完全排出后,将雌、雄个体分别养殖在不同的笼内,暂养7 d后(暂养期间饱食投喂)对海胆进行解剖,取每个个体的性腺组织,称重后在液氮中快速冷冻6 h后转移至超低温冰箱(-80 ℃)中保存备用。性腺指数(GI,%)计算公式为
GI=WG/WB×100%。
其中:WG为性腺的总湿质量(g);WB为海胆的体质量(g)。
取部分产卵前和产卵后雌、雄个体的性腺称重后,放入预先称重的干净培养皿中,72 ℃烘箱中烘干72 h至恒重,再次称重,计算性腺含水率。含水率(GM,%)计算公式为
GM=(WG1-WD1)/WG1×100%。
其中:WG1为部分性腺的湿质量(g);WD1为部分性腺烘干后的质量(g)。
1.2.2 脂类组成测定
总脂提取:采用国际通用的标准脂肪提取法,即氯仿-甲醇(体积比为2∶1)法[19]。
磷脂含量测定:将总脂用硝酸-高氯酸混合液(体积比为4∶1)消化,并用钼蓝比色法测定总脂中的磷脂含量[20]。
胆固醇和甘油三酯含量测定:将所提总脂用氯仿溶解并定容至100 mL,取一定体积的氯仿溶液,减压干燥后,按照试剂盒的使用说明测定胆固醇和甘油三酯含量。
游离脂肪酸含量测定:取上述氯仿溶液,减压干燥后,用4 mL正庚烷溶解,并加入1 mL脂肪酸显色剂 (5%醋酸铜溶液,用吡啶调节pH为6.1),充分振荡后离心,取上层有机相于710 nm波长下测定吸光度,计算游离脂肪酸含量。该部分由青岛科标有限公司检测。
1.2.3 脂肪酸组成测定 采用毛细管气相色谱法测定脂肪酸含量。用ThermoFisher Trace 1310 ISQ气相色谱质谱联用仪和TG-5MS(30 m×0.25 mm×0.25 μm)色谱柱进行分析,由青岛科标公司检测。
(1) 样品处理。取80~100 mg样品加入到15 mL离心管中,继续加入2 mL 5%盐酸-甲醇溶液,3 mL氯仿-甲醇溶液(体积比为1∶1),100 μL十九烷酸甲酯内标。于85 ℃水浴锅中水浴1 h,水浴完成后,等温度降到室温,在离心管中加入1 mL正己烷,震荡萃取2 min之后静置1 h,等待分层。取上层清液100 μL,用正己烷定容到1 mL。再用0.45 μm滤膜过膜后上机测试。
(2) 色谱条件。TG-5MS毛细管柱(30 m×0.32 mm×0.25 μm),不分流进样,开阀时间为1 min,载气流速为1.2 mL/min。进样口温度为290 ℃,检测器温度为80 ℃,保持1 min后以10 ℃/min的速率升温至200 ℃,继续以5 ℃/min的速率升温至250 ℃,最后以2 ℃/min的速率升到270 ℃,保持3 min。
(3) 质谱条件。传输线温度为280 ℃,EI离子源,电离能量70 eV,离子源温度为280 ℃,质量扫描范围为30~400 amu。
1.3 数据处理
利用 SPSS 18.0 软件对试验数据进行统计分析,采用t检验进行显著性差异检测,显著性水平设为0.05,数据以平均值±标准差(mean±S.D.)表示。
2 结果与分析
2.1 繁殖前后中间球海胆性腺指数、含水率、脂肪含量和脂类成分的变化
从表1 可见:中间球海胆排卵/精前与排卵/精后,雌、雄个体间的性腺指数和性腺含水率均无显著性差异(P>0.05),排卵前雌性个体性腺中脂类含量显著高于排精前雄性个体(P<0.05),排卵后雌性个体性腺中脂类含量显著高于排精后雄性个体(P<0.05);中间球海胆雌、雄个体繁殖后,性腺指数、脂类含量较繁殖前显著降低(P<0.05),性腺含水率在繁殖前后无显著性差异(P>0.05)。
表1 中间球海胆繁殖前后性腺指数、含水率和脂类含量的变化
Tab.1 Changes in gonado-somatic index,moisture and total lipid content in sea urchin Strongylocentrotus intermedius before and after spawning
%
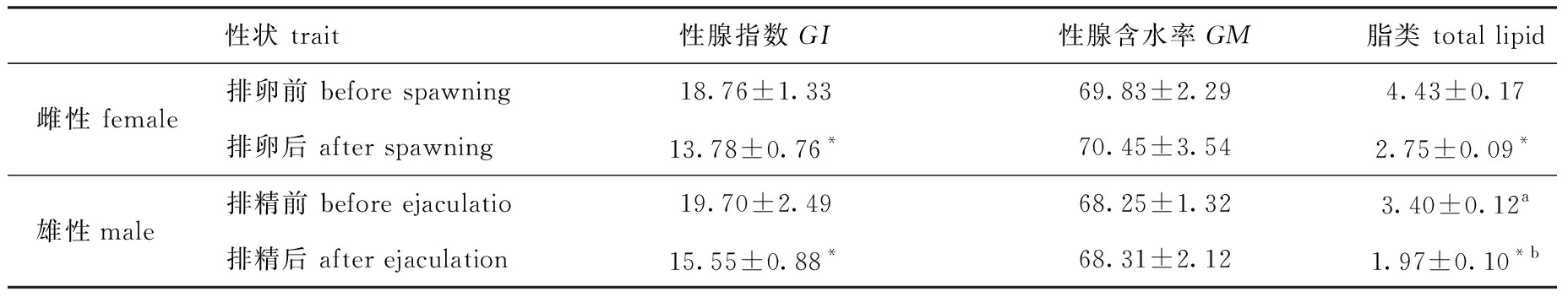
性状 trait性腺指数 GI性腺含水率 GM脂类 total lipid雌性 female排卵前 before spawning18.76±1.3369.83±2.294.43±0.17排卵后 after spawning13.78±0.76*70.45±3.542.75±0.09*雄性male排精前 before ejaculatio19.70±2.4968.25±1.323.40±0.12 a排精后 after ejaculation15.55±0.88*68.31±2.121.97±0.10*b
注:同列中,*表示繁殖前后个体间有显著性差异(P <0.05);a表示排精前与排卵前雌、雄个体间有显著性差异(P<0.05);b表示排精后与排卵后雌、雄个体间有显著性差异(P<0.05);脂类含量=性腺总脂含量/性腺湿质量,下同
Notes: * indicates significantly different between pre- and post spawning in the same column(P <0.05),a indicates significant difference between males and females before pre spawning;b indicates significant difference between males and females post spawning; gonad lipid content is the ratio of total lipid to gonad wet weight,et sequentia
中间球海胆性腺脂类主要由磷脂、胆固醇、游离脂肪酸和甘油三酯组成, 表2为各性腺中脂类成分的含量(g/100 g,脂类成分含量/性腺湿质量)。从表2可见:海胆性腺以磷脂为主;雌、雄海胆中,排精前雄性个体性腺中的磷脂含量和游离脂肪酸含量显著高于排卵前雌性个体(P<0.05),而排精前雄性个体性腺中的胆固醇含量则显著低于排卵前雌性个体(P<0.05),甘油三酯在两者间无显著性差异(P>0.05);排精后雄性个体性腺中的胆固醇含量显著低于排卵后雌性个体胆固醇含量(P<0.05),在其他3种脂肪组成上排精后与排卵后雌、雄个体间不存在显著性差异(P>0.05);雌性个体性腺中的磷脂含量在排卵前后无显著性差异(P>0.05),胆固醇含量在雌性个体排卵后显著升高(P<0.05),游离脂肪酸和甘油三酯在雌性个体产卵后显著降低(P<0.05);雄性个体排精前后性腺中的磷脂含量无显著性差异(P>0.05),雄性个体在排精后性腺中的胆固醇、游离脂肪酸和甘油三酯含量均显著降低(P<0.05)。
表2 中间球海胆繁殖前后性腺中脂类成分含量
Tab.2 Content of lipid class in gonads of sea urchin Strongylocentrotus intermedius before and after spawning
g/100 g
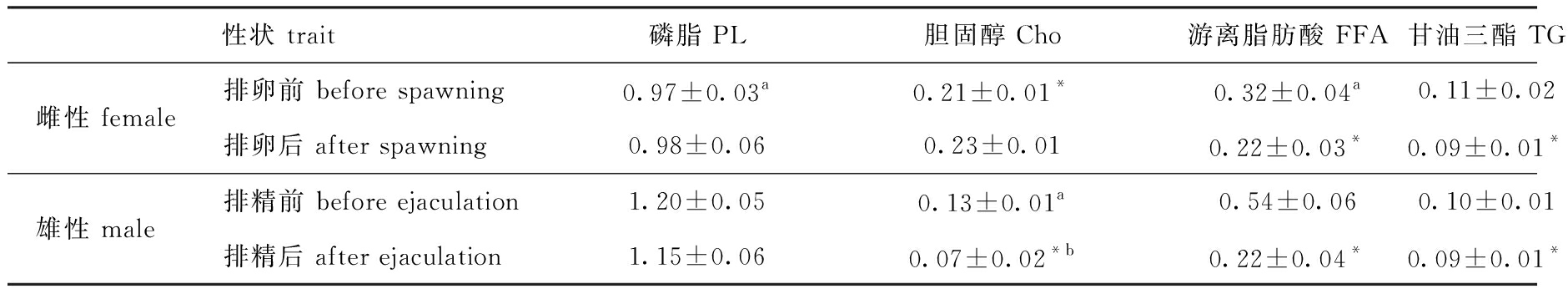
性状 trait磷脂 PL胆固醇 Cho游离脂肪酸 FFA甘油三酯 TG雌性 female排卵前 before spawning0.97±0.03a0.21±0.01*0.32±0.04a0.11±0.02排卵后 after spawning0.98±0.060.23±0.010.22±0.03*0.09±0.01*雄性 male排精前 before ejaculation1.20±0.050.13±0.01a0.54±0.060.10±0.01排精后 after ejaculation1.15±0.060.07±0.02*b0.22±0.04*0.09±0.01*
2.2 繁殖前后中间球海胆性腺脂肪酸含量的变化
中间球海胆繁殖前后性腺脂肪酸组成(mg/kg,脂肪酸成分含量/性腺湿质量)如表3所示。从表3可见:通过毛细管气相色谱法,共检测出24种脂肪酸,雌、雄个体性腺的主要脂肪酸(脂肪酸含量>1400 mg/kg)为C14∶0、C16∶0(软脂酸)湿质量、C18∶0(硬脂酸)、C20∶1、C20∶4(n-6)(AA)、C20∶5(n-3)(EPA)。排精前与排卵前,雌性个体性腺中的C13∶0、C14∶0、C17∶0、C18∶0、C20∶0、C16∶1、C20∶2、C20∶4(n-6)(AA)、∑SFAs、∑PUFAs、∑n-6PUFAs含量显著低于雄性个体(P<0.05),雌性个体在C18∶1(n-9)、C18∶2(n-6) 、∑MUFAs含量上显著高于雄性个体(P<0.05),雌、雄个体在C15∶0、C16∶0、C14∶1、C20∶1、C18∶3(n-6)、C22∶1(n-9)、C20∶5(n-3)(EPA)、∑n-3PUFAs含量上无显著性差异(P>0.05)。
排精后与排卵后,雄性性腺中的 C14∶0、C15∶0、C16∶0、C17∶0、C16∶1、C18∶1(n-9)、C20∶1、C22∶1(n-9)、C18∶2(n-6)、C18∶3(n-6)、C20∶2、C20∶3(n-3)、∑SFAs、∑MUFAs、∑PUFAs、∑n-6PUFAs含量显著高于雌性个体(P<0.05),雌性个体性腺中的C18∶0、C20∶5(n-3)和C22∶6(n-3)含量显著高于雄性个体(P<0.05),雌、雄个体在C20∶0 、C20∶4(n-6)(AA)、∑n-3PUFAs含量上无显著性差异(P>0.05)。
在排/精卵前中间球海胆性腺中大部分脂肪酸含量高于排精/卵后,其性腺组织中C14∶0、C15∶0、C16∶0、C17∶0、C20∶0、C16∶1、C20∶1、C22∶1(n-9)、C18∶2(n-6)、C18∶3(n-6)、C20∶2、C20∶4(n-6)(AA)、C20∶5(n-3)(EPA)、∑SFAs、∑PUFAs、∑n-3PUFAs、∑n-6PUFAs的含量在繁殖前均显著高于繁殖后(P<0.05)。雌性海胆排卵后性腺中C18∶1(n-9)、∑MUFAs含量显著低于排卵前(P<0.05),而C18∶0的含量在海胆产卵后显著升高(P<0.05);雄性海胆排精后性腺中C13∶0、C18∶0含量显著低于排精前 (P<0.05),C14∶1含量在排精前后无显著性差异(P>0.05),雄性海胆在排精后只有C18∶1(n-9)和∑MUFAs含量显著升高(P<0.05)。在产后的雌、雄海胆性腺中均检测到微量的C22∶6(n-3)(DHA)和C20∶3(n-3)。
表3 中间球海胆繁殖前后性腺中脂肪酸组成(湿质量)
Tab.3 Fatty acid composition of gonads of sea urchin Strongylocentrotus intermedius before and after spawning (wet weight)
mg/kg
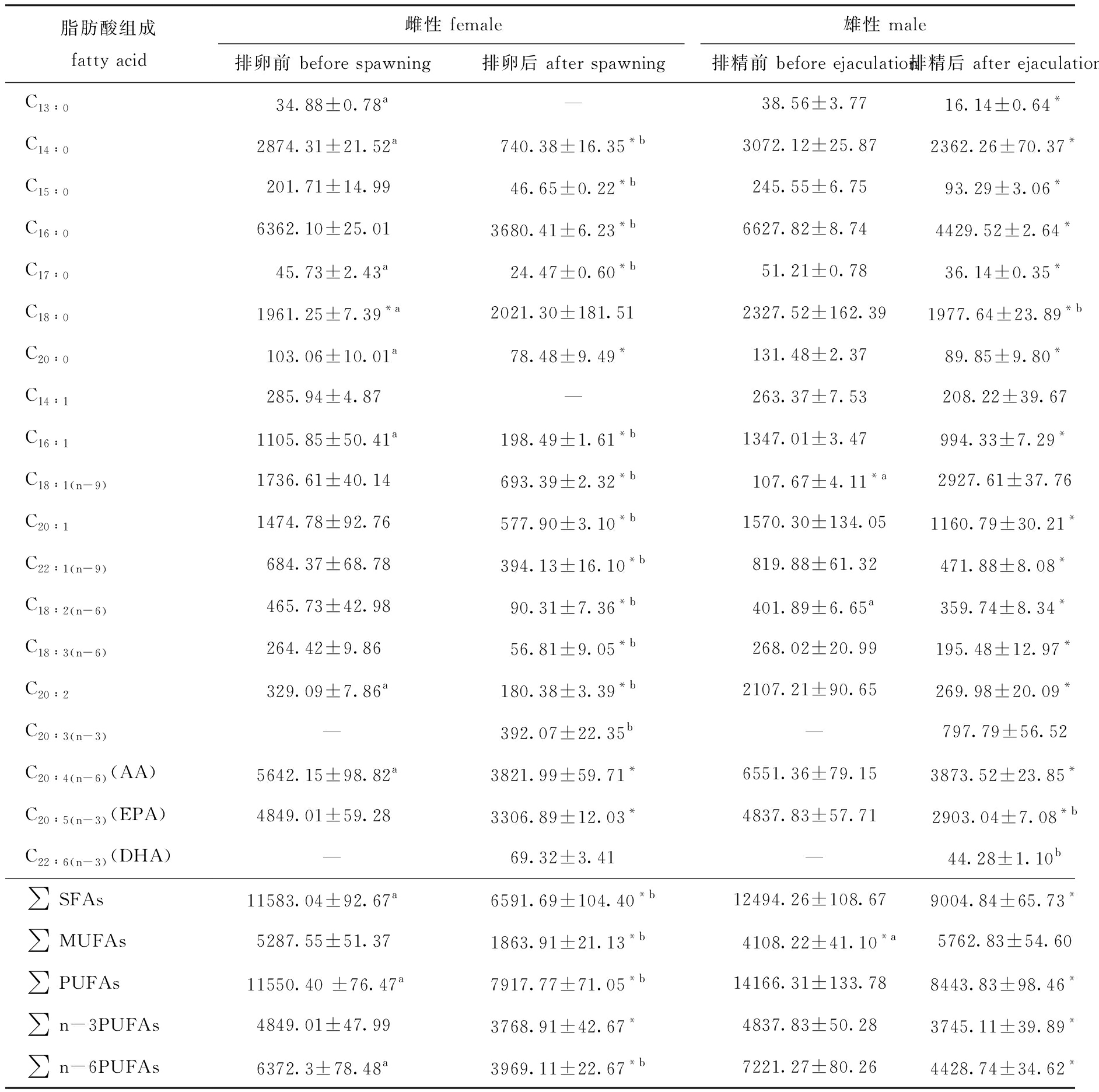
脂肪酸组成fatty acid雌性 female雄性 male排卵前 before spawning排卵后 after spawning排精前 before ejaculation排精后 after ejaculationC13∶034.88±0.78a—38.56±3.7716.14±0.64*C14∶02874.31±21.52 a740.38±16.35*b3072.12±25.872362.26±70.37*C15∶0201.71±14.9946.65±0.22*b245.55±6.7593.29±3.06*C16∶06362.10±25.013680.41±6.23*b6627.82±8.744429.52±2.64*C17∶045.73±2.43 a24.47±0.60*b51.21±0.7836.14±0.35*C18∶01961.25±7.39*a2021.30±181.512327.52±162.391977.64±23.89*bC20∶0103.06±10.01a78.48±9.49*131.48±2.3789.85±9.80*C14∶1285.94±4.87—263.37±7.53208.22±39.67C16∶11105.85±50.41a198.49±1.61*b1347.01±3.47994.33±7.29*C18∶1(n-9)1736.61±40.14693.39±2.32*b107.67±4.11*a2927.61±37.76C20∶11474.78±92.76577.90±3.10*b1570.30±134.051160.79±30.21*C22∶1(n-9)684.37±68.78394.13±16.10*b819.88±61.32471.88±8.08*C18∶2(n-6)465.73±42.9890.31±7.36*b401.89±6.65 a359.74±8.34*C18∶3(n-6)264.42±9.8656.81±9.05*b268.02±20.99195.48±12.97*C20∶2329.09±7.86 a180.38±3.39*b2107.21±90.65269.98±20.09*C20∶3(n-3)—392.07±22.35b—797.79±56.52C20∶4(n-6)(AA)5642.15±98.82 a3821.99±59.71*6551.36±79.153873.52±23.85*C20∶5(n-3)(EPA)4849.01±59.283306.89±12.03*4837.83±57.712903.04±7.08*bC22∶6(n-3)(DHA)—69.32±3.41—44.28±1.10b∑SFAs11583.04±92.67 a6591.69±104.40*b12494.26±108.679004.84±65.73*∑MUFAs5287.55±51.371863.91±21.13*b4108.22±41.10*a5762.83±54.60∑PUFAs11550.40 ±76.47 a7917.77±71.05*b14166.31±133.788443.83±98.46*∑n-3PUFAs4849.01±47.99 3768.91±42.67*4837.83±50.283745.11±39.89*∑n-6PUFAs6372.3±78.48 a3969.11±22.67*b7221.27±80.264428.74±34.62*
注:同行中*表示繁殖前后个体间有显著性差异(P <0.05);a表示排精前与排卵前雌、雄个体间有显著性差异(P<0.05);b表示排精后与排卵后雌、雄个体间有显著性差异(P <0.05);SFAs为饱和脂肪酸总量;MUFAs为单不饱和脂肪酸总量;PUFAs为多不饱和脂肪酸总量; —表示未检出
Note: *indicates significantly different between pre-and post spawning in the same column (P<0.05);a indicates significant difference between males and females before pre spawning(P<0.05);b indicates significant difference between males and females post spawning(P<0.05); SFAs, sum of saturated fatty acids; MUFAs, sum of monounsaturated fatty acids; PUFAs, sum of polyunsaturated fatty acids; —, undetected
3 讨论
3.1 繁殖对海胆性腺指数、含水率、脂类含量的影响
性腺是海胆唯一可食用的部分,性腺品质的好坏直接决定其营养和经济价值,而性腺指数、脂肪含量和含水率是影响性腺品质的重要因素。本研究中发现,排精前雄性海胆的性腺指数(GI)略高于雌性海胆,这与孔泳滔等[21]对中间球海胆的研究结果相同,该研究发现,3月—10月雄性海胆性腺指数略高于雌性,这说明雄性海胆性腺发育速率快于雌性海胆。在繁殖季节,雄性海参往往先于雌性海参成熟,排精后再刺激雌性个体排卵。本研究中还发现,排卵/精前,雌性个体的脂类含量普遍显著高于雄性,这与沈妍等[22]在对F3代中间球海胆家系研究中得到的结果相似。与海胆相似,中华绒螯蟹也主要以性腺作为重要食用部位,研究发现,雌性性腺中的脂类含量高于雄性[23],这可能与雌性海胆繁殖前在卵黄中积累较多卵黄蛋白有关,卵黄蛋白是一种脂类含量较高的脂蛋白,是幼体发育过程中重要的营养和能量来源,其含量高低是评价卵质量的重要指标。与其他动物不同,雌、雄海胆性腺中均含有较高含量的卵黄蛋白,可达到总蛋白的10%~15%[3]。因此,海胆精/卵的排出导致海胆的性腺指数及脂类含量出现显著下降。本研究中还发现,雌、雄海胆性腺中的含水率无显著性差异,这与沈研等[24]的研究结果相同。而常亚青等[25]研究发现,雌性性腺水分显著低于雄性,这可能是由于取样时间不同所致。
3.2 繁殖对海胆性腺脂类成分含量的影响
甘油三酯和磷脂是生物生殖腺的主要脂类组分,并为其后代胚胎发育和开口前的幼体发育提供能量,研究表明,甘油三酯是巨扇贝Placopecten magellanicus[26]、大海扇贝Pecten maximus[27]和中华绒螯蟹[28]卵巢和胚胎中的主要脂类成分。本研究显示,中间球海胆性腺中脂类主要为磷脂、胆固醇、游离脂肪酸和甘油三酯,其中,磷脂是主要组成成分,繁殖前后海胆性腺中磷脂含量无显著性变化。这与对瘤背石磺Onchidium verruculatum Cuvier[10]和桃红对虾Penaeus duorarum duorarum[29]的研究结果不一致,该研究中发现,瘤背石磺繁殖后性腺中的磷脂下降了80.53%。本研究中,中间球海胆性腺中甘油三酯和游离脂肪酸在排精/卵后含量显著降低,这说明产卵后脂类水平的降低主要是甘油三酯和游离脂肪酸类。吴旭干等[10]研究发现,产卵后雌性瘤背石磺中的游离脂肪酸含量较产卵前显著升高,这可能是由于产精/卵后脂类合成代谢旺盛,以用于卵黄物质的累积,从而为下一个性腺发育周期做准备。本研究中,中间球海胆雌性性腺中胆固醇含量在产卵后显著升高,这一方面可能是中间球海胆在产卵过程中选择性利用脂类所致,另一方面,胆固醇是雌二醇等性类固醇激素的重要前体物质,性类固醇激素含量增加是促进性腺进入下一发育周期的重要物质。
通过对海胆繁殖前后脂类成分及含量变化的研究,建议在实际生产中海胆繁殖前1~2个月在饲料中添加磷脂、游离脂肪酸、甘油三酯等物质,以促进海胆性腺发育,提高海胆的营养及经济价值。
3.3 繁殖对海胆性腺脂肪酸含量的影响
本研究结果显示,中间球海胆雌、雄性腺中共有24种脂肪酸,且排精/卵前后性腺中的脂肪酸种类未发生变化,其主要饱和脂肪酸包括 C14∶0、C16∶0、C18∶0,不饱和脂肪酸包括C20∶1 、C20∶4(n-6)、C20∶5(n-3)。丁君等[16]研究4种海胆(光棘球海胆Strongylocentrotus nudus、马粪海胆Hemicentrotus pulcherrimus、海刺猬Glyptocidaris crenularis、中间球海胆)性腺脂肪酸组成时发现:马粪海胆性腺中主要不饱和脂肪酸是C20∶1、C16∶1、C20∶2、C20∶4n-6、C20∶5(n-3),其中C20∶2含量最高;海刺猬性腺中主要不饱和脂肪酸是C20∶1、C20∶4(n-6)、C20∶5(n-3),其中C20∶5(n-3)含量最高;光棘球海胆性腺中主要不饱和脂肪酸是C20∶2、C20∶4(n-6)、C20∶5(n-3),其中C20∶5(n-3)含量最高;中间海胆中主要不饱和脂肪酸是C20∶1、C20∶4(n-6)、C20∶5(n-3),其中C20∶4(n-6)含量最高。这与本研究结果相似。进一步分析发现,C20∶4(n-6)(AA)和C20∶5(n-3)(EPA)是中国北方4种经济海胆不饱和脂肪酸的主要组成成分,但这4种海胆性腺中其他种脂肪酸的组成和含量仍存在差异。
中间球海胆排精/卵前,雄性性腺中的C20∶4(n-6)(AA)含量要显著高于雌性海胆,而EPA含量则无显著性差异,这与常亚青等[25]的研究结果一致。排精/卵后,雌、雄海胆大部分脂肪酸含量显著下降,但C18∶0含量在雌性海胆产卵后显著升高,C18∶1(n-9)含量在雄海胆性排精后显著升高,同时,雄性海胆性腺中几乎所有C18到C20的不饱和脂肪酸含量均显著高于雌性性腺中相应的不饱和脂肪酸含量。而以往有研究表明,贝类产卵后部分脂肪酸含量会有升高现象[10],同时,也有研究表明,棘皮动物可利用C18单不饱和脂肪酸合成其他的长链不饱和脂肪酸(EPA、AA、DHA等)[30-31],推测中间球海胆繁殖后,性腺中脂肪酸会发生转化,且在这一过程中雄性海胆较雌性海胆有更快地脂肪酸转化、合成能力,下一步工作中,笔者将重点开展此方面的研究。
4 结论
采用毛细管气相色谱法对中间球海胆繁殖前后性腺中脂类和脂肪酸含量变化进行分析比较,结果如下:
(1)中间球海胆在排精前与排卵前,雌、雄个体间性腺指数、性腺含水率均无显著性差异(P>0.05),雌性性腺中脂类含量显著高于雄性(P<0.05)。
(2)磷脂是海胆性腺脂类的主要组分,海胆在繁殖后性腺中的游离脂肪酸和甘油三酯显著下降(P<0.05),雌性海胆排卵后胆固醇含量显著升高(P<0.05)。
(3)中间球海胆主要的饱和脂肪酸为C14∶0、C16∶0、C18∶0,不饱和脂肪酸为C20∶4(n-6)、C20∶5(n-3),雌、雄海胆性腺的大部分脂肪酸含量在排卵/精后显著下降(P<0.05),雌性海胆排卵后性腺中的C18∶0含量显著升高(P<0.05),雄性海胆排精后性腺中的C18∶1(n-9)含量显著升高(P<0.05)。