鱼类等生物体在生存过程中可能遇到各种环境(如重金属、温度、磁场等)的变化,而内外环境的变化在一定程度上会引起溶菌酶(LZM)、血液蛋白、碱性磷酸酶(AKP)和乙酰胆碱酯酶(AChE)等生物血清生化指标的变化。AKP参与体内的消化、运输等功能,是生物体中非常重要的解毒体系[1],而一定的环境胁迫会导致AKP活性下降。高举等[2]和詹付凤等[3]发现,铅离子和镉离子均对鲫Carassius auratus AKP活性有抑制作用。高权新等[4]研究发现,高温会导致银鲳幼鱼AKP活性下降。AChE不仅是细胞发育及成熟的重要参与者,还参与神经功能调节和肌肉运动等重要功能,但某些环境胁迫会抑制其活性。一定浓度的草甘膦污染液对鲫AChE均起抑制作用[5]。LZM能够破坏致病菌的细胞壁,使得致病菌死亡,起到抗菌、抗病毒等作用,但其活性同样会受到某些环境变化的影响,其中,温度上升一定程度上会促使史氏鲟Acipenser schrencki血清和组织中LZM的含量升高[6]。血液蛋白是由肝脏合成而来,其含量和质量的变化在一定程度上能反映出机体肝脏等器官是否正常,但这种变化会受到环境变化的影响,研究表明,经磁处理水饲养的鲫血清蛋白谱带与对照组有明显差异[7]。
从目前国内外研究现状来看,通过检测生化指标变化研究环境胁迫对生物体影响的报道众多,但研究电磁场对生物生理影响的报道较少,且大多以白鼠等陆生生物为研究对象。如一定强度的电磁辐射会降低大鼠的血红蛋白 [8];脉冲电磁场会导致大鼠体内多项指标异常,细胞凋亡和坏死细胞增多,从而引起机体损伤[9]。关于电磁场对鱼类的影响,目前仅有少量研究报道,如袁健美等 [10]就不同强度电磁场对12种海洋生物存活率与行为影响进行了研究;刘宪亭等[11]就磁处理水对罗非鱼Oreochromis mossambica生长的影响进行了研究;汝碧潇[12]就电磁场(ELF)对罗非鱼的生物学效应存在“窗”特性进行了研究;Formicki等[13]研究发现,鳟的仔鱼与幼鱼的行为改变会受到磁场的影响;Juutilainen[14]研究发现,ELF对哺乳动物生长发育无明显影响,但会促进其骨骼发育。另有研究表明,添加脉冲磁场作用时,大鼠心电幅值增大若干倍,且该幅值随着电流的增大而增大[15];ELF对小鼠记忆能力的影响也具有“窗效应”[16]。迄今为止,有关电磁场对鱼类生理影响的研究鲜有报道,而随着水域风电场的大规模建设,电磁场对水生生物生理、行为等的影响也越来越受到人们的关注。为此,本研究中以鲫为研究对象,外加电磁场胁迫,选取血清溶菌酶(LZM)、蛋白、碱性磷酸酶(AKP)和乙酰胆碱酯酶(AChE)等作为反映电磁场对鲫幼鱼影响的主要生化指标,通过鱼类行生理试验方法,研究了不同磁场强度环境对鲫幼鱼的影响,探讨了电磁场辐射时间及电磁场强度与各生化指标变化间的关系,以期为电磁场生物学研究提供参考。
1 材料与方法
1.1 材料
试验用鲫幼鱼和饲料来自上海南汇地区东海鱼类养殖基地。选择健康生长状况良好的鲫40尾,雌雄兼有,体长为(13±0.5)cm,体质量为(103±2)g,放于实验室水槽内暂养(无电磁场辐射)。
玻璃水箱规格为50 cm×50 cm×50 cm,水箱材质为透明亚克力板,试验前用黑色塑料板将水箱包裹,以减少光照对试验的影响。试验全程除更换试验用水和血液采集外无其他人为活动干扰。血液采集使用1 mL一次性无菌注射器。其他试验用品包括2 mL无菌离心管、37 ℃水浴锅、离心机、紫外可见分光光度计(UV-1700)、样品低温保存冰柜(DW-40W255)、盐度计(IC20-III)、便携式pH计(SG2-ELK)和压力蒸汽灭菌器(XFS-280A)。
测量鲫幼鱼生化指标的试剂盒主要有:碱性磷酸酶(AKP)测试盒(缓冲液、基质液、显色剂等),乙酰胆碱酯酶(AChE)测试盒(标准品、底物缓冲液、显色剂、抑制剂、透明剂等),溶菌酶检测试剂盒(菌粉、菌粉溶剂、标准品等),蛋白定量测试盒等,上述4种试剂盒均购于南京建成生物工程研究所,指标具体检测原理与方法见说明书。血液抗凝剂为柠檬酸葡萄糖溶液B(ACD)。
1.2 方法
1.2.1 试验装置及试验鱼饲养管理 试验在玻璃水箱中进行。根据亥姆霍兹线圈电磁场分布特点,将试验鱼缸放置在亥姆霍兹线圈中轴线处,鱼缸整体处于距中心三分之二半径范围内的均匀磁场区域,线圈可外接电源产生磁场。试验用鱼放置在水缸中,配备24 h充氧装置(图1)。水缸和底座采用亚克力材料,不影响磁场正常发生。
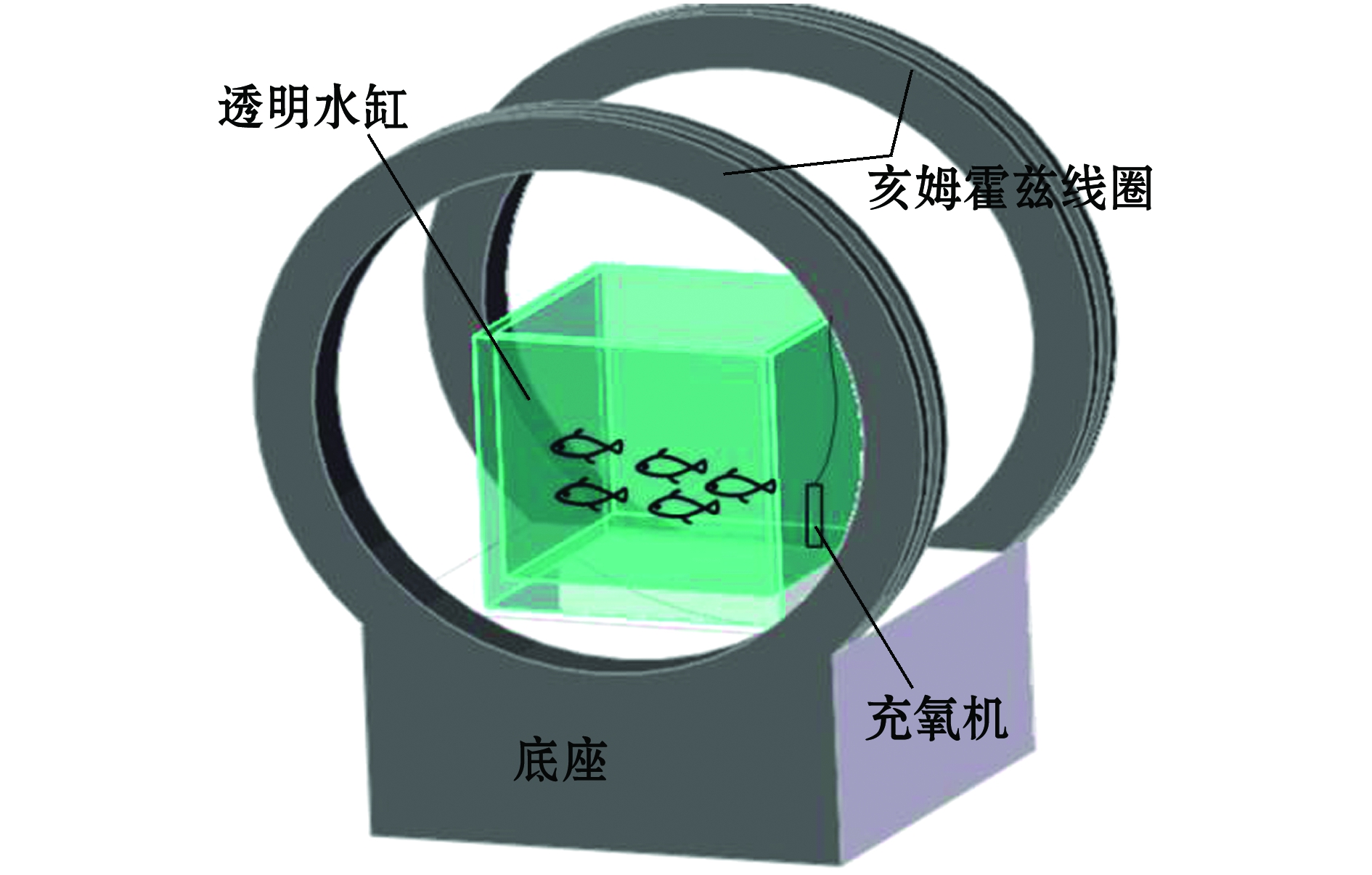
图1 电磁场对鲫幼鱼影响试验装置示意图
Fig.1 Schematic diagram of a test device in the effects of electromagnetic field on juvenile crucian carp experiment
试验用养殖水为经过48 h曝气处理的自来水,养殖过程中实行24 h增氧,溶解氧保持在(10.93±0.1)mg/L。每天定时(12:00)向每个缸内投放约6 g颗粒状饲料,每天换水1/4,水温为(10±1)℃,pH约为7.0。试验用鱼在暴露磁场试验前先暂养一周,以避免试验用鱼在采集和运输过程中因剧烈运动或环境改变而引起血液指标变化。
1.2.2 试验设计 试验中将鲫幼鱼随机分为5组,每组8尾。以相同数量不接受电磁场辐射试验鱼作为空白对照组,其余4个试验组鱼全天候不间断分别暴露在0.5、1.0、1.5、2.0 mT的恒定磁场环境中,除电磁场辐射外,其他试验条件与暂养时保持相同。血液采集时间固定于上午11:00,每48 h从鱼尾动脉采血1次,每次对所有试验鱼均采集血液样本1.5 mL,共采集5次,试验时间共持续10 d。血液样本采集后,立即以3000 r/min离心3 min,取上清液并保存于冰箱(4 ℃)中以备用。试验结束后,按照相同方法另取样本进行重复试验。试验数据取两次试验的平均值,并利用F检验进行几组样本间与对照组间的差异性分析。
2 结果与分析
2.1 不同电磁场环境下鲫血清碱性磷酸酶活性的变化
从表1可见:对照组鱼血清AKP活性在试验阶段基本保持在稳定水平(29.8~30.5 U/L),各电磁场试验组鱼血清的AKP活性随着磁场暴露时间的延长均出现不同程度的降低;从试验第2天开始至试验结束,各电磁场试验组鱼AKP活性均显著低于对照组(P<0.05);在0~4 d内AKP活性降幅较大,4~8 d内AKP活性降幅有所减缓,8~10 d内AKP活性趋于平稳;试验结束时,鲫血清中AKP活性降至初始状态的63%~65%。
从表1还可见,在不同磁场强度下,与初始值相比,从第2天开始各电磁场组鱼AKP活性变化存在显著性差异(P<0.05)。其中,2 mT试验组较其他试验组AKP活性下降幅度最大,活性最低,各电磁场试验组鱼AKP活性变化幅度为A2.0 mT>A1.5 mT>A1.0 mT>A0.5 mT。各试验组最终AKP活性为U2.0 mT<U1.5 mT<U1.0 mT<U0.5 mT。因此,在等辐射时间内,酶活性与电磁场强度呈负相关关系。
表1 电磁场对鲫幼鱼血清碱性磷酸酶活性的影响
Tab.1 Effects of electromagnetic field on alkaline phosphatase activity in serum of juvenile crucian carp U/L
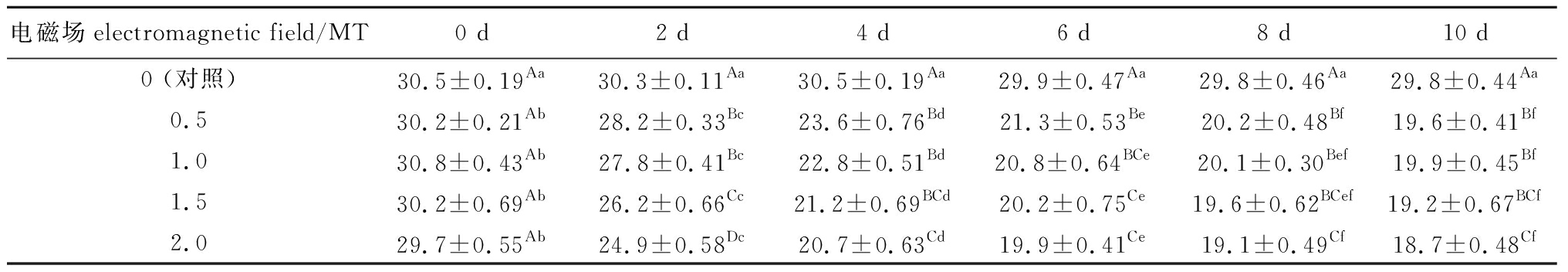
电磁场electromagnetic field/MT0 d2 d4 d6 d8 d10 d0 (对照)30.5±0.19Aa30.3±0.11Aa30.5±0.19Aa29.9±0.47Aa29.8±0.46Aa29.8±0.44Aa0.5 30.2±0.21Ab28.2±0.33Bc23.6±0.76Bd21.3±0.53Be20.2±0.48Bf19.6±0.41Bf1.0 30.8±0.43Ab27.8±0.41Bc22.8±0.51Bd20.8±0.64BCe20.1±0.30Bef19.9±0.45Bf1.5 30.2±0.69Ab26.2±0.66Cc21.2±0.69BCd20.2±0.75Ce19.6±0.62BCef19.2±0.67BCf2.0 29.7±0.55Ab24.9±0.58Dc20.7±0.63Cd19.9±0.41Ce19.1±0.49Cf18.7±0.48Cf
注:同行中标有不同小写字母者表示组内有显著性差异(P<0.05);同列中标有不同大写字母者表示组间有显著性差异(P<0.05);标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same line are significant differences in the same group at the 0.05 probability level;The means with different capital letters within the same column are significantly different among the group at the 0.05 probability level;The means with the same letters within the same line are not significant differences, et sequentia
2.2 不同电磁场环境下鲫血清蛋白含量的变化
从表2可见:对照组鱼血清总蛋白含量在试验阶段基本保持在稳定水平(37.67~39.12 g/L),各电磁场试验组鱼血清蛋白含量随着磁场暴露时间的延长均出现不同程度的降低;与对照组相比,第2天时,1.5、2.0 mT试验组血清蛋白含量下降明显(P<0.05),而1.0、0.5 mT试验组血清蛋白含量下降不明显(P>0.05);第4~10 天时,各试验组血清蛋白含量均呈明显下降(P<0.05),在0~6 d内,各电磁场试验组鱼血清蛋白含量降低幅度较大,由平均39.13 g/L降至29.50 g/L,降低了24.61%;试验结束时,各电磁场试验组血清蛋白含量是初始状态的68.26%~74.90%。
从表2还可见,对于不同磁场下的各试验组在相同暴露时间内,电磁场强度较大的试验组鱼血清总蛋白含量较低,且在暴露初期下降程度大于电磁场强度较小的试验组,但在后期基本都处于稳定。其中,1.5 mT和2.0 mT强度电磁场对血清蛋白含量均有明显的抑制作用,且抑制程度明显高于1.0 mT和0.5 mT强度,尤其是2.0 mT试验组在第2~8天时显著低于0.5、1.0 mT组(P<0.05),但1.5 mT和2.0 mT两组间蛋白含量变化程度相近(P>0.05)。各试验组对血清蛋白含量抑制变化幅度为U2.0 mT≈U1.5 mT>U1.0 mT>U0.5 mT。各试验组最终血清蛋白含量为G2.0 mT<G1.5 mT<G1.0 mT<G0.5 mT。
第8天后电磁场强度较大试验组蛋白含量较低,可能是因为较强的电磁场对鱼类肝脏等细胞的破坏性更大,导致蛋白合成效率降低,无法及时补充血液中消耗的总蛋白量。
表2 电磁场对鲫幼鱼血清蛋白含量的影响
Tab.2 Effects of electromagnetic field on protein content in serum of juvenile crucian carp g/L
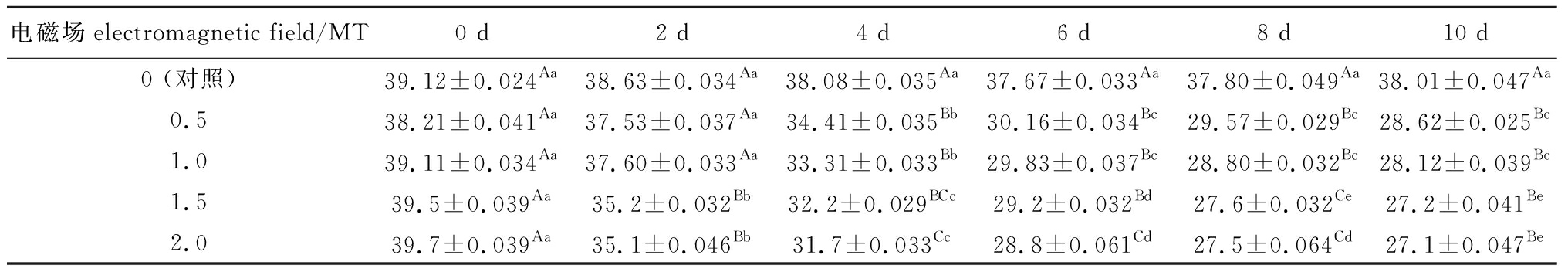
电磁场electromagnetic field/MT0 d2 d4 d6 d8 d10 d0 (对照)39.12±0.024Aa38.63±0.034Aa38.08±0.035Aa37.67±0.033Aa37.80±0.049Aa38.01±0.047Aa0.5 38.21±0.041Aa37.53±0.037Aa34.41±0.035Bb30.16±0.034Bc29.57±0.029Bc28.62±0.025Bc1.0 39.11±0.034Aa37.60±0.033Aa33.31±0.033Bb29.83±0.037Bc28.80±0.032Bc28.12±0.039Bc1.5 39.5±0.039Aa35.2±0.032Bb32.2±0.029BCc29.2±0.032Bd27.6±0.032Ce27.2±0.041Be2.0 39.7±0.039Aa35.1±0.046Bb31.7±0.033Cc28.8±0.061Cd27.5±0.064Cd27.1±0.047Be
2.3 不同电磁场环境下鲫血清乙酰胆碱酯酶活性的变化
从表3可见:对照组鱼血清AChE活性在试验阶段略有增加,但基本保持在稳定水平(2.62~2.80 U/mL),各电磁场试验组鱼体内的AChE活性随着磁场暴露时间的延长先增强后减弱,最终低于原始活性;各电磁场试验组酶活性在第2天时出现较明显的增强趋势,但与对照组相比,0.5、1.5、2.0 mT试验组AChE活性变化幅度显著增大(P<0.05);各电磁场试验组AChE活性在第4~10天时逐渐减弱,并最终下降至初始酶活性的85.98%~95.47%,对照组上升至初始酶活性的106.49%。
从表3还可见,对于不同磁场强度下的试验组在相同暴露时间内,电磁场强度较大的试验组鱼血清AChE活性波动较大,且在暴露中期下降程度大于电磁场强度较小的试验组,但在后期基本都处于稳定。在第2天时,2.0 mT和1.5 mT试验组间AChE活性增强程度较大,明显高于1.0 mT和0.5 mT试验组(P<0.05);在第8~10 天时,2.0 mT试验组AChE活性下降程度明显高于其他试验组(P<0.05)。试验过程中,各电磁场试验组AChE活性变化幅度为A2.0 mT>A1.5 mT>A1.0 mT>A0.5 mT。各电磁场试验组最终AChE活性依次为U0.5 mT>U1.5 mT>U1.0 mT>U2.0 mT。
表3 电磁场对鲫幼鱼血清乙酰胆碱酯酶活性的影响
Tab.3 Effects of electromagnetic field on acetylcholine esterase activity in serum of juvenile crucian carp U/mL

电磁场electromagnetic field/MT0 d2 d4 d6 d8 d10 d0 (对照)2.62±0.022Aa2.64±0.034Aa2.71±0.019Ab2.76±0.043Abc2.80±0.035Ac2.79±0.033Ac0.5 2.65±0.037Aa2.72±0.037Bb2.61±0.029ABc2.58±0.024Bd2.54±0.046Bde2.53±0.032Be1.0 2.59±0.043Aa2.68±0.039Ab2.58±0.027Bc2.47±0.034CDd2.41±0.039Ce2.39±0.033Ce1.5 2.64±0.037Aa2.83±0.024Cb2.72±0.035Ac2.52±0.022Cd2.48±0.026Dd2.43±0.026Ce2.0 2.71±0.027Aa2.92±0.024Db2.57±0.054Bc2.44±0.026Dd2.35±0.021Ee2.33±0.030De
2.4 不同电磁场环境下鲫血清溶菌酶活性的变化
从表4可见:对照组鱼血清LZM活性在试验阶段基本保持在稳定水平(198.53~205.75 U/mL),各电磁组试验组鱼血清LZM活性随磁场暴露时间的延长呈先增强后减弱趋势,最终低于原始活性。其中,在0~4 d内,LZM活性出现增强,在2 mT电磁场环境中酶活性最强,达到了253.09 U/mL;4~10 d时,LZM活性稳步下降,在第10 天时达到最低水平(178.98~198.83 U/mL)。在第2~6 天时,各电磁场试验组鱼LZM活性明显高于对照组(P<0.05);在第8天时,1.0 mT试验组LZM活性仍然显著高于对照组(P<0.05),其他试验组LZM活性均下降至对照组水平(P>0.05),在第10天时,1.5、2.0 mT试验组LZM活性显著低于对照组(P<0.05),其他试验组LZM活性略低于对照组(P>0.05)。
从表4还可见,在第2天时各试验组之间LZM活性变化存在差异性(P<0.05),第4 天时2.0 mT试验组LZM活性明显高于其他试验组(P<0.05),第6~8天时,1.0 mT试验组LZM活性高于其他试验组(P<0.05),第10天时,2.0 mT试验组LZM活性明显低于其他试验组(P<0.05)。因此,不同强度电磁场辐射对鲫血清LZM活性影响程度不同。试验过程中,各电磁场试验组LZM活性变化幅度为A2.0 mT>A1.5 mT>A1.0 mT>A0.5 mT,各电磁场试验组最终LZM活性依次为U0.5 mT≈U1.0 mT>U1.5 mT>U2.0 mT。
表4 电磁场对鲫幼鱼血清溶菌酶活性的影响
Tab.4 Effects of electromagnetic field on lysozyme activity in serum of juvenile crucian carp U/mL

电磁场electromagnetic field/MT0 d2 d4 d6 d8 d10 d0 (对照)198.53±0.72Aa205.75±0.76Aa205.37±0.75Aa203.28±0.76Aa199.84±0.78Aa198.83±0.75Aa0.5 198.72±0.77Aa215.82±0.73Bb221.68±0.75Bc233.18±0.72Bd200.65±1.19Aa195.03±0.57Aa1.0 199.11±0.76Aa210.63±1.19Cb228.32±1.06Cc241.26±0.73Cd211.68±0.77Be197.27±1.19Aa1.5 198.81±0.99Aa211.59±1.32Cb247.13±1.12Dc219.87±1.12Dd198.75±1.10Aa186.07±1.11Be2.0 199.43±1.19Aa219.37±1.07Eb253.09±1.20Ec218.66±1.21Dd197.64±1.20Aa178.98±0.56Ce
3 讨论
鱼类本身生存的环境为自然电磁环境,电磁强度较弱,而人为制造的电磁环境为强电磁环境。因此,外加0.5~2.0 mT强度的电磁场必然引起鲫原有生存环境的变化,而这种电磁胁迫可能会一定程度上引起鲫体内生化指标变化。
3.1 电磁场对鲫血清碱性磷酸酶活性的影响
从本试验结果可以看出,外界电磁场环境的变化也会引起鱼类体内AKP活性的变化,主要表现为抑制作用。AKP活性在试验前期下降较快,这可能是由于外界电磁环境急性变化引起的。高权新等[4]认为,急性温度胁迫能够显著影响银鲳幼鱼的正常代谢,并在一定程度上改变其体内AKP活性,其中高温处理使得鱼体内AKP活性下降。而本研究结果显示,磁场胁迫也会引起鲫幼鱼血清AKP的变化,在磁场强度为2 mT的情况下,鲫幼鱼体内AKP活性下降幅度最大,且AKP活性下趋势与磁场强度增强呈负相关,而随着时间的延长,AKP活性变化趋于平稳。
高举等[2]研究认为,铅离子能够对鲫不同器官及组织的AKP产生差异性影响,对鲫肠、鳃组织中的AKP活性起到了抑制作用。詹付凤等[3]研究发现,镉对鲫不同器官及组织的AKP影响也存在差异。周洋等[17]研究发现,150 mT的恒定磁场(CMF)能够促进小鼠成骨细胞的增殖与功能,而200 mT的CMF对小鼠成骨细胞的增殖及功能有抑制作用。李玥等[18]研究发现,30、100、200 μT的极低频磁场(ELE-MF)对日本长耳大白兔体质量、血常规和肝肾功能无影响。因此,内外界环境的变化可能会引起包括鱼类在内的生物体体内生化指标和器官的变化。
3.2 电磁场对鲫血清蛋白含量的影响
从本试验结果可知,电磁胁迫引起了鲫血清蛋白含量的变化,主要表现为抑制作用。血清蛋白含量在试验前期(0~6 d)下降较快,这可能是由于外界电磁环境急性变化引起的。而随着时间的延长,血清蛋白含量变化趋于平稳,这可能是体内蛋白含量达到最低状态而无法继续下降,或者是电磁场抑制了某些与蛋白质的生物合成有关的酶的活性。曾仕廉等[7]研究发现,用磁处理水饲养的鲫血清蛋白谱带与对照组有明显差异,血清蛋白谱带平均变化率为32.5%,磁处理水对鲫的最佳影响时期为10 d左右。这与本研究中鲫幼鱼血清蛋白含量在试验组与对照组间的变化差异及试验组随试验时间产生变化的研究结果相一致。
3.3 电磁场对鲫血清乙酰胆碱酯酶活性的影响
杨煜荣等[19]通过对小白鼠外加3100 Gs电磁场研究发现,电磁场能增加正常小白鼠血清胆碱酯酶活性,而Barnothy[20]也发现了此规律。林建原等[21]在磁场对AChE活性影响的研究中发现,磁化时间为120 min、磁场强度为150 mT时,AChE活力增加24.0%,如果作用时间达 15 h, AChE的活性基本丧失。所以,不同强度的电磁场对不同生物的AChE影响也不同。而本研究结果显示,在第0~2天内,鲫幼鱼血清AChE活性出现增强,甚至在2.0 mT电磁场环境中酶活性最强,达到了2.92 U/mL。初步分析认为,电磁场对鱼体的刺激引起鱼体神经系统分泌过多乙酰胆碱,为了水解过多乙酰胆碱,保持鱼体系统稳定,从而分泌较多的AChE。第2~8天时酶活性的降低速度较快,这可能是由于较长时间暴露,引起细胞坏死或蛋白质分子构象异常所导致[22],具体原因有待进一步研究;第8~10天时AChE活性趋于稳定并处在较低水平,此时已有少量试验鱼出现萎靡不振甚至死亡现象。
本试验中,电磁场强度较大试验组鱼血清AChE酶活性波动也较大,可能是因为较强的电磁场对鱼类细胞通透性或神经递质的传递影响较大,其造成的瞬间刺激作用也较为明显,极易容易引起鱼体不适,导致鱼体做出应激反应。
3.4 电磁场对鲫血清溶菌酶活性的影响
从本试验结果可知,在相同暴露时间内,电磁场强度较大的试验组鱼血清LZM酶活性波动较大,且在暴露中期下降程度大于电磁场强度较小的试验组。电磁场强度较大试验组LZM酶活性波动大,可能是因为较强的电磁场对鱼类的瞬间刺激作用较为明显,体内坏死细胞等较多,鱼体为分解坏死细胞等分泌大量LZM,后因长期辐射,引起免疫系统紊乱,导致LZM活性降低。
王文博等[23]研究发现,高密度养殖鲫会使其血清中LZM活性受到抑制,影响其健康。邓平平等[24]研究发现,盐度对长江刀鲫的非特异性免疫酶活性有一定影响。王炜军等[25]在其研究中发现,LZM本身具有一定磁性,其活性会受到磁的影响。因此,在外加电磁场胁迫时,LZM活性发生一定程度的变化。结合本研究初步判断,一定强度的电磁场胁迫会抑制鲫血清LZM活性。
4 结论
电磁场对鲫血清4种生化指标的影响基本为抑制作用,说明多数外界环境的变化对鱼体本身会造成不利影响。而电磁场对这些酶或蛋白质的影响机制目前还不确定,可能是通过直接作用试验对象本身而产生应激性,进而影响其功能,也有可能对构成这些物质的蛋白质等分子产生影响。但通过本研究发现,电磁场对血清蛋白含量有减少的作用。因此,一系列酶活性的降低极有可能是由血清蛋白含量减少造成的。酶活性的降低和蛋白含量的减少说明磁场对其需要长时间影响才能产生。
[1] 何海琪,孙凤.中国对虾酸性和碱性磷酸酶的特性研究[J].海洋与湖沼,1992,23(5):555-560.
[2] 高举,赵欣平,詹付凤,等.铅对鲫鱼碱性磷酸酶和酸性磷酸酶活性的影响[J].四川动物,2008,27(2):201-204.
[3] 詹付凤,赵欣平.重金属镉对鲫鱼碱性磷酸酶和酸性磷酸酶活性的影响[J].四川动物,2007,26(3):641-643.
[4] 高权新,谢明媚,彭士明,等.急性温度胁迫对银鲳幼鱼代谢酶、离子酶活性及血清离子浓度的影响[J].南方水产科学,2016,12(2):59-66.
[5] 张彬彬.草甘膦对鲫鱼肝脏内膜系统和乙酰胆碱酯酶的影响[J].滨州学院学报,2011,27(3):93-96.
[6] 华育平,刘红柏,张颖.温度、疾病感染对史氏鲟血清和各组织中溶菌酶水平的影响[J].东北林业大学学报,2005,33(3):63-66.
[7] 曾仕廉,傅蕙英.磁处理水对鲫鱼血清蛋白和乳酸脱氢酶同工酶的影响[J].水生生物学报,1994,18(1):32-36.
[8] Cakir D U,Yokus B,Akdag M Z,et al.Alterations of hematological variations in rats exposed to extremely low frequency magnetic fields(50 Hz)[J].Archives of Medical Research,2009,40(5):352-356.
[9] Emre M,Cetiner S,Zencir S,et al.Oxidative stress and apoptosis in relation to exposure to magnetic field[J].Cell Biochemistry and Biophysics,2011,59(2):71-77.
[10] 袁健美,贲成恺,高继先,等.海上风电磁场对12种海洋生物存活率与行为的影响[J].生态学杂志, 2016,35(11):3051-3056.
[11] 刘宪亭,鲁大椿,孙小异,等.磁水对莫桑比克罗非鱼生长的作用效果[J].淡水渔业,1981(3): 34-37.
[12] 汝碧潇.极低频电磁场对罗非鱼生长影响及其机制探讨[D].武汉:华中科技大学,2012.
[13] Formicki K,Sadowski M,Tański A,et al.Behaviour of trout (Salmo trutta L.) larvae and fry in a constant magnetic field[J].Journal of Applied Ichthyology,2004,20(4):290-294.
[14] Juutilainen J.Developmental effects of electromagnetic fields[J].Bioelectromagnetics,2005,26(S7):S107-S115.
[15] 常斌.生物体电磁兼容研究[D].天津:天津大学,2007.
[16] 席晓莉,文峻,王斯刚,等.低频脉冲磁场对小鼠学习记忆能力的影响 [J].第四军医大学学报,1998,19(2):214-215.
[17] 周洋,曾融生,官晨雨,等.不同强度恒定磁场对小鼠成骨细胞增殖及功能的影响[J].中华口腔医学研究杂志:电子版,2015,9(3):185-192.
[18] 李玥,刘兴发,张丞,等.极低频磁场对兔血常规和肝肾功能的影响[J].高电压技术,2013,39(1):188-192.
[19] 杨煜荣,王勇,冯华,等.电磁场对小白鼠血清胆碱酯酶活性的影响[J].内蒙古医学杂志,1982,2(4):470-472.
[20] Barnothy M F.Biological Effects of Magnetic Fields:Volume 2[M].New York:Plenum Press,1994:79-102.
[21] 林建原,黄志勤,朱元保.乙酰胆碱酯酶的磁效应研究[J].赣南医学院学报,2004,24(3):241-242.
[22] 吉尔鲍特G G.酶法分析手册[M].缪辉南,陈石根,译.上海:上海科学技术出版社,1982:71-76.
[23] 王文博,汪建国,李爱华,等.拥挤胁迫后鲫鱼血液皮质醇和溶菌酶水平的变化及对病原的敏感性[J].中国水产科学,2004,11(5):408-412.
[24] 邓平平,施永海,汪洋,等.盐度对长江刀鲚幼鱼非特异性免疫酶和消化酶活力的影响[J].大连海洋大学学报,2016,31(5):533-537.
[25] 王炜军,方颖,黄国林.蛋壳残留溶菌酶的磁性亲和分离[J].华南农业大学学报,2005,26(4):62-66.