糖类是廉价且重要的能源物质,不仅为机体提供能量,而且参与合成非必需氨基酸[1]。在饲料中添加适量的糖类不仅可以节约蛋白质,降低饲料成本,同时还能减少氨氮的排放,减轻对水体环境的污染[2]。鱼类被认为是“先天的糖尿病体质”,其对糖类的利用能力远不如陆生动物[3],饲料中糖水平超过一定限度会导致鱼类生长迟缓,抗病力减弱,甚至死亡[4-5]。因而,如何提高鱼类对糖类的利用能力已成为其营养学的研究重点。
铬是一种人体和动物体必需的微量元素,在机体内主要以三价铬离子(Cr3+)的形式存在。铬毒性小,在肝脏组织中含量较高[6-7]。铬在机体中主要影响糖代谢过程,是胰岛素活性的辅因子和葡萄糖耐量因子。目前,铬作为营养素在水产养殖上的研究已经取得一些成果,研究表明,在饲料中添加适宜水平的Cr3+可以有效促进草鱼Ctenopharyngodon idellus[8]、团头鲂Megalobrama amblycephala[9]、大黄鱼Larmichthys crocea[10]、虹鳟Oncorhynchus mykiss[11]、凡纳滨对虾Litopenaeus vannamei[12]和中华绒螯蟹Eriocheir sinensis[13]的生长性能,提高罗非鱼Oreochromis niloticus×Oreochromis aureus[14]、条纹鲈Morone saxatilis[15]的糖利用能力,还可增强莫桑比克罗非鱼[16]、虹鳟[17]免疫机能,此外,Cr3+还能有效改善鱼体应激状态[18-19]。
鲤是中国重要的经济养殖鱼类,具有抗病力和生活力强等特点。目前,已有学者在用Cr3+促进鲤生长和加强饲料利用方面做了一些研究[20-21],但有关Cr3+影响鲤糖利用能力的研究较少,且这些研究所使用的铬源多是无机铬盐,而动物对无机铬的利用率远低于有机铬,有机铬的生物活性也更强[22-23]。蛋氨酸铬(CrMet)是蛋氨酸与Cr3+的螯合物,能够有效缓解矿物元素之间的拮抗竞争作用,更有利于铬的吸收。笔者前期研究了不同Cr3+水平对鲤生长、血液指标和部分免疫指标的影响,结果发现,0.8 mg/kg Cr3+组获得最优生长性能和免疫力[24]。为进一步探讨Cr3+对鲤糖利用能力的影响,本试验在饲料中添加不同水平蛋氨酸铬,检测其对鲤糖代谢相关酶活力及其基因表达的影响,旨在为探究铬促进鲤糖代谢的机理提供参考。
1 材料与方法
1.1 材料
CrMet购自湖北拓楚慷元医药化工有限公司,有效含量为99%,Cr3+含量为80%。试验用鲤购自天津晨辉饲料有限公司。
1.2 方法
1.2.1 试验饲料的制备 以酪蛋白为蛋白源,大豆油为脂肪源,糊精为糖源,CrMet为铬源,基础饲料配方为:豆油6.0%、预混物1.0%、氯化胆碱0.2%、微晶纤维素19.0%、羧甲其纤维素钠2.0%、磷酸二氢钙1.8%、糊精35.0%,在基础饲料中添加Cr3+水平分别为0(对照)、0.1、0.2、0.4、0.8、1.6、3.2 mg/kg(饲料),制成7种纯化饲料。所有饲料原料均过80目筛,原料逐级放大混匀后,用双螺杆制粒机制成颗粒饲料,饲料自然风干后保存备用。饲料常规营养组成见表1。
表1 试验饲料的常规营养组成
Tab.1 Approximate nutrient composition of the experimental dietsw/%
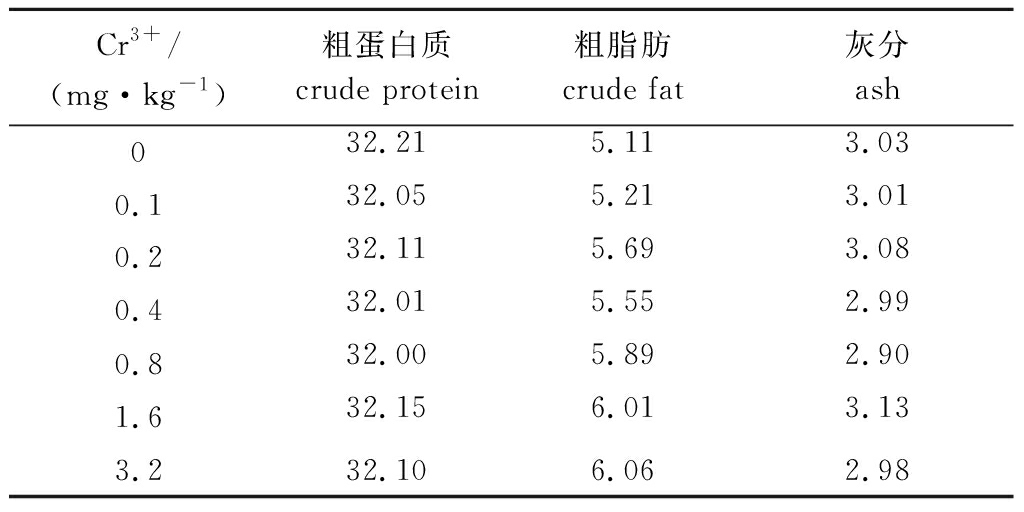
Cr3+/(mg·kg-1)粗蛋白质crude protein粗脂肪crude fat灰分ash032.215.113.030.132.055.213.010.232.115.693.080.432.015.552.990.832.005.892.901.632.156.013.133.232.106.062.98
分别采用105 ℃烘干恒重法、凯氏微量定氮法、索式抽提法和马弗炉550 ℃灼烧法测定水分、粗蛋白质、粗脂肪和灰分含量。
1.2.2 试验设计 试验于天津晨辉饲料有限公司养殖基地进行,正式试验开始前先进行1周暂养驯化,期间用不添加Cr3+的基础组饲料投喂,待试验鱼适应养殖基地环境后,从中选取健康的体质量为(40.95±4.80)g的试验鱼,随机分为7组,每组设3个重复,每个重复60尾鱼。于每日8:00和17:00投喂,投喂量为鱼体质量的3%~4%,投喂后1 h吸去粪便,日换水量为1/3~1/2,养殖容器为800 L蓝色塑料水箱。试验期间,水温为(28.0±1.0)℃,水体pH为(7.0±0.2),水中溶解氧≥5.0 mg/L,氨氮≤0.05 mg/L,养殖周期为8周。
1.2.3 样品采集 饲养试验结束后,禁饲48 h,从每箱中随机选取10尾鱼,用MS-222麻醉后迅速置于冰盘上进行解剖,取其肝胰脏,放入液氮中速冻后,转入超低温冰箱(-80 ℃)中保存,以备进行肝胰脏糖代谢酶活性的测定。
余下的试验鱼在禁饲48 h后进行再投喂,于投喂0、3、6、12、24、48 h时取0(对照)、0.8、3.2 mg/kg Cr3+组试验鱼的肝胰脏和肠道,放入液氮中速冻后,转入超低温冰箱(-80 ℃)中保存,用于糖代谢相关基因表达的检测。
1.2.4 糖代谢酶活力测定 肝胰脏解冻后按质量与体积比为1 mg∶9 mL加入预冷的生理盐水,使用玻璃匀浆器在冰水浴中制成10% 的组织匀浆液,4 ℃下以4000 r/min离心10 min,取上清液。肝胰脏中己糖激酶(Hexokinase, HK)、丙酮酸激酶(Pyruvate Kinase, PK)、琥珀酸脱氢酶(Succinate Dehydrogenase, SDH)均采用南京建成生物工程研究所生产的试剂盒测定;磷酸烯醇式丙酮酸激酶(Phosphoenolpyruvate carboxykinase, PEPCK)、磷酸果糖激酶(Phosphofructokinase, PFK)、葡萄糖-6-磷酸脱氢酶(Glucose 6-phosphatedehydrogenase, G6PDH) 活性均采用Elisa试剂盒(Assay Designs公司)测定。
1.2.5 总RNA提取及荧光定量PCR表达
(1)总RNA提取及cDNA合成。分别取适量肝胰脏、肠道组织(约50 mg),剪碎后放入玻璃匀浆器中,加2 mL RNAiso Plus研磨组织至完全弥散均匀。按照RNAiso Plus说明书提取鲤肝胰脏RNA。提取RNA过程中使用的离心管、枪头等耗材均经去RNA酶处理。最后加适量DEPC水溶解。利用微量分光光度计测定鲤肝胰脏总RNA的OD260 nm/OD280 nm值,均在1.8~2.1,说明提取出的总RNA纯度较高。再利用PrimeScriptTM RT Master Mix试剂盒(TaKaRa),将肝胰脏中的总RNA反转录为cDNA第一链。
(2)引物设计。采用Primer Premier 6.0软件进行引物设计,引物设计所依据的基因模板序列均来源于NCBI DNA数据库。引物由苏州金唯智生物科技有限公司合成。以β-肌动蛋白基因(β-actin)(序列号M24113)作为内参基因。引物设计见表2,其中IR为胰岛素受体基因(序列号EU009571.1),GLUT2为葡萄糖转运载体2基因(序列号AF247730.1),SGLT为钠/葡萄糖共转运载体基因(序列号JN867793.1)。
表2 引物设计
Tab.2 Primer design
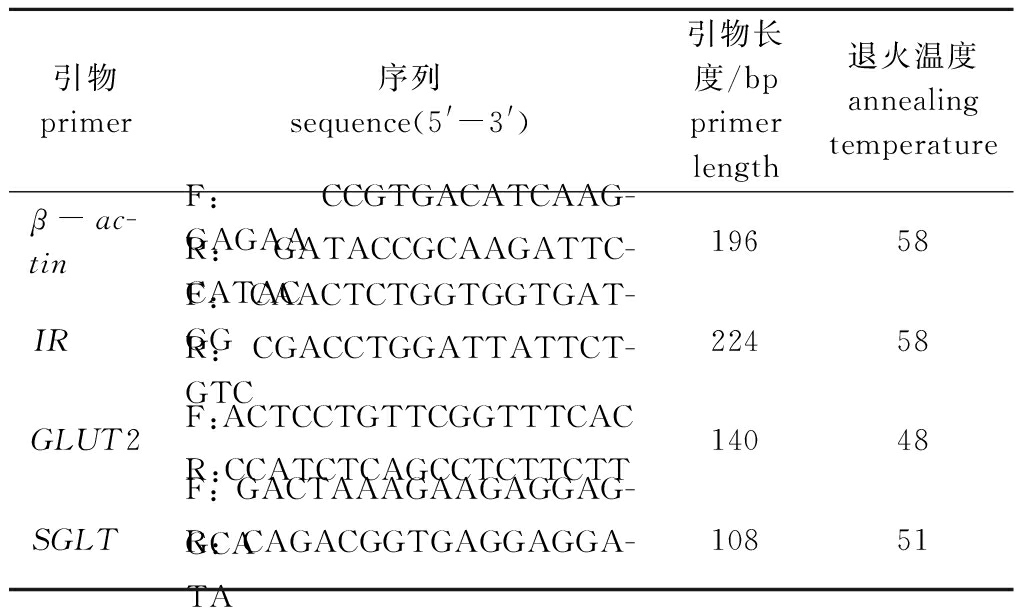
引物 primer序列sequence(5'-3')引物长度/bpprimer length退火温度annealing temperatureβ-ac-tinF:CCGTGACATCAAG-GAGAAR:GATACCGCAAGATTC-CATAC19658IRF:CAACTCTGGTGGTGAT-GGR:CGACCTGGATTATTCT-GTC224 58GLUT2F:ACTCCTGTTCGGTTTCAC R:CCATCTCAGCCTCTTCTT140 48SGLTF:GACTAAAGAAGAGGAG-GCAR:CAGACGGTGAGGAGGA-TA108 51
(3)荧光定量。荧光定量PCR采用SYBR Green染色法,选用SYBR® Premix Ex TaqTM Ⅱ试剂盒,在BIO-RAD系统进行,采用两步法。PCR反应体系(共20 μL):SYBR Premix Ex Taq Ⅱ(2×)10 μL,上、下游引物(10 μmol/L)各0.5 μL,cDNA 2 μL,ddH2O 7 μL。
PCR反应条件为:95 ℃下预变性3 min;95 ℃下循环变性15 s,51~58 ℃下退火复性15 s,共进行40个循环;72 ℃下再延伸2 min。收集荧光信号,每个样本重复3次,目的基因相对表达量用2-△△Ct法进行计算。
1.3 数据处理
试验数据均用平均值±标准差(mean±S.D.)表示。采用SPSS 19.0软件进行单因素方差分析(ANOVA),用Duncan法进行多重比较。
2 结果与分析
2.1 不同Cr3+水平对鲤肝胰脏糖代谢酶活力的影响
从表3可见:Cr3+添加水平为0.8~1.6 mg/kg时,试验鱼肝胰脏HK活力显著高于其他各组(P<0.05),而PEPCK活力则显著低于对照组和3.2 mg/kg Cr3+添加组(P<0.05);PK活力在Cr3+添加水平为0.2~1.6 mg/kg时,显著高于对照组和0.1 mg/kg Cr3+添加组(P<0.05);PFK活力在Cr3+添加水平为0.8~3.2 mg/kg时,显著高于其他各组(P<0.05);SDH活力最高值出现在0.8 mg/kg Cr3+添加组,显著高于对照组、0.1、0.2、1.6、3.2 mg/kg Cr3+添加组(P<0.05);而Cr3+添加水平对G6PDH活力无显著性影响(P>0.05)。
表3 不同Cr3+水平对鲤肝胰脏糖代谢酶活力的影响
Tab.3 Effects of Cr3+ levels on activities of enzymes related to carbohydrate metabolism in hepatopancreas of common carp
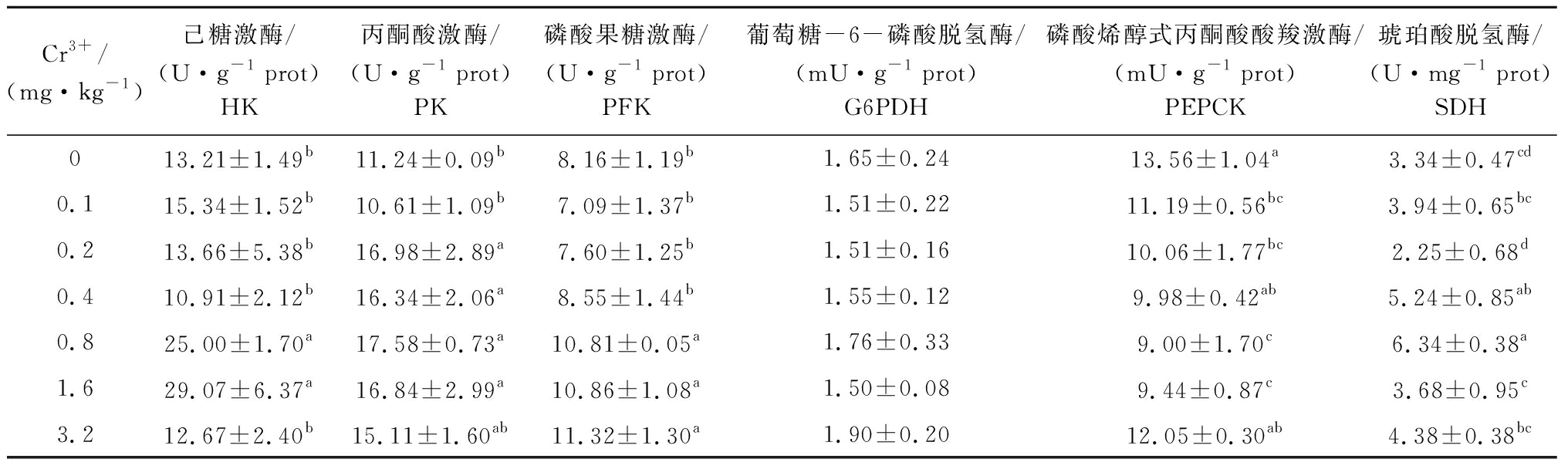
Cr3+/(mg·kg-1)己糖激酶/(U·g-1 prot)HK丙酮酸激酶/(U·g-1 prot)PK磷酸果糖激酶/(U·g-1 prot)PFK 葡萄糖-6-磷酸脱氢酶/(mU·g-1 prot)G6PDH磷酸烯醇式丙酮酸酸羧激酶/(mU·g-1 prot)PEPCK琥珀酸脱氢酶/(U·mg-1 prot)SDH0 13.21±1.49b11.24±0.09b8.16±1.19b1.65±0.2413.56±1.04a3.34±0.47cd0.1 15.34±1.52b10.61±1.09b7.09±1.37b1.51±0.2211.19±0.56bc3.94±0.65bc0.2 13.66±5.38b16.98±2.89a7.60±1.25b1.51±0.1610.06±1.77bc2.25±0.68d0.4 10.91±2.12b16.34±2.06a8.55±1.44b1.55±0.129.98±0.42ab5.24±0.85ab0.8 25.00±1.70a17.58±0.73a10.81±0.05a1.76±0.339.00±1.70c6.34±0.38a1.6 29.07±6.37a16.84±2.99a10.86±1.08a1.50±0.089.44±0.87c3.68±0.95c3.2 12.67±2.40b15.11±1.60ab11.32±1.30a1.90±0.2012.05±0.30ab4.38±0.38bc
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2 禁食再投喂后不同Cr3+水平对鲤糖代谢相关基因表达的影响
2.2.1 Cr3+水平对鲤肝胰脏IR基因表达的影响 从表4可见:禁食再投喂后,各组试验鱼肝胰脏中IR mRNA表达量均在12 h时达到峰值,其中,对照组、3.2 mg/kg Cr3+添加组的IR mRNA表达量在12 h时显著高于其他时间点(P<0.05);0.8 mg/kg Cr3+添加组的IR mRNA表达量在12 h时显著高于0、3、6、48 h时(P<0.05),但与24 h时相比无显著性差异(P>0.05)。3、12 h时,0.8 mg/kg Cr3+添加组IR mRNA表达量显著高于3.2 mg/kg组(P<0.05),但与对照组均无显著性差异(P>0.05);24、48 h时,0.8 mg/kg Cr3+组IR mRNA表达量显著高于对照组和3.2 mg/kg组(P<0.05)。
表4 禁食再投喂后不同Cr3+水平下鲤肝胰脏IR表达变化情况
Tab.4 The IR expression in hepatopancreas of common carp refed diets containing different levels of Cr3+ after fasten

Cr3+/(mg·kg-1)0 h3 h6 h12 h24 h48 h0 1.00±0.00b0.86±0.06ABb1.03±0.15Ab1.82±0.09ABa0.95±0.08Bb0.87±0.03Bb0.8 1.00±0.00c0.88±0.05Ac0.94±0.13Ac2.17±0.29Aa1.95±0.01Aa1.34±0.02Ab3.21.00±0.00b0.69±0.06Bcd0.89±0.02Abc1.29±0.19Ba0.86±0.08Bbc0.57±0.08Cd
注:标有不同小写字母表示同组内不同时间点有显著性差异(P<0.05);标有不同大写字母表示相同时间点不同组间有显著性差异(P<0.05);标有相同字母者表示组间有显著性差异(P>0.05),下同
Note: Means with different letters are significant differences at different time in the same group;means with different capital letters are significant differences in different groups at the same time, and means with same letters are not significant differences, et sequentia
2.2.2 Cr3+水平对鲤肝胰脏GLUT2基因表达的影响 从表5可见:禁食再投喂后,不同Cr3+水平组鲤肝胰脏中GLUT2 mRNA表达量均随投喂时间的延长而呈先上升后下降的趋势,对照组鲤肝胰脏GLUT2 mRNA表达量在3、6 h时显著高于12、24、48 h时(P<0.05);0.8 mg/kg Cr3+添加组鲤GLUT2 mRNA表达量在6 h时达到峰值,且显著高于除12 h外的其他各时间点(P<0.05);3.2 mg/kg Cr3+添加组鲤GLUT2 mRNA表达量峰值也出现在6 h时,且显著高于除3 h外的其他各时间点(P<0.05)。3 h时,0.8、3.2 Cr3+mg/kg 添加GLUT2 mRNA表达量均显著高于对照组(P<0.05);而6 h时,各组间均无显著性差异(P>0.05);12、24、48 h时,0.8 mg/kg Cr3+添加组GLUT2 mRNA表达量显著高于对照组和3.2 mg/kg Cr3+添加组(P<0.05)。
表5 禁食再投喂后不同Cr3+水平下鲤肝胰脏GLUT2表达变化情况
Tab.5 The GLUT2 expression in hepatopancreas of common carp refed diets containing different levels of Cr3+ after fasten

Cr3+/(mg·kg-1)0 h3 h6 h12 h24 h48 h00.83.21.00±0.00ab1.00±0.00d1.00±0.00b1.11±0.05Ba1.17±0.08Acd1.35±0.03Aa1.21±0.22Aa1.92±0.29Aa1.42±0.32Aa0.82±0.01Bb1.71±0.19Aab0.99±0.03Bb0.84±0.05Bb1.38±0.10Abc0.95±0.05Bb0.55±0.02Cc1.11±0.03Acd0.81±0.02Bb
2.2.3 Cr3+水平对鲤肠道SGLT 表达的影响 从表6可见:禁食再投喂后,不同Cr3+水平组鲤肠道中SGLT mRNA表达量均在12 h时达到峰值,其中,对照组和3.2 mg/kg Cr3+组SGLT mRNA表达量显著高于其他各时间点(P<0.05),0.8 mg/kg Cr3+添加组表达量显著高于除6 h外的其他各时间点(P<0.05);各时间点下,不同水平蛋氨酸铬处理后鲤肠道中SGLT mRNA表达量均无显著性差异(P>0.05)。
表6 禁食再投喂后不同Cr3+水平下鲤肠道SGLT表达变化情况
Tab.6 The SGLT expression in intestine of common carp refed diets containing different levels of Cr3+ after fasten

Cr3+/(mg·kg-1)0 h3 h6 h12 h24 h48 h00.83.21.00±0.00b1.00±0.00b1.00±0.00c0.88±0.04b0.91±0.11b0.84±0.10c0.94±0.16b1.37±0.09ab1.39±0.14b1.75±0.13a2.36±0.27a1.88±0.24a0.89±0.01b1.15±0.17b0.76±0.10c1.05±0.04b0.85±0.13b0.98±0.05c
3 讨论
3.1 Cr3+对鲤糖代谢酶活力的影响
Cr3+通过调节葡萄糖代谢酶影响机体葡萄糖代谢。糖酵解是包括鱼类在内的所有生物有机体唯一的葡萄糖分解途径。HK是肝胰脏利用葡萄糖的第一限速酶,它能催化葡萄糖生成葡萄糖-6磷酸,其活性受葡萄糖-6-磷酸的抑制,这一反应保证进入细胞的葡萄糖能立即被磷酸化,其活性高低决定了机体糖代谢和胰岛素分泌的幅度[25]。除HK外,PK也是控制糖酵解途径速率的关键酶。PK催化的反应是葡萄糖生成丙酮酸的最后一步反应,即催化磷酸烯醇式丙酮酸转化成丙酮酸。本试验中,在饲料中添加0.8 mg/kg Cr3+后,HK、PFK和PK活性均较对照组及低水平Cr3+组显著升高,说明Cr3+能够刺激鱼体糖酵解过程,加速葡萄糖的分解代谢。张宏馨等[26]研究发现,给糖尿病小鼠灌喂富铬酵母水溶液后,其HK活力显著升高,与本试验结果相类似。而Ahmed 等[20]对鲤的研究发现,饲料中添加CrCl3对其HK活力无影响,与本试验结果不同,其原因可能是由于试验采用的铬源不同造成的,本试验中使用的是氨基酸螯合铬,一般认为,在生理环境中,有机铬的生物活性和稳定性远高于无机铬[27],无机铬的吸收率仅为1%~3%[28],而有机铬的吸收率可达10%~25%[29],而且氨基酸螯合铬还能够有效缓解矿物元素间的拮抗竞争作用,因而,本试验结果可能因为试验鱼吸收更多的Cr3+所致。潘庆等[30]对奥尼罗非鱼的研究发现,经吡啶羧酸铬处理后,试验鱼肝胰脏PFK活力显著升高,也与本试验结果相类似。
PEPCK作为糖异生关键的限速酶,能催化草酰乙酸在磷酸烯醇式丙酮酸转移[31]。研究发现,Cr3+一方面在机体内形成核酸衍生物直接抑制PEPCK活性[32];另一方面又可以通过提高胰岛素效率而进一步间接抑制活性。本试验中,在饲料中添加0.8、1.6 mg/kg的Cr3+时有效降低了PEPCK活性,与乔伟[33]对大鼠的研究结果相一致。SDH是三羧酸循环(TCA)的限速酶之一,研究发现,经Cr3+处理后,大鼠骨骼肌细胞SDH活性显著升高,分析其原因可能是Cr3+通过增强胰岛素的生物学功能,进而提高胰岛素对SDH活性的影响[33]。本试验结果与上述结果相类似,在饲料中添加0.8 mg/kg Cr3+后,鲤肝胰脏的SDH活性显著升高,说明Cr3+有助于促进鲤葡萄糖分解代谢功能,提高葡萄糖转化为能量的利用效率。本试验中,当Cr3+添加水平为3.2 mg/kg时,HK、PK、PEPCK和SDH活性均回到与对照组相似水平,说明Cr3+添加量过多,反而会对鲤的糖利用能力产生负面影响。G6PDH是糖代谢的磷酸戊糖途径的关键酶。本试验中,Cr3+未对G6PDH产生显著影响,这与Pan等[34]对罗非鱼的研究结果相一致。
3.2 Cr3+对鲤糖代谢相关基因表达的影响
糖类物质被鱼类摄入体内后,被肠道消化酶分解为葡萄糖。葡萄糖被吸收进入血液后,使血糖浓度升高,促使胰岛素分泌并作用于肝脏组织靶细胞,从而激活胰岛素信号通路[35],且葡萄糖进入肝脏后的过程必须经过胰岛素信号通路来完成[36]。胰岛素会与细胞膜上的特异性受体IR相结合,将信号由胞外传递到胞内,使得处于胞浆的小囊泡内的GLUT转移到细胞膜上,将胞外的葡萄糖转运至胞内,完成葡萄糖的转运。目前,已有学者研究了Cr3+影响哺乳动物糖代谢的作用机制,发现Cr3+可通过增加IR的数量,提高其活性,加快GLUT的转膜速率,进而影响葡萄糖在机体内的转运过程[37]。Miranda等[38]对大鼠的研究发现,与不添加Cr3+的对照组相比,Cr3+处理后其IR mRNA的表达量显著升高。此外,体外试验也发现,在大鼠骨骼肌细胞培养液中添加Cr3+可以显著提高 IR和GLUT4 mRNA的表达量[39]。孙敏敏等[40]研究了不同铬源及水平对罗非鱼IR和GLUT2基因表达的影响,结果显示,在饲料中添加不同水平的酵母铬(CrY)、吡啶羧酸铬(CrP)对IR基因表达无明显影响,但在饲料中添加0.8 mg/kg CrP 和 0.8 mg/kg CrY能显著提高罗非鱼肝脏组织 GLUT2 基因的表达。笔者前期研究了不同Cr3+水平对鲤生长、血液指标以及部分免疫指标的影响,结果发现,0.8 mg/kg Cr3+组获得最优生长性能及免疫力,结合本试验糖代谢酶活性结果,选择0.8、3.2 mg/kg Cr3+组检测IR、GLUT2和SGLT基因表达情况,得出与上述试验相类似的结果;禁食再投喂后3、12、24、48 h时,0.8 mg/kg Cr3+添加组试验鱼GLUT2 mRNA表达量均显著高于对照组,而随Cr3+添加水平升高至3.2 mg/kg,禁食再投喂后12、24、48 h时,GLUT2 mRNA的表达量反而显著降低;此外,在禁食再投喂后12、48 h时,0.8 mg/kg Cr3+添加组IR mRNA表达量较对照组也显著升高。
有研究表明,吸收葡萄糖主要是通过肠道黏膜的钠/葡萄糖共转运载体(SGLT),它是协助葡萄糖吸收的主要蛋白,对葡萄糖转运载体(GLUT)的吸收具有重要意义[37]。已有研究发现,饲料中糖的种类与含量、Na+,以及胰岛素样生长因子 (IGF)、蛋白激酶、养殖动物的年龄与健康状况等均会影响SGLT mRNA的表达[38-43]。聂国兴等[44]在罗非鱼饲料中添加木聚糖酶,结果发现,适宜水平的木聚糖酶能上调前肠SGLT mRNA的表达,促进葡萄糖吸收,从而提高尼罗罗非鱼的生长速度。而本试验中不同水平Cr3+处理后未对SGLT mRNA产生影响,说明Cr3+可能不具有调控SGLT基因的作用,其原因还有待进一步研究。
综上所述,以蛋氨酸铬为铬源时,在饲料中添加0.8 mg/kg Cr3+能提高糖酵解途径酶活性,降低糖异生途径酶活性,诱导IR、GLUT2基因的相对表达量,促进鲤的糖代谢作用。
[1] Wilson R P,Poe W E.Apparent inability of channel catfish to utilize dietary mono and disaccharides as energy sources[J].The Journal of Nutrition,1987,117(2):280-285.
[2] Hatlen B,Grisdale-Helland B,Helland S J.Growth,feed utilization and body composition in two size groups of Atlantic halibut (Hippoglossus hippoglossus) fed diets differing in protein and carbohydrate content[J].Aquaculture,2005,249(1-4):401-408.
[3] Hemre G I,Mommsen T P,Krogdahl Å.Carbohydrates in fish nutrition:effects on growth,glucose metabolism and hepatic enzymes[J].Aquaculture Nutrition,2002,8(3):175-194.
[4] Li X F,Liu W B,Lu K L,et al.Dietary carbohydrate/lipid ratios affect stress,oxidative status and non-specific immune responses of fingerling blunt snout bream,Megalobrama amblycephala[J].Fish & Shellfish Immunology,2012,33(2):316-323.
[5] 戈贤平,刘波,谢骏,等.饲料中不同碳水化合物水平对翘嘴红鲌生长及血液指标和糖代谢酶的影响[J].南京农业大学学报,2007,30(3):88-93.
[6] 刘兵,瞿明仁,张学峰,等.微量元素铬在动物营养上的研究与应用[J].江西饲料,2006(4):7-10,18.
[7] Pechova A,Pavlata L.Chromium as an essential nutrient:a review[J].Veterinarni Medicina,2007,52(1):1-18.
[8] Liu T L,Wen H,Jiang M,et al.Effect of dietary chromium picolinate on growth performance and blood parameters in grass carp fingerling,Ctenopharyngodon idellus[J].Fish Physiology and Bioehemistry,2010,36(3):565-572.
[9] 周兴华,陈建.吡啶甲酸铬对团头鲂生产性能的影响[J].兽药与饲料添加剂,2002,7(4):3-4.
[10] Wang J,Ai Q H,Mai K S,et al.Dietary chromium polynicotinate enhanced growth performance,feed utilization,and resistance to Cryptocaryon irritans in juvenile large yellow croaker (Larmichthys crocea)[J].Aquaculture,2014,432:321-326.
[11] Selcuk Z,Tiril S U,Alagil F,et al.Effects of dietary L-carnitine and chromium picolinate supplementations on performance and some serum parameters in rainbow trout (Oncorhynchus mykiss)[J].Aquaculture International,2010,18(2):213-221.
[12] 杨奇慧,谭北平,董晓慧,等.铬对凡纳滨对虾生长性能、血清生化指标及非特异性免疫酶活性的影响[J].动物营养学报,2013,25(4):795-804.
[13] 杨允辉,周永奎,史合群,等.饲料中添加铬对河蟹非特异性免疫力和抗应激能力的影响[J].淡水渔业,2006,36(5):11-15.
[14] 潘庆,刘胜,郑诚,等.烟酸铬对奥尼罗非鱼生长及组织营养成分的影响[J].水生生物学报,2002,26(2):197-200.
[15] Rawles S D,Gatlin III D M.Carbohydrate utilization in striped bass (Morone saxatilis) and sunshine bass (M. chrysops ♀×M. saxatilis ♂)[J].Aquaculture,1998,161(1-4):201-212.
[16] Arunkumar R I,Rajasekaran P,Michael R D.Differential effect of chromium compounds on the immune response of the African mouth breeder Oreochromis mossambicus (Peters)[J].Fish & Shellfish Immunology,2000,10(8):667-676.
[17] Gatta P P,Thompson K D,Smullen R,et al.Dietary organic chromium supplementation and its effect on the immune response of rainbow trout (Oncorhynchus mykiss)[J].Fish & Shellfish Immunology,2001,11(5):371-382.
[18] Wedemeyer G A.Effects of rearing conditions on the health and physiological quality of fish in intensive culture[M]//Iwama G K,Pickering A D,Sumpter J P,et al.Fish Stress and Health in Aquaculture.Cambridge,USA:Cambridge University Press,1997:35-71.
[19] Castro M P,Claudiano G S,Petrillo T R,et al.Acute aerocystitis in Nile tilapia bred in net cages and supplemented with chromium carbochelate and Saccharomyces cerevisiae[J].Fish & Shellfish Immunology,2014,36(1):284-290.
[20] Ahmed A R,Moody A J,Fisher A,et al.Growth performance and starch utilization in common carp (Cyprinus carpio L.) in response to dietary chromium chloride supplementation[J].Journal of Trace Elements in Medicine and Biology,2013,27(1):45-51.
[21] Hertz Y,Mader Z,Hepher B,et al.Glucose metabolism in the common carp (Cyprinus carpio L.):the effects of cobalt and chromium[J].Aquaculture,1989,76(3-4):255-267.
[22] Anderson R A,Kozlovsky A S.Chromium intake,absorption and excretion of subjects consuming self-selected diets[J].The American Journal of Clinical Nutrition,1985,41(6):1177-1183.
[23] Paripatananont T,Lovell R T.Comparative net absorption of chelated and inorganic trace minerals in channel catfish Ictalurus punctatus diets[J].Journal of the World Aquaculture Society,1997,28(1):62-67.
[24] 尹帅.不同铬源对鲤鱼生长及糖代谢调控的影响[D].天津:天津农学院,2017.
[25] Saxena A K,Srivastava P,Baquer N Z.Effects of vanadate on glycolytic enzymes and malic enzyme in insulin-dependent and -independent tissues of diabetic rats[J].European Journal of Pharmacology,1992,216(1):123-126.
[26] 张宏馨,李军,杨宏莉,等.富铬酵母对试验性糖尿病小鼠糖代谢酶活性的影响[J].黑龙江畜牧兽医,2009(4):82-83.
[27] National Research Council.The Role of Chromiumin Animal Nutrition[M].Washington,DC:National Academy Press,1997.
[28] Mertz W.Chromium occurrence and function in biological systems[J].Physiological Reviews,1969,49(2):163-239.
[29] Seerley R W.Organic chromium and manganese in human nutrition[C]//Proceeding of Alltech’s Ninth Annual Symposium.Nicholasville,KY,USA,1993:41-51.
[30] 潘庆,毕英佐,颜惜玲,等.有机铬对奥尼罗非鱼生长和糖利用的影响[J].水生生物学报,2002,26(4):393-399.
[31] NRC.Nutrient Requirements of Fish and Shrimp[R].Washington,DC:National Academies Press,2011.
[32] Kramer P,Nowak T.The preparation and characterization of Cr(III) and Co(III) complexes of GDP and GTP and their interactions with avian phosphoenolpyruvate carboxykinase[J].Journal of Inorganic Biochemistry,1988,32(2):135-151.
[33] 乔伟.小肽铬对大鼠生长性能和糖代谢的影响与机理研究[D].成都:四川农业大学.2009.
[34] Pan Q,Liu S,Tan Y G,et al.The effect of chromium picolinate on growth and carbohydrate utilization in tilapia,Oreochromis niloticus×Oreochromis aureus[J].Aquaculture,2003,225(1-4):421-429.
[35] Pilch P F,Lee J.Insulin receptor family[M]//Lennarz W Z,Lane M D.Encyclopedia of Biological Chemistry.Amsterdam:Elsevier,2004:436-440.
[36] Laychock S G.Insulin receptor signaling[M]//Henry H L,Norman A W.Encyclopedia of Hormones.Amsterdam:Elsevier,2003:368-380.
[37] Yang X P,Palanichamy K,Ontko A C.A newly synthetic chromium complex-chromium(phenylalanine)3 improves insulin responsiveness and reduces whole body glucose tolerance[J].FEBS Letters,2005,579(6):1458-1464.
[38] Miranda E R,Dey C S.Effect of chromium and zinc on insulin signaling in skeletal muscle cells[J].Biological Trace Element Research,2004,101(1):19-36.
[39] Qiao W,Peng Z L,Wang Z S,et al.Chromium improves glucose uptake and metabolism through upregulating the mRNA levels of IR,GLUT4,GS,and UCP3 in skeletal muscle cells[J].Biological Trace Element Research,2009,131(2):133-142.
[40] 孙敏敏,刘含亮,王红卫,等.酵母铬对尼罗罗非鱼生长和糖代谢的影响[J].动物营养学报,2013,25(9):2136-2142.
[41] Garriga C,Planas J M,Moretó M.Aldosterone mediates the changes in hexose transport induced by low sodium intake in chicken distal intestine[J].The Journal of Physiology,2001,535(1):197-205.
[42] Laverty G,Bjarnadottir S,Elbrønd V S.et al.Aldosterone suppresses expression of an avian Colonic sodium-glucose cotransporter[J].American Journal of Physiology,2001,281(4):R1042-R1050.
[43] Barfull A,Garriga C,Mitjans M,et al.Ontogenetic expression and regulation of Na+-D-glucose cotransporter in jejunum of domestic chicken[J].American Journal of Physiology,2002,282(3):G559-G564.
[44] 聂国兴,王俊丽,华雪铭,等. 木聚糖酶对尼罗罗非鱼钠葡萄糖共转运载体(SGLT1)mRNA表达的影响[J].水产学报,2007,31(6):765-770.