刺参Apostichopus japonicus具有较高的营养价值和药用价值,自20世纪80年代以来,其人工育苗和养殖技术不断完善,目前,已成为中国重要的海水养殖经济品种之一[1]。研究表明,刺参能以生物能的形式将环境中的废弃物(包括残饵、粪便、浮游植物残渣和其他颗粒有机物等)转化为有价值的营养物质,被认为是海底的清道夫[2-3]。利用刺参进行生态混养,不仅可以有效改善水质,修复养殖环境,还可以进一步完善养殖系统的食物链结构,从而增强系统本身的稳定性和自净能力,降低养殖行为对环境的污染。同时,还可以降低养殖成本,提高养殖空间与资源的利用率,增加养殖生物自身的产量。
鉴于刺参较强的沉积食性特性和生物修复潜力,其在综合养殖系统中的生态作用日益受到关注,并得到广泛应用[2-18]。张起信[6]于1990年首次报道了对虾Penaeus orientalis和刺参混养技术,随后与刺参综合养殖相关的报道日益增多。刺参综合养殖研究主要包括:刺参与贝类混养,如栉孔扇贝Chlamys farreri[7]、皱纹盘鲍Haliotis discus hannai[8]、西施舌Mactra antiquata[9]等;刺参与鱼类混养,如红鳍东方鲀Takifugu rubripes[10]、海鲈Dicentrarchus labrax[2]等;刺参与大型海藻混养,如海带Laminaria japonicus[7]、龙须菜Gracilaria verrucosa[11]等;棘皮动物间的混养,如刺参与虾夷马粪海胆Hemicentrotus pulcherrimus[12]。这些混养模式均取得了较好的经济和生态效益。此外,由于刺参具有夏眠习性,夏眠期间养殖池塘空间和饵料等资源仍存在较大的利用余地。为了进一步提高养殖效率,有必要探索刺参养殖池塘混养其他经济种类的复合养殖模式。
日本囊对虾Penaeus japonicus俗称竹节虾、花虾、车虾等,其肉质鲜美、适应性强,易于活体运输,具有较高的营养价值和保健作用[13],是中国北方沿海主要养殖的对虾种类之一。刺参与多种虾类的混养研究表明,参虾混养模式不但可以改善养殖水体的水质,还可以有效预防虾病的发生,同时提高刺参与对虾的产量[14-17]。目前,在养殖生产实践中,大多数从业者仍主要根据经验进行品种的搭配混养,对混养品种密度、搭配比例的选择缺乏相关科学依据。为此,本研究中在常用刺参养殖密度的基础上,探究了刺参和日本囊对虾在池塘混养中的适宜密度与搭配比例,以期为参虾生态混养模式的推广应用提供参考依据。
1 材料与方法
1.1 材料
试验池塘位于辽宁省葫芦岛兴城市海滨乡海参养殖工业园区内,池塘面积约为40万m2,水深为1.5~3.5 m,试验在池塘内的围隔中进行,于海参池塘中分散24个围隔,规格为5 m×5 m×3 m,围隔间距为10 m,围隔内投放网礁作为刺参附着基。刺参于2015年5月20日投入围隔中,日本囊对虾于2015年6月6日投入围隔中。
试验所用刺参购于试验池塘附近的刺参养殖工业园区内,初始湿体质量为(6.05±3.15)g;日本囊对虾苗购于附近育苗场,初始体长为(10.36±2.56)mm,初始湿体质量为(0.89±0.36)g。
1.2 方法
1.2.1 试验设计 试验采用双因子设计,刺参设置10、15 ind./m2 2个密度组,日本囊对虾设置0、2、4、8 ind./m2 4个密度组,共计8个混养组,每组设3个重复,试验为期4个多月。养殖期间为了防止日本囊对虾互残,前3 d少量投喂冰冻卤虫,后期不投喂,刺参不投饵,每天换水前用YSI水质自动分析仪记录水温、盐度、pH和溶解氧(DO)等水质参数。
1.2.2 生长指标的测定与计算 试验过程中约30 d取样一次,从每组随机取刺参和对虾各30 尾,测量其湿质量。特定生长率(%/d)计算公式为
特定生长率=(ln Wf-ln W0)/t×100%。
其中:W0为试验初始时日本囊对虾平均体质量(g);Wf为试验结束时日本囊对虾平均体质量(g);t为试验持续时间(d)。
1.3 数据处理
试验数据采用SPSS 16.0统计软件进行方差分析,描述性统计值用平均值±标准差(mean±S.D.)表示,显著性水平设为0.05。
2 结果与分析
2.1 水质变化
试验时间为5月中旬—10月中旬,试验期间,刺参养殖池塘水温为16.18~26.00 ℃,盐度为29.45~32.92,pH值为8.21~8.66,溶解氧为5.93~13.09 mg/L(图1和图2)。
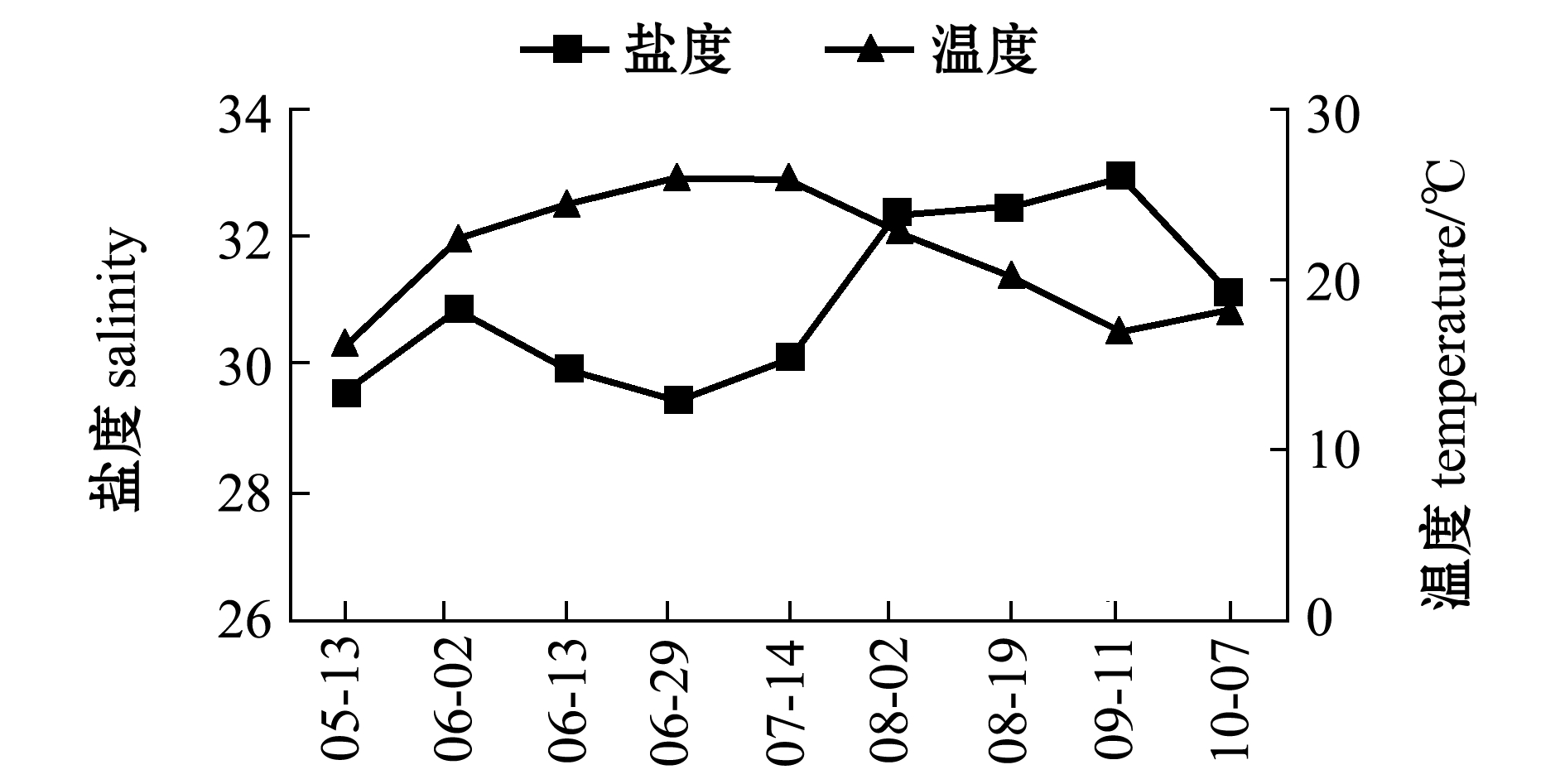
图1 试验期间养殖池塘盐度和温度的变化
Fig.1 Variations in salinity and temperature in the culture ponds during the experiment
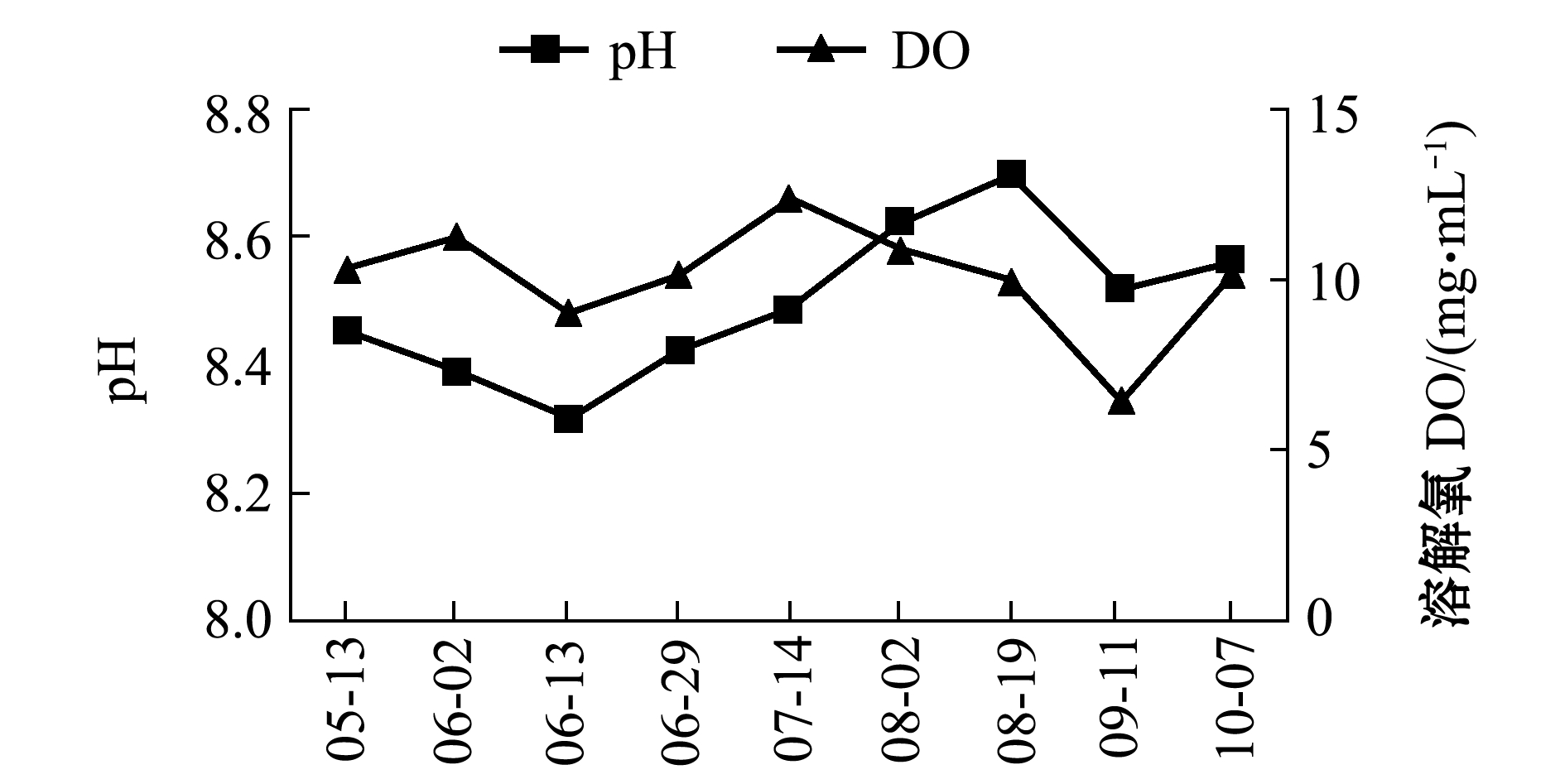
图2 试验期间养殖池塘pH和溶解氧含量的变化
Fig.2 Variations in pH and dissolved oxygen level in the culture ponds during the experiment
2.2 刺参生长
从图3可见,5—10月,混养各密度对虾的两个密度组的刺参体质量均呈上升趋势,湿质量变化明显。试验前期,5月下旬—6月中旬,刺参平均湿质量由初始的(6.05±3.15)g快速增长到(10.10±2.75)g;7月中旬随着水温上升,刺参生长速度逐渐放缓,湿质量变化不明显;9月中旬后,随着水温的降低,刺参湿质量又开始快速增长,且有部分池塘刺参达到显著增长的水平(P<0.05)。
在不同阶段,搭配混养不同密度的日本囊对虾,对两种密度下刺参的湿质量变化无显著性影响(P>0.05)(图3),对刺参存活率也无显著性影响(P>0.05)(表1)。
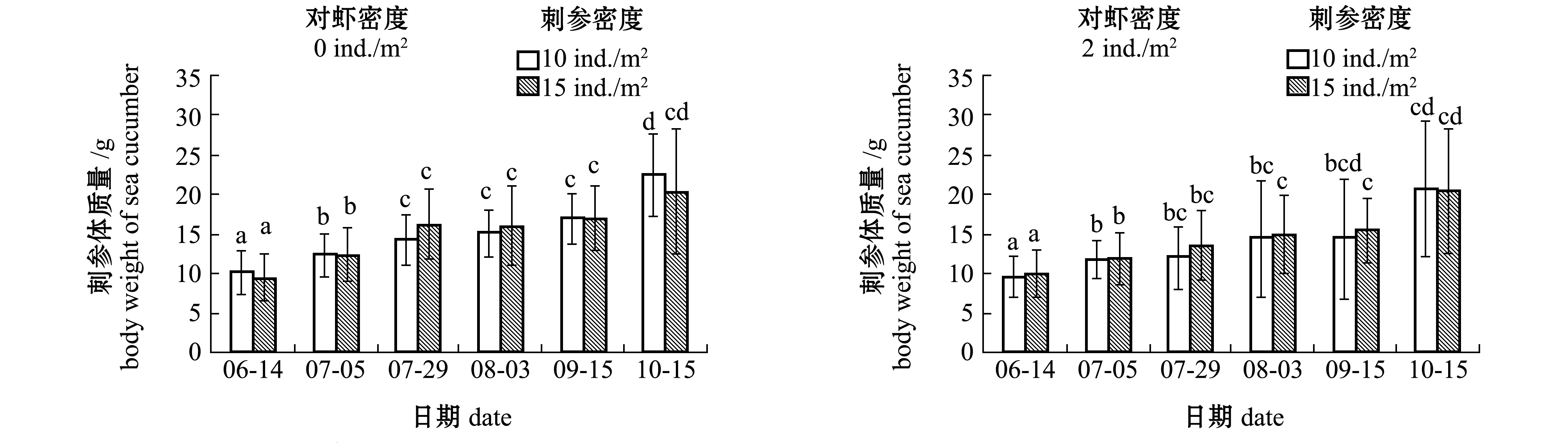
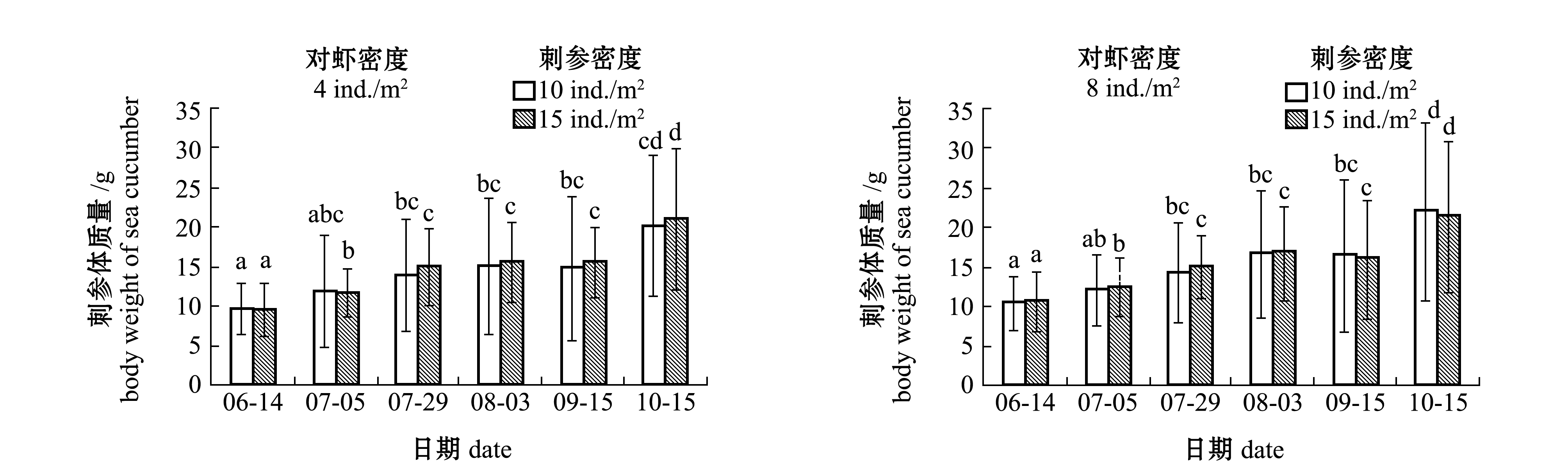
注:标有不同字母者表示同一刺参密度组不同养殖时间下或同一养殖时间下不同刺参密度组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters at the same density of sea cucumber Apostichopus japonicus are significant differences in different time,or in the same time in different densities of sea cucumber at the 0.05 probability level, and the means with the same letters are not significant differences among groups
图3 混养不同密度对虾条件下刺参的生长
Fig.3 Growth of sea cucumber Apostichopus japonicus in co-culture ponds with different densities of kuruma shrimp Penaeus japonicus
表1 混养不同密度对虾条件下刺参的存活率
Tab.1 Survival rate of sea cucumber Apostichopus japonicus in co-culture with different densities of kuruma shrimp Penaeus japonicus%
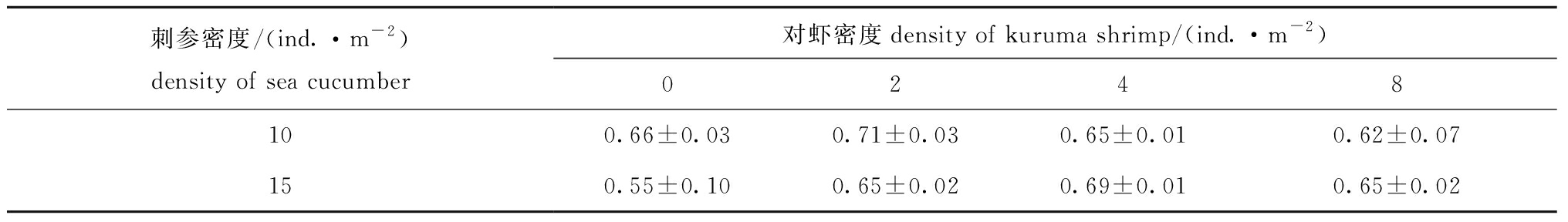
刺参密度/(ind.·m-2)density of sea cucumber对虾密度density of kuruma shrimp/(ind.·m-2)0248100.66±0.030.71±0.030.65±0.010.62±0.07150.55±0.100.65±0.020.69±0.010.65±0.02
2.3 对虾生长
从图4、图5可见:6月和9月,日本囊对虾保持较快的生长速度;7月中旬—8月下旬,日本囊对虾生长相对缓慢;在混养不同密度刺参条件下,日本囊对虾的体质量、特定生长率和存活率无显著性差异(P>0.05)。
对虾的生长状况与自身放养密度呈负相关(图4和图5),对虾不同密度组之间在终末体质量与特定生长率上有显著性差异(P<0.05),各试验组对虾在平均产量上也有较大差异(表2)。随着自身养殖密度的增大,日本囊对虾的存活率、终末体质量和特定生长率均呈下降趋势(表2)。
试验结束时,与密度为10、15 ind./m2刺参混养的两个2 ind./m2对虾密度组日本囊对虾的终末体质量(33.90、32.47 g),显著高于4 ind./m2对虾密度组(25.48、25.16 g)和8 ind./m2对虾密度组(20.29、21.63 g)(P<0.05,表2),但根据存活率计算成产量后,8 ind./m2对虾密度组的平均产量约为343 kg/hm2,高于2 ind./m2密度组的平均产量242 kg/hm2和4 ind./m2密度组的平均产量319 kg/hm2。
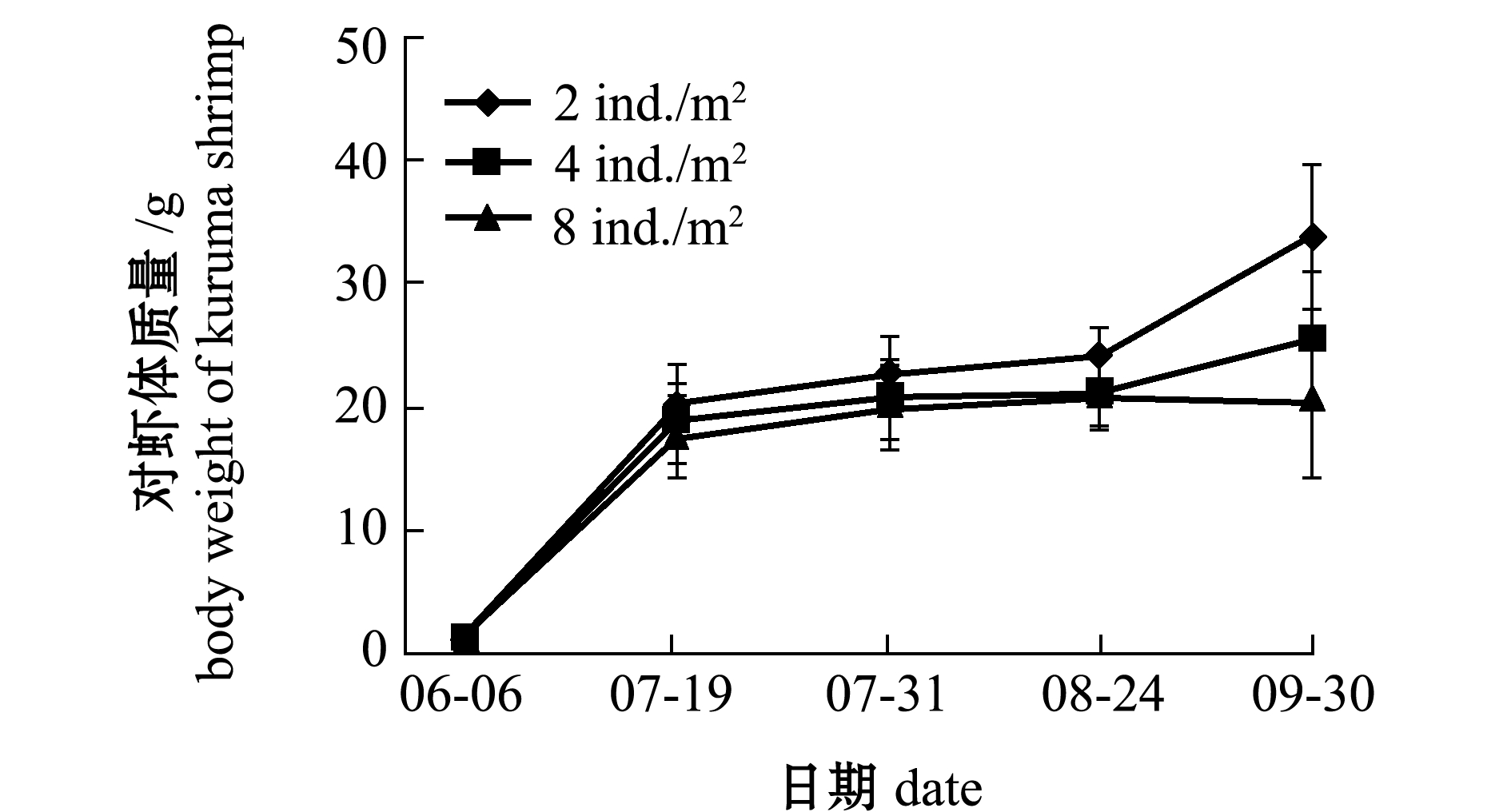
图4 混养10 ind./m2密度刺参条件下日本囊对虾的生长
Fig.4 Growth of kuruma shrimp Penaeus japonicus in co-culture with sea cucumber Apostichopus japonicus at density of 10 ind./m2
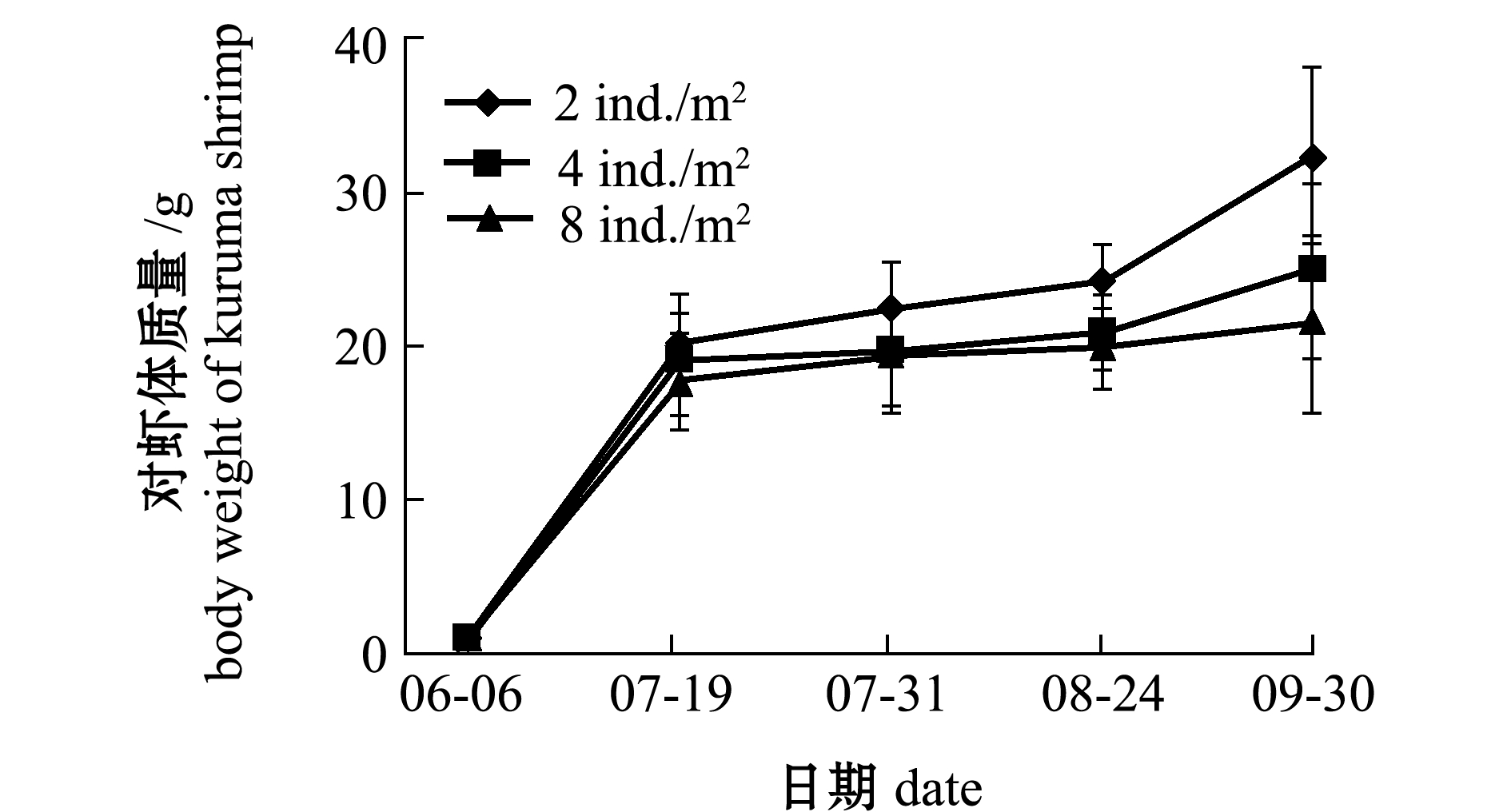
图5 混养15 ind./m2密度刺参条件下日本囊对虾的生长
Fig.5 Growth of kuruma shrimp Penaeus japonicus in co-culture with sea cucumber Apostichopus japonicus at 15 ind./m2
表2 试验结束时日本囊对虾的终末体质量、特定生长率、存活率和产量
Tab.2 Final body weight, SGR, survival rate, and yield of kuruma shrimp Penaeus japonicus at the end of co-culture
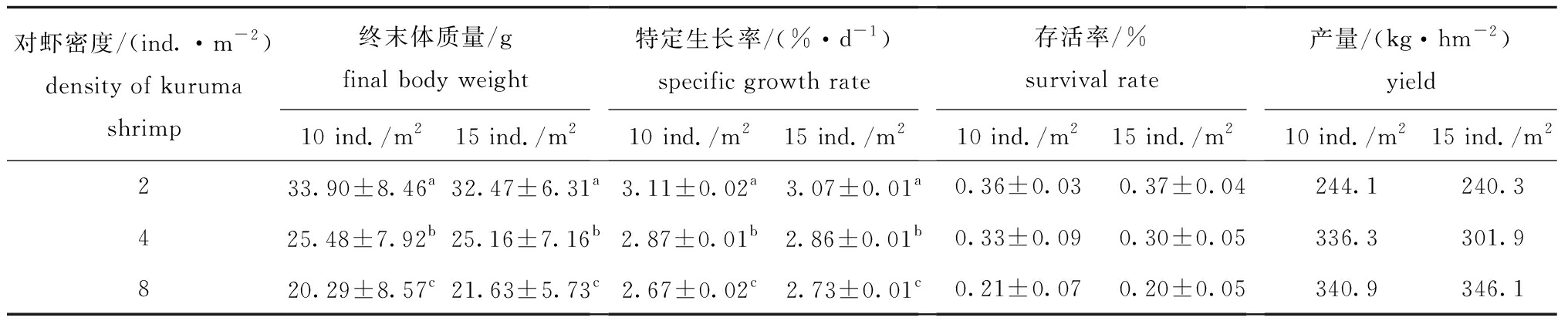
对虾密度/(ind.·m-2)density of kuruma shrimp终末体质量/gfinal body weight10 ind./m215 ind./m2特定生长率/(%·d-1)specific growth rate10 ind./m215 ind./m2存活率/%survival rate10 ind./m215 ind./m2产量/(kg·hm-2)yield10 ind./m215 ind./m2233.90±8.46a32.47±6.31a3.11±0.02a3.07±0.01a0.36±0.030.37±0.04244.1240.3425.48±7.92b25.16±7.16b2.87±0.01b2.86±0.01b0.33±0.090.30±0.05336.3301.9820.29±8.57c21.63±5.73c2.67±0.02c2.73±0.01c0.21±0.070.20±0.05340.9346.1
注:同一指标下,标有不同字母者表示同一刺参密度下不同对虾密度组或同一对虾密度下不同刺参密度组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters in the same index are significant differences in different densities of kuruma shrimp P.japonicus in the same density of sea cucumber A.japonicus,or in the different density of sea cucumber A.japonicus at same density of kuruma shrimp P.japonicus at the 0.05 probability level, and the means with the same letters are not significant differences among groups
3 讨论
3.1 刺参的生态作用
通过生态系统内的多品种复合养殖,可以生产更多样的产品,减少有害物质和废物排放,改善和保护养殖环境,促进养殖生物生长等,是实现水产养殖业高效低碳发展的重要途径,也是未来水产养殖业的发展方向之一[18-21]。
刺参被认为是适合综合养殖系统的理想物种,它能摄食底栖生物、沉积物、细菌、真菌和有机碎屑,有助于减少有机负荷。研究表明,刺参对摄入泥土中有机质的消化率约为15%,对动物性的碎屑、藻类和菌类的消化吸收率最高达87%。同时,刺参能增加营养物质的水平再分配和沉积物的生物扰动作用[2-3,22],在养殖系统底部营养物质循环中起到关键性作用,从而影响整个养殖系统底栖生物的初级生产力[23-24],在当前日益严重的养殖环境高污染和富营养化的情况下,刺参的这种生态作用日渐被人们所重视[18]。
3.2 刺参与对虾混养的优势
目前,以刺参为主的池塘复合养殖模式已有较多报道,Kang等[25]对刺参与皱纹盘鲍混养的研究表明,刺参可有效地清除混养池塘中的残饵和粪便,达到净化水质、促进皱纹盘鲍生长的目的。滕炜鸣等[10]研究表明,刺参与红鳍东方鲀混养模式不但可降低养殖行为带来的自身污染,还可有效增加养殖收益。董双林[18]报道,刺参与扇贝、对虾的生态混养模式可使刺参生长速度提高49.3%,此外还额外获得可观的对虾产量。于海波等[26]研究发现,由于对虾的生物沉积与扰动作用,加强了养殖系统内水体与底泥间的偶联作用,加快了营养盐的循环,防止了营养盐在底泥连续积累造成的养殖环境恶化,实现了既增产又减少自身污染的功能。在对刺参与日本囊对虾的混养研究中也发现,刺参和日本囊对虾混养,不论在时间上还是空间上均能充分有效地利用水体,在刺参夏眠期间正是日本囊对虾生长的最佳时期。此时对虾不但可以充分利用池塘中的饵料,其活动又增加了水体的溶解氧,进而有效抑制在此阶段可能爆发的赤潮和大型有害藻类。何振平等[17]发现,刺参和日本囊对虾混养可以使对虾产量由原来的150 kg/hm2提升至300 kg/hm2,同时刺参回捕率也显著增加,高达83.4%,显著增加了养殖效益。
本研究中,混养不同密度的日本囊对虾并未给主要养殖种类刺参的生长带来明显的促进作用,分析原因,混养对虾周期约4个月,主要处于夏季高温期,刺参生长与日常活动受到高温的影响,对刺参的生长速率统计造成一定偏差。同时,试验池塘生物饵料较为丰富,有钩虾属Gammarus、蜾赢蜚属Corophium等对虾的适合饵料生物,试验期间未投喂饵料,这对刺参与日本囊对虾的生长速率也有一定的影响。从试验结果分析,混养日本囊对虾并未对刺参的生长造成负面影响,在刺参正常生长的同时,增加了日本囊对虾的收益。这与Bell等[27]对糟海参Holothuria scabra与细角滨对虾Litopenaeus stylirostris的混养效果研究结果相同。
3.3 刺参与对虾混养的适宜比例
本研究中日本囊对虾的生长主要受到自身放养密度的影响。其中2 ind./m2密度组对虾的生长速度最快,在平均终末体质量、特定生长率、存活率方面均大于4、8 ind./m2密度组,8 ind./m2密度组在试验后期,生长速度明显下降,并开始出现负增长现象,但此时2、4 ind./m2密度组的对虾仍保持较快的生长速度,说明若混养对虾密度过高会导致对虾后期生长速度下降,这应该与空间和饵料不足等有关。此外,本研究中日本囊对虾的存活率较一些报道偏低,这可能与试验在围隔中进行有关。相较池塘、围堰等开放养殖模式,围隔内的温度、盐度等易受到外界环境条件波动的影响。同时,由于对虾的摄食、遮蔽空间有限,随着对虾密度的增加、生长,天然饵料会逐渐不足,进而会导致对虾自残发生,如对虾8 ind./m2密度组的存活率明显低于其他低密度组,应该与以上因素有关。
从产量上分析,2 ind./m2密度组平均产量为241.02 kg/hm2,明显低于4 ind./m2密度组的311.87 kg/hm2与8 ind./m2密度组的354.91 kg/hm2。但若考虑到对虾价格受规格影响较大的因素(如2015年对虾规格大于25 g/ind.约140元/kg,小于25 g/ind.约120 元/kg),则在本研究中混养密度为4 ind./m2时,从混养对虾获取的额外收益最高。本研究结果可以为参虾池塘生态混养模式的推广应用提供参考。
[1] 常亚青,隋锡林,李俊.刺参增养殖业现状、存在问题与展望[J].水产科学,2006,25(4):198-201.
[2] Zamora L N,Yuan Xiutang,Carton A G,et al.Role of deposit-feeding sea cucumbers in integrated multitrophic aquaculture:progress,problems,potential and future challenges[J].Reviews in Aquaculture,2016:1-18,doi:10.1111/raq.12147.
[3] Ahlgren M O.Consumption and assimilation of salmon net pen fouling debris by the red sea cucumber Parastichopus californicus:implications for polyculture[J].Journal of the World Aquaculture Society,1998,29(2):133-139.
[4] 袁秀堂,王丽丽,杨红生,等.刺参对筏式贝藻养殖系统不同碳、氮负荷自污染物的生物清除[J].生态学杂志,2012,31(2):374-380.
[5] 袁秀堂,杨红生,周毅,等.刺参对浅海筏式贝类养殖系统的修复潜力[J].应用生态学报,2008,19(4):866-872.
[6] 张起信.虾参混养技术[J].海洋科学,1990(6):65-66.
[7] 杨红生,周毅,王健,等.烟台四十里湾栉孔扇贝、海带和刺参负荷力的模拟测定[J].中国水产科学,2001,7(4):27-31.
[8] 王云.刺参密度对鲍参混养效果的影响[J].福建农业学报,2014,29(7):633-636.
[9] 李文波,高如承,潘辉,等.西施舌稚贝与仿刺参幼参混养的研究[J].福建师范大学学报:自然科学版,2012,28(4):82-87.
[10] 滕炜鸣,王庆志,周遵春,等.刺参与红鳍东方鲀的生态混养效果[J].水产学报,2017,41(3):407-414.
[11] 王肖君,孙慧玲,谭杰,等.龙须菜对刺参生长及环境因子的影响[J].渔业科学进展,2011,32(5):58-66.
[12] 王吉桥,程鑫,杨义,等.不同密度的虾夷马粪海胆与仿刺参混养的研究[J].大连水产学院学报,2007,22(2):102-108.
[13] 许星鸿,刘翔,阎斌伦,等.日本对虾肌肉营养成分分析与品质评价[J].食品科学,2011,32(13):297-301.
[14] Pitt R,Duy N D Q,Duy T V,et al.Sandfish (Holothuria scabra) with shrimp (Penaeus monodon) co-culture tank trials[J].SPC Beche-de-mer Information Bulletin,2004,20:12-22.
[15] Purcell S W,Patrois J,Fraisse N.Experimental evaluation of co-culture of juvenile sea cucumbers,Holothuria scabra (Jaeger),with juvenile blue shrimp,Litopenaeus stylirostris (Stimpson)[J].Aquaculture Research,2006,37(5):515-522.
[16] Chen Yanfeng,Luo Peng,Hu Chaoqun,et al.Effect of shrimp (Litopenaeus vannamei) farming waste on the growth,digestion,ammonium-nitrogen excretion of sea cucumber (Stichopus monotuberculatus)[J].Journal of Ocean University of China,2015,14(3):484-490.
[17] 何振平,王秀云,刘艳芳,等.参虾池塘高效混养技术[J].水产科学,2008,27(12):665-667.
[18] 董双林.中国综合水产养殖的发展历史、原理和分类[J].中国水产科学,2011,18(5):1202-1209.
[19] 董双林.高效低碳——中国水产养殖业发展的必由之路[J].水产学报,2011,35(10):1595-1600.
[20] Soto D.Integrated mariculture:a global review[R].FAO Fisheries and Aquaculture Technical Paper No.529.Rome,Italy:FAO,2009:133-181.
[21] Chopin T,Robinson S M C,Troell M,et al.Multitrophic integration for sustainable marine aquaculture[M]//Jørgensen S E,Fath B D.The Encyclopedia of Ecology,Ecological Engineering.Oxford:Elsevier,2008:2463-2475.
[22] Yuan Xiutang,Meng Leiming,Wang Lili,et al.Responses of scallop biodeposits to bioturbation by a deposit-feeder Apostichopus japonicus (Echinodermata:Holothuroidea):does the holothurian density matter?[J].Aquaculture Research,2016,47(2):512-523.
[23] Schneider K,Silverman J,Woolsey E,et al.Potential influence of sea cucumbers on coral reef CaCO3 budget:a case study at One Tree Reef[J].Journal of Geophysical Research:Biogeosciences,2011,116(G4):G04032.
[24] MacTavish T,Stenton-Dozey J,Vopel K,et al.Deposit-feeding sea cucumbers enhance mineralization and nutrient cycling in organically-enriched coastal sediments[J].PLoS One,2012,7(11):e50031.
[25] Kang K H,Kwon J Y,Kim Y M.A beneficial coculture:charm abalone Haliotis discus hannai and sea cucumber Stichopus japonicus[J].Aquaculture,2003,216(1-4):87-93.
[26] 于海波,高勤峰,孙永军,等.刺参-对虾复合养殖系统主要营养盐动态变化及循环过程的研究[J].中国海洋大学学报,2013,43(9):25-32.
[27] Bell J D,Agudo N N,Purcell S W,et al.Grow-out of sandfish Holothuria scabra in ponds shows that co-culture with shrimp Litopenaeus stylirostris is not viable[J].Aquaculture,2007,273(4):509-519.