岩虫Marphysa sanguinea隶属于环节动物门、多毛纲、矶沙蚕科、岩虫属,俗称红沙蚕、黄金沙蚕,是广泛分布于中国沿海潮间带岩礁和泥沙底质区的大型浅海底栖多毛类。其在摄食利用沉积有机物的同时,能够疏通底质、改善底质结构、加快物质循环。由于其血色鲜红、肉质肥厚,在日本钓渔业被誉为 “黄金钓饵”,具有显著的经济效益[1]。纯化的岩虫抗菌肽已被证实对肝癌细胞增殖和甲胎蛋白(AFP)分泌均有抑制作用[2]。近年来,随着海洋游钓产业的快速发展,国际市场对岩虫的需求日益增加,但由于过度采捕,中国的岩虫自然资源明显下降,通过人工增养殖提高岩虫资源量是促进资源可持续利用的重要途径[1,3-4] 。
碳是生物体内含量最多的元素。对于异养生物而言,碳元素主要来源于栖息生境中各种饵料,碳的吸收与利用主要取决于碳的转化效率,即生物体所摄入的碳在生命活动中的分配情况[5]。对于海洋生物而言[6],不同生物对于碳的吸收与利用情况有明显差异,外界环境因子对生物体内碳的分配与利用具有一定影响。从已有的研究中可见,环境温度和体质量是海洋生物体对食物中碳元素吸收利用的主要影响因子[7]。目前,国内外一些学者先后报道了不同海洋动物的碳元素收支利用,如对虾[7-8]、 刺参[9]、 贻贝[10]、 长牡蛎[11]等, 但关于岩虫的碳吸收利用情况尚未见报道。本研究中,通过研究不同温度与体质量条件下,食物中碳元素在岩虫体内的分配与利用情况,建立了岩虫的碳收支方程,以期能为掌握底栖动物营养物质利用,开展岩虫人工配合饵料与养殖研究提供理论依据。
1 材料与方法
1.1 材料
试验用岩虫采自大连市黑石礁近海潮间带,采用人工挖捕方式采集。试验用海水取自大连市黑石礁海域,经沉淀沙滤后贮存备用,盐度为31~32。
1.2 方法
1.2.1 养殖管理 挑选虫体完整、活力健壮的岩虫作为试验动物。按虫体湿质量分为3组:(1.2±0.1)、(4.0±0.3)、(8.5±1.1)g, 分别记为S、M、L组,放入品字缸(50 cm×40 cm×40 cm)中。水槽底部放置若干U型塑料管以模拟岩虫喜穴居的自然生境,以控温仪 (HXSWT-100)控制温度。每天换水1次,微充气保证溶氧充足。每天晚上换水后按照总虫体体质量的5%~10%投喂新鲜孔石莼Ulva pertusa。
1.2.2 试验设计 试验设16、20、24℃ 3个温度组,每个温度设3个重复,S组放2尾岩虫,M和L组各放1尾岩虫,并设空白对照组 (无岩虫)。试验初始水温为10℃,岩虫暂养7 d后每日升温1℃,达到试验温度后,使岩虫适应3~7 d后进行各项试验。试验期间,每天用虹吸法及时收集残饵和粪便,烘干后保存用于摄食率和排粪率的测定。
1.2.3 碳含量的测定 将待测的岩虫、孔石莼和粪便样品在70℃下烘干至恒重,研碎均匀,用元素分析仪测定样品中的碳含量。
用Winkler碘量法测定水样中的溶氧量,根据对照组、试验组水中溶氧变化计算耗氧率:
其中:O为单位体质量耗氧率[mg/(g·h)];O0、OT分别为试验结束时对照组、试验组水体中溶解氧浓度 (mg/L);t为试验时间 (h);V为试验水体积 (L);W为试验虫体干质量 (g)。
代谢碳率根据耗氧率来计算,根据C∶O=1∶2计算得出:1 mg(O2)=0.375 mg(C)。
1.2.4 最小碳需求量 生物体吸收的碳量仅能够维持其代谢需求量,此时的碳需求量称为最小碳需求量 (minimal carbon requirement, MCR)。Warren等[12]提出的碳收支方程为
其中:CC为摄食碳;FC为粪便碳;UC为排泄碳;RC为代谢碳 (IC);PC为累积碳。由于排泄损失的碳量比例很小,可以暂将UC忽略,故一般用PC=CC-FC-RC来计算生长碳量,即吸收的碳量减去代谢碳量的值[13-14]。 当PC=0 时, 即 CC-RC=FC, 吸收碳量仅能够维持代谢的量,这时的碳需求量就是最小碳需求量[MCR,mg/(g·h)],其计算公式为
MCR=0.375×R×QR。 (3)其中:R为耗氧率;QR为呼吸熵 (生物体在同一时间内,释放二氧化碳与吸收氧气的摩尔比),其大小根据生物体利用能源物质 (如碳、氮)的不同而不同,一般为0.7~1.0,本试验中取0.85[15]。
1.3 碳元素收支平衡
根据测得的石莼和岩虫粪便中的碳含量,以及岩虫对石莼的摄食率、排泄碳率和排粪率,分别计算出岩虫的CC、RC+UC和FC,再根据生物能量收支方程得出:

2 结果与分析
2.1 不同温度下岩虫的摄食碳率
岩虫对孔石莼中碳的摄食率见图1。当温度由16℃上升到20℃时,各规格下岩虫的碳摄食率均增高,当温度继续升高到24℃时,摄食率反而降低;同一温度下,摄食率随体质量的增加而减少。
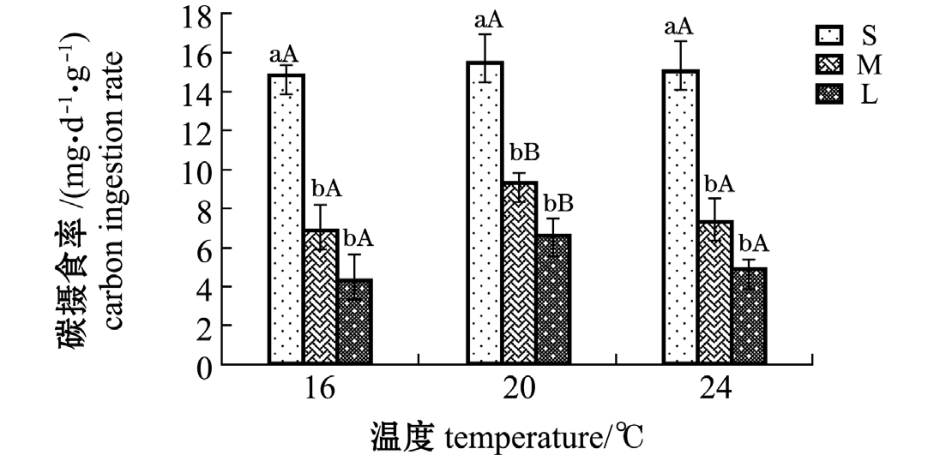
图1 不同温度下岩虫的碳摄食率
Fig.1 Carbon ingestion rate of rock worm Marphysa sanguinea at different temperatures
注:标有不同大写字母者表示同一规格不同温度组间有显著性差异 (P<0.05),标有不同小写字母者表示同一温度不同规格组间有显著性差异 (P<0.05),标有相同字母者表示组间无显著性差异 (P>0.05),下同
Note:The means with different capital letters in different temperatures in same size are significantly different at the 0.05 probability level,the means with different letters in different size in the same temperature being significantly different at the 0.05 probability level,and the means with the same letters are not significant differences,et sequentia
以岩虫的干质量为区组变量,温度为分组变量,单位体质量摄食碳量为观测数据,变量经双因素方差分析表明,温度和体质量对摄食碳有极显著影响 (F=64.95, P<0.01; F=30.14, P<0.01)。多重比较结果表明:同一温度下,S组碳摄食率均显著高于M、L组 (P<0.05),而M、L组间无显著性差异 (P>0.05);S组各温度下碳摄食率无显著性差异 (P>0.05),M、L组在20℃时有最大值,与16℃和24℃时有显著性差异 (P<0.05)。
体质量与摄食碳呈负相关关系,可用关系式COC=aWb表示,其中 COC为岩虫的碳摄食率[mg/(d·g)],W为岩虫的干体质量 (g),a、b为系数。a值的生物学意义为个体单位质量的碳摄食率。温度16℃时a值最高,为11.61;b值为单位体质量碳摄食率随体质量增加的减少比率,变动范围为-0.47~-0.89(表1)。在同一温度下,碳摄食率随体质量增大而减小,两者之间显著相关。
表1 不同温度下岩虫体质量与摄食碳率的关系
Tab.1 Parameters of regressive equation between carbon ingestion rate and body weight of rock worm Marphysa sanguinea at different temperatures
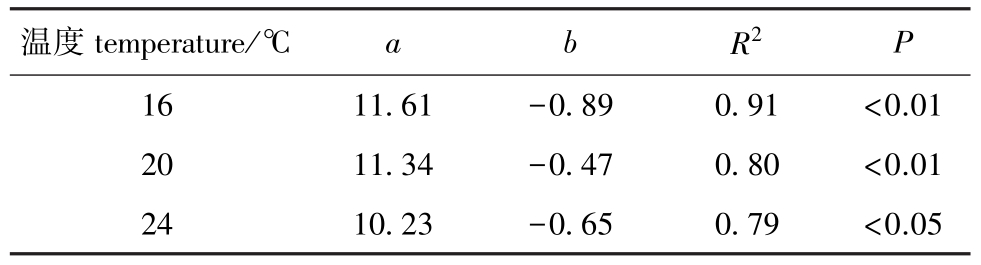
温度temperature/℃ a b R2 P 16 11.61 -0.89 0.91 <0.01 20 11.34 -0.47 0.80 <0.01 24 10.23 -0.65 0.79 <0.05
2.2 岩虫碳吸收率
从表 2可见:碳的吸收效率 AC范围为50.2%~76.9%,以20℃时最高,温度高于或低于20℃,AC均会降低,温度对AC有极显著性影响(F=77.81,P<0.01);碳的 KC范围为 13.4%~44.1%,显示岩虫对饵料中的碳具有较高的吸收率;随着温度的升高KC也升高,温度为20℃时达到最大值,之后又随着温度的升高而降低,温度对KC也有极显著性影响 (F=8.14,P<0.01)。在16℃和20℃下,S组岩虫的AC、KC均显著大于M、L组 (P<0.05);24℃下,S组和M组的AC、KC均无显著性差异 (P>0.05),二者均显著大于L组(P<0.05)。
表2 不同温度下岩虫的碳吸收效率和碳毛生长率
Tab.2 Carbon assimilation efficiency and gross growth rate of rock worm Marphysa sanguinea at different temperatures %
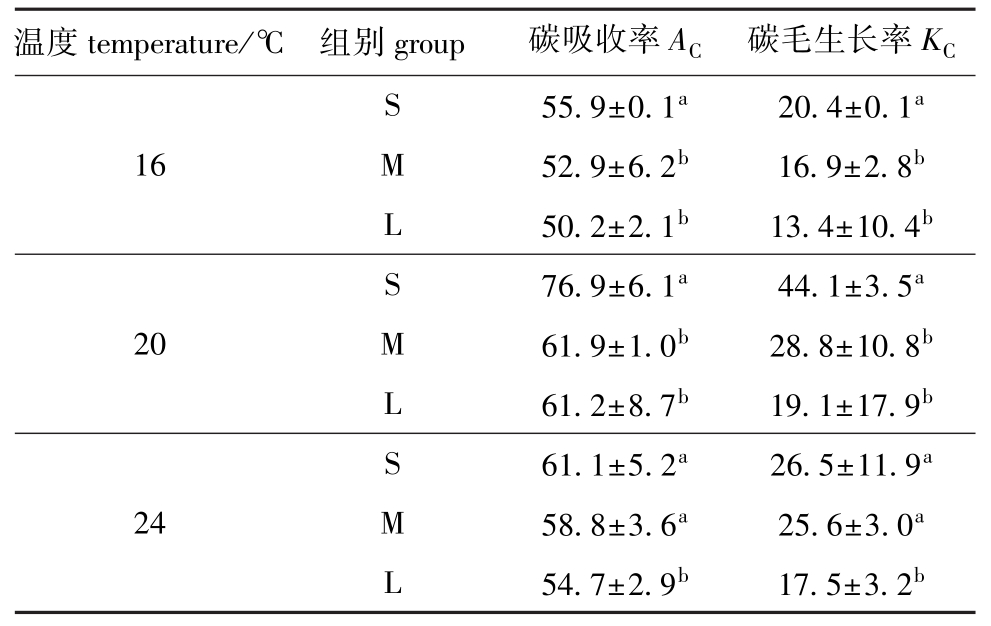
温度temperature/℃ 组别group 碳吸收率AC 碳毛生长率KC S 55.9±0.1a 20.4±0.1a 16 M 52.9±6.2b 16.9±2.8b L 50.2±2.1b 13.4±10.4b S 76.9±6.1a 44.1±3.5a 20 M 61.9±1.0b 28.8±10.8b L 61.2±8.7b 19.1±17.9b S 61.1±5.2a 26.5±11.9a 24 M 58.8±3.6a 25.6±3.0a L 54.7±2.9b 17.5±3.2b
2.3 岩虫的最小碳需求量
从图2可见,各温度下,随体质量的增加最小碳需求量减少。经双因素方差分析表明,温度对最小碳需求量有显著性影响 (F=3.88,P=0.04),体质量对最小碳需求量有极显著性影响 (F=13.05,P<0.01)。经Tukey检验表明,S组与M、L组有显著性差异 (P<0.05),而M、L组间无显著性差异 (P>0.05)。最小碳需求量 (MCR)与虫体干质量 (W)呈负幂函数关系,即MCR=aWb,其中a、b为参数。a值的生物学意义为个体单位质量的MCR,在温度24℃时,a值最小为4.20;b值为单位体质量MCR随体质量增加的减少比率,变动范围为-0.33~-0.90(表3)。
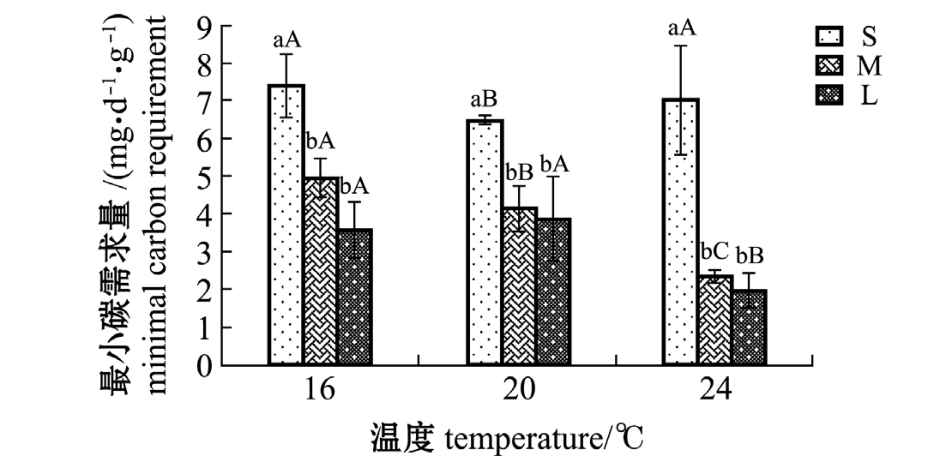
图2 不同温度下岩虫的最小碳需求量
Fig.2 Minimal carbon requirement of rock worm Marphysa sanguinea at different temperatures
表3 不同温度下岩虫最小需碳量与体质量的关系
Tab.3 Parameters of regressive equation between minimal carbon requirement and body weight of rock worm Marphysa sanguinea at different temperatures
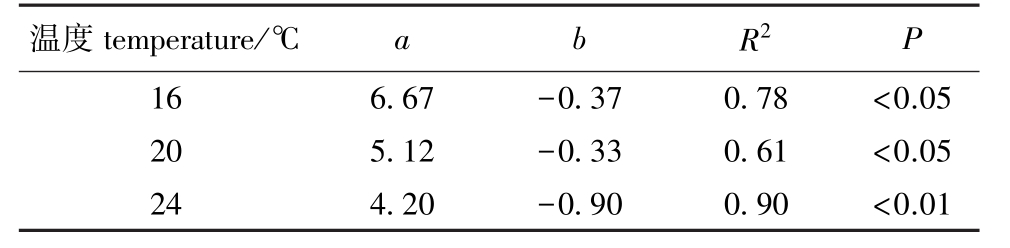
温度temperature/℃ a b R2 P 16 6.67 -0.37 0.78 <0.05 20 5.12 -0.33 0.61 <0.05 24 4.20 -0.90 0.90 <0.01
2.4 岩虫摄食碳的分配
假设摄食的碳为100%,计算其他各组分比例,建立了16、20、24℃下不同规格岩虫对饵料中碳的收支方程。从表4可见:温度为16~24℃时,由呼吸和排泄消耗的碳占摄食碳的比例最大,为47.3%~64.9%,20℃时生长累积碳占摄食碳的比例最高,为19.1%~44.1%。
3 讨论
3.1 岩虫对碳的吸收效率及毛生长率
碳对一切生命而言均是一种非常重要的基本构成元素,是一切有机物的基本成分。吸收效率体现了种类的消化能力,其受到许多生物及非生物因素的影响,如生物体质量、生理状态、摄食水平和水温等。康斌等[16]报道了鮻Liza haematocheila对高营养价饵料的碳吸收效率为84.6%,对低营养价饵料的值为90.4%。张硕等[7]报道,20℃和25℃时,中国对虾摄食沙蚕的平均碳吸收效率分别为95.6%和97.1%。郭东晖等[17]报道了中华假磷虾Pseudeuphausia sinica碳吸收效率为84%~95%。本试验中,16、20、24℃下岩虫碳吸收效率平均分别为53.0%、66.7%和58.2%,而且同一温度下,体质量小的岩虫碳吸收效率较高。本试验结果低于已报道的数据,这可能与生物体质量、饵料中碳的含量及计算方法不同均有关系。碳的毛生长率是摄取的碳分配给生长碳的比例,是岩虫生长的重要指标。本研究中,温度是影响碳毛生长率的主要因子。王俊等[18]报道了三疣梭子蟹Portunus trituberculatus幼蟹的碳毛生长率随着温度升高而升高,平均为28%,而张硕等[7]报道中国对虾在20~25℃内,碳累积率随着温度升高而降低,平均为24.9%。本研究中,岩虫在16、20、24℃下碳毛生长率平均分别为16.9%、30.7%和23.2%,且均随着温度升高而发生变化,20℃时达到最大值,而当温度继续升高,碳累积率下降,显示出20℃是岩虫碳累积的最佳温度。
表4 不同温度下岩虫的碳元素收支
Tab.4 Carbon budget of rock worm Marphysa sanguinea at different temperatures %
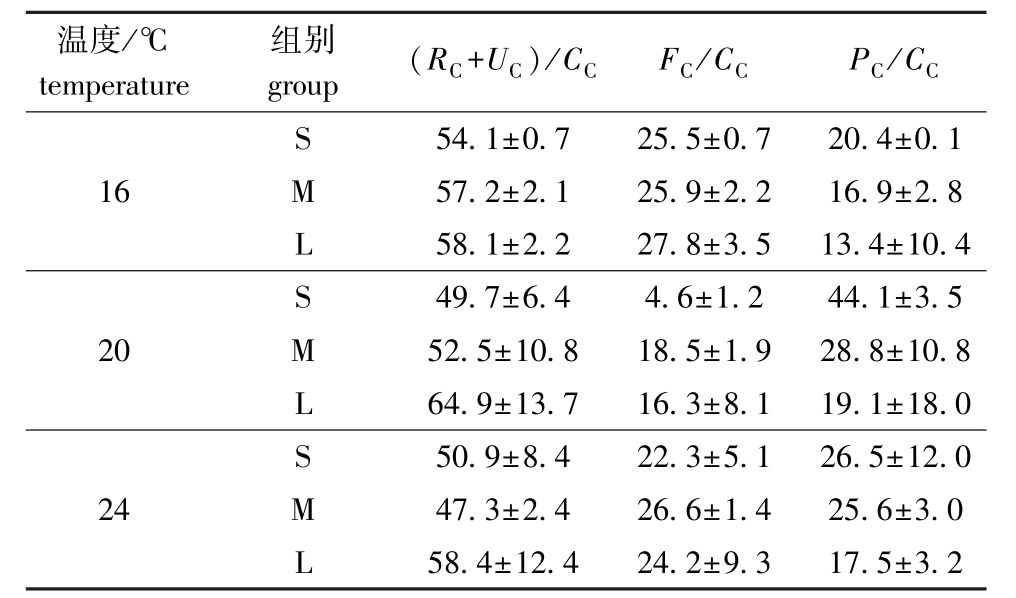
温度/℃temperature组别group (RC+UC)/CC FC/CC PC/CC S 54.1±0.7 25.5±0.7 20.4±0.1 16 M 57.2±2.1 25.9±2.2 16.9±2.8 L 58.1±2.2 27.8±3.5 13.4±10.4 S 49.7±6.4 4.6±1.2 44.1±3.5 20 M 52.5±10.8 18.5±1.9 28.8±10.8 L 64.9±13.7 16.3±8.1 19.1±18.0 S 50.9±8.4 22.3±5.1 26.5±12.0 24 M 47.3±2.4 26.6±1.4 25.6±3.0 L 58.4±12.4 24.2±9.3 17.5±3.2
3.2 岩虫的最小碳需求量
温度通过生命代谢活动进而影响着生物体碳需求量与碳消费。有关环境因子对多毛类最小碳需求量影响的研究报道并不多,但是对贝类、刺参等物种的研究较多。毛兴华等[15]对海湾扇贝Argopectens irradias和栉孔扇贝Chlamys farreri的最小碳需求量进行了研究,结果表明,单位软体部干质量的最小碳需求量与个体大小呈负相关关系。王玲[19]研究了温度和体质量对双齿围沙蚕最小碳需求量的影响,试验范围内,最小碳需求量以20℃时为最低,单位体质量最小碳需求量与体质量呈负幂函数关系:MCR=aWb,a值在20℃时有最小值1.54,b值变动范围为-0.41~-0.67。董波等[13]研究了温度为9~26℃时菲律宾蛤仔Ruditapes philippinarum的最小碳需求量,其需求量 (Y)与蛤仔软体部干质量 (X)呈幂函数关系 Y=aXb,b值平均为0.43±0.12。本试验中,水温为16℃时,由于温度较低,岩虫要消耗较大部分的碳来适应环境并维持自身代谢需要,故在该温度下,岩虫的最小碳需求量上升。在温度为20~24℃时,岩虫的最小碳需求量较小,累积碳大部分用于其个体生长。另外,在相同温度下,岩虫的最小碳需求量与体质量呈负相关关系,即小个体的岩虫的最小碳需求量高,这说明小个体正处于快速生长阶段,代谢旺盛,这符合一般生物的代谢规律[14,20]。
3.3 岩虫的碳收支
碳收支体现生物对食物中来源的碳元素的消化、吸收与利用,不同环境和生物个体对食物中碳元素的利用支出也不尽相同,且受到多种生物和非生物环境因子影响。对于水生生物来说,测定食物中碳元素的支出主要是通过测定食物的吸收效率得到。但其测定的难点在于水生动物的食物与粪便均产生在水环境中,收集较为困难,且易于溶解和损失。岩虫碳收支测定中规避了上述难点,岩虫摄食大型海藻孔石莼,食物易于采样分析。同时,岩虫的粪便为黏膜包裹的小型颗粒状,不易分散到水中,因此,试验中的吸收效率测定误差较小。
王玲[19]对双齿围沙蚕的摄食碳率进行了研究,结果表明,随着温度的上升,20℃时摄食碳达到最高,温度继续升到24℃时,摄食碳显著降低。在同一温度下,摄食碳率与体质量呈负相关关系。张硕等[7]对中国对虾的碳收支进行测定发现,随温度升高和体质量下降,碳摄食量显著增加。规格对摄食碳分配比率影响不大,温度是影响碳分配的主要影响因素。本研究结果表明,在20℃时岩虫生长碳占摄食碳的比例出现最大值,而并非随温度升高而持续增加,毛生长率也呈现这种规律。表明在温度变化条件下,岩虫自身具有一定的生理适应性,主要原因是,16~24℃时岩虫代谢碳占摄食碳的比例变化不大。生长能的比率主要是由排粪中的碳决定的,摄食碳随温度升高而明显增加,同时代谢碳变化不大,这样就导致了温度上升过程中生长碳占摄食碳比例的增加,并在20℃时达到最高值。随着温度继续升高,当温度达到24℃时,岩虫摄食碳率降低,吸收效率也降低,排粪碳占摄食碳的比例升高,所以生长碳占摄食碳的比例也随之降低。
参考文献:
[1] 于海志,朱丽岩,郑家声.岩虫的性腺发育和生殖周期[J].中国水产科学,2005,12(6):669-674.
[2] 潘卫东,刘向辉,戈峰.海洋岩虫抗菌肽筛选及抗癌活性的初步研究[J].中国海洋药物,2004,23(3):1-6.
[3] 杨大佐,周一兵,陈爱华,等.岩虫室内人工繁育的初步研究[J].水产科学,2011,30(9):572-574.
[4] 蔡含筠,侯林,马明辉.岩虫的个体发育[J].辽宁师范大学学报:自然科学版,1994,17(4):328-335.
[5] Houghton R A.Balancing the global carbon budget[J].Annual Review of Earth and Planetary Sciences,2007,35(1):313-347.
[6] Schindler D W,Curtis P J,Bayley S E,et al.Climate-induced changes in the dissolved organic carbon budgets of boreal lakes[J].Biogeochemistry,1997,36(1):9-28.
[7] 张硕,董双林,王芳.温度和体重对中国对虾碳收支的影响[J].应用生态学报,2000,11(4):615-617.
[8] 张硕,董双林,王芳.中国对虾生物能量学研究:Ⅱ.温度和体重对能量收支的影响[J].青岛海洋大学学报,1998,28(2):228-232.
[9] 孟雷明,王丽丽,雷艳,等.盐度对刺参碳、氮收支影响的初步研究[J].大连海洋大学学报,2013,28(1):34-38.
[10] Smaal A C,Vonck A P M A.Seasonal variation in C,N and P budgets and tissue composition of the mussel Mytilus edulis[J].Marine Ecology Progress Series,1997,153:167-179.
[11] Bayne B L.Carbon and nitrogen relationships in the feeding and growth of the Pacific oyster,Crassostrea gigas(Thunberg)[J].Journal of Experimental Marine Biology and Ecology,2009,374(1):19-30.
[12] Warren C E,Davis G E.Laboratory studies on the feeding,bioenergetics,and growth of fish[R].Corvallis,OR:Pacific Cooperative Water Pollution and Fisheries Research Laboratories,Agricultural Experiment Station,Oregon State University,1967:19-20.
[13] 董波,李军,王海燕,等.不同温度与饵料浓度下菲律宾蛤仔的能量收支[J].中国水产科学,2003,10(5):398-403.
[14] Griffiths C L,Griffiths R J.Animal Energetics:Volume 2.Bivalvia Through Reptilia[M].Amsterdam:Elsevier,1987.
[15] 毛兴华,郝亚威,杨小龙.海湾扇贝和栉孔扇贝的碳代谢及能量代谢[J].海洋学报,1997,19(4):132-137.
[16] 康斌,线薇微,武云飞.不同摄食水平条件下鮻的碳收支研究[J].中国海洋大学学报,2007,37(2):247-250.
[17] 郭东晖,李少菁,陈峰,等.中华假磷虾碳氮收支的实验研究[J].海洋学报,2005,27(1):101-106.
[18] 王俊,姜祖辉,陈瑞盛,等.三疣梭子蟹幼蟹的摄食和碳收支[J].海洋水产研究,2004,25(6):25-29.
[19] 王玲.双齿围沙蚕(Perinereis aibuhitensis Grube)能量收支及碳、氮元素收支的研究[D].大连:大连水产学院,2004.
[20] 刘英杰.青蛤摄食生理和代谢生理以及能量收支的基础研究[D].青岛:中国海洋大学,2005.