锦鲤疱疹病毒病 (Koi Herpesvirus Diease,KHVD)是由锦鲤疱疹病毒 (Koi Herpesvirus,KHV)引起的一种高致病性和高死亡率的病毒性疾病,死亡率高达80%。KHVD是世界动物卫生组织 (OIE)必报疾病之一[1],给中国及世界多个国家鲤和锦鲤养殖业造成了严重的经济损失。目前,没有可供使用的特效药物来治疗该种疾病,接种疫苗一直被认为是有效的治疗病毒性疾病的手段,但免疫效果一直未能达到良好的目标效果[2]。
热休克蛋白 (Heat shock protein,HSP)是细胞或生物体在各种不利条件 (包括缺氧、盐度、重金属、自由基、病毒感染)刺激下产生的与抗逆性相关的一类应激蛋白[3-5]。根据分子量和等电点的不同,划分为七大家族:小 HSP、HSP40、HSP60、 HSP70、 HSP90、 HSP110和泛素[6]。 在免疫过程中,热休克蛋白可以作为佐剂、抗原、抗原载体,能提高专一性免疫效果[7]。研究人员通过构建重组HSP-肽段复合体进行抗肿瘤免疫试验发现,HSP既具有增强免疫的功能,又具有免疫佐剂的一系列特征;在抗原呈递中通过HSP将内源性和外源性抗原呈递给MHCⅠ分子,专一启动CD8+T 细胞, 激活 CTLs免疫应答[8-11]。
与其他HSP家族相比,HSP90家族含量丰富,具有非常高的保守性[12]。HSP90可与细胞中多种不同功能的蛋白结合形成复合物,调节细胞的活性,增强结构稳定性[13]。当受到有害物质胁迫时,HSP90表达水平提高,产生热耐受作为分子伴侣来帮助细胞,维持机体稳态[14-15]。近年来,HSP所具有的免疫增强作用在核酸疫苗中应用广泛。焦凤平等[14]将重组质粒 PC-P6-gBCTL-HSP70与单纯疱疹病毒Ⅱ型 (HSV-2)疫苗联合免疫发现,其具有同时增强体液免疫与细胞免疫的功能;李淑君[15]研究发现,加入佐剂HSP65后与DNA质粒联合,比单一灭活苗或单一DNA质粒诱导细胞免疫水平均高;Bolhassani等[16]研究发现,HSPgp96作为佐剂与人体乳头瘤E7(HPV E7蛋白)联合免疫显示,其具有特异性细胞免疫应答。因此,加入相关热休克蛋白佐剂以提高核酸疫苗免疫效果是必不可少的。
目前,HSP90在作为水产动物免疫佐剂方面的应用还不常见。本研究中通过构建pEGFP-C1-HSP90真核表达载体,探究pEGFP-C1-HSP90作为免疫佐剂与pIRES-ORF81核酸疫苗 (吉林农业大学动物科学技术学院重点实验室基于KHV主要保护性抗原囊膜蛋白ORF81研制的KHV核酸疫苗,保护率达80%以上,专利号为CN102988973A)[17-19]联合免疫的免疫效果,旨在为锦鲤疱疹病毒病的治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 试验鱼 试验鱼购自长春市某养鱼场,选取体质量为200~300 g的健康鲤150尾,在实验室25℃水族箱中饲养2周以上。
1.1.2 质粒、细胞、病毒重组 质粒 pIRESORF81、KHV阳性血清和鲤脑细胞 (CCB)由吉林农业大学动物科学技术学院保存和冻存[20]。
1.1.3 试验试剂 DNA Marker(DL2000、DL5000)及反转录酶、限制性内切酶、T4DNA连接酶均为TaKaRa产品;凝胶回收试剂盒、卡那霉素、氨苄青霉素购自AxyGen公司;焦磷酸二乙酯(DEPC)购自北京鼎国公司;EndoFectin TM-Max转染试剂购自长春维尔特科技有限公司;抗鲤IgM单克隆抗体购自AQUATIC Diagnostic Ltd;羊抗鼠酶标二抗购自三箭生物科技有限公司;其他试剂均为国产分析纯级别。
1.2 方法
1.2.1 HSP90基因的引物设计与合成 根据Gen-Bank上登录的鲤 HSP90基因序列 (登录号:L513382.1),使用Primer Premiers 5.0软件设计引物。上、下游引物分别为
其中画线部分依次引入XhoⅠ和EcoRⅠ限制性酶切位点,由生工生物工程 (上海)股份有限公司合成。
1.2.2 HSP90基因的克隆与鉴定 将健康试验鲤用体积分数为75%的乙醇消毒,在超净工作台上解剖鱼体,取其头肾组织。采用TRizol(Invitrogen)提取总RNA,并反转录为cDNA,建立100 μL反转录体系。PCR反应程序:95℃下预变性5 min;94℃下变性30 s,63.5℃下退火30 s,共进行35个循环;在72℃下延伸1 min,于4℃下保存,用琼脂糖凝胶电泳检测扩增产物。
将回收纯化的HSP90目的基因连接至pMD-19T克隆载体,连接产物转化至DH5α大肠杆菌感受态细胞中,经双酶切和PCR鉴定均为阳性的重组克隆质粒保种,由生工生物工程 (上海)股份有限公司测序,将测序结果与GenBank登陆的基因序列进行BLAST比对。
1.2.3 pEGFP-C1-HSP90重组质粒的构建回收
用T4DNA连接酶将pMD19-T-HSP9目的基因与pEGFP-C1酶切回收的大片段连接后,转入至大肠杆菌感受态细胞DH5α中,用含有卡那霉素液体的LB培养基进行筛选后,经PCR和双酶切进行验证。选取阳性质粒命名为pEGFP-C1-HSP90并由生工生物工程 (上海)股份有限公司进行测序。
1.2.4 重组质粒pEGFP-C1-HSP90的细胞表达将纯化重组表达质粒pEGFP-C1-HSP90及pIRESORF81菌液划线培养。挑取单一乳白色菌落接种到液体LB培养基 (Kan抗性)中,培养至对数生长期后进行扩摇,收集菌体进行重组质粒的大量提取。使用Nanodrop 2000超微量分光光度计测定重组表达质粒在260 nm波长时的吸光值,并计算重组表达质粒浓度 (μg/μL),其计算公式为
用L-15培养基分别稀释重组表达质粒pEGFP-C1-HSP90和转染试剂 EndoFectionTM Max,并置于室温。用125 μL L-15培养基分别稀释重组表达质粒 pEGFP-C1-HSP90(2.5 μg) 和不同剂量 (5.0、7.5、10.0 μg) 的转染试剂EndoFectionTM Max,并将两者充分混匀,静置10~20 min,形成DNA-EndoFectionTM混合物,并将混合物逐滴加入到每个细胞培养孔中,在26℃培养箱中孵育转染细胞,24 h后在荧光倒置显微镜下观察细胞转染情况并采集图片。
1.2.5 重组质粒 pEGFP-C1-HSP90与 pIRESORF81联合免疫 随机选取10尾鲤头肾组织样品进行PCR检测,鉴定结果显示均未感染KHV。将试验鱼平均分为6组,每组10尾,将表1试剂按组分配,每组配制成2000 μL,给每尾鲤肌肉注射,剂量均为200 μL。每周免疫1次,共免疫3次。
1.2.6 重组表达质粒pEGFP-C1-HSP90诱导鲤的免疫效果检测 采用尾静脉取血方法,免疫前采血一次,共进行3次免疫,第一次和第二次免疫一周后采血一次,第三次免疫后第一周、第二周、第三周分别采血一次。制备血清后进行间接ELISA检测,结果通过酶标仪OD450 nm测定。
表1 鲤免疫分组及注射量
Tab.1 Immune groups and injection volumes in common carp

组别 group pIRES-ORF81/μg pEGFP-C1-HSP90/μgPBS/mL 1 2 3 4 5 6——1 0 200 10 10 10— —5 1 0 20— —
2 结果与分析
2.1 HSP90基因的PCR扩增
将鲤头肾组织所提取的RNA进行反转录,获得cDNA模板,以HSP90-F1、R2为引物进行PCR扩增,获得与预期片段大小相符的687 bp基因,结果如图1所示。
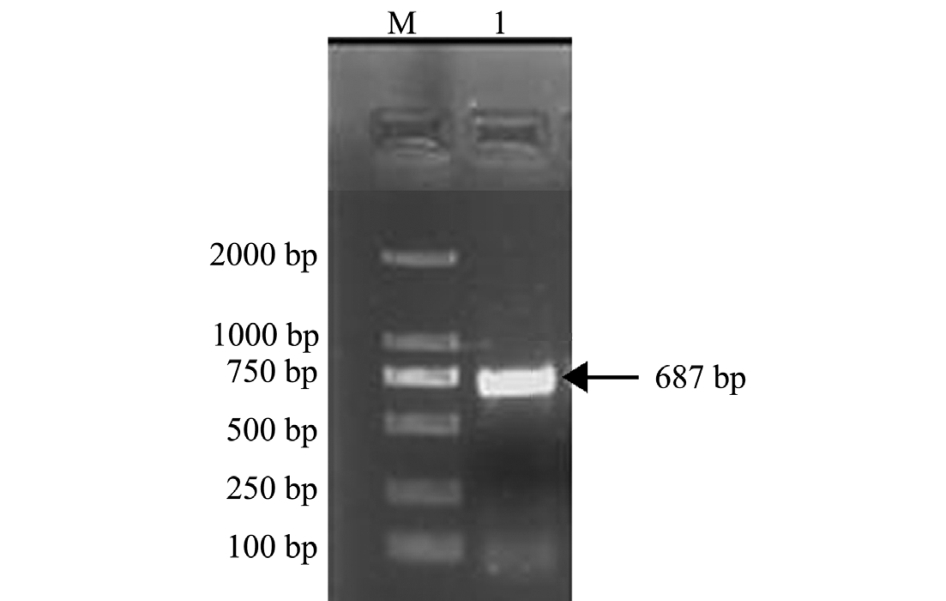
图1 鲤HSP90基因的PCR扩增
Fig.1 The PCR amplification product of HSP90 in common carp
注:M为DL2000 DNA Marker;1为PCR产物
Note:M, DL2000 DNA Marker; 1, PCR product of HSP90
2.2 克隆质粒pMD19-T-HSP90的双酶切鉴定
使用XhoⅠ和EcoRⅠ两种内切酶对重组质粒pMD19-T-HSP90进行双酶切鉴定。结果显示,符合预期结果大小,在687 bp处有明显条带 (图2),表明成功构建了重组质粒pMD19-T-HSP90。
2.3 测序结果的BLAST比对
将HSP90的测序结果在GenBank中进行BLAST比对,结果见图3,所克隆的HSP90基因与GenBank中登入的鲤HSP90基因序列匹配度相同。
2.4 重组表达质粒pEGFP-C1-HSP90的双酶切鉴定
将重组质粒pEGFP-C1-HSP90进行双酶切鉴定。结果显示,在687 bp处有明显条带,另一条带在5000 bp左右 (图4),与预期结果相符。表明成功构建了重组质粒pEGFP-C1-HSP90。
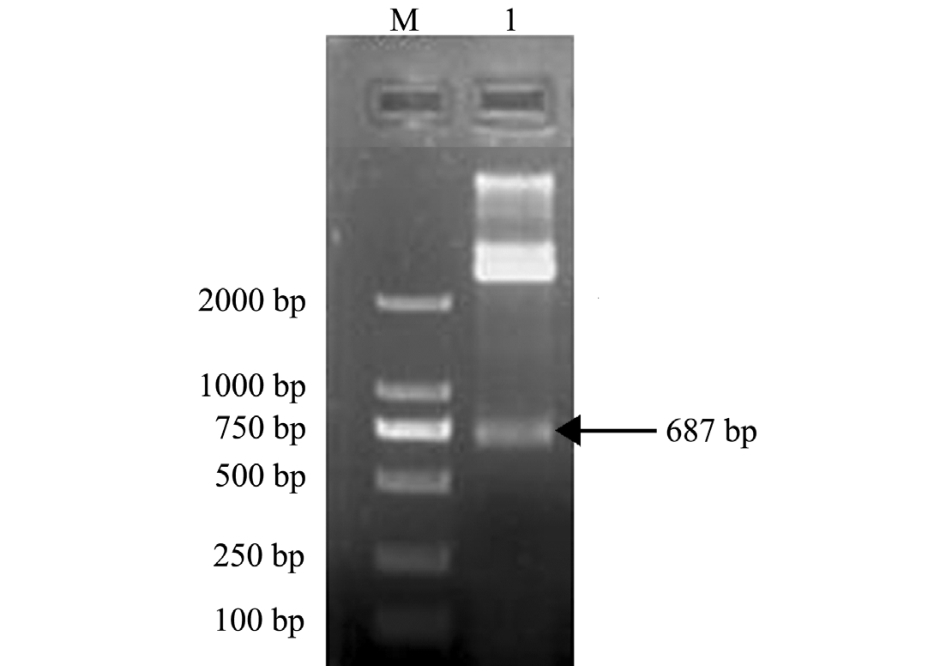
图 2 pMD19-T-HSP90的双酶切
Fig.2 Identification of double restriction enzyme diges
tion for pMD19-T-HSP90
注:M为DL2000 DNA Marker; 1为pMD19-T-HSP90的双酶切产物
Note:M, DL2000 DNA Marker; 1, the double digested product of pMD19-T-HSP90
2.5 重组质粒pEGFP-C1-HSP90的细胞表达
2.5.1 重组表达质粒浓度 根据浓度公式计算出pEGFP-C1-HSP90、 pIRES-ORF81 重组表达质粒的浓度分别为 0.95、 0.63 μg/μL。
2.5.2 重组表达质粒的转染 将重组质粒pEGFPC1-HSP90(2.5 μg) 分别与3种不同剂量 (5.0、7.5、 10.0 μg) 的转染试剂 EndoFectionTM Max混合后转染至鲤脑细胞中,转染24 h后在荧光倒置显微镜下观察转染情况并成像。结果显示,转染试剂EndoFectionTM Max剂量为5.0 μg时转染效果最佳,重组质粒在鲤脑细胞中的转染荧光图见图5。
2.6 对试验动物的PCR检测
随机选取10尾试验鲤,对其头肾组织样品基因组进行PCR扩增,以KHV病毒作为阳性对照。结果显示,所选10尾试验鲤均为KHV阴性 (图6),未携带KHV病毒,可以进行免疫试验。
2.7 抗体水平ELISA检测
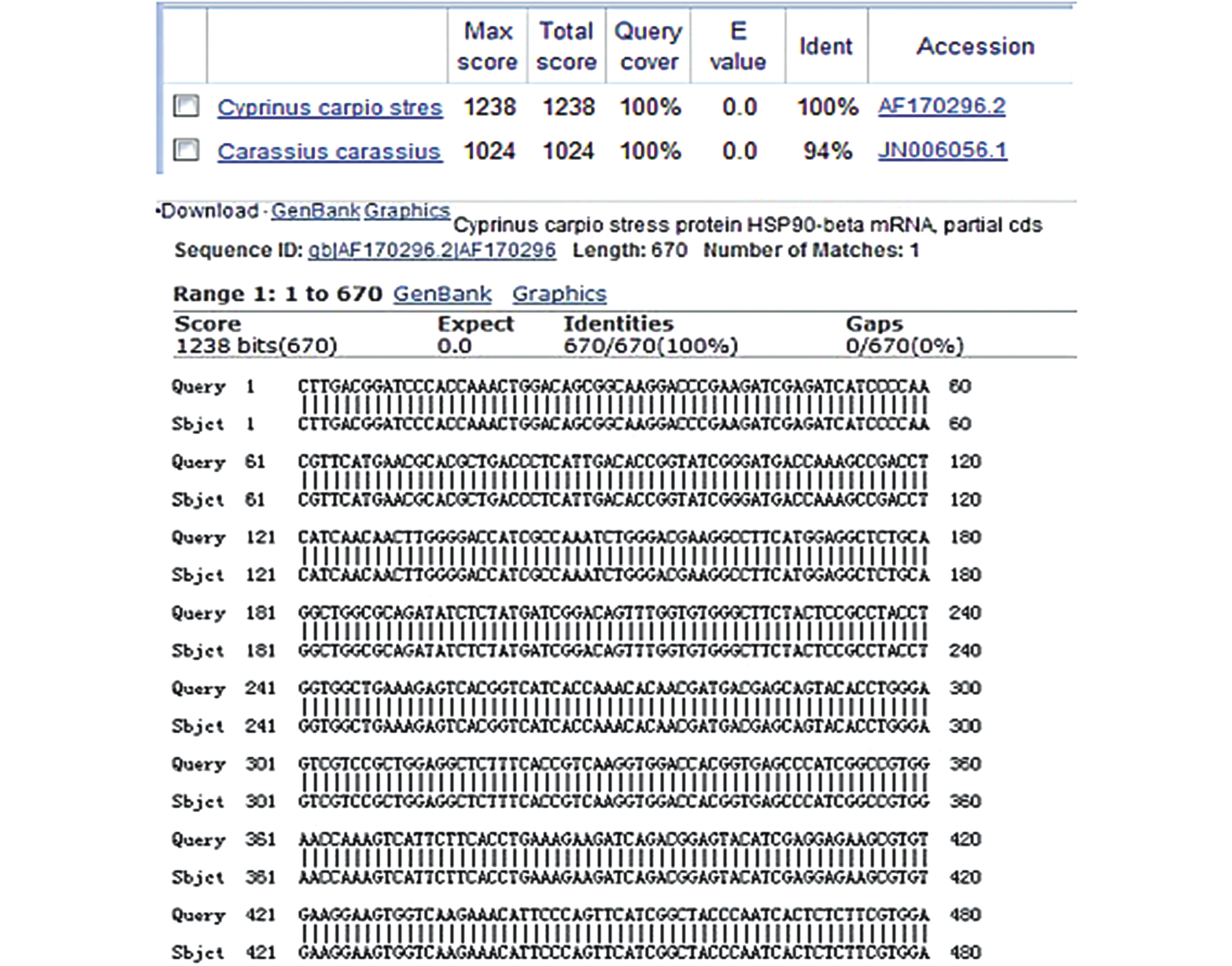
图3 鲤HSP90基因的BLAST比对
Fig.3 The BLAST contrast of HSP90 gene in common carp
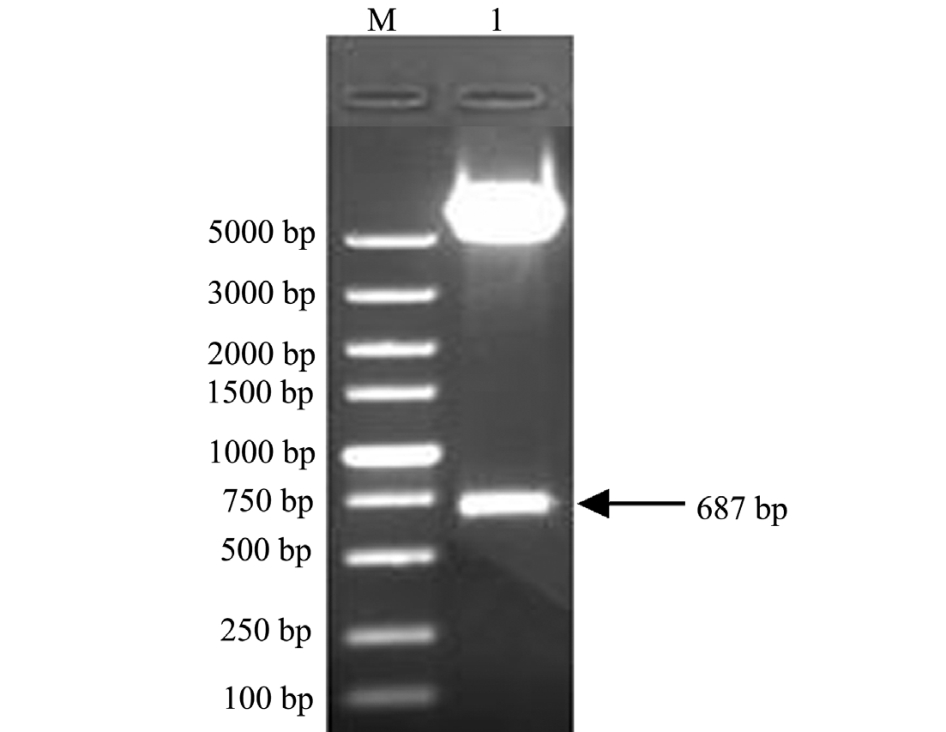
图4 pEGFP-C1-HSP90的双酶切鉴定
Fig.4 The PCR identification of recombinant plasmid pEGFP-C1-HSP90
注:M为DL5000 DNA Marker; 1为pEGFP-C1-HSP90的双酶切产物
Note:M, DL5000 DNA Marker; 1, PCR product of pEGFP-C1-HSP90

图5 pEGFP-C1-HSP90在鲤脑细胞中的表达 (5 μg)
Fig.5 Expression in common carp brain(CCB)cells of pEGFP-C1-HSP90(5 μg)
通过间接ELISA方法检测抗体水平,在450 nm处吸光值平均数和标准差的计算结果如表2所示。从表2可见,空白对照组与PBS对照组均没有特异性抗体产生,而重组质粒单独免疫或联合免疫均可以获得较高的抗体水平,免疫次数增加的同时抗体水平也随之增加。与单独用pIRES-ORF81核酸免疫相比,pEGFP-C1-HSP90作为佐剂联合免疫抗体水平相对升高,其中第6组即pIRESORF81(10 μg) +pEGFP-C1-HSP90(20 μg) 在各免疫剂量组中相对较好,第三次免疫后两周,抗体水平达到最高 (1.316 9),但与其他组无显著性差异 (P>0.05)。后续为验证重组质粒的安全性,在结束试验后对试验鱼暂养一个月,未发现对鱼体健康存在不良影响,并随机筛选部分试验鱼进行了组织病理学观察,也未发现异常。
表2 ELISA检测抗体水平 (OD450 nm)
Tab.2 Antibody detection(OD450 nm)by ELISA
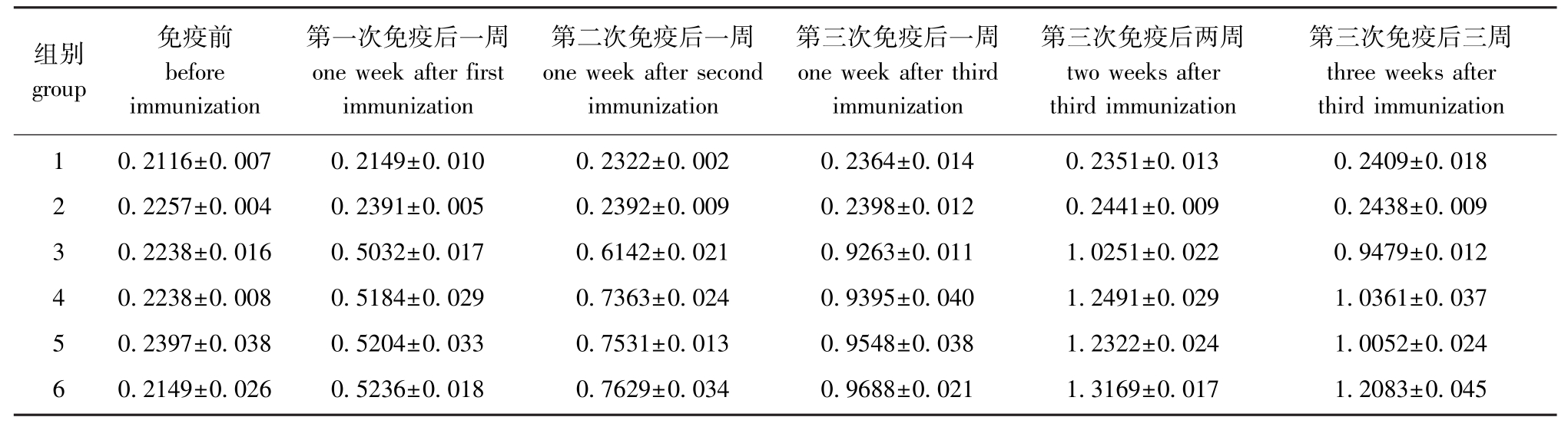
组别group免疫前before immunization第一次免疫后一周one week after first immunization第二次免疫后一周one week after second immunization第三次免疫后一周one week after third immunization第三次免疫后两周two weeks after third immunization第三次免疫后三周three weeks after third immunization 1 2 3 4 5 6 0.2116±0.007 0.2257±0.004 0.2238±0.016 0.2238±0.008 0.2397±0.038 0.2149±0.026 0.2149±0.010 0.2391±0.005 0.5032±0.017 0.5184±0.029 0.5204±0.033 0.5236±0.018 0.2322±0.002 0.2392±0.009 0.6142±0.021 0.7363±0.024 0.7531±0.013 0.7629±0.034 0.2364±0.014 0.2398±0.012 0.9263±0.011 0.9395±0.040 0.9548±0.038 0.9688±0.021 0.2351±0.013 0.2441±0.009 1.0251±0.022 1.2491±0.029 1.2322±0.024 1.3169±0.017 0.2409±0.018 0.2438±0.009 0.9479±0.012 1.0361±0.037 1.0052±0.024 1.2083±0.045
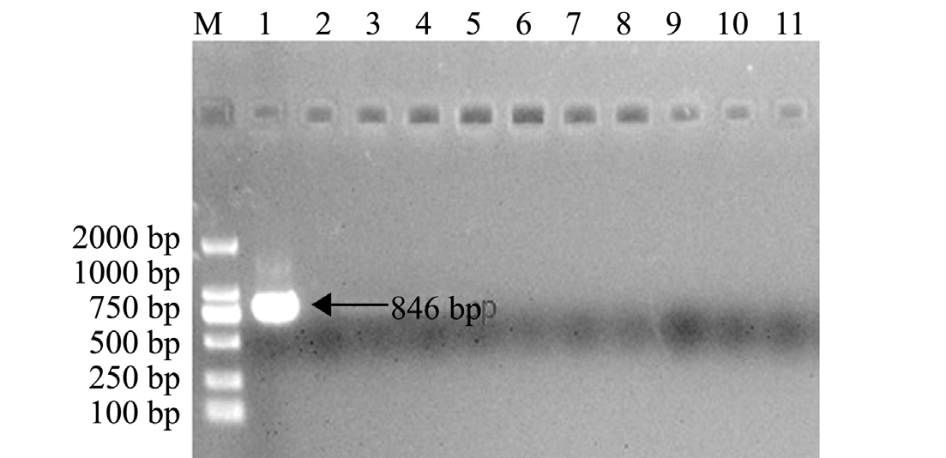
图6 试验鲤的PCR检测
Fig.6 The PCR detections of the test common carp
注:M为DL2000 DNA Marker;1为阳性对照;2~11分别为10尾鲤组织样品DNA的PCR产物
Note:M, DL2000 DNA Marker; 1, positive control; 2-11, the PCR products of common carp tissue DNA in random sampling
3 讨论
3.1 KHV相关疫苗研制情况
自20世纪90年代末首次对KHV的描述以来,这种病毒已经在世界范围内流行,对鲤和锦鲤产业可持续健康发展造成极大危害。KHV也通过影响野生鲤种群进而对环境产生负面影响,其作为水生动物疫病病毒越来越被重视。但现有开发的核酸疫苗都或多或少存在一些问题。其中,弱毒苗虽然免疫效果较好[21-22],但存在散毒和返强的危险,后经Yasumoto等[23]研发的用质体脂包裹甲醛灭活的KHV灭活疫苗与弱毒疫苗相比,具有安全性好、不存在散布病毒和造成KHV新疫源的危险,但其产生的保护力不强,仅为65%,需要反复多次免疫,一直未能达到预期效果。因此,为了增强核酸疫苗的免疫原性,加入如佐剂的免疫刺激剂尤为重要。
3.2 HSP90免疫佐剂研究情况
相关学者研究表明,病毒HSP90高度保守,在生物体内发挥极其重要的功能。王婷婷等[24]研究发现,菱鲆Psetta maxima胚胎细胞系在感染鳗弧菌Vibrio anguillarum 6 h后,HSP90β即可被检测到且显著上调;冯俪等[25]通过构建 PVAXHSP90重组质粒联合核酸疫苗显示出良好的免疫保护作用,都具有良好的免疫应答和抗原呈递作用。
本试验中,为增强pIRES-ORF81核酸疫苗的免疫活性,选择 HSP90作为 KHV pIRES-ORF81疫苗的佐剂。用 pIRES-ORF81与重组表达质粒pEGFP-C1-HSP90联合免疫患病鲤,采集鲤血清,通过间接ELISA检测抗体水平。研究结果表明,重组质粒单独免疫或联合免疫均可以获得较高的抗体水平,与单独用pIRES-ORF81核酸免疫效果相比, pEGFP-C1-HSP90与 pIRES-ORF81联合免疫后抗体水平相对升高。可以看出,HSP90可以提高专一性免疫效果,重组表达质粒 pEGFP-C1-HSP90对pIRES-ORF81的抗体水平起到了促进作用,与上述学者的研究结果相似。本研究结果可为后续水生动物热休克蛋白研究提供参考数据,还可为锦鲤疱疹病毒病的疫苗研制及用免疫佐剂联合免疫治疗提供新的思路。
参考文献:
[1] Eide K E,Miller-Morgan T,Heidel J R,et al.Investigation of koi herpesvirus latency in koi[J].Journal of Virology,2011,85(10):4954-4962.
[2] Waltzek T B,Kelley G O,Stone D M,et al.Koi herpesvirus represents a third cyprinid herpesvirus(CyHV-3)in the family Herpesviridae[J].The Journal of General Virology,2005,86(Pt6):1659-1667.
[3] Ritossa F.A new puffing pattern induced by temperature shock and DNP in Drosophila[J].Experientia,1962,18(12):571-573.
[4] Basu N,Todgham A E,Ackerman P A,et al.Heat shock protein genes and their functional significance in fish[J].Gene,2002,295(2):173-183.
[5] 刘玲玉,孟玉强,杨学冬.热休克蛋白生物学作用的研究进展[J].阴山学刊,2007,21(1):61-64,76.
[6] Krenek S,Schlegel M,Berendonk T U.Convergent evolution of heat-inducibility during subfunction analization of the Hsp70 gene family[J].BMC Evolutionary Biology,2013,13:49.
[7] Tutar L,Tutar Y.Heat shock proteins:an overview[J].Current Pharmaceutical Biotechnology,2010,11(2):216-222.
[8] Linderoth N A,Popowicz A,Sastry S.Identification of the peptidebinding site in the heat shock chaperone/tumorrejection antigen Gp96(Grp94)[J].The Journal of Biological Chemistry,2000,275(8):5472-5477.
[9] Van Herwijnen M J,Wieten L,Van Der Zee R,et al.Regulatory T cells that recognize a ubiquitous stress-inducible self-antigen are long-lived suppressors of autoimmune arthritis[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(35):14134-14139.
[10] Borges T J,Wieten L,VanHerwijnen M J,et al.The anti-inflammatory mechanisms of Hsp70[J].Frontiers in Immunology,2012,3:95.
[11] Tobian A A R,Canaday D H,Harding C V.Bacterial heat shock proteins enhance class II MHC antigen processing and presentation of chaperoned peptides to CD4+T cells[J].The Journal of Immunology,2004,173(8):5130-5137.
[12] Mitsiades C S,Mitsiades N S,McMullan C J,et al.Antimyeloma activity of heat shock protein-90 inhibition[J].Blood,2006,107(3):1092-1100.
[13] Powers M V,Workman P.Targeting of multiple signalling pathways by heat shock protein 90 molecular chaperone inhibitors[J].Endocrine-Related Cancer,2006,13(S1):S125-S135.
[14] 焦凤萍,王玉,于爱莲,等.HSV-2gD、gBCTL表位及Hsp70融合DNA疫苗的免疫的效果观察[J].免疫学杂志,2013,29(11):962-965.
[15] 李淑君.Hsp65对GPMV DNA疫苗免疫作用的研究[D].长春:吉林农业大学,2013.
[16] Bolhassani A,Rafati S.Heat-shock proteins as powerful weapons in vaccine development[J].Expert Review of Vaccines,2008,7(8):1185-1199.
[17] 李新伟.锦鲤疱疹病毒ORF25、ORF81基因核酸疫苗的构建及免疫原性的研究[D].长春:吉林农业大学,2012.
[18] 周井祥,李新伟,王好,等.锦鲤疱疹病毒-CJ株ORF81基因的克隆及生物信息学分析[J].水产学报,2011,35(12):1780-1786.
[19] 周井祥,王好,李新伟,等.一种锦鲤疱疹病毒核酸疫苗:CN,CN 102988973A[P].2012-03-27.
[20] 朱霞,李新伟,王好,等.一株锦鲤疱疹病毒的分离与鉴定[J].中国预防兽医学报,2011,33(5):340-343.
[21] Ronen A,Perelberg A,Abramowitz J,et al.Efficient vaccine against the virus causing a lethal disease in cultured Cyprinus carpio[J].Vaccine,2003,21(32):4677-4684.
[22] Perelberg A,Ronen A,Hutoran M,et al.Protection of cultured Cyprinus carpio against a lethal viral disease by an attenuated virus vaccine[J].Vaccine,2005,23(26):3396-3403.
[23] Yasumoto S,Kuzuya Y,Yasuda M,et al.Oral immunization of common carp with aliposome vaccine fusing koi herpesvirus antigen[J].Fish Pathology,2006,41(4):141-145.
[24] 王婷婷,陈松林,孟亮,等.大菱鲆热休克蛋白90基因cDNA的克隆及其表达特征[J].渔业科学进展,2010,31(2):51-59.
[25] 冯俪,聂思静,黄艺华,等.鸡堆型艾美耳球虫HSP90克隆表达及其核酸疫苗的免疫保护作用[J].中国兽医杂志,2016,52(1):10-13.