在自然水域中,浮游动物是水域初级生产者向高级营养层传递的中间环节,浮游动物摄食率的高低将决定水域初级生产转换以及食物网传递的效率,饵料的大小、形状、密度、营养价值等均对其摄食有显著影响。研究表明,大多数浮游动物具有摄食选择,能够选择摄食高营养[1-5]、无毒性[6]的有机颗粒。有学者研究表明,一些桡足类可通过口器上的化学感应器识别浮游藻类分泌物而主动选择性摄食饵料颗粒[7-8]。李超伦等[9]研究表明,饵料颗粒大小及浓度对中华哲水蚤Calanus sinicus摄食选择性存在一定影响。一些浮游动物对有毒有害的藻类,能够通过降低摄食率,减少有害藻类的毒性。吴振兴等[10]研究表明,卤虫Brine shrimp对有毒饵料藻的摄食率明显小于无毒的角毛藻和东海原甲藻。
虽然关于浮游动物对食物选择性的研究较多,但经饵料驯化后,动物对其驯化饵料是否具有依赖性的研究并不多见[11],而对于开口饵料的驯化,尤为罕见。卤虫是许多水产经济动物苗种和水族宠物的重要饵料[12],艾比湖的卤虫资源量在全国100多个盐湖中名列前茅。因此,对艾比湖卤虫的摄食研究具有重要的生态学意义。本试验中,以艾比湖卤虫为研究对象,探究了艾比湖卤虫在不同粒径开口饵料藻驯化下,对饵料藻的摄食率,以及对混合饵料是否存在摄食选择性,以期为卤虫培养中饵料藻的选取提供参考依据。
1 材料与方法
1.1 材料
试验用卤虫由采自新疆艾比湖的卤虫休眠卵,经孵化后所得。饵料藻分别为湛江等鞭金藻Isochrysis zhanjiangensis(简称等鞭金藻,符号记为D)、杜氏盐生藻Dunaliella salina(简称盐藻,符号记为Y)、青岛大扁藻Platymonas helgolondica(简称扁藻,符号记为B),3种藻均来自于大连海洋大学水生生物学重点实验室,经单种扩大培养直至试验所需浓度。
1.2 方法
1.2.1 饵料藻细胞粒径和湿质量的测定 用细胞体积法在显微镜下测量藻体大小,每种藻随机选取50个细胞,分别测量大小并计算细胞体积,再求其平均值。等鞭金藻按照球形体积计算,盐藻和扁藻按照椭球形体积计算。藻体湿质量则为细胞体积×海水密度 (海水密度为1.03 g/cm3)。根据3种饵料藻的细胞体积和湿质量 (表1),可得出3种藻体积和湿质量的比值近似为等鞭金藻∶盐藻∶扁藻≈1∶2∶6。
表1 3种饵料藻的细胞体积和湿质量
Tab.1 Cell volume and wet weight of three alga species

饵料藻food alga体积/μm3 volume体积计算公式volume formula湿质量/(mg·ind.-1 wet weight等鞭金藻I.zhanjiangensis 4 3 πR3 72±7 7.416×10-8盐藻D.salina 4 3 ab2π 145±15 14.935×10-8扁藻P.helgolondica 4 3 ab2π 416±33 42.848×10-8)
1.2.2 艾比湖卤虫的孵化与培育 将保存良好的艾比湖卤虫卵置于盐度为40的水中充气孵化,水温为 (27±1)℃,pH为8.2。卤虫卵孵化后,待48 h卤虫幼体进食时,将幼体分成3组,每组放于1 L的烧杯中,分别以等鞭金藻、盐藻和扁藻作为开口饵料培育,分别记为等鞭金藻开口饵料组(简称KD)、盐藻开口饵料组 (简称KY组)和扁藻开口饵料组 (简称KB组),连续驯化培养15 d,在卤虫的体长为0.8~1.0 cm后开始正式试验,正式试验前均饥饿处理24 h。
1.2.3 试验设计
(1)艾比湖卤虫对密度相同单一粒径饵料藻的摄食率。饥饿处理结束后,将KD、KY和KB组不同开口饵料培育的卤虫,分别再投喂单一饵料等鞭金藻 (D)、盐藻 (Y)和扁藻 (B),试验用250 mL锥形瓶,内盛200 mL单一藻液,每种藻试验初始密度设为20×104cells/mL。3种藻的初始密度为等鞭金藻 126×104cells/mL、盐藻 88×104 cells/mL、扁藻55×104cells/mL,先加入3种藻液体积分别为等鞭金藻32 mL、盐藻45 mL、扁藻73 mL,然后再分别加入备用海水至200 mL。
每个试验设3个平行,3个对照。平行组中每瓶藻中放入20只卤虫,对照组不放卤虫,用封口膜封口,试验进行2 h。试验结束时加入碘液固定,显微镜下用细胞计数法测定藻细胞密度。
(2)艾比湖卤虫对密度相同混合粒径饵料藻的摄食率。卤虫饥饿处理结束后,对KD、KY和KB组不同开口饵料培育的卤虫,分别投喂混合饵料。开口饵料等鞭金藻组KD的饵料混合方式为DY混合 (等鞭金藻与盐藻混合)、DB混合 (等鞭金藻与扁藻混合)、DYB混合 (3种藻混合);同样,开口饵料盐藻KY的饵料混合方式为YD混合、YB混合和YDB混合;开口饵料扁藻组KB的饵料混合方式为BD混合、BY混合和BDY混合。
试验同样采用250 mL锥形瓶,内盛200 mL混合藻液,试验中保证每种藻开始的密度相同,均为20×104cells/mL,当2种藻混合时,锥形瓶中的藻密度为40×104cells/mL,3种混合时,藻密度为60×104cells/mL。
混合藻试验也设置3个平行组与3个对照组。试验组两种藻混合的锥形瓶中投放40只卤虫,3种藻混合的锥形瓶中投放60只卤虫。对照组不放卤虫,用封口膜封口,试验进行2 h。试验结束时均加入碘液固定,显微镜下用细胞计数法测定藻细胞的密度。
1.2.4 指标的计算
(1)藻细胞密度计算公式[13]为
其中:N为原水样中藻类的密度 (cells/L);Cs为计数框的面积 (mm2);Fs为计数视野面积(mm2);Fn为视野个数;V为原样定容的体积(mL);v为计数框体积 (mL);Pn为计数所得藻类的个体数 (细胞总数)(cells)。
(2)摄食率计算公式[14]为
其中:IR为艾比湖卤虫摄食率[mL/(ind.·h)];Ctc为t时对照组中藻类的密度 (cells/mL);Ctf为t时平行组中藻类的密度 (cells/mL);t为试验时间(h);V为试验水样体积 (mL);n为水样中浮游动物 (卤虫)的总数 (ind.);Co为原藻类密度(cells/mL)。
(3)摄食选择性指数计算公式[15]为
其中:EI为摄食选择性指数;Gi为总摄食颗粒中i粒径级组所占的比例;Fi为饵料中i粒径级组所占的比例。
1.3 数据处理
试验数据采用SPSS 22.0软件进行处理,在ANOVA单因子方差分析的基础上,采用Duncan多重比较检验组间差异,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 艾比湖卤虫对相同密度饵料藻的摄食率
经过不同开口饵料驯化后,艾比湖卤虫对相同密度下单一粒径藻的摄食率见图1。从图1可见,3组开口饵料组中,卤虫对3种饵料藻的摄食率有显著性差异 (P<0.05),对单一饵料藻的摄食率依次均为等鞭金藻>盐藻>扁藻,呈现出细胞粒径越小摄食率越高的现象。此外,还可以看出,卤虫对单一饵料的摄食率大小与开口饵料驯化有关。对等鞭金藻的摄食率以开口饵料为等鞭金藻的KD组最高,为30.6×104cells/(ind.·h);对盐藻的摄食率以开口饵料为盐藻的KY组最高,为16.6×104 cells/(ind.·h);对扁藻的摄食率以开口饵料为扁藻的KB组最高,为6.7×104cells/(ind.·h)。
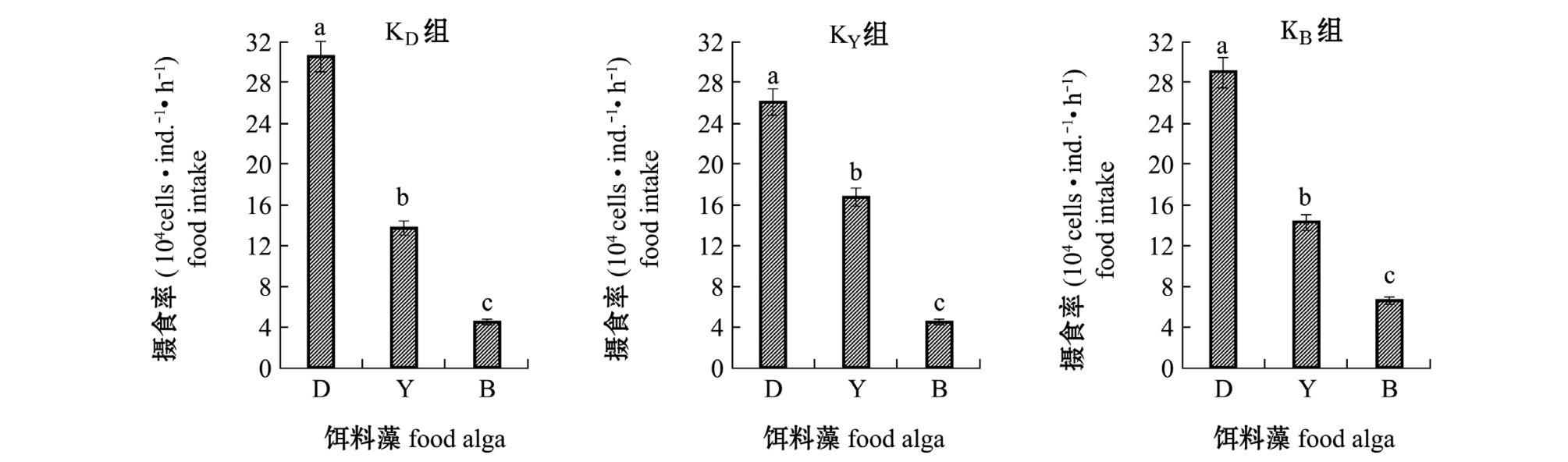
图1 艾比湖卤虫对相同密度单种饵料藻的摄食率
Fig.1 Food intake of brine shrimp Artemia parthenogenetica Aibi Lake for single food alga at same density of alga
注:标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05)
Note:The means with different letters are significant differences at the 0.05 probability level,and the means with the same letters are not significant differences
表2为经过不同开口饵料驯化后,由两种密度相同的藻混合时,艾比湖卤虫对不同藻的摄食率。从表2可知,3组开口饲料组中,卤虫的摄食率依次均为等鞭金藻>盐藻>扁藻,其中,艾比湖卤虫对等鞭金藻的摄食率,KD组平均为18.8×104 cells/(ind.·h),占总摄食率80%以上,显著高于KY和KB组 (P<0.05);艾比湖卤虫对盐藻的摄食率,KY组平均为9.9×104cells/(ind.·h),占总摄食率53%,显著高于KD、KB组 (P<0.05);艾比湖卤虫对扁藻的摄食率,KB组平均为4.4×104 cells/(ind.·h),占总摄食率的32%,显著高于KD、KY组的摄食率 (P<0.05)。
经过不同开口饵料驯化后,3种密度相同的藻混合时,艾比湖卤虫对3种藻均有摄食。图2显示,卤虫的摄食率亦是等鞭金藻>盐藻>扁藻,整体表现趋势与2种藻混合相似,卤虫对同一种藻的摄食率在不同开口饵料组中具有明显差异。3组开口饵料驯化组中,卤虫对等鞭金藻的摄食率,最高的是KD组,为12.7×104cells/(ind.·h),高出KY、KB组近30%,KD组与KY、KB组有极显著性差异 (P<0.01);卤虫对盐藻的摄食率,最大的是KY组,为7.6×104cells/(ind.·h),高出 KB组40%多,高出KD组近一倍,KY组与KD、KB组有极显著性差异 (P<0.01);对扁藻的摄食率,最高的是KB组,为3.5×104cells/(ind.·h),KB组与其他两组有显著性差异 (P<0.05)。以上结果表明,经开口饵料驯化后可明显提高卤虫对该藻的摄食率。
2.2 艾比湖卤虫对不同粒径藻的摄食选择性
卤虫经不同开口饵料驯化后,对2种密度相同混合藻的摄食选择性试验结果如表3所示,其中,卤虫对等鞭金藻的食物选择性,在等鞭金藻开口饵料KD组的DY和DB混合方式下均处于正选择性,平均值为0.23;而对盐藻的食物选择性,在盐藻开口饵料KY组的YB混合方式下为正选择,YD混合为负选择,平均为0.05;对扁藻的食物选择性,扁藻开口饵料KB组的BD和BY混合方式下均处于负选择性,平均为-0.31。
表2 艾比湖卤虫对2种密度相同混合饵料藻的摄食率Tab.2 Food intake of brine shrimp Artemia parthenogenetica Aibi Lake at the same concentration of two alga
mixture species 104cells/(ind.·h)
注:同列中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05)
Note:The means with different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences
组别group混合方式feeding pattern对等鞭金藻的摄食率food intake for I.zhanjianggensis对盐藻的摄食率food intake for D.salina对扁藻的摄食率food intake for P.helgolondica总摄食率total food intake 19.1±0.2a DY混合26.1等鞭金藻开口饵料组KD DB混合7.0±0.1b 18.4±0.2a 2.4±0.2b 20.8 YD混合24.6盐藻开口饵料组KY 10.0±0.2a 14.6±0.2b 9.7±0.2a YB混合3.1±0.1c 12.6 BD混合16.8扁藻开口饵料组KB BY混合4.1±0.2a 12.7±0.1c 4.7±0.1a 6.2±0.1c 10.9
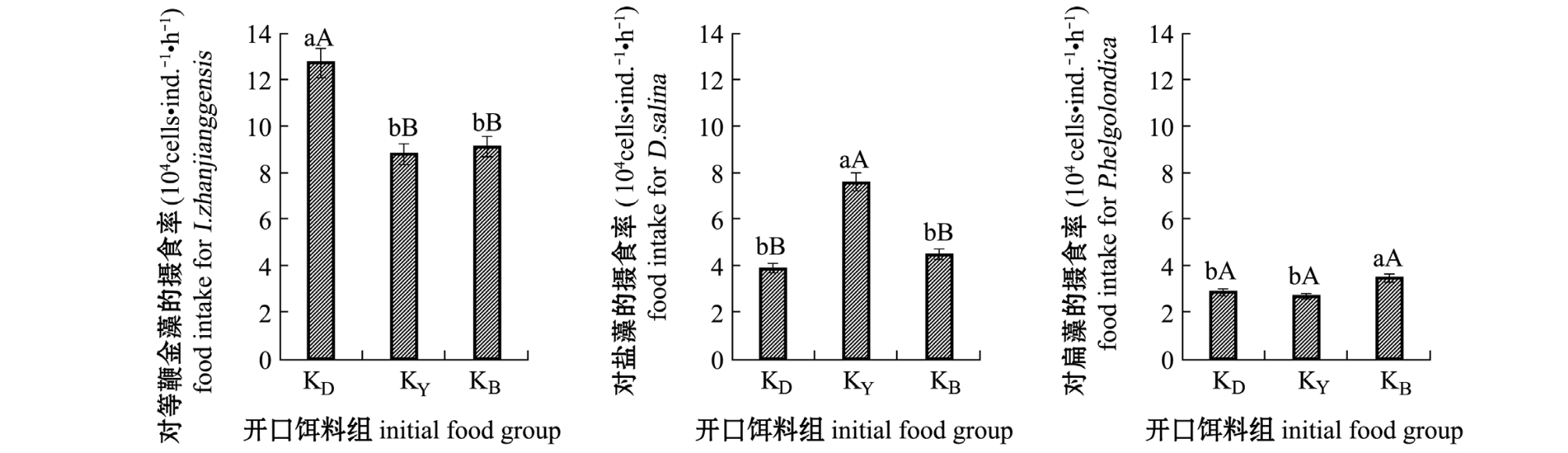
图2 艾比湖卤虫对3种密度相同混合饵料藻的摄食率
Fig.2 Food intake of brine shrimp Artemia parthenogenetica Aibi Lake at the same concentration of alga mixture species
注:标有不同大写字母者表示组间有极显著性差异 (P<0.01),标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05)
Note:The means with different capital letters are very significantly different at the 0.01 probability level,with different letters being significantly different at the 0.05 probability level,and the means with the same letters are not significant differences
图3为卤虫对3种密度相同的混合饵料藻的摄食选择性。由图3可知,在3组开口饵料驯化下,各组卤虫对等鞭金藻的食物选择性指数EI均大于0,但以KD组最大,为0.31;对盐藻的EI,在KY组中值为0.11,属于正选择性,其他2组为负值;而对扁藻的食物选择指数3组中均为负值,处于负选择性。以上结果均说明,不论开口饵料驯化与否,3种饵料等密度混合时,卤虫优先选择等鞭金藻,其次盐藻,最后是扁藻。开口饵料的驯化,可提高卤虫对盐藻的食物选择性大小,但对扁藻的食物选择性大小影响不大。
3 讨论
3.1 低等动物对食物的摄食选择性
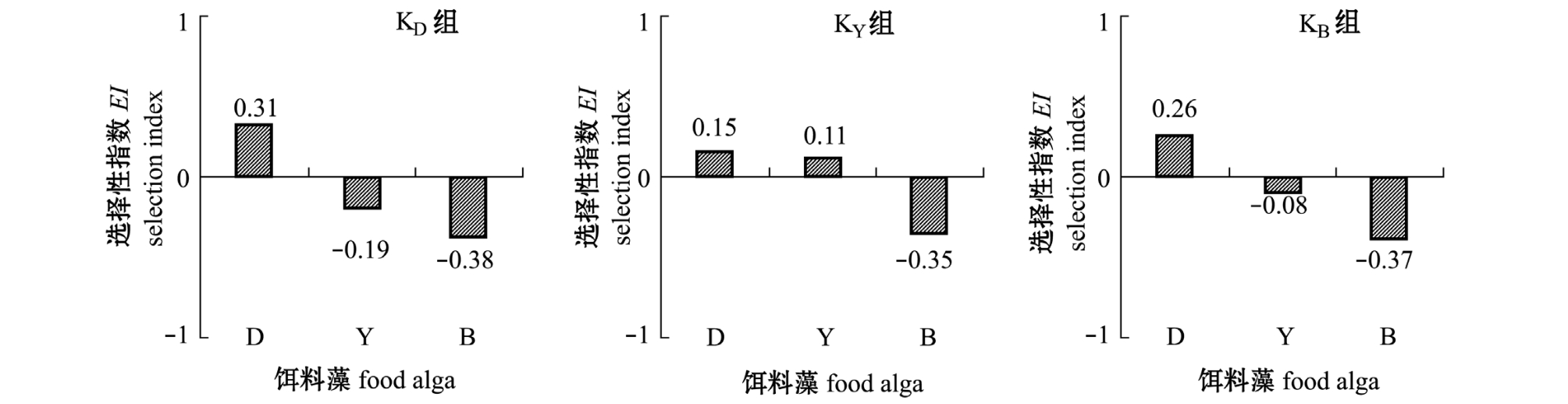
图3 艾比湖卤虫对3种藻密度相同的混合饵料藻的摄食选择性Fig.3 Feeding selectivity index of brine shrimp Artemia parthenogenetica Aibi Lake for the mixture of the three alga spe
cies at the same concentration
表3 艾比湖卤虫对2种混合藻类的摄食选择性指数
Tab.3 Feeding selectivity index for the mixture of two alga species of brine shrimp Artemia parthenogenetica Aibi Lake
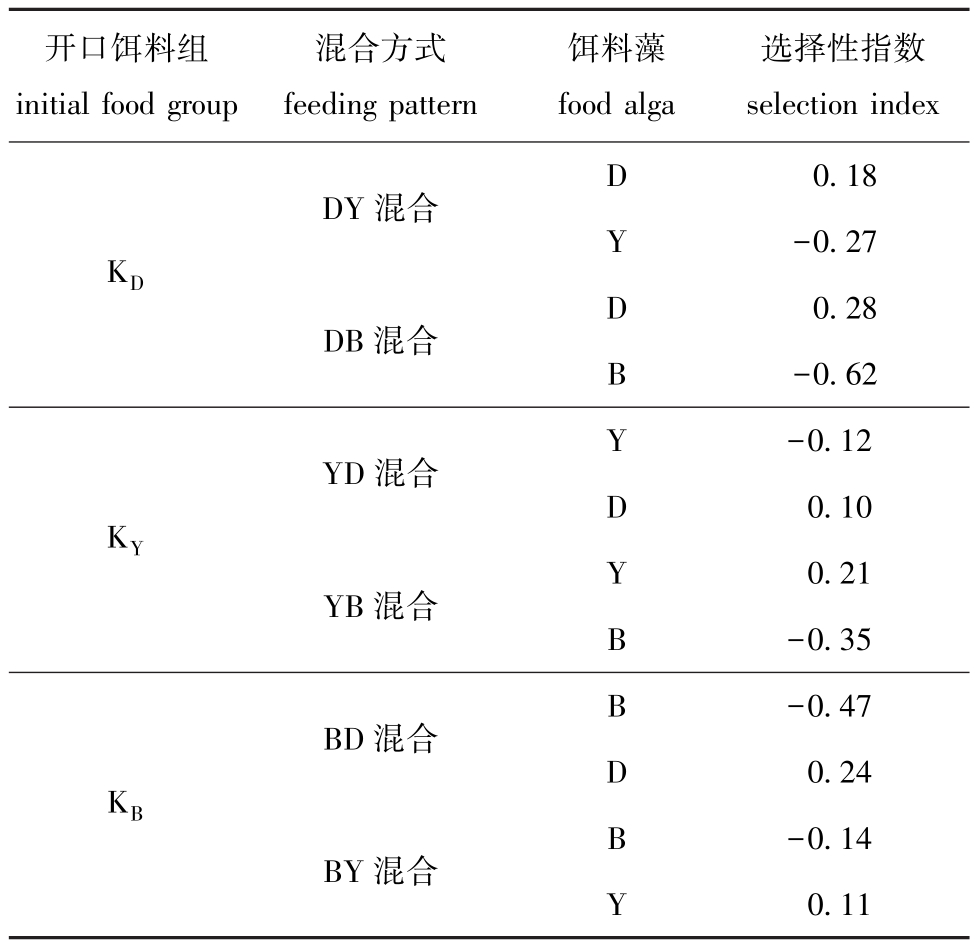
开口饵料组initial food group混合方式feeding pattern饵料藻food alga选择性指数selection index D DY混合KD 0.18 Y-0.27 D DB混合0.28 B-0.62 Y YD混合KY YB混合-0.12 D 0.10 Y 0.21 B-0.35-0.47 D 0.24 B-0.14 Y 0.11 B BD混合KB BY混合
低等动物对食物颗粒究竟有无选择性的问题,争论由来已久。 Bernard[16]、 Foster-Smith[17]和Winter[18]等认为,贝类对食物颗粒无选择性;而Kiørboe等[19]研究表明,贝类对食物颗粒有无选择性,与贝类种类有关,有许多试验也证明了Kiørboe这种观点。张朝辉等[20]研究表明,九孔鲍Haliotis diversicolor最喜食孔石莼Ulva pertusa,其次为海带Laminaria japonica,不喜食马尾藻Sargassum spp.和细枝江蓠Gracilaria tenuistipitata;高如承等[21]研究表明,西施舌稚贝Coelomactra antiquata幼体对直径11.2 μm的四爿藻Subcordiformis sp.具有较高的选择性,而对直径小的牟氏角毛藻Chaetoceros mulleri和云霄微型藻Chorella sp.摄食选择性很低,即对试验的3种藻中粒径大的摄食率高;张爱菊等[22]研究表明,池蝶蚌 Hyriopsis schlegerli幼蚌对食物颗粒具有一定的选择性。此外,棘皮动物海星的捕食选择更为明显,齐占会等[23]研究表明,多棘海盘车Asterias amurensis和海燕Asterina pectinifera均对菲律宾蛤仔Ruditapes philippinarum具有明显的捕食选择性,而海星的捕食选择主要受捕食能量效率的影响,与猎物的丰度和能量的高低以及搜寻处理猎物的能量消耗等因素有关。
对食物具有摄食选择性,在对小型的浮游动物研究中也有类似的结果。高亚辉等[24]试验表明,太平洋纺锤水蚤Acartia pacifica对不同藻类的摄食率明显不同,对异胶藻Heterogloea sp.的摄食率最大,其次是球等鞭金藻Isochrysis galbana和三角褐指藻Phaeodactylum tricornumtum,而对于粒径超过100 μm的中华盒形藻 Biddulphia sinensis、豪猪棘冠藻Corethron hystrix几乎不摄食。
桡足类双齿许水蚤Schmackeria dubin在6种混合的饵料藻中,表现出对等鞭金藻的摄食率和选食率最大,显著高于个体大的颤藻和个体小的小球藻[25]。同样,赵文等[26]对2种桡足类的摄食研究表明,长腹剑水蚤Oithona simills选食率和选择指数最高的是球等鞭金藻,小拟哲水蚤Para calanusparvus选食率和选食指数最高是盐藻。枝角类中,长刺溞Daphnia longispina对栅藻Scenedesmus sp.和小环藻Cyclotella sp.的选择性远高于隐藻Cryptomonas sp.和丝藻Ulothrix sp.[27]。
本试验的摄食选择结果显示,当控制混合粒径藻液中每种藻的密度一致时,无论单一藻还是2种或3种藻混合,艾比湖卤虫对粒径最小的等鞭金藻的摄食选择性最高,其次为盐藻,最后为扁藻。说明卤虫对不同粒径的饵料存在选择性。吴振兴等[10]的研究也表明,在卤虫的摄食试验中,卤虫对有毒的亚历山大藻的摄食率明显小于无毒的角毛藻和东海原甲藻。这与廖永岩等[28]、Baylor等[29]曾提到的卤虫是非选择性滤食浮游动物的观点不一致。
滤食性浮游动物,摄食主要是靠胸肢上的刚毛过滤食物,对于直径大于刚毛间距的藻能予以截留,对于小于刚毛间距的藻则因滤过而不能获取[27,30]。由于不同动物或不同发育期的刚毛间距不同,对适宜的藻类也相差较大。适宜中华哲水蚤Calanus sinicus摄食的饵料粒径范围为8~30 μm[9],而卤虫过滤的适宜食物颗粒大小为5~16 μm[31],因此,不难看出,试验中卤虫对等鞭金藻的摄食选择性最高,对扁藻的摄食选择性最差。另外,个体太小的藻类也不利于浮游动物摄食,本试验中作者也证实了用个体较小的微绿球藻饲育卤虫,效果并不好。
当然,动物的摄食选择会随着条件不同而变化。有研究表明,一些桡足类在较高饵料浓度时,对粒径较小的饵料藻摄食率最高,而当饵料维持在较低浓度范围时,则对较大粒径的饵料藻摄食选择性最高,即随着饵料浓度的变化,一些桡足类的摄食选择性也将发生转换[32]。
3.2 开口饵料驯化对卤虫摄食选择性的影响
本试验表明,艾比湖卤虫在开口饵料驯化下,对开口饵料藻的摄食率显著高于其他试验组。虽然对浮游动物及贝类的食物选择性研究很多,但经饵料驯化后,动物对其驯化饵料是否具有依赖性的研究并不多见。李敏等[11]研究表明,黑鲍Haliotis hannai♀×H.discus♂最喜食海带,经不同单一饵料驯化后,黑鲍对海带的喜食程度并无显著改变,与本试验摄食研究结果有差异,其原因一方面是物种不同,另一方面,可能李敏等研究中的黑鲍驯化时间偏短或驯化时间偏晚,而本试验中对艾比湖卤虫驯化的饵料是其孵化出来后,摄食的第一种饵料即开口饵料。因此,饵料驯化的时机和驯化时间,可能会影响动物对饵料的选食率。
浮游动物摄食选择机制是较为复杂的,有可能是机械的,也有可能是主动的 (如行为性的、触觉的、视觉的、化学感受的),也有可能是几种作用的综合结果[15]。有研究表明,轮虫除了借助纤毛转动形成的水流过滤和摄取食物,纤毛上的触觉刺激和化学感应等一些感受器也可以帮助轮虫主动的选择食物[33-34]。在一些研究中,浮游动物同时具有两种摄食选择机制,即被动的机械性摄食机制和主动的行为性摄食机制,在不同的饵料环境中两种机制相互转换。饵料颗粒的大小、饵料密度是主要的影响变换因素。哲水蚤在饵料粒径小于5 μm时,采取被动的摄食方式;在饵料粒径大于5 μm时,采取主动的摄食方式[35]。
艾比湖卤虫对开口饵料存在明显的习惯性摄食,开口饵料驯化可以显著提高其摄食率,对盐藻开口饵料驯化的卤虫尤为明显。艾比湖为高盐湖泊[36],浮游植物种类组成较为单一,湖中的盐藻占有绝对优势,栖息环境是否也会影响卤虫的摄食习惯,是否存在卤虫摄食的内在机制,这需要进一步研究。
参考文献:
[1] Paffenhöfer G A,VanSant K B.The feeding response of a marine planktonic copepod to quantity and quality of particles[J].Marine Ecology-Progress Series,1985,27:55-65.
[2] Houde S E L,Roman M R.Effects of food quality on the functional ingestion response of the copepod Acartiatonsa[J].Marine Ecolog y-Progress Series,1987,40:69-77.
[3] Cowles T J,Olson R J,Chisholm S W.Food selection by copepods:discrimination on the basis of food quality[J].Marine Biology,1988,100(1):41-49.
[4] Butler N M,Suttle C A,Neill W E.Discrimination by freshwater zooplankton between single algal cells differing in nutritional status[J].Oecologia,1989,78(3):368-372.
[5] 杨为东,赵文,李多慧,等.饵料浮游动物种类和密度对海月水母摄食和生长的影响[J].大连海洋大学学报,2010,25(3):228-232.
[6] Huntley M,Sykes P,Rohan S,et al.Chemically-mediated rejection of dinoflagellate prey by the copepods Calanus pacificus and Paracalanus parvus:mechanism,occurrence and significance[J].Marine Ecology-Progress Series,1986,28:105-120.
[7] Gill C W,Poulet S A.Responses of copepods to dissolved free amino acids[J].Marine Ecology-Progress Series,1988,43:269-276.[8] Ward J E,Cassell H K,MacDonald B A.Chemoreception in the sea scallop Placopecten magellanicus(Gmelin).I.Stimulatory effects of phytoplankton metabolites on clearance and ingestion rates[J].Journal of Experimental Marine Biology and Ecology,1992,163(2):235-250.
[9] 李超伦,孙松,王荣.中华哲水蚤对自然饵料的摄食选择性实验研究[J].海洋与湖沼,2007,38(6):529-535.
[10] 吴振兴,邹迎麟,朱明远,等.有毒亚历山大藻对卤虫存活率和摄食率的影响[J].生态学报,2006,26(12):3943-3947.
[11] 李敏,朱长波,张汉华,等.驯化摄食对黑鲍饵料选择性的影响研究[J].南方水产,2007,3(4):14-19.
[12] 彭瑞冰,蒋霞敏,鲁凯,等.不同饵料对卤虫生长、总脂含量及脂肪酸组成的影响[J].生物学杂志,2013,30(5):68-72.
[13] 赵文.水生生物学[M].北京:中国农业出版社,2005.
[14] Frost B W.Effects of size and concentration of food particles on the feeding behavior of the marine planktonic copepod Calanus pacificus[J].Limnology and Oceanography,1972,17(6):805-815.
[15] Poulet S A.Grazing of Pseudocalanus minutus on naturally occurring particulate matter[J].Limnology and Oceanography,1973,18(4):564-573.
[16] Bernard F R.Nutrition of Crassostrea gigas(Thunberg,1795):an aspect of estuarine energetics[D].London:University of London,1972:448.
[17] Foster-Smith R L.The effect of concentration of suspension and inert material on the assimilation of algae by three bivalves[J].Journal of the Marine Biological Association of the United Kingdom,1975,55(2):411-418.
[18] Winter J E.A review on the knowledge of suspension-feeding in lamellibranchiate bivalves,with special reference to artificial aquaculture systems[J].Aquaculture,1978,13(1):1-33.
[19] Kiørboe T,Møhlenberg F.Particle selection in suspension-feeding bivalves[J].Marine Ecology-Progress Series,1981,5(3):291-296.
[20] 张朝晖,朱明远,毛兴华.九孔鲍(Haliotis diversicolor)对饵料选择性的研究[J].海洋科学,1990,14(3):10-12.
[21] 高如承,庄惠如,汪彦愔,等.西施舌稚贝对3种微藻选择性及摄食率研究[J].福建师范大学学报:自然科学版,2007,23(1):70-73.
[22] 张爱菊,朱俊杰,刘金殿.3种微藻对池蝶蚌幼蚌的选择滤食与生长的影响[J].浙江海洋学院学报:自然科学版,2012,31(1):65-69.
[23] 齐占会,王珺,毛玉泽,等.两种海星对三种双壳贝类的捕食选择性和摄食率[J].生态学报,2013,33(16):4878-4884.
[24] 高亚辉,林波.几种因素对太平洋纺锤水蚤摄食率的影响[J].厦门大学学报:自然科学版,1999,38(5):751-757.
[25] 罗晓霞,黄翔鹄,洪腾.食物类型和浓度对双齿许水蚤摄食的影响[J].广东海洋大学学报,2008,28(3):39-44.
[26] 赵文,宋青春,高放.大连近海两种桡足类摄食生态的初步研究[J].大连水产学院学报,2002,17(1):8-14.
[27] 张钰,谷孝鸿,何俊.太湖长刺溞对浮游植物摄食的生态学研究[J].湖泊科学,2008,20(1):100-104.
[28] 廖永岩,夏营顺,何碧华.不同投饵密度对卤虫高密度养殖的影响[J].安徽农业科学,2011,39(26):16149-16153,16179.
[29] Baylor E R,Sutcliffe W H Jr.Dissolved organic matter in seawater as a source of particulate food[J].Limnology and Oceanography,1963,8(4):369-371.
[30] 赵文,王巧晗,张琳,等.温度、盐度和食物条件对西藏拟溞摄食强度的影响[J].生态学报,2010,30(11):3065-3072.
[31] 成永旭.生物饵料培养学[M].2版.北京:中国农业出版社,2005:174-182.
[32] Mullin M M,Sloan P R,Eppley R W.Relationship between carbon content,cell volume,and area in phytoplankton[J].Limnology and Oceanography,1966,11(2):307-311.
[33] 房宽,唐学玺,张璟,等.饵料微藻的种类和密度差异对褶皱臂尾轮虫幼虫摄食和选食行为的影响[J].海洋环境科学,2013,32(4):497-501.
[34] 冯蕾,王进河,唐学玺.壶状臂尾轮虫摄食生态的实验研究[J].海洋环境科学,2009,28(4):349-354.
[35] 林霞,朱艺峰,赵崖.几种环境因子对墨氏胸刺水蚤摄食的影响[J].海洋湖沼通报,2002(4):38-45.
[36] 任慕莲,杨文荣,姜作发,等.新疆艾比湖卤虫[M].乌鲁木齐:新疆科技卫生出版社,1992.