菲律宾蛤仔Ruditapes philippinarum是中国四大养殖贝类之一,其单种产量在中国养殖贝类中最高,年产量约320万t,占世界总产量的90%以上[1]。近年来,由于国内外市场对菲律宾蛤仔需求量日益增加,渔民扩大了捕捞强度,养殖中环境污染等因素,导致菲律宾蛤仔养殖性状退化,其生长速度变缓,病害频发,死亡率增大,严重制约了中国菲律宾蛤仔养殖业的可持续发展。研究表明,对菲律宾蛤仔进行遗传改良是解决以上问题的主要途径[2]。
基因型与环境互作是指环境的差异对不同基因型作用效果不同,即表型值的差异随着基因型和环境的变化而变化[3]。生长性状是菲律宾蛤仔重要的育种指标,性状表现是基因型和环境因素共同作用的结果,不同基因型的品种在不同环境影响下性状表现会有所不同。进行基因型与环境互作效应分析,对于菲律宾蛤仔育种区域的划分,以及育种目标和育种方案的制定具有重要意义[4]。目前,关于贝类基因型与环境互作的研究报道较多,主要集中在合浦珠母贝Pinctada fucata[5]、弗吉尼亚牡蛎Crassostrea virginica[6-7]、 紫贻贝 Mytilus edulis[8-9]、波罗地海蛤 Macama baithiea[10]、侏儒蛤 Mulinia lateralis[11]等贝类中。为探讨菲律宾蛤仔选育家系对不同环境的适应性,本研究中开展了基因型与环境互作效应的研究,以期为培育适应不同环境的优良菲律宾蛤仔品种提供理论依据。
1 材料与方法
1.1 材料
以大连石河菲律宾蛤仔 (以下简称蛤仔)野生群体为亲贝,采用2×2双列杂交方法分别构建自交家系AA(♀A×♂A)、BB(♀B×♂B),杂交家系 AB(♀A×♂B)、 BA(♀B×♂A), 共AA、 AB、BB、BA 4个基因型。各家系幼虫按照蛤仔 “三段法”[12]培育2个月,获得4个家系壳长2~3 mm稚贝作为蛤仔基因型与环境互作试验的材料。选取贝壳无损伤、壳形规整、活力强的4个基因型稚贝各500枚作为温度、盐度和养殖环境试验的材料。
1.2 方法
1.2.1 蛤仔基因型与温度互作试验 试验水温设置为20、24、28℃,每个温度设置3个重复。各试验组均在盐度为30~32的500 L玻璃钢水循环控温水槽养殖系统内进行。采用4个基因型×3个温度的双因素设计。
试验开始前,随机测量每个家系30枚个体壳长作为家系的起始数据。每天全量换水,24 h充气,按1∶1比例投喂叉鞭金藻Dicrateria sp.和小球藻Chlorella sp.。试验开始后,每隔15 d,使用电子游标卡尺 (精确到0.01 mm)测量30枚蛤仔稚贝的壳长,试验周期为45 d。
1.2.2 蛤仔基因型与盐度互作试验 试验盐度设置为20、25、30,每个盐度设置3个重复。各试验组在温度为22~26℃的30 L水桶内进行。采用3个盐度×4个基因型的双因素的设计。饲养及测量方法同 “1.2.1”节,试验周期为30 d,试验结束时取样测量各家系稚贝的壳长。
1.2.3 蛤仔基因型与养殖环境互作试验 3个不同养殖环境组试验分别为:温度为24~28.5℃、盐度为29~30的室外土池,温度为22~26℃、盐度为30~32的500 L玻璃钢水槽,温度为22~26℃、盐度为30~32的30 L水桶,每个环境下设置3个重复。试验采用4个基因型×3个养殖环境的双因素设计。饲养及测量方法同 “1.2.1”节。试验周期为30 d,试验结束时取样测量各家系稚贝的壳长。
1.2.4 生长指标的计算 壳长增长率计算公式为
其中:L1为试验结束时平均壳长 (μm);L0为试验开始时平均壳长 (μm);t为试验时间 (d)。
1.3 数据处理
采用SPSS 19.0软件进行环境因素和基因型对壳长增长率的双因素方差分析,如果环境因素与基因型间的相互作用显著 (P<0.05),则用Eberhart和Russell方法[3]分析基因型稳定性和估算稳定性参数。
2 结果与分析
2.1 壳长生长性状基因型与温度互作
2.1.1 不同温度条件下各家系壳长增长率比较
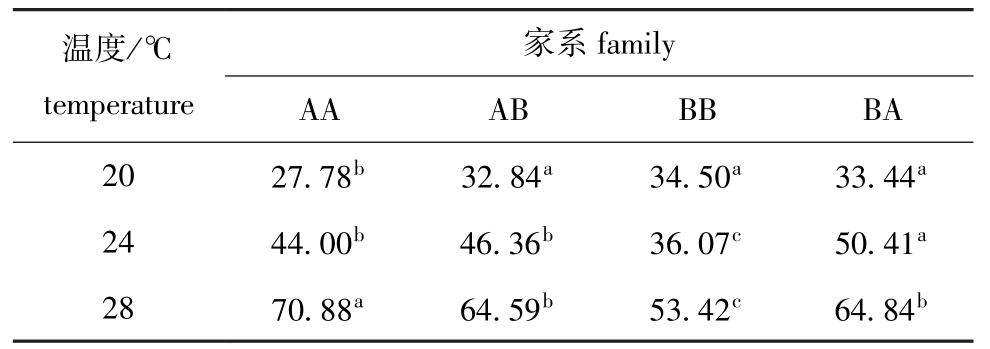
从表1可见:随着温度的升高各基因型的生长率逐渐增加,在20℃时,AA家系生长最慢,与其他家系有显著性差异 (P<0.05),其他3个家系间无显著性差异 (P>0.05);在24℃下,基因型家系BB生长缓慢,与其他家系有显著性差异 (P<0.05),BA家系生长最快,与其他家系有显著性差异 (P<0.05);在28℃下,AA家系生长最快,与其他家系有显著性差异 (P<0.05),BB家系生长最慢,与其他家系有显著性差异 (P<0.05)。
表1 3个温度条件下各基因型家系的壳长增长率
Tab.1 Growth rate of shell length of Manila clam in different genotype families at three temperature μm/d
注:同行中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同
Note:The means with different letters within the same line are significant differences at the 0.05 probability level,and the means with the same letters within the same line are not significant differences,et sequentia
温度/℃temperature家系family AA AB BB BA 20 27.78b 32.84a 34.50a 33.44a 24 44.00b 46.36b 36.07c 50.41a 28 70.88a 64.59b 53.42c 64.84b
2.1.2 方差分析 通过双因素方差分析 (表2)发现,温度和基因型两因素均对壳长增长有显著性影响 (P<0.05),但两因素之间的交互作用对壳长生长无显著性影响 (P>0.05),因此,不能用Eberhart和Russell方法进行家系基因型稳定性分析和稳定性参数估算。
2.2 壳长生长性状基因型与盐度互作
2.2.1 不同盐度条件下各家系壳长增长率比较
从表3可见:基因型家系AA在3个盐度下生长率最高,与其他3个基因型家系壳长生长有显著性差异 (P<0.05);BB家系除在25盐度下与BA家系生长无显著性差异 (P>0.05)外,在盐度20和30下生长率均最慢,与其他家系有显著性差异(P<0.05);AB和BA家系壳长生长趋于两者之间。2.2.2 方差分析 通过双因素方差分析 (表4)发现,盐度和基因型两因素都对壳长生长存在极显著性影响 (P<0.01),但两因素之间的交互作用对壳长生长无显著性影响 (P>0.05),因此,不能用Eberhart和Russell方法进行家系基因型稳定性分析和稳定性参数估算。
表2 温度和基因型及其交互作用对壳长增长率的影响
Tab.2 Effects of temperature, genotype and their interaction on growth of shell length in Manila clam

注:∗表示有显著性影响 (P<0.05),∗∗表示有极显著影响 (P<0.01),下同
Note:∗means significant effect(P<0.05), ∗∗ means very significant effect(P<0.01), et sequentia
来源source 平方和sum of square 自由度free degree 均方mean square F值F value P温度 temperature(T) 121.078 2 60.539 67.558∗∗ 0.001基因型 genotype(G) 7.144 3 2.381 2.657∗ 0.038温度×基因型T×G 10.777 6 1.796 2.004 0.059误差error 311.845 12 25.987
2.3 壳长生长性状基因型与养殖环境互作
2.3.1 不同养殖环境下各家系壳长增长率比较
从表5可见:除基因型家系AA外,其他各家系均随着养殖环境从小水体向大水体的转变,壳长生长逐渐加快;在30 L水桶中,AA家系壳长生长最快,与其他家系有显著性差异 (P<0.05);在循环水槽中,AB家系生长最快,与BA家系无显著性差异 (P>0.05),二者与其他家系均有显著性差异(P<0.05);在室外土池中,AB家系生长最快,与AA家系无显著性差异 (P>0.05),二者与其他家系均有显著性差异 (P<0.05)。
表3 3个盐度条件下各基因型家系的壳长增长率
Tab.3 Growth rate of shell length of the genotype families at three salinities μm/d
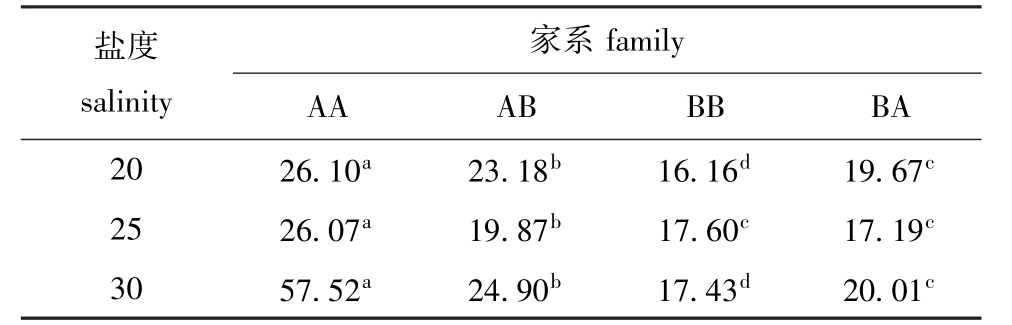
盐度salinity家系family AA AB BB BA 20 26.10a 23.18b 16.16d 19.67c 25 26.07a 19.87b 17.60c 17.19c 30 57.52a 24.90b 17.43d 20.01c
表4 盐度和基因型及其交互作用对壳长增长率的影响
Tab.4 Effects of temperature, genotype and their interaction on growth of shell length

来源source 平方和sum of square 自由度free degree 均方mean square F值F value P盐度 salinity(S) 9.954 2 4.977 4.974∗∗ 0.009基因型 genotype(G) 17.906 3 5.969 5.965∗∗ 0.007盐度×基因型 S×G 10.357 6 1.726 1.725 0.068误差error 348.192 12 29.016
2.3.2 方差分析 通过双因素方差分析 (表6)发现,养殖环境和基因型两因素均对壳长生长有极显著性影响 (P<0.01),且两因素间的交互作用对壳长生长有显著性影响 (P<0.05),因此,符合用Eberhart和Russell方法进行家系基因型稳定性分析和稳定性参数估算。
表5 3个养殖环境条件下各基因型家系的壳长增长率Tab.5 Growth rate of shell length of the genotype families
under three culture patterns μm/d
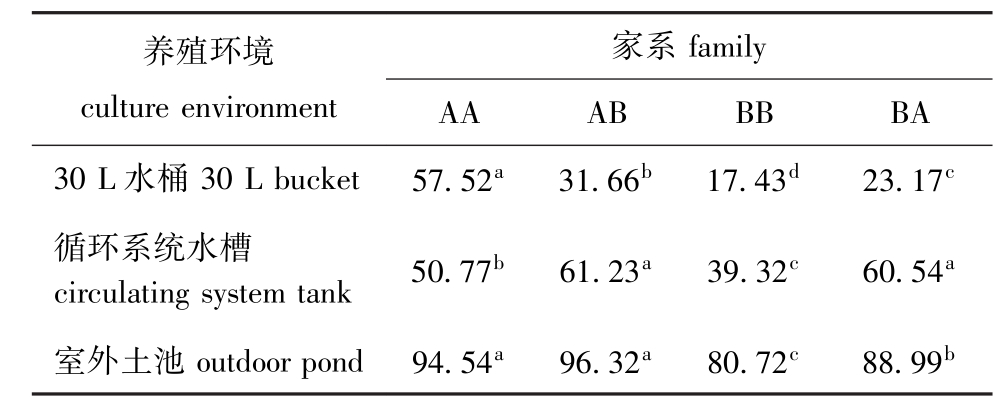
养殖环境culture environment家系family AA AB BB BA 30 L水桶30 L bucket 57.52a 31.66b 17.43d 23.17c循环系统水槽circulating system tank 50.77b 61.23a 39.32c 60.54a室外土池outdoor pond 94.54a 96.32a 80.72c 88.99b
表6 环境和基因型及其交互作用对壳长增长率的影响
Tab.6 Effects of environment, genotype and their interaction on shell growth

来源source 平方和sum of square 自由度free degree 均方mean square F值F value P环境 environment(E) 184.763 2 92.381 84.262∗∗ 0.001基因型 genotype(G) 21.494 3 7.165 6.535∗∗ 0.005环境×基因型 E×G 16.439 6 2.740 2.499∗ 0.042误差error 348.192 12 29.016
2.3.3 基因型与环境互作分析 基因型稳定性参数结果见表7,采用线性回归方法能解释基因型与环境互作。经回归离差检验表明,各基因型非模式均方与0的差异不显著 (P>0.05),由此可知,可通过环境指数的线性函数来部分预测各基因型的表现。按照回归系数的大小可确定各基因型对环境变化反应的灵敏程度为BB>AB>BA>AA。
基因型与环境互作方差分析结果见表8。F检验结果表明,基因型、养殖环境、基因型与环境的交互作用对壳长增长率均有极显著性影响 (P<0.01)。
表7 基因型稳定性参数
Tab.7 Stability parameters of the genotypes
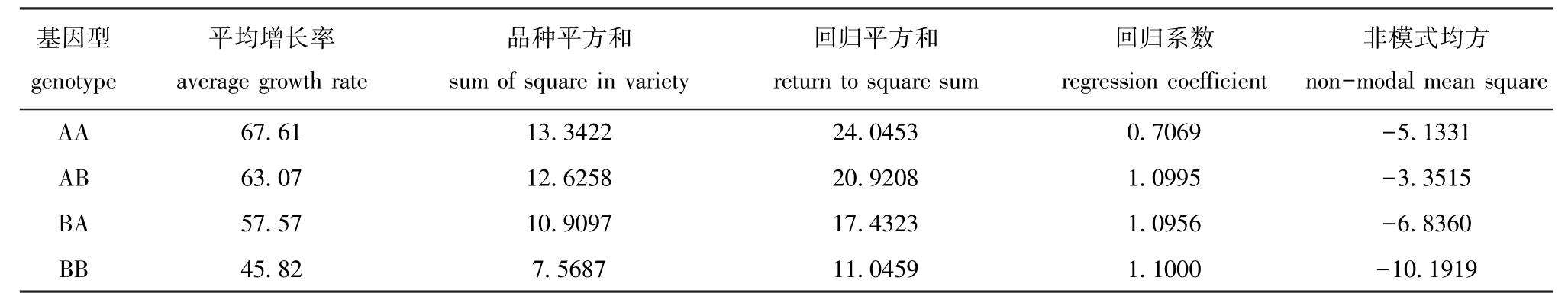
基因型genotype非模式均方non-modal mean square AA 67.61 13.3422 24.0453 0.7069 -5.1331 AB 63.07 12.6258 20.9208 1.0995 -3.3515 BA 57.57 10.9097 17.4323 1.0956 -6.8360 BB 45.82 7.5687 11.0459 1.1000 -10.1919平均增长率average growth rate品种平方和sum of square in variety回归平方和return to square sum回归系数regression coefficient
表8 基因型与环境互作方差分析
Tab.8 Variance analysis of interaction between the genotype and environment
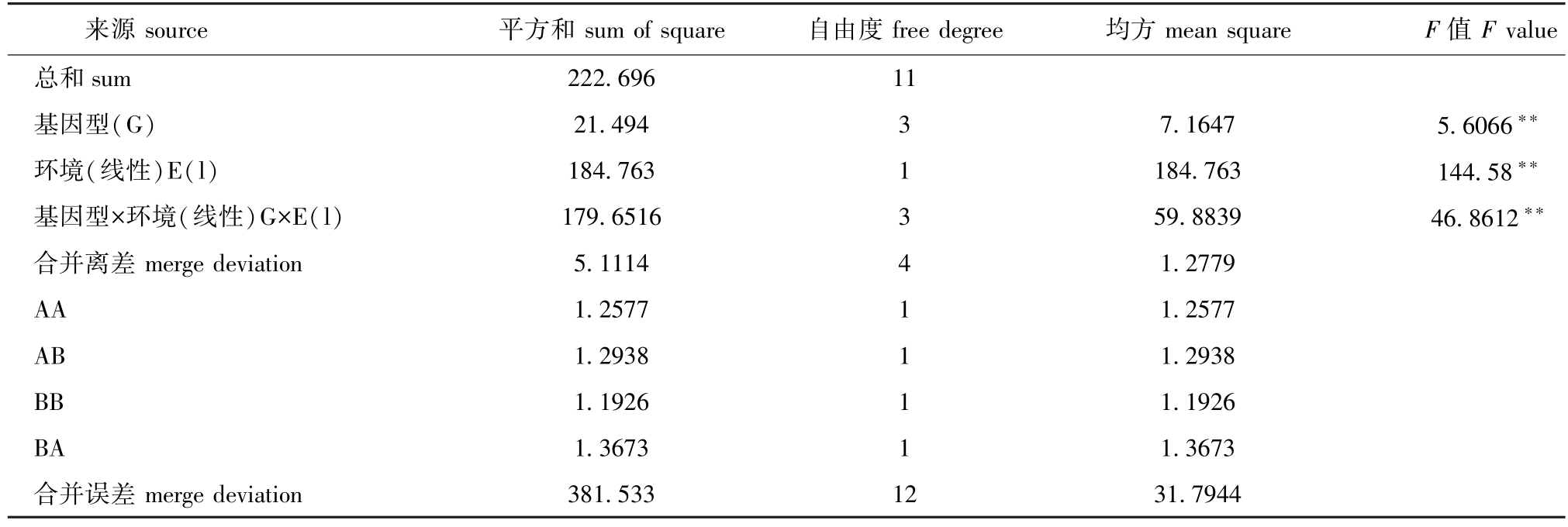
来源source 平方和sum of square 自由度free degree 均方mean square F值F value总和sum 222.696 11基因型(G) 21.494 3 7.1647 5.6066∗∗环境(线性)E(l) 184.763 1 184.763 144.58∗∗基因型×环境(线性)G×E(l) 179.6516 3 59.8839 46.8612∗∗合并离差merge deviation 5.1114 4 1.2779 AA 1.2577 1 1.2577 AB 1.2938 1 1.2938 BB 1.1926 1 1.1926 BA 1.3673 1 1.3673合并误差merge deviation 381.533 12 31.7944
3 讨论
3.1 基因型与温度互作对蛤仔稚贝壳长生长性状的影响
目前,基因型与环境的交互作用对动植物的影响尚存争议。一些学者认为,基因型与环境交互作用对遗传育种会产生较大的影响,这种交互作用的存在可能会使育种计划停留在理论上,而无法真正带来利益[13]。Dominik等[13]对一种产毛羊育种评估时指出,忽略基因型与环境的交互作用不仅会降低实际收益,同时也会对选择指数估算造成较大偏差。另一些学者认为,基因型与环境交互作用对表型差异贡献比率不大,基因型与环境互作对选育计划并不会造成巨大的影响,更不应因为这种交互作用就放弃选育工作的开展,尽管存在基因型与环境互作效应,但通过选育依然可为人类带来实际收益[14]。
本试验中,由于不同家系控制生长性状的相关基因型频率可能存在差异,因此,把不同家系养殖在不同温度条件下,估算了温度与基因型对壳长生长性状的影响程度。在壳长差异平方和中,温度效应所占比例最大,温度和基因型因素交互作用所占比重较小,此结论与Brake等[15]对太平洋牡蛎的研究结果类似。Brake等[15]指出,环境与基因型的交互作用对体质量性状影响仅占2%,对成活率影响仅占7%,对产量影响仅占5%。Swan等[16]对澳大利亚太平洋牡蛎C.gigas的研究发现,基因型与环境的互作效应也不显著;Beaumont等[17]将地中海贻贝M.gazlloporvincialis和紫贻贝M.edulis种间杂交的幼虫及对照组幼虫培养在3个不同的盐度下,发现对照组幼虫的生长明显大于其他3组,随着温度升高,杂交组幼虫的生长均会加快,但基因型与环境互作效应并不显著。
本研究中,由于试验的基因型及温度数据较少,对壳长生长性状统计分析时,发现交互作用未有统计学上的显著差异,但这并不能据此否定交互作用的存在,应在以后的试验中增加温度组数和构建更多的基因型家系。
3.2 基因型与盐度互作对蛤仔稚贝壳长生长性状的影响
对于海水养殖动物而言,海水盐度是一个非常重要的环境因素,盐度不仅可以影响到蛤仔的生长发育,而且也影响其成活率及疾病的爆发[18]。同样,生物品系的基因型在较大程度上对其幼体、成体阶段的生长与存活起决定性作用[19]。本研究中,基因型效应对蛤仔生长影响最大,但是基因型与环境互作对蛤仔生长影响不显著。Kvingedal等[20]将大珠母贝P.maxima饲养在3个不同的盐度下,发现盐度对基因型的影响不显著,而Newkirk等[21]研究了两个美洲牡蛎C.virginica杂交幼虫与对照组幼虫在低盐条件下的生长与存活情况,发现杂交幼虫的存活率低于对照组幼虫,表现出明显的非加性效应,即基因型与环境的交互作用对牡蛎的生长与存活有显著影响。Newkirk[22]对4个不同群体美洲牡蛎进行杂交,在4个不同的盐度下培养杂交组和对照组幼虫,也发现幼虫的生长基因型与环境互作对牡蛎幼虫的生长有显著影响。本研究结果与上述结论相反,这可能是由于试验所设的盐度梯度未超过蛤仔的耐受范围,导致表型变异平方和中由环境变化引起的变异组分降到了最低,提高了交互作用的P值;其次,由于试验环境与外界自然真实环境存在差异,而且在试验过程中蛤仔均有一定程度的死亡,导致取样数据出现偏差,在统计方法运算时,有可能把这种偏差记入在交互作用中;最后,可能由于测量误差,导致在统计计算时减少了基因型引起的表型变异方差。
3.3 基因型与养殖环境互作对蛤仔稚贝壳长生长性状的影响
基因型与环境互作效应分析是品种稳定性分析的重要内容之一,其研究方法分为线性和非线性两种[17],对环境指数的估计是线性回归的核心。基因型与环境的交互作用,对海洋贝类的影响普遍存在,传统的基因型与环境互作的分析方法主要是根据品种回归于各地点的环境因子得到线性相关结果。该方法简洁明了、计算方便,但线性模型要求品种的性状指标与环境因子间存在线性关系,否则容易增大误差。在海洋动物养殖中,由于环境因子复杂,很难保证这种线性关系的真实存在,所以其结果的可靠度受到较大影响。
基于品种表型值对环境指数回归的Eberhart和Russell方法是研究基因型与环境互作的方法之一。本试验结果表明,用Eberhart和Russell方法对基因型与环境的互作效应进行分析,能解释大部分基因型与环境互作的方差分析,本试验中各基因型的壳长增长率和环境指数间存在线性关系,因此,可以用环境指数的线性函数来预测壳长增长率。邓岳文等[4]采用线性回归方法对皱纹盘鲍Haliotis discus hanai基因型与环境互作进行分析,结果表明,各基因型的壳长增长率和环境指数之间存在线性关系,可以用环境指数的线性函数来预测壳长增长率。Kvingedal等[23]把3个不同地理群体的大珠母贝家系放在两个地理位置养殖,发现大珠母贝家系之间,以及在两个地理位置培养出的大珠母贝之间的壳长生长存在显著差异,表明基因型与环境互作效应显著;Newkirk[22]对4个不同群体的美洲牡蛎群体间自繁及其群体间杂交的后代,在4个不同盐度环境下的养殖研究发现,基因型与环境互作效应显著;Mallet等[6]研究指出,5个不同群体的美洲牡蛎在两个室外试验场养殖过程中存在显著的基因型与环境交互作用。本试验中虽然所选用的基因型只有4个,而且只设定了3个环境因子,每个环境因子梯度变化较小,但研究结果表明,所选不同基因型家系能够产生生长性状遗传变异。因此,如果在特定环境选用特定基因型,可以在遗传育种中获得优良生长性状的遗传进展,合理利用基因型与环境互作理论,可有效地指导蛤仔育种区域的划分及育种目标与育种方案的制定。
参考文献:
[1] 闫喜武.菲律宾蛤仔养殖生物学、养殖技术与品种选育[D].青岛:中国科学院研究生院(海洋研究所),2005.
[2] 孙谦,段强,桑士田,等.菲律宾蛤仔选育家系间杂交的Kung育种值及配合力分析[J].大连海洋大学学报,2017,32(4):381-386.
[3] 郭平仲.数量遗传分析[M].北京:北京师范学院出版社,1987.
[4] 邓岳文,刘晓,张国范.皱纹盘鲍基因型与环境互作的初步研究[J].海洋科学,2005,29(12):31-34.
[5] 吴曼,刘宝锁,黄桂菊,等.合浦珠母贝不同生长阶段的基因型与环境互作效应[J].中国水产科学,2015,22(5):916-924.
[6] Mallet A L,Haley L E.Growth rate and survival in pure population matings and crosses of the oyster Crassostrea virginica[J].Canadian Journal of Fisheries and Aquatic Sciences,1983,40(7):948-954.
[7] Rodhouse P G,Gaffney P M.Effect of heterozygosity on metabolism during starvation in the American oyster Crassostrea virginica[J].Marine Biology,1984,80(2):179-187.
[8] Newkirk G F.Genetics of shell color in Mytilus edulis L.and the association of growth rate with shell color[J].Journal of Experimental Marine Biology and Ecology,1980,47(1):89-94.
[9] Diehl W J,Koehn R K.Multiple-locus heterozygosity,mortality,and growth in a cohort of Mytilus edulis[J].Marine Biology,1985,88(3):265-271.
[10] Green R H,Singh S M,Hicks B,et al.An Arctic intertidal population of Macoma balthica(Mollusca,Pelecypoda):genotypic and phenotypic components of population structure[J].Canadian Journal of Fisheries and Aquatic Sciences,1983,40(9):1360-1371.
[11] Scott T M,Koehn R K.The effect of environmental stress on the relationship of heterozygosity to growth rate in the coot clam Mu-linia lateralis(Say)[J].Journal of Experimental Marine Biology and Ecology,1990,135(2):109-116.
[12] Zhang Guofan,Yan Xiwu.A new three-phase culture method for Manila clam,Ruditapes philippinarum,farming in northern China[J].Aquaculture,2006,258(1-4):452-461.
[13] Dominik S,Kinghorn B P.Neglecting genotype×environment interaction results in biased predictions from selection index calculations[J].Livestock Science,2008,114(2-3):233-240.
[14] Iwamoto R N,Myers J M,Hershberger W K.Heritability and genetic correlations for flesh coloration in pen-reared coho salmon[J].Aquaculture,1990,86(2-3):181-190.
[15] Brake J,Evans E,Langdon C.Evidence for genetic control of pigmentation of shell and mantle edge in selected families of Pacific oyster,Crassostrea gigas[J].Aquaculture,2004,229:89-98.
[16] Swan A A,Thompson P A,Ward R D.Genotype×environment interactions for weight in Pacific oysters(Crassostrea gigas)on five Australian farms[J].Aquaculture,2007,265(1-4):91-101.
[17] Beaumont A R,Turner G,Wood A R,et al.Hybridisations between Mytilus edulis and Mytilus galloprovincialis and performance of pure species and hybrid veliger larvae at different temperatures[J].Journal of Experimental Marine Biology and Ecology,2004,302(2):177-188.
[18] 郑怀平,张国范,刘晓,等.海湾扇贝杂交家系与自交家系生长和存活的比较[J].水产学报,2004,28(3):267-272.
[19] 黄英姿,毛盛贤.基因型与环境互作研究的新进展[J].作物学报,1992,18(2):116-125.
[20] Kvingedal R,Evans B S,Taylor J J U,et al.Family by environment interactions in shell size of 43-day old silver-lip pearl oyster(Pinctada maxima),five families reared under different nursery conditions[J].Aquaculture,2008,279(1-4):23-28.
[21] Newkirk G F,Waugh D L,Haley L E.Genetics of larval tolerance to reduced salinities in two populations of oysters,Crassostrea virginica[J].Journal of the Fisheries Research Board of Canada,1977,34(3):384-387.
[22] Newkirk G Y.Interaction of genotype and salinity in larvae of the oyster Crassostrea virginica[J].Marine Biology,1978,48(3):227-234.
[23] Kvingedal R,Evans B S,Lind C E,et al.Population and family growth response to different rearing location,heritability estimates and genotype×environment interaction in the silver-lip pearl oyster(Pinctada maxima)[J].Aquaculture,2010,304(1-4):1-6.