内分泌干扰物在环境中分布广泛,可以影响激素调节的生理进程以及野生动物和人类的内分泌系统及其生殖系统的功能[1]。内分泌干扰物通过模拟或阻断内源性激素的活动,改变内源性激素的新陈代谢或与内源性激素竞争结合相应的激素受体而发挥毒害作用[2]。17α-炔雌醇 (17α-ethinylestradiol,EE2)是口服避孕药的主要活性成分[3],已经作为一种具有雌激素效应的典型内分泌干扰物而被广泛研究。已有研究显示,雌激素是通过其特异性的雌激素受体介导而发挥作用[4-7]。雌激素受体作为核受体超家族一员,其结构包括A~F 6个功能域[8]。N端的A/B结构域包含非配体依赖性激活结构域 (AF-1),参与调控雌激素和雌激素受体的结合。C区是一个DNA结合结构域 (DNA binding domain,DBD),主要负责DNA的结合,其序列在不同物种间高度保守。紧接着DBD的D区是一个铰链功能域,核定位信号 (nuclear localization signals,NLS)通常位于此区域。C端的E/F区域包括 E区配体结合域 (ligand binding domain,LBD)和F区[9]。LBD结构域含有第二个转录激活功能域 (AF-2),它的转录激活是配体依赖性的。F结构域的具体功能还未阐明。
雌激素受体 (estrogen receptor,ER)首先在大鼠Ratttus norvegicus子宫中被发现[10],随后从无脊椎动物如牡蛎Crassostrea gigas[11]到哺乳动物如人类Homo sapiens[12-13]的多种物种中被鉴定得到。哺乳动物存在2个雌激素受体基因ERα和ERβ,如小鼠Mus musculus[14]。硬骨鱼中存在至少3个不同雌激素受体亚型基因,如在大西洋石首鱼Micropogonias undulatus[15]、日本青鳉 Oryzias latipes[16]、斑马鱼 Danio rerio[17]、大口鲈 Micropterus salmoides[18]、尼罗罗非鱼Oreochromis niloticus[19]和大黄鱼 Larimichthys crocea[20]中存在 ERα1/β1/β2 3 个雌激素受体,而在金鱼 Carassius auratus[21]和虹鳟Oncorhynchus mykiss[22]中存在 ERα1/α2/β1/β2 4 个雌激素受体基因。研究显示,ERα和ERβ基因在多种组织中均有表达,在肝脏和性腺中高表达[21,23],但它们在不同鱼类中的表达模式不相同。这表明,不同鱼类中含有多个雌激素受体亚型基因,但其精确功能尚未阐明。已有报道显示,环境雌激素可不同程度地影响雌激素受体各亚型基因的表达。例如,EE2暴露显著诱导日本青鳉Oryzias latipes肝脏ERα基因表达,且呈剂量依赖效应[24];环境剂量EE2显著诱导雄性虾虎鱼Pomatoschistus minutus肝脏 ERα/β 基因表达[25]。 17β-雌二醇(17β-estradiol,E2)显著诱导虹鳟肝脏ERα基因的表达[26];石油废水和E2暴露,可以对大西洋鳕Gadus morhua胚胎和仔鱼产生高死亡率,但是对变态后幼鱼却未见明显影响[27]。这些都说明,不同鱼类以及同一种鱼类的不同生命周期对环境雌激素的敏感度不同,不同雌激素受体基因对环境雌激素的响应也不尽相同。卵黄蛋白原 (vitellogenin,vtg)基因通常被用作内分泌干扰的分子标志物。在卵生脊椎动物中,卵黄蛋白原在肝脏中产生,然后通过血液循环运输到卵巢[28]。已有研究显示,vtg基因的表达受到环境雌激素的显著影响。例如,EE2暴露下日本青鳉显著诱导肝脏vtg1基因表达[24],同样可以显著诱导虹鳟肝脏vtg1基因表达[26]。
海水青鳉Oryzias melastigma是一种潜在的海洋模式鱼类,正逐渐被广泛应用于生态毒理学研究[29-30]。海水青鳉与日本青鳉基因背景相近,很多研究资料可以参考淡水青鳉加以利用[31]。本研究中利用海水青鳉作为一种生态毒理学模型,克隆获得海水青鳉雌激素受体3个亚型基因OM-ERα/β1/β2的cDNA序列,并预测分析了其结构特性和进化特征,采用实时荧光定量PCR方法分析其在多个组织中及多个发育时间点的表达,并观察不同剂量的环境雌激素EE2水体暴露对海水青鳉仔鱼雌激素受体基因的表达调控,旨在为进一步开展与海水青鳉内分泌干扰相关的研究提供基础资料。
1 材料与方法
1.1 材料
试验用海水青鳉由香港城市大学赠予,厦门大学近海海洋环境科学国家重点实验室已建立一套完全自主循环的海水养殖系统,用于饲养海水青鳉,稳定繁殖7年。养殖条件为:室温 (25±2)℃,人工海水盐度为32±1,海水溶解氧含量为 (6.5±0.2)mg/L,昼夜光照比为14∶10。
将17α-炔雌醇 (EE2)(Sigma-Aldrich) 溶于DMSO中,母液浓度为10 mg/L,4℃下保存备用。
1.2 方法
1.2.1 试验设计及样品采集 海水青鳉的胚胎发育和个体发育与淡水青鳉Oryzias latipes相似[32]。选取胚胎发育的2个时间点 (4、8 dpf)及个体发育的5个时间点 (1、4、8、16、30 dph)作为检测靶点。其中:4 dpf(dpf=days post fertilization)为受精后第4天,是鳃血管形成期;8 dpf,肝脏发育完全;1 dph(dph=days post hatching),为孵化后的第一天。
选取性成熟的亲本鱼,根据腹鳍和尾鳍特征区分性别。显微镜下解剖,分别采集脑、肝脏、性腺、脾脏、肠、胃、眼、心脏、鳃和肌肉组织,随机将3尾鱼的同一组织混合为一个样品,共4个平行样。
受精卵和子代仔鱼的样品采集如下:试验前一晚清空鱼缸底部所有鱼卵,次日8:00采集亲本鱼新鲜产出的受精卵,并转移至新鱼缸内待孵化。采集鱼卵样品时,每20粒混合为一个样品,共4个平行样;鱼卵从第9天开始,陆续孵化出仔鱼。采集孵化后仔鱼样品时,每4尾混合为一个样品,共设4个平行样。所有样品采集后,立即置于液氮中速冻后于超低温冰箱 (-80℃)中保存备用。
1.2.2 水体暴露 取孵化后20 d(20 dph)的海水青鳉健康仔鱼336尾,进行EE2急性暴露试验。试验分为3组:健康对照组、溶剂DMSO对照组(VDMSO∶Vseawater=1∶20 000) 和 EE2暴露组 (5、50、500 ng/L)。健康组16尾,溶剂对照组和EE2暴露的3个浓度组分别随机分配80尾。每24 h更换全部的染毒液,整个暴露试验过程中不饲喂仔鱼,分别于染毒后0、6、12、24、48、96 h时间点采样。
1.2.3 RNA提取和基因克隆 利用TRIzol(Invitrogen)提取胚胎和仔鱼的总RNA。提取过程中,为去除基因组 DNA的污染,使用 RNase-free DNase I(Promega)消化处理样品RNA。使用Nanodrop 2000(Thermo)测定总RNA的浓度,RNA质量通过15 g/L的琼脂糖凝胶鉴定。取用DNase I消化处理后的RNA反转录为cDNA,用作PCR模板。根据日本青鳉及其他硬骨鱼雌激素受体基因的已知cDNA序列,设计简并引物,首先扩增海水青鳉雌激素受体基因的ORF序列,然后再根据已获得的特异性序列,设计引物 (表1),进行RACE PCR扩增,以获得相应的全长cDNA序列,具体试验方法参见文献 [33]。
表1 本试验中用于基因克隆的引物
Tab.1 Primers used in the gene cloning in the experiment
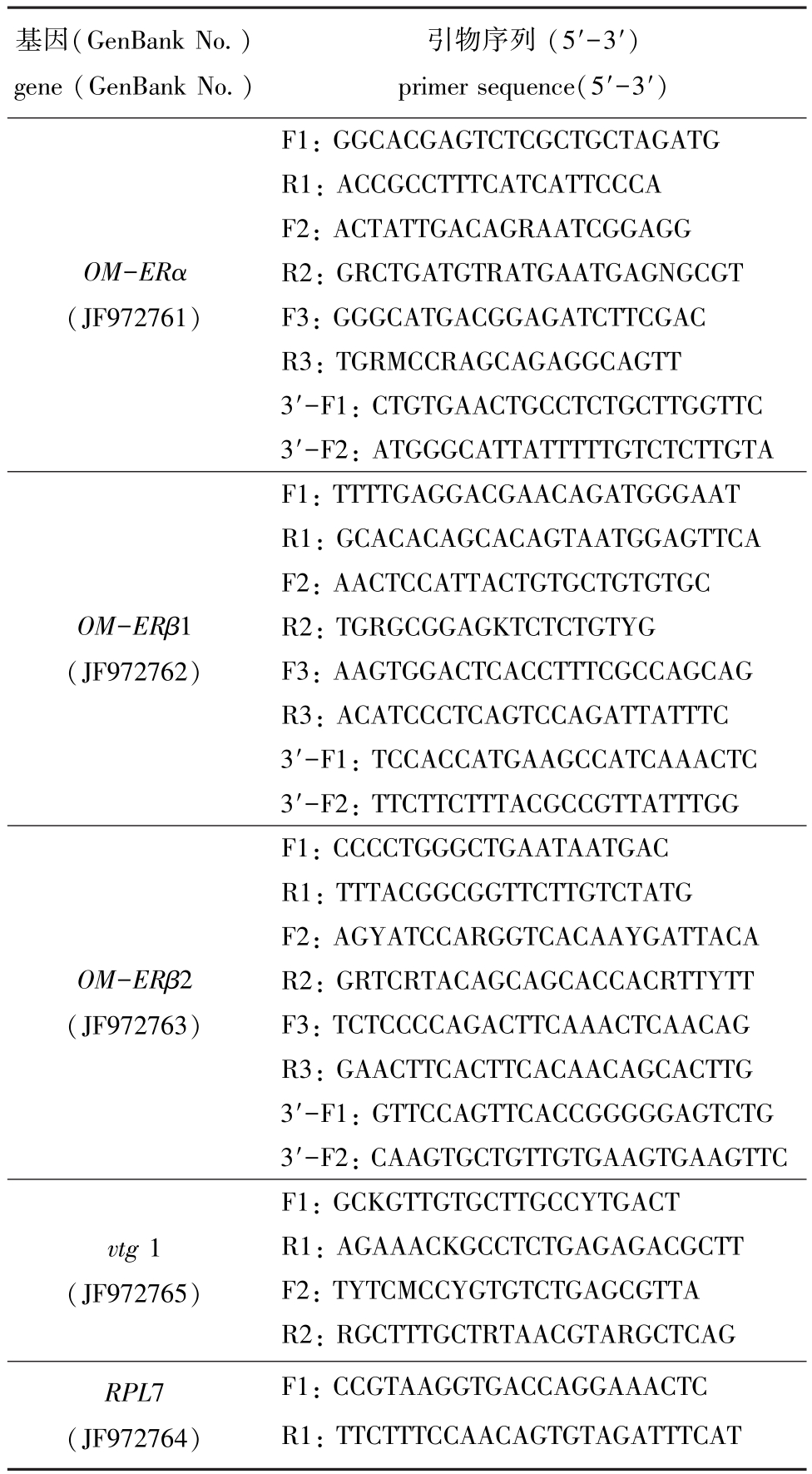
基因(GenBank No.)gene(GenBank No.)引物序列 (5′-3′)primer sequence(5′-3′)OM-ERα(JF972761)F1:GGCACGAGTCTCGCTGCTAGATG R1:ACCGCCTTTCATCATTCCCA F2:ACTATTGACAGRAATCGGAGG R2:GRCTGATGTRATGAATGAGNGCGT F3:GGGCATGACGGAGATCTTCGAC R3:TGRMCCRAGCAGAGGCAGTT 3′-F1:CTGTGAACTGCCTCTGCTTGGTTC 3′-F2:ATGGGCATTATTTTTGTCTCTTGTA OM-ERβ1(JF972762)F1:TTTTGAGGACGAACAGATGGGAAT R1:GCACACAGCACAGTAATGGAGTTCA F2:AACTCCATTACTGTGCTGTGTGC R2:TGRGCGGAGKTCTCTGTYG F3:AAGTGGACTCACCTTTCGCCAGCAG R3:ACATCCCTCAGTCCAGATTATTTC 3′-F1:TCCACCATGAAGCCATCAAACTC 3′-F2:TTCTTCTTTACGCCGTTATTTGG OM-ERβ2(JF972763)F1:CCCCTGGGCTGAATAATGAC R1:TTTACGGCGGTTCTTGTCTATG F2:AGYATCCARGGTCACAAYGATTACA R2:GRTCRTACAGCAGCACCACRTTYTT F3:TCTCCCCAGACTTCAAACTCAACAG R3:GAACTTCACTTCACAACAGCACTTG 3′-F1:GTTCCAGTTCACCGGGGGAGTCTG 3′-F2:CAAGTGCTGTTGTGAAGTGAAGTTC vtg 1(JF972765)F1:GCKGTTGTGCTTGCCYTGACT R1:AGAAACKGCCTCTGAGAGACGCTT F2:TYTCMCCYGTGTCTGAGCGTTA R2:RGCTTTGCTRTAACGTARGCTCAG RPL7(JF972764)F1:CCGTAAGGTGACCAGGAAACTC R1:TTCTTTCCAACAGTGTAGATTTCAT
1.2.4 生物信息学分析 使用BLASTn进行序列相似性分析,使用CLUSTAL W进行序列比对分析。采用邻位相接法 (Neighbor-Joining,NJ)以及MEGA 4.0软件对不同物种的雌激素受体蛋白构建系统进化树,其中以人Homo sapiens ERα、ERβ序列为外群,空位信息视为碱基缺失,自展检验(bootstrap analysis)设为1000次。通过在线网站(http://zhanglab.ccmb.med.umich.edu/I-TASSER/)预测OM-ERα蛋白保守的DNA结合域和配体结合域的3D结构。
1.2.5 实时荧光定量PCR 取1 μg消化处理后的RNA反转录为cDNA,用于定量PCR检测,SYBR Green实时荧光定量PCR方法参照文献 [34],所检测的各目的基因的特异性引物序列分别为:OMERα (F:CGACGAGTCCTCTGGTGTTC, R:CTGTAAACGGGCGTGGAA)、 OM-ERβ1(F:GCCACGACTTCACCAGCATACC,R:CAGAACAAAGAGGCACTTAGCGAC)、 OM-ERβ2(F:CCCAAAGTCCACAACATCAATCC,R:CGTAATCGTGACACACAGGCACAGAA)、vtg1(F:AAGGCTGACCGTATCCTCCTGACTA,R: GATTTTTGGATTCCCTCTGGCACTT)、 RPL7(F:CTGAGGATTGCTGAGCCTTACAT,R:CTCAACACAGATGATGCCGTATT)。
反应程序为:①50℃下2 min:激活UNG酶,消除体系配制过程中产生的非特异PCR产物的污染;②95℃下10 min:预变性,同时激活聚合酶、灭活UNG酶;③95℃下变性15 s,60℃下退火并延伸1 min,共进行45个循环;在60℃下再延伸并采集荧光信号。反应结束后,对反应体系直接进行溶解曲线分析试验,分析PCR产物特异性。反应条件为:95℃下变性15 s,从60℃到95℃线性梯度升高温度,全过程采集荧光信号,分析信号峰值,以确定扩增产物的特异性。核糖体蛋白7基因 (RPL7)在不同组织和不同发育时期的表达量较一致,且内分泌干扰物暴露下表达量较稳定[35],故本研究中选取RPL7作为内参基因。
1.3 数据处理
根据标准曲线结果,选择模板cDNA的最佳稀释倍数以及目的基因的特异性引物,按上述反应体系进行Real time PCR扩增反应并建立熔解曲线。以RPL7基因为内参,使用7500 system SDS 1.3.1.21软件分析q-PCR反应的荧光信号值,通过2-ΔΔCt法计算各基因的相对表达量。使用Origin 8.5软件绘制各基因表达水平的柱状图。使用SPSS 13.0软件对数据进行单因素方差分析 (Oneway ANOVA),用Tukey法分析组间差异,显著性水平设为0.05,极显著水平设为0.01。
2 结果与分析
2.1 海水青鳉雌激素受体亚型基因的克隆及序列分析

图1 海水青鳉雌激素受体基因的cDNA序列及预测氨基酸序列
Fig.1 cDNA sequences and deduced amino acid sequences in estrogen receptor genes in marine medaka Oryzias melastigma
注:∗表示终止密码子;ATG表示起始密码子;AATAA表示加尾信号;灰色阴影部分表示保守的DNA结合域 (DBD)
Note:∗,termination codon;ATG,initiation codon; AATAA,tailing signal; conservative DNA binding domain(DBD)is shown in shade
本研究中,克隆得到海水青鳉3个雌激素受体亚型基因 (OM-ERα/β1/β2)。 从图 1可见:OM-ERα基因 (GenBank登录号:JF972761)的cDNA序列为2762 bp,包含一段82 bp的5′非编码区,最长开放阅读框 (ORF)序列为1857 bp(含终止密码子TAA),共编码618个氨基酸,预测相对蛋白分子量约为67 000;3′非编码区为823 bp,包含多腺苷酸终止信号序列 (AATTAAA),位于poly(A)上游2701~2707 bp的位置。OM-ERβ1基因(GenBank登录号:JF972762)的cDNA序列为2835 bp,最长ORF序列1689 bp(含终止密码子TAG),共编码562个氨基酸,预测相对蛋白分子量约为62 000;5′非编码区和3′非编码区分别为183 bp和963 bp,加尾信号 (AATAA)位于poly(A)上游2725~2730 bp的位置。OM-ERβ2基因(GenBank登录号:JF972763)的cDNA序列为2471 bp,最长ORF序列为1896 bp(含终止密码子TGA),共编码631个氨基酸,5′非编码区和3′非编码区分别为101 bp和474 bp。
2.2 海水青鳉雌激素受体的结构域分析
与其他核受体家族基因编码的蛋白类似,OMERα/β1/β2编码的蛋白均具有核受体超家族的6个功能结构域,分别划分为A/B结构域 (转录激活区)、C结构域 (DNA结合域,DBD)、D结构域(铰链区)、E结构域 (配体结合域,LBD)和F区。海水青鳉雌激素受体3个亚型基因开放阅读框和各个结构域的相似度见表2。氨基酸序列的多重比对分析 (图2)表明,在6个结构域中,DBD结构域在进化上最保守,LBD结构域次之,D区(铰链区)和A/B区 (转录激活区)保守性较低。
2.3 海水青鳉雌激素受体系统进化树分析
根据所获得的海水青鳉雌激素受体的氨基酸序列,利用MEGA 4.0软件构建系统进化树 (图3),从鱼类到哺乳动物基本符合物种进化规律。进化树显示,OM-ERα与所有物种的ERα亚型聚为一支,所有的ERβ1和ERβ2聚在同一大支上,且大部分ERβ1聚为一分支,大部分ERβ2聚为一分支。
2.4 OM-ERα单体DBD和LBD结合域的3D模型建立
作为核受体家族的成员,雌激素受体蛋白的DNA结合域 (DBD)和配体结合域 (LBD)是两个较为保守的区域,其中DBD最为保守。通过在线网站 (http://zhanglab.ccmb.med.umich.edu/I-TASSER/) 构建OM-ERα单体的DBD和LBD的3D模型,DBD含有两个α-螺旋结构,LBD含有5个α-螺旋结构 (图4)。
表2 海水青鳉3个雌激素受体氨基酸相似度比较
Tab.2 Amino acid identities among three estrogen receptors in marine medaka Oryzias melastigma %

结构域domain编码的蛋白encoded protein OM-ERα OM-ERβ1 OM-ERβ2 ORF OM-ERα 100 OM-ERβ1 39.81 100 OM-ERβ2 38.50 47.90 100 A/B OM-ERα 100 OM-ERβ1 10.33 100 OM-ERβ2 13.51 24.28 100 C OM-ERα 100 OM-ERβ1 93.94 100 OM-ERβ2 95.45 98.48 100 D OM-ERα 100 OM-ERβ1 26.25 100 OM-ERβ2 27.06 36.47 100 E/F OM-ERα 100 OM-ERβ1 50.52 100 OM-ERβ2 42.98 55.26 100
2.5 OM-ERα/β1/β2基因在不同发育时期和不同组织中的表达特性
从图5可见:OM-ERα在海水青鳉胚胎第4天(4 dpf),直到孵化后不同时间点 (1~30 dph)其表达量整体上无明显变化规律;OM-ERβ1在4 dpf胚胎表达量最低,随后表达量逐渐升高,且在孵化的当天 (1 dph)表达量出现一个峰值,其后缓慢下降,并在30 dph时表达量又上升;OM-ERβ2的表达量从4 dpf到16 dph持续升高,并在16 dph和30 dph时阶段表达量为最高。
OM-ERα在海水青鳉雄性和雌性的性腺和脾脏中表达量最高,其次在雌性肝脏中表达量也较高,但在雄性肝脏中表达量较低,雌、雄肝脏间有显著性差异 (P<0.05);在脑、肠、胃、眼、鳃、心脏、肌肉等其他组织中也检测到OM-ERα mRNA的转录,但表达量相对较低,且各组织间无显著性差异 (P>0.05)。OM-ERβ1在雌雄青鳉的肝脏、性腺 (精巢和卵巢)、肠和胃中表达量相对较高,且在雄性性腺和胃中的表达量显著高于雌性 (P<0.05)。OM-ERβ2在雌雄青鳉的肝脏和性腺 (精巢和卵巢)中高表达,且精巢中的表达量显著高于卵巢 (P<0.05);其次在胃和肠中的表达量相对较高;其他组织中的表达量相对较低,且各组织间无显著性差异 (P>0.05)。

图2 海水青鳉3个雌激素受体基因推导的氨基酸序列与人类ERα氨基酸序列比对
Fig.2 Comparison of amino acid sequence alignment of three estrogen receptor genes in marine medaka Oryzias melastigma with human ERα(P03372)
注:黑色竖线表示各保守的功能结构域分隔区;∗表示保守氨基酸残基;★表示8个半胱氨酸参与保守的两个锌指结构的组成;黑色阴影表示MAPK作用位点;灰色阴影部分表示配体结构域内与结合雌激素关联的螺旋结构;▼表示雌激素作用位点;●表示AP-1结合位点;黑色线框分别表示P-box、D-box和AF-2位点
Note:Black vertical lines indicate each conservative functional domain; ∗ denotes conservative amino acid residues;★indicates eight cysteine residues for construction of zinc finger motif; Black shadow denotes MAPK site; Gray shadow denotes helical structures related to binding estrogen in the ligand binding domain(LBD); ▼ indicates estrogen action site; ● indicates AP-1 binding site;Black wireframe denotes P-box,D-box and AF-2 site,respectively
2.6 EE2急性暴露下海水青鳉仔鱼OM-ERα/β1/β2基因的表达特性
对孵化后20 d(20 dph)的海水青鳉仔鱼进行EE2急性染毒试验 (96 h),结果如图6所示。从图6可见:与溶剂对照组相比,OM-ERα仅在50 ng/L EE2中暴露6 h时显著上调达2.1倍 (P<0.05)(图6-A); EE2暴露后 6~96 h, 50 ng/L EE2显著诱导OM-ERβ1 mRNA的转录表达 (P<0.05) (图6-B),但5 ng/L与500 ng/L EE2均未影响 OMERβ1的表达 (P<0.05); OM-ERβ2的转录表达呈现EE2低浓度诱导、高浓度抑制的趋势,尤其是在低浓度 (5 ng/L)EE2中暴露6 h后,OM-ERβ2表达较溶剂对照组上调5.9倍;在中浓度 (50 ng/L)中暴露6 h后,也可诱导OM-ERβ2的转录,表达量较溶剂对照组上调2.5倍 (图6-C);分子标志物vtg1也被显著诱导表达,应答模式呈浓度依赖和时间依赖关系 (图6-D)。
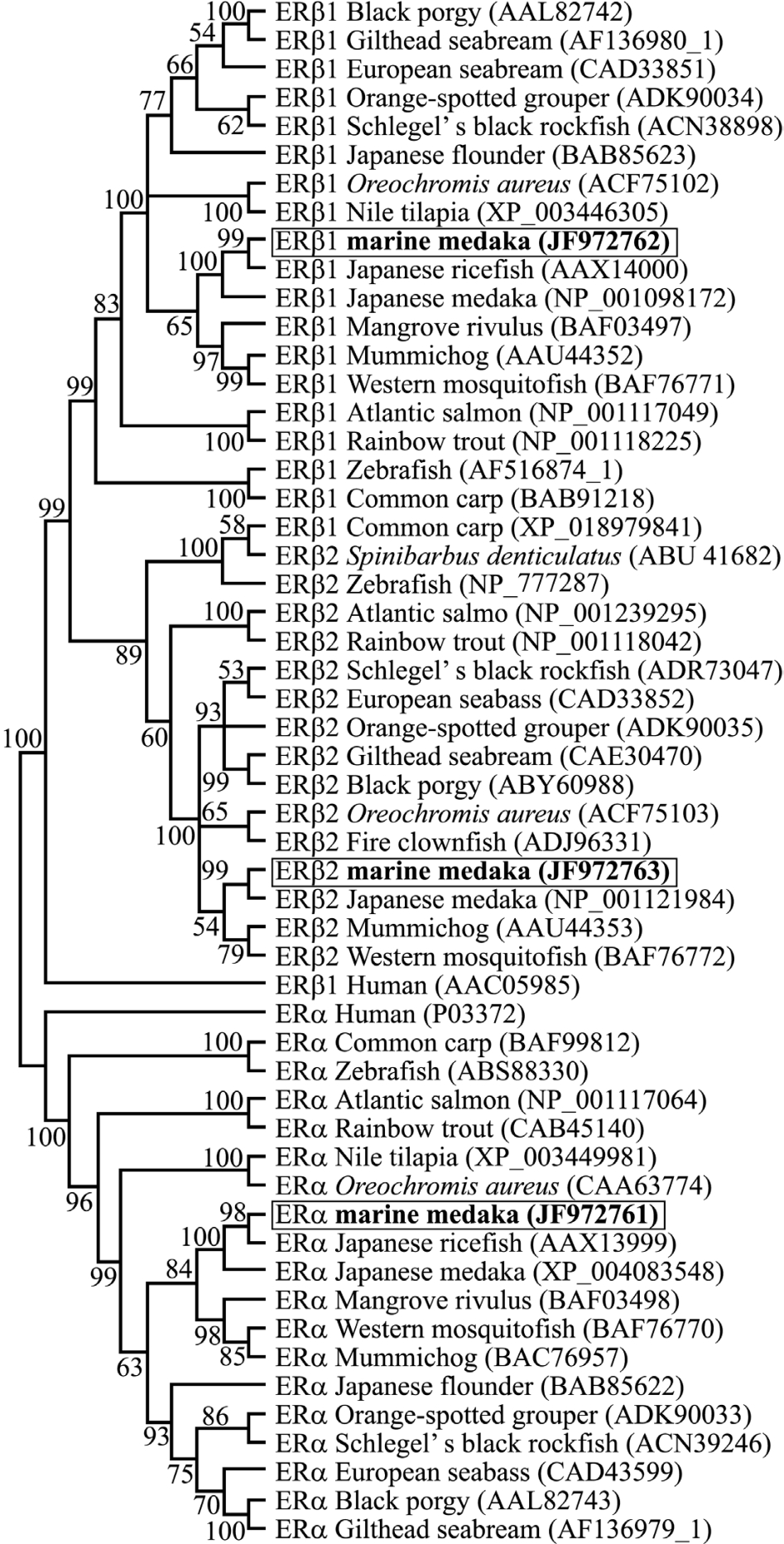
图3 基于雌激素受体氨基酸序列构建的系统进化树
Fig.3 Neighbor-Joining(NJ)tree constructed based on the amino acid sequences of estrogen receptors from vertebrates
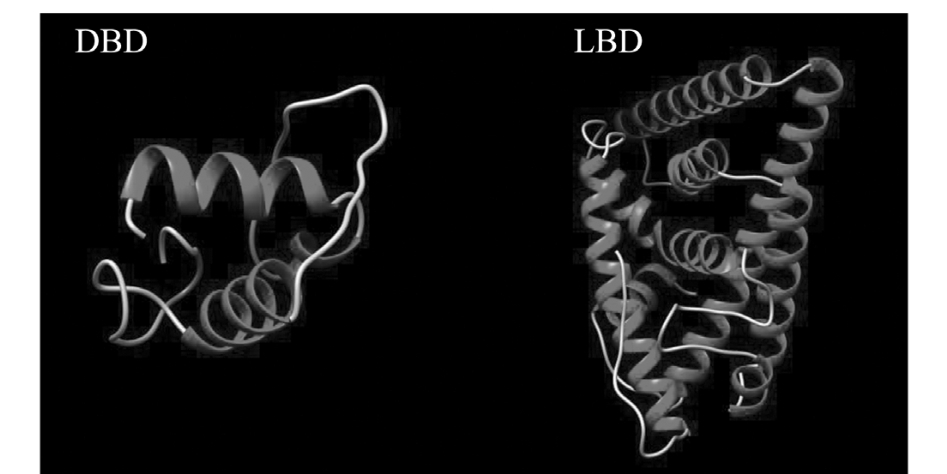
图4 OM-ERα单体DNA结合域 (DBD)和配体结合域 (LBD)的3D模型
Fig.4 Tridimensional models of the nonamer DNA and ligand binding domain of OM-ERα
3 讨论
3.1 海水青鳉雌激素受体基因OM-ERα/β1/β2序列分析
本研究中克隆获得了海水青鳉3个雌激素受体亚型基因 (OM-ERα/β1/β2),进化树分析表明,其分别属于各自的雌激素受体亚型聚类,ERα和ERβ分属两大类群,说明异型ER的亲缘关系较远,而ERβ亚型又分为β1和β2两支,说明他们的亲缘关系较近。
序列分析显示,海水青鳉雌激素受体属于典型的核受体家族成员,这与已报道的人类、老鼠及其他鱼类的结果相似,结构上分为6个功能域[11]。DBD结构域在进化上高度保守,参与DNA的结合,此区域含有8个保守的半胱氨酸,参与锌指结构的形成,这两个锌指结构协同作用,共同调节受体与特定DNA序列的结合,从而进一步调控靶基因的转录表达;保守的 P-box(CEGCKA)和 D-box(PATNQ)存在于C结构域,P-box参与DNA识别,D-box参与DNA依赖性二聚化[11]。LBD结构域氨基酸数量最多,发挥的作用最大,5个保守的螺旋结构即位于此区域,他们参与配体的结合。此外,依赖配体的转录激活区 (AF-2,序列为YDLLLEML)也位于此区域,当AF-2与不同的雌激素接触时,会呈现出不同的构象变化,以此来决定结合特异性的辅助因子以调控靶基因的转录表达[11,36]。此外,一个潜在的AP-1结合位点[CGACTAC替代为TGA(GC)T(C/A)A]位于DBD结构域,其可能参与通过蛋白/蛋白互作的方式激活ER,从而介导AP-1蛋白的合成[11,36]。海水青鳉雌激素受体基因OM-ERα/β1/β2编码蛋白的保守氨基酸残基和重要功能结构域的存在,暗示他们具有相似的生理功能。OM-ERα/β1/β2编码蛋白的A/B结构域的长度差异很大,这暗示其在非配体依赖性的转录激活功能上存在差异[37]。与人类 ERα相似,海水青鳉 OMERα/β1/β2编码蛋白的A/B结构域富含S和P氨基酸残基,同时含有潜在MAPK激酶 (mitogen-activated protein kinase, MAPK) 作用位点[P-X(1,2)-S-P)],MAPK可以通过作用于保守的丝氨酸残基 (对应hERα第118号丝氨酸残基)磷酸化该位点[38-39]。
3.2 海水青鳉雌激素受体基因OM-ERα/β1/β2的组织表达特征
OM-ERα/β1/β2 在所检测的海水青鳉肝脏、 性腺、脑等10种组织中均有表达。其中,OM-ERα在雌鱼肝脏中表达量较高,但在雄鱼肝脏中表达量较低,表明OM-ERα基因在海水青鳉肝脏内的表达存在性别差异 (P<0.05)。海水青鳉雄鱼肝脏内OM-ERα基因表达量低,这与已报道的其他鱼类不同,如斑马鱼[17]、大嘴鲈[18]、虹鳟 (ERα1)[22]朝鲜鱊Acheilognathus yamatsutae[36]和稀有鮈鲫Gobiocypris rarus[4]。雌激素E2通过ERα促使卵黄蛋白前体vtg(卵黄蛋白原)在雌鱼肝脏内合成[22],因为雄鱼体内E2水平很低,肝脏内ERα表达量通常比雌鱼低很多[18,40]。这与本研究结果相同。
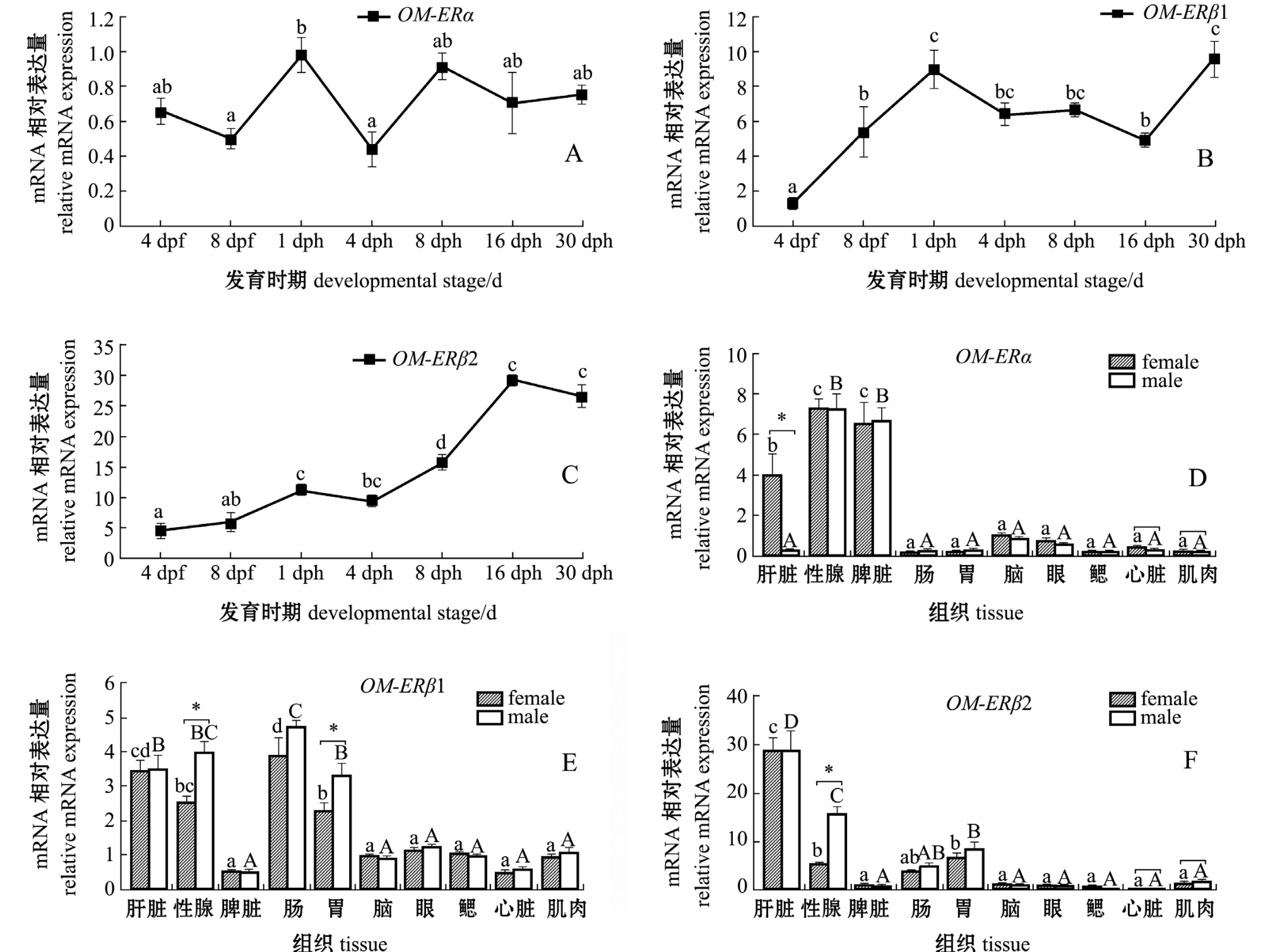
注:dpf表示受精后天数,dph表示孵化后天数;内参基因为RPL7;A、B、C图中,标有不同小写字母表示组间有显性差异 (P<0.05);D、E、F图中,标有不同小写字母者表示雌鱼各组织间有显著性差异 (P<0.05),标有不同大写字母者表示雄鱼各组织间有显著性差异(P<0.05);标有相同字母者表示组间无显著性差异 (P<0.05);∗表同一组织雌雄鱼间有显著性差异 (P<0.05)
Note:dpf= days post fertilization,dph = days post hatching; RPL7 as reference gene;In the Figures A, B and C,the means with different letters are significant differences in various group;in Figures D, E dand F,the means with different letters are significant difference among all the tested tissues in female fish at the 0.05 probability level, the means with capital letters are significant differences in male, and the means with same letters are not significant differences; ∗denotes significant difference in both male and female(P<0.05)
海水青鳉雌激素受体基因同样在性腺内高表达,但OM-ERβ1/β2在性腺中的表达存在雌雄差异,雄性显著高于雌性,这与对尼罗罗非鱼的研究结果相似[19]。已有研究显示,雌激素受体的组织特异性表达与功能密切相关。肝脏和性腺中的雌激素受体在与配体特异性结合后,分别调控与生殖相关基因的表达以及与卵黄蛋白原蛋白合成相关基因的表达,进而调控性腺的生长发育和生殖周期的变化[18]。 OM-ERα/β1/β2在肝脏 (雄鱼 OM-ERα 除外)和性腺中高表达,暗示他们与生殖活动的调控关系密切。E2通常被认为是雌性特异性激素,但这一传统观点近些年受到挑战。研究发现,雌激素、雌激素受体和芳香酶在雄性个体睾丸中均存在[41-42]。大黄鱼3个雌激素受体基因 (LcERs)在肝脏和性腺中的表达具有性别特异性和发育阶段特异性,并推测LcERα和LcERβ2与雌鱼肝脏中E2的生理学作用有关,LcERβ2与雄鱼肝脏中卵黄生成作用调控有关[20]。因此,雄鱼精巢内高表达的ER可能与ER介导的精巢功能和精子发生有关,而雌鱼卵巢内ER高表达与卵巢功能有关。本研究中,ER在卵巢中的表达水平不同,暗示不同亚型的ER以性别特异性的方式在繁殖中扮演不同的角色,但其各自的具体功能需要进一步研究阐明。
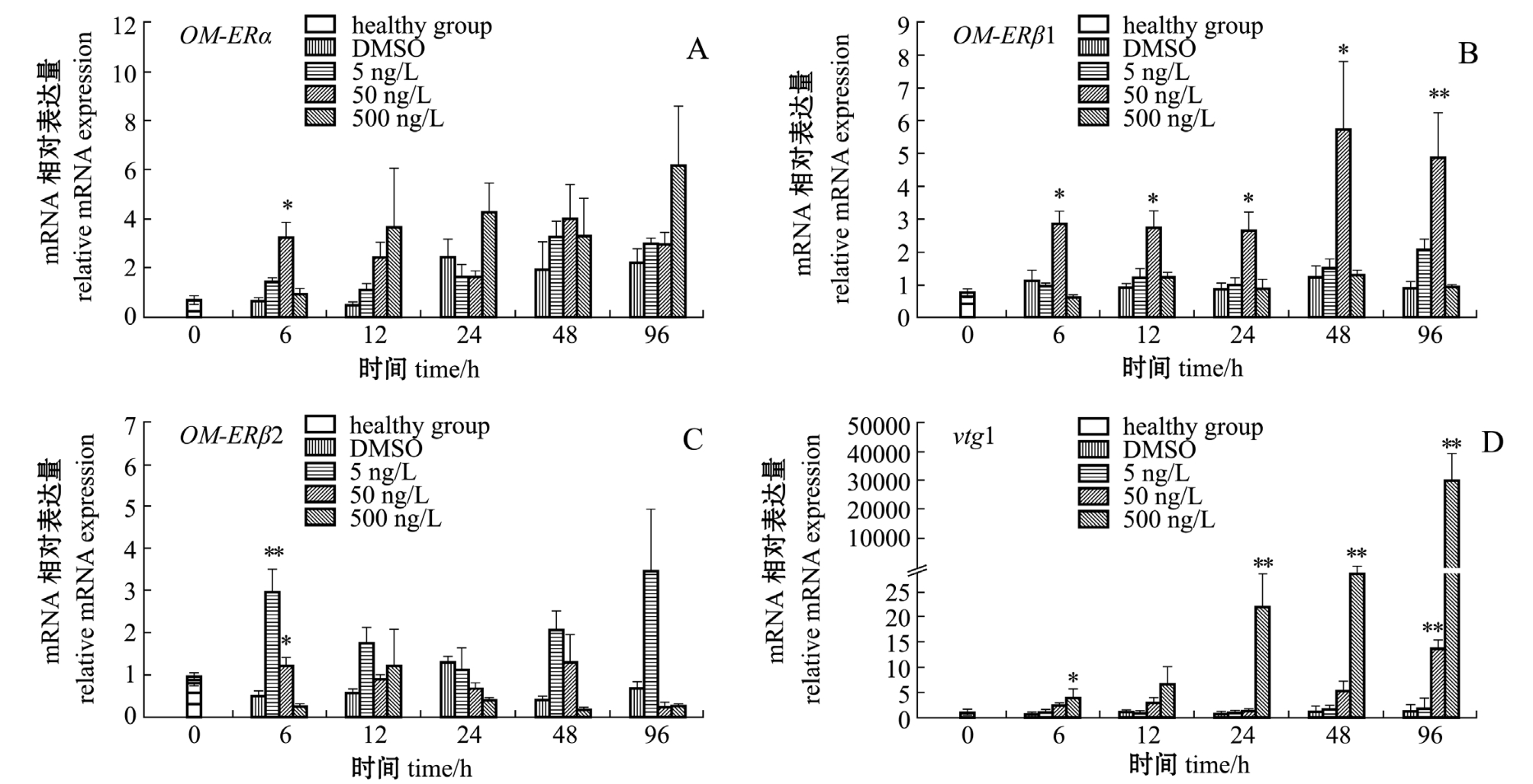
图6 EE2对海水青鳉仔鱼雌激素受体基因转录的影响(DMSO=0.005%,20 dph)
Fig.6 Effects of EE2 on transcript abundance of ER mRNAs in marine medaka larvae(DMSO=0.005%,20 dph)
注:∗表示与溶剂对照组相比有显著性差异 (P<0.05),∗∗表示与溶剂对照组相比有极显著性差异 (P<0.01)
Note:∗,significant differences compared with the solvent control(P<0.05);∗∗,very significant differences compared with the solvent control(P<0.01)
3.3 环境雌激素EE2对海水青鳉仔鱼OM-ERα/β1/β2基因表达的影响
关于环境雌激素对鱼类的影响,近年来已有相关研究报道。而多数研究是利用成鱼进行染毒试验。本研究中将海水青鳉仔鱼暴露于不同浓度的EE2水体中, 检测发现其 OM-ERα/β1/β2基因及vtg1基因均可不同程度地响应EE2刺激,但是响应程度不同。结果显示,仔鱼中分子标志物基因vtg1被诱导上调表达,且其表达与EE2暴露浓度呈剂量依赖关系。值得注意的是,OM-ERβ1基因在50 ng/L EE2暴露下上调表达,低浓度 (5 ng/L)EE2诱导OM-ERβ2基因上调表达,而高浓度 (500 ng/L)的EE2则抑制其表达。这一结果与已有研究类似:在不同浓度 (0.01、0.10、1.00 nmol/L)的EE2中暴露3 d,显著抑制了稀有鮈鲫仔鱼ERβ1基因的表达,但是ERβ2的应答模式呈现低剂量诱导、高剂量抑制的趋势[4]。本研究中所使用的EE2浓度单为ng/L,换算后分别相当于0.017、0.170、1.700 nmol/L,与上述研究中所使用的浓度 (0.01、0.10、1.00 nmol/L)范围相当。已有报道指出,内分泌干扰物的作用效应通常不是单一的剂量反应关系,而是在剂量与响应之间存在一种倒U型的关系[43],本研究中OM-ERβ2的应答模式即符合该模型。因此,可以认为,不同鱼类对同一种内分泌干扰物的敏感度不同,而水体暴露的浓度、暴露方式和暴露时间等都是评价这一问题的重要因子[5-6]。
综上,海水青鳉20日龄仔鱼可以作为生物模型使用。
参考文献:
[1] Shanle E K,Xu W.Endocrine disrupting chemicals targeting estrogen receptor signaling:identification and mechanisms of action[J].Chemical Research in Toxicology,2011,24(1):6-19.
[2] Diamanti-Kandarakis E,Bourguignon J P,Giudice L C,et al.Endocrine-disrupting chemicals:an endocrine society scientific statement[J].Endocrine Reviews,2009,30(4):293-342.
[3] Arcand-Hoy L D,Benson W H.Fish reproduction:an ecologically relevant indicator of endocrine disruption[J].Environmental Toxicology and Chemistry,1998,17(1):49-57.
[4] Wang H P,Wang J J,Wu T T,et al.Molecular characterization of estrogen receptor genes in Gobiocypris rarus and their expression upon endocrine disrupting chemicals exposure in juveniles[J].A-quatic Toxicology,2011,101(1):276-287.
[5] Hogan N S,Currie S,LeBlanc S,et al.Modulation of steroidogenesis and estrogen signalling in the estuarine killifish(Fundulus heteroclitus)exposed to ethinylestradiol[J].Aquatic Toxicology,2010,98(2):148-156.
[6] Marlatt V L,Lakoff J,Crump K,et al.Sex-and tissue-specific effects of waterborne estrogen on estrogen receptor subtypes and E2-mediated gene expression in the reproductive axis of goldfish[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2010,156(1):92-101.
[7] Jedeon K,Loiodice S,Marciano C,et al.Estrogen and bisphenol a affect male rat enamel formation and promote ameloblast proliferation[J].Endocrinology,2014,155(9):3365-3375.
[8] Ascenzi P,Bocedi A,Marino M.Structure-function relationship of estrogen receptor α and β:impact on human health[J].Molecular Aspects of Medicine,2006,27(4):299-402.
[9] Gronemeyer H,Gustafsson J Å,Laudet V.Principles for modulation of the nuclear receptor superfamily[J].Nature Reviews Drug Discovery,2004,3(11):950-964.
[10] Jensen E V.Mechanism of estrogen action in relation to carcinogenesis[J].Proceedings Canadian Cancer Conference,1966,6:143-165.
[11] Matsumoto T,Nakamura A M,Mori K,et al.Oyster estrogen receptor:cDNA cloning and immunolocalization[J].General and Comparative Endocrinology,2007,151(2):195-201.
[12] Green S,Walter P,Kumar V,et al.Human oestrogen receptor cDNA:sequence,expression and homology to v-erb-A[J].Nature,1986,320(6058):134-139.
[13] Mosselman S,Polman J,Dijkema R.ERβ:identification and characterization of a novel human estrogen receptor[J].FEBS Letters,1996,392(1):49-53.
[14] Tremblay G B,Tremblay A,Copeland N G,et al.Cloning,chromosomal localization,and functional analysis of the murine estrogen receptor β[J].Molecular Endocrinology,1997,11(3):353-365.
[15] Hawkins M B,Thornton J W,Crews D,et al.Identification of a third distinct estrogen receptor and reclassification of estrogen receptors in teleosts[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(20):10751-10756.
[16] Kawahara T,Okada H,Yamashita I.Cloning and expression of genomic and complementary DNAs encoding an estrogen receptor in the medaka fish,Oryzias latipes[J].Zoological Science,2000 17(5):643-649.
[17] Menuet A,Pellegrini E,Anglade I,et al.Molecular characterization of three estrogen receptor forms in zebrafish:binding characteristics,transactivation properties,and tissue distributions[J].Biology of Reproduction,2002,66(6):1881-1892.
[18] Sabo-Attwood T,Kroll K J,Denslow N D.Differential expression of largemouth bass(Micropterus salmoides)estrogen receptor isotypes alpha,beta,and gamma by estradiol[J].Molecular and Cellular Endocrinology,2004,218(1-2):107-118.
[19] Wang D S,Senthilkumaran B,Sudhakumari C C,et al.Molecular cloning,gene expression and characterization of the third estrogen receptor of the Nile tilapia,Oreochromis niloticus[J].Fish Physiology and Biochemistry,2005,31(2-3):255-266.
[20] Chen S H,Pu L L,Xie F J,et al.Differential expression of three estrogen receptors mRNAs in tissues,growth development,embryogenesis and gametogenesis from large yellow croaker,Larimichthys crocea[J].General and Comparative Endocrinology,2015,216:134-151.
[21] Ma C H,Dong K W,Yu K L.cDNA cloning and expression of a novel estrogen receptor β-subtype in goldfish(Carassius auratus)[J].Biochimica et Biophysica Acta(BBA)-Gene Structure and Expression,2000,1490(1-2):145-152.
[22] Nagler J J,Cavileer T,Sullivan J,et al.The complete nuclear estrogen receptor family in the rainbow trout:discovery of the novel ERα2 and both ERβ isoforms[J].Gene,2007,392(1-2):164-173.
[23] Cotter K A,Nacci D,Champlin D,et al.Cloning of multiple ERα mRNA variants in killfish(Fundulus heteroclitus),and differential expression by tissue type,stage of reproduction,and estrogen exposure in fish from polluted and unpolluted environments[J].Aquatic Toxicology,2015,159:184-197.
[24] Zhang X W,Hecker M,Park J W,et al.Real-time PCR array to study effects of chemicals on the hypothalamic-pituitary-gonadal axis of the Japanese medaka[J].Aquatic Toxicology,2008,88(3):173-182.
[25] Humble J L,Saaristo M,Lindström K,et al.Effects of 17α-ethinyl estradiol exposure on estrogen receptors α and β and vitellogenins A,B and C mRNA expression in the liver of sand goby(Pomatoschistus minutus)[J].Marine Environmental Research,2014,96:12-18.
[26] Osachoff H L,Shelley L K,Furtula V,et al.Induction and recovery of estrogenic effects after short-term 17β-estradiol exposure in juvenile rainbow trout(Oncorhynchus mykiss)[J].Archives of Environmental Contamination and Toxicology,2013,65(2):276-285.
[27] Meier S,Morton H C,Nyhammer G,et al.Development of Atlantic cod(Gadus morhua)exposed to produced water during early life stages:effects on embryos,larvae,and juvenile fish[J].Marine Environmental Research,2010,70(5):383-394.
[28] Rotchell J,Ostrander G.Molecular markers of endocrine disruption in aquatic organisms[J].Journal of Toxicology and Environmental Health Part B:Critical Reviews,2003,6(5):453-496.
[29] Bo J,Cai L,Xu J H,et al.The marine medaka Oryzias melastigma-A potential marine fish model for innate immune study[J].Marine Pollution Bulletin,2011,63(5-12):267-276.
[30] Deane E E,van de Merwe J P,Hui J H,et al.PBDE-47 exposure causes gender specific effects on apoptosis and heat shock protein expression in marine medaka,Oryzias melastigma[J].Aquatic Toxicology,2014,147:57-67.
[31] Kasahara M,Naruse K,Sasaki S,et al.The medaka draft genome and insights into vertebrate genome evolution[J].Nature,2007,447(7145):714-719.
[32] Iwamatsu T.Stages of normal development in the medaka Oryzias latipes[J].Mechanisms of Development,2004,121(7-8):605-618.
[33] Yang M,Wang K J,Chen J H,et al.Genomic organization and tissue-specific expression analysis of hepcidin-like genes from black porgy(Acanthopagrus schlegelii B.)[J].Fish&Shellfish Immunology,2007,23(5):1060-1071.
[34] Wang K J,Cai J J,Cai L,et al.Cloning and expression of a hepcidin gene from a marine fish(Pseudosciaena crocea)and the antimicrobial activity of its synthetic peptide[J].Peptides,2009,30(4):638-646.
[35] Zhang Z B,Hu J Y.Development and validation of endogenous reference genes for expression profiling of medaka(Oryzias latipes)exposed to endocrine disrupting chemicals by quantitative real-time RT-PCR[J].Toxicological Sciences,2007,95(2):356-368.
[36] Kim J G,Kim H R,Park Y J,et al.Molecular cloning and characterization of the estrogen receptor from the striped bitterling(Acheilognathus yamatsutae)[J].Environmental Health and Toxicology,2011,26:e2011005.
[37] Pakdel F,Métivier R,Flouriot G,et al.Two estrogen receptor(ER)isoforms with different estrogen dependencies are generated from the trout ER gene[J].Endocrinology,2000,141(2):571-580.
[38] Ali S,Metzger D,Bornert J M,et al.Modulation of transcriptional activation by ligand-dependent phosphorylation of the human oestrogen receptor A/B region[J].The EMBO Journal, 1993, 12(3):1153-1160.
[39] Bunone G,Briand P A,Miksicek R J,et al.Activation of the unliganded estrogen receptor by EGF involves the MAP kinase pathway and direct phosphorylation[J].The EMBO Journal,1996,15(9):2174-2183.
[40] Menuet A,Le Page Y,Torres O,et al.Analysis of the estrogen regulation of the zebrafish estrogen receptor(ER)reveals distinct effects of ERα,ERβ1 and ERβ2[J].Journal of Molecular Endocrinology,2004,32(3):975-986.
[41] Sharpe R M.The roles of oestrogen in the male[J].Trends in Endocrinology & Metabolism,1998,9(9):371-377.
[42] O'Donnell L,Robertson K M,Jones M E,et al.Estrogen and spermatogenesis 1[J].Endocrine Reviews,2001,22(3):289-318.
[43] Vom Saal F S,Timms B G,Montano M M,et al.Prostate enlargement in mice due to fetal exposure to low doses of estradiol or diethylstilbestrol and opposite effects at high doses[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(5):2056-2061.