牡蛎是全球养殖规模最大的贝类,也是中国重要的经济养殖贝类之一。牡蛎资源丰富、口味宜人,并具有镇静安神、滋阴补阳、软坚散结、收敛固涩等药用价值功效,被称为 “海底牛奶”[1]。多糖广泛存在于动物、植物和微生物中,是构成生命体的基本物质。对多糖进行硫酸酯化能使其产生更多的生物活性[2]。硫酸酯化多糖具有抗氧化[3]、抗肿瘤[4]、抗病毒[5]等生物活性。因为多糖保肝的机理主要是清除自由基,防止自由基对肝细胞损伤,通常具有抗氧化活性的多糖均具有保肝作用[6]。Shi等[7]利用热水浸提法提取的牡蛎多糖,对四氯化碳 (CCl4)致小鼠急性肝损伤和酒精致小鼠慢性肝损伤具有保护作用。侯丽等[8]利用水提醇沉法提取牡蛎多糖,对小鼠急性酒精肝损伤具有保护作用,作用机理可能是提高了肝组织的抗氧化能力。目前尚未见对硫酸酯化牡蛎多糖保肝作用的报道。本研究中,用实验室前期制备得到的粗牡蛎多糖[7]除蛋白纯化后,进行硫酸酯化修饰,制备硫酸酯化牡蛎多糖 (SCGP),研究了SCGP对CCl4致小鼠急性肝损伤的保护作用,以期为牡蛎的开发利用提供科学依据。
1 材料与方法
1.1 材料
粗牡蛎多糖由本实验室前期制备所得;氯磺酸、吡啶、N,N-二甲基酰胺 (DMF)、硫酸钾、三氯乙酸、氯化钡、分子量标准品 (Dextran T-10、 Dextran T-40、 Dextran T-70、 Dextran T-500、Dextran T-2000)均购自美国Sigma公司;SPF级昆明小鼠 (体质量18~22 g)购自大连医科大学实验动物中心 [SCXK(辽)2008-0002];联苯双脂滴丸 (批号160701)购自北京协和药厂;谷丙转氨酶、谷草转氨酶、超氧化物歧化酶、丙二醛和考马斯亮蓝蛋白质测定试剂盒购自南京建成生物工程公司;其他试剂均为分析纯。
试验用主要仪器有:L-2130型高效液相色谱仪(日本Hitachi公司);2000ES型蒸发光检测器(美国 Alltech公司);MuLTiSJAN MK3酶标仪、Microcl 17R离心机 (美国 Thermo公司);DMLLLED型倒置显微镜(德国Leica公司);UV-754紫外分光光度计(上海光谱仪器有限公司)。
1.2 方法
1.2.1 粗牡蛎多糖的制备 参考Shi等[7]的方法。取去除内脏的新鲜牡蛎肉,粉碎匀浆,匀浆液热水浸提3次,过滤得上清液,上清液冷却至室温,用冰醋酸调节pH至5.1,等电点沉淀过夜,以8000 r/min离心10 min得上清液,上清液通过相对分子质量截留量为10 000的中空纤维聚砜膜得截留液,喷雾干燥得到牡蛎多糖。
1.2.2 粗牡蛎多糖除蛋白质 粗牡蛎多糖采用Sevag法[9]除蛋白质。将喷雾干燥后的粗牡蛎多糖配制成10%浓度的水溶液,加入Sevag试剂 (正丁醇∶三氯甲烷=1∶5),牡蛎多糖溶液与Sevag试剂的体积比为4∶1,振荡充分反应30 min,静置后用分液漏斗分液,保留上层清液,重复5次。在上层清液中加3倍体积乙醇沉淀过夜,以8000 r/min离心10 min,收集沉淀,真空冷冻干燥得纯化牡蛎多糖。
1.2.3 多糖、蛋白质含量测定 采用苯酚-硫酸法测定多糖含量[10],采用Follin-酚法测定蛋白质含量[11]。
1.2.4 硫酸酯化牡蛎多糖的制备 采用氯磺酸-吡啶法制备硫酸酯化牡蛎多糖[12]。
酯化剂的制备:向三颈烧瓶中加入60 mL吡啶,在冰水浴中充分搅拌后,在40 min内逐滴加入10 mL氯磺酸,制得酯化试剂备用。
酯化试验:在40 mL N,N-二甲基甲酰胺中溶解2.0 g前期纯化的牡蛎多糖,充分搅拌后加入到装有酯化试剂的三颈烧瓶中,60℃下水浴,搅拌3 h。反应结束后冷却至室温,加入质量浓度为10%的氢氧化钠溶液调至中性。之后加入3倍体积的乙醇 (体积分数95%)过夜,以8000 r/min离心10 min得沉淀。将沉淀溶解于水中,透析3 d,真空冷冻干燥得到硫酸酯化修饰产物[13]。
1.2.5 硫酸根含量及相对分子量的测定
(1)硫酸根含量。采用明胶-比浊法测定SCGP硫酸基含量[14]。称取样品3 mg,加入1 mL浓度为1 mol/L的盐酸,100℃下水解6 h,冷却后挥发干燥,残渣用1 mL蒸馏水溶解。用硫酸钾溶液制作标准曲线,以0.2 mL盐酸溶液作为空白,分别加入三氯乙酸3.8 mL、氯化钡-明胶溶液1.0 mL,室温下静置15 min,在360 nm波长下测定吸光值A1;以1.0 mL明胶溶液代替氯化钡溶液,同法测定吸光值A2。以硫酸基毫克数为横坐标,吸光值 (A1-A2)为纵坐标,制作硫酸根含量标准曲线。
取代值(DS)= 162×(S/98)/(100-96×S/98),其中,S为硫酸根含量占多糖百分比。
(2)相对分子质量。使用液相色谱法测定相对分子质量,采用TSK-Gel G5000PW XL色谱柱(TOSOH)(300 mm×7.8 mm), 流速为0.2 mL/min,用2000ES型蒸发光检测器 (Alltec)检测分析。相对分子质量标准品采用Dextran T-10(10 000)、Dextran T-40(40 000)、 Dextran T-70(70 000)、Dextran T-500(500 000)和Dextran T-2000(2000 000),标准品用超纯水配成1 mg/mL溶液,进样量为20 μL,记录保留时间,计算洗脱体积。以洗脱体积为横坐标,分子量的对数为纵坐标,求线性回归方程。样品用超纯水配制成1 mg/mL溶液,同条件下进行分析,记录保留时间,算出洗脱体积,代入回归方法计算相对分子质量。
1.2.6 CCl4致小鼠急性肝损伤模型的建立 将72只SPF级昆明小鼠 (雌、雄各半)分为6组,分别为对照组、模型组、联苯双脂 (200 mg/kg)药物组,以及硫酸酯化牡蛎多糖低浓度 (200 mg/kg)、中浓度 (400 mg/kg)、高浓度 (800 mg/kg)剂量组,各组每日灌胃1次,对照组和模型组给予同体积的生理盐水,连续灌胃14 d,于末次给药2 h后,对照组按0.2 mL/10 g腹腔注射植物油,模型组、药物组、SCGP灌胃组均腹腔注射含0.2%CCl40.2 mL/10 g植物油溶液,禁食不禁水,18 h后摘眼球取血,离心 (3000 r/min,10 min),取上层血清,置于冰箱 (-20℃)中冻存备用。处死小鼠后迅速取肝脏,用生理盐水洗净,用滤纸吸干血水,称取肝左叶组织0.3 g,制成10%的匀浆液,离心 (4500 r/min,10 min),取上清液,4℃下保存备用。称取肝右叶组织0.3 g,用中性福尔马林溶液进行固定,石蜡包埋切片。苏木精-伊红(H.E)染色,在倒置显微镜下观察肝组织形态[15]。1.2.7 生化指标检测 按试剂盒说明书方法测定小鼠血清中谷丙转氨酶 (ALT)和谷草转氨酶(AST)活性,以及肝组织匀浆液中超氧化物歧化酶 (SOD)活性和丙二醛 (MDA)含量。
1.3 数据处理
试验数据以平均值±标准差 (mean±S.D.)表示,采用SPSS 11.0软件进行单因素方差分析,用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 纯化后的牡蛎多糖含量及蛋白质含量
用苯酚-硫酸法测得粗牡蛎多糖含量为57.4%,用Follin-酚法测得粗牡蛎多糖中蛋白质含量为28.7%。其中蛋白质含量仍然较高,故采用Sevag法脱除蛋白质,经Sevag法脱除蛋白质后,测得多糖含量为97.8%,蛋白质含量为1.8%,这表明蛋白质脱除效果较好。
2.2 SCGP的硫酸根含量及其相对分子量
用明胶-比浊法测得SCGP的硫酸根含量为28.96%,取代值 (DS)为 0.66。如图 1所示,SCGP纯度良好、分子量组成均一。经分子量标准品制作相对分子量标准曲线,方程为y=-0.2441 x+8.7011(R2=0.9973),代入标准回归方程得到SCGP的相对分子质量聚集度大于2 000 000,表明SCGP是大分子多聚糖。
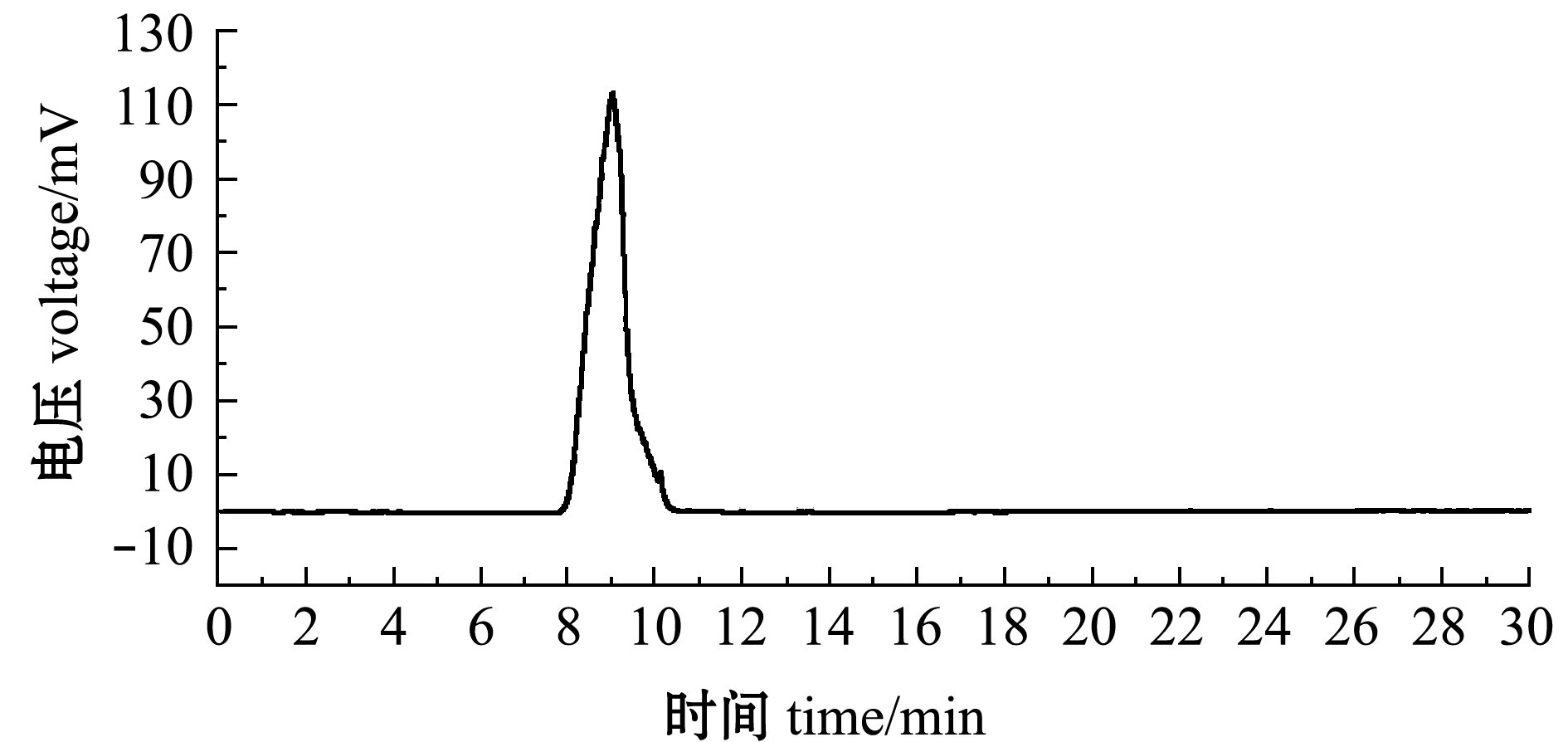
图1 SCGP的高效液相色谱分子量鉴定
Fig.1 Molecular mass identification of SCGP by HPLC
2.3 SCGP对CCl4致小鼠急性肝损伤生化指标的影响
SCGP对CCl4致小鼠急性肝损伤生化指标结果如表1所示,模型组各项指标均显著区别于对照组(P<0.05),表明建模成功。模型组小鼠血清中ALT、AST活性显著高于对照组 (P<0.05),肝组织中SOD活性显著低于对照组 (P<0.05),肝组织中MDA含量显著高于对照组 (P<0.05)。药物组与模型组相比,所检测指标均有显著性差异(P<0.05),说明联苯双脂滴丸具有治疗效果。灌胃SCGP各剂量组的小鼠血清中ALT和AST活性,肝组织中MDA含量均显著低于模型组 (P<0.05),SCGP高剂量组SOD活性与模型组相比显著上升(P<0.05),说明低、中、高剂量组的SCGP均可显著抑制由CCl4导致的小鼠血清ALT、AST活性的升高,并可以降低小鼠肝组织中MDA含量。灌胃SCGP高剂量组可显著提高肝损伤小鼠肝组织中SOD活性,但低、中SCGP剂量组无显著性差异。
2.4 SCGP对CCl4致小鼠急性肝损伤肝组织学的影响
肝组织切片显示 (图2),正常组小鼠肝细胞排列规则,模型组肝细胞出现空泡变性,细胞无规律性,并有炎症、坏死现象,主要原因是CCl4致细胞膜和细胞器膜损坏,组织液外流。SCGP灌胃组和药物组肝细胞病变较模型组明显减少,这表明SCGP能明显减轻CCl4对肝组织的急性损伤。
表1 SCGP对CCl4致肝损伤小鼠血清和肝组织中酶活性的影响 (平均值±标准差,n=10)
Tab.1 Effects of SCGP on activities of serum and hepatic enzymes in mice with liver injury induced by CCl4(mean±S.D.,n=10)
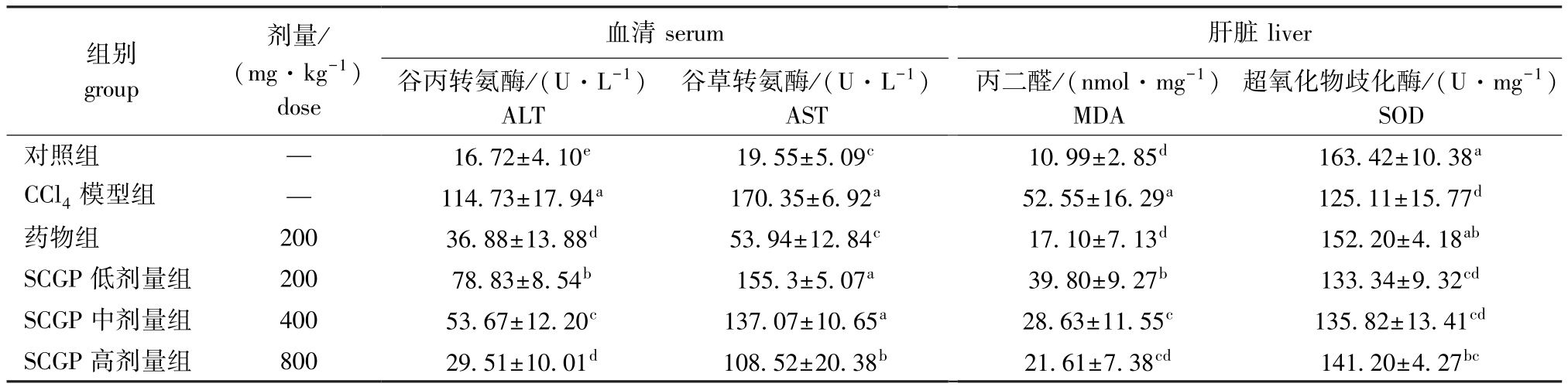
注:同列中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05)
Note: The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences
组别group(mg·kg-1)dose谷丙转氨酶/(U·L-1)ALT谷草转氨酶/(U·L-1)AST丙二醛/(nmol·mg-1)MDA超氧化物歧化酶/(U·mg-1)SOD对照组 — 16.72±4.10e 19.55±5.09c 10.99±2.85d 163.42±10.38a CCl4模型组 — 114.73±17.94a 170.35±6.92a 52.55±16.29a 125.11±15.77d药物组 200 36.88±13.88d 53.94±12.84c 17.10±7.13d 152.20±4.18ab SCGP 低剂量组 200 78.83±8.54b 155.3±5.07a 39.80±9.27b 133.34±9.32cd SCGP 中剂量组 400 53.67±12.20c 137.07±10.65a 28.63±11.55c 135.82±13.41cd SCGP 高剂量组 800 29.51±10.01d 108.52±20.38b 21.61±7.38cd 141.20±4.27bc
3 讨论
CCl4经肝脏细胞内质网代谢,导致自由基增加,影响生物结构或通过氧激活产生的三线态氧,对肝脏产生损伤作用。CCl4致小鼠急性肝损伤模型的建立主要用来筛选和评价保肝药物[16-17]。多糖护肝原理主要是其能有效清除自由基,减少CCl4在肝组织中产生的自由基,防止肝组织病变,达到对肝组织的保护目的,此类多糖有山药硒多糖[18]、虫茶多糖[19]、药桑多糖[20]、金线莲多糖[21]等;其次,多糖能改善肝损伤小鼠的生化指标,降低小鼠ALT、AST和MDA含量,提高SOD活性,达到减轻肝损伤的作用,原因可能是多糖提高了肝脏线粒体呼吸复合酶活性,并通过清除自由基来减少过氧化程度,恢复正常功能[22];三是,多糖能促进免疫细胞DNA合成,使脾细胞和T细胞大量增殖,提高机体免疫能力[23],如西洋参多糖能显著促进机体免疫细胞增殖,增强机体免疫能力[24]。
小鼠肝损伤时,体内会产生大量ALT、AST,并进入血液中,导致两种转氨酶在小鼠血清中大量升高,只要有1%的肝细胞损伤,就能使血清酶活性升高一倍,故这两种酶是检测肝细胞受损的灵敏指标[25]。CCl4损伤小鼠肝细胞是其在体内产生大量自由基,干扰蛋白质合成,影响生物体的结构和功能[6]。SOD是保护细胞内抗氧化酶的主要成分,其可以保护细胞免受自由基损害,同时SOD也是衡量机体抗氧化能力的指标[26]。MDA是细胞过氧化作用最终产生的小分子代谢产物,其含量可以间接表明机体组织的过氧化程度,反映肝脏细胞损伤情况[27]。本研究表明,较高浓度的SCGP对CCl4导致的小鼠急性肝损伤具有明显的减轻作用。

图2 各组小鼠肝组织切片对比 (H.E,×100)Fig.2 Histopathological comparison of liver in mice in
various groups(H.E,×100)
注:A为对照组;B为CCl4模型组;C为药物组;D为SCGP低剂量组;E为SCGP中剂量组;F为SCGP高剂量组
Note: A, control; B, CCl4control; C, drug group; D, low SCGP group;E, mid-SCGP group;F,high SCGP group
同时,根据SCGP肝损伤生化指标结果,对比之前Shi等[7]等研究的牡蛎多糖对CCl4致小鼠急性肝损伤的保肝试验结果,发现经硫酸酯化的牡蛎多糖的保肝能力得到了提升。经过SCGP灌胃的小鼠ALT、MDA指标可分别降低31%~74%和24%~59%,而灌胃牡蛎多糖两指标只能降低12%~17%和6%~11%[7],并且灌胃SCGP后AST和SOD指标均能恢复至接近正常水平,表明经过硫酸酯化后牡蛎多糖的保肝能力确实得到了提升。
4 结论
本研究中用牡蛎多糖通过硫酸酯化制备得到SCGP,并用其对由CCl4致急性肝损伤小鼠进行了灌胃试验,研究了SCGP对CCl4导致小鼠急性肝损伤的保护作用。结果表明,SCGP低、中、高剂量组可显著降低血清中 ALT、AST活性 (P<0.05),明显降低肝组织中MDA含量 (P<0.05),SCGP高剂量组可显著提高肝组织中SOD活性(P<0.05)。肝组织切片观察,SCGP组能减轻肝细胞损伤状况。本研究表明,SCGP能有效保护受损的肝组织,减轻CCl4对小鼠肝组织的急性损伤。
参考文献:
[1] 徐静.牡蛎提取物的降血糖活性研究[D].济南:山东大学,2005.
[2] Wang Li,Li Xiaoxuan,Chen Zhengxing.Sulfated modification of the polysaccharides obtained from defatted rice bran and their antitumor activities[J].International Journal of Biological Macromolecules,2009,44(2):211-214.
[3] Wang Junlong,Niu Shengfan,Zhao Baotang,et al.Catalytic synthesis of sulfated polysaccharides.Ⅱ:comparative studies of solution conformation and antioxidant activities[J].Carbohydrate Polymers,2014,107(17):221-231.
[4] Ji Chenfeng,Ji Yubin,Meng Deyou.Sulfated modification and antitumor activity of laminarin[J].Experimental and Therapeutic Medicine,2013,6(5):1259-1264.
[5] Ghosh T,Chattopadhyay K,Marschall M,et al.Focus on antivirally active sulfated polysaccharides:from structure-activity analysis to clinical evaluation[J].Glycobiology,2009,19(1):2-15.
[6] 曲敏,田丽冉,佟长青,等.大鲵低聚糖肽对四氯化碳致小鼠急性肝损伤的保护作用[J].食品工业科技,2013,34(14):350-352,369.
[7] Shi Xuan, Ma Huihui, Tong Changqing, et al.Hepatoprotectiveeffect of a polysaccharide from Crassostrea gigas on acute and chronic models of liver injury[J].International Journal of Biological Macromolecules,2015,78:142-148.
[8] 侯丽,汪秋宽,何云海,等.牡蛎多糖提取及其对小鼠急性酒精肝损伤的保护作用[J].食品工业科技,2014,35(22):356-358,370.
[9] Staub A M.Removal of proteins:sevag method[M]//Whistler R L.Methods in Carbohydrate Chemistry.New York, USA:Academic Press, Inc,1965:5-6.
[10] DuBois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Anal Chem,1956,28(3):350-356.
[11] 张龙翔,张庭芳,李令媛.生化实验方法和技术[M].2版.北京:高等教育出版社,1997.
[12] Strydom D J.Chromatographic separation of 1-phenyl-3-methyl-5-pyrazolone-derivatized neutral,acidic and basic aldoses[J].Journal of Chromatography A,1994,678(1):17-23.
[13] 赵冠华,佟长青,李伟,等.硫酸酯化牡蛎多糖对3种肿瘤细胞抑制及凋亡的影响[J].食品工业科技,2017,38(13):302-306.
[14] Yang Jingfeng,Zhu Beiwei,Zheng Jie,et al.Stimulation of lymphocyte proliferation by oyster glycogen sulfated at C-6 position[J].Carbohydrate Polymers,2013,94(1):301-308.
[15] 郭国丽,陈悦,佟长青,等.水溶性黑木耳根多糖对四氯化碳所致小鼠肝损伤的保护作用[J].食品工业科技,2015,36(24):341-344.
[16] Kuriakose G C,Kurup M G.Antioxidant and antihepatotoxic effect of Spirulina laxissima against carbon tetrachloride induced hepatotoxicity in rats[J].Food & Function,2011,2(3-4):190-196.
[17] Tomasi A,Albano E,Banni S,et al.Free-radical metabolism of carbon tetrachloride in rat liver mitochondria.A study of the mechanism of activation[J].Biochemical Journal,1987,246(2):313-317.
[18] 滕杨,谷娜,罗时旋,等.山药硒多糖对CCl4诱导小鼠急性肝损伤的保护作用[J].食品工业科技,2015,36(15):362-364.
[19] 王睿,孙鹏,赵欣.虫茶粗多糖对四氯化碳诱导小鼠肝损伤预防效果研究[J].现代食品科技,2015,31(5):6-11.
[20] 夏娜,陈义磊,陶海燕,等.药桑多糖对四氯化碳所致大鼠肝损伤的保护作用[J].食品科学,2015,36(13):247-251.
[21] Zeng Biyu,Su Minghua,Chen Qingxi,et al.Protective effect of a polysaccharide from Anoectochilus roxburghii against carbon tetrachloride-induced acute liver injury in mice[J].Journal of Ethnopharmacology,2017,200:124-135.
[22] 耿广琴,杨志军,杨秀娟,等.黄芩水煎液对CCl4肝损伤小鼠肝线粒体的影响[J].中国中医药科技,2015,22(6):641-643.
[23] 高峰,赵龙凤.干扰素联合薄芝糖肽治疗慢性乙型肝炎30例观察[J].医学信息,2011,24(1):214.
[24] 杨修仕,周闲容,王丽君 ,等.西洋参多糖的超滤分离及其免疫增强活性研究[J].食品工业科技,2014,35(5):49-52,57.
[25] Comporti M.Lipid peroxidation and cellular damage in toxic liver injury[J].Lab Invest,1985,53(6):599-623.
[26] 王吉桥,樊莹莹,徐振祥,等.饲料中β-胡萝卜素和虾青素添加量对仿刺参幼参生长及抗氧化能力的影响[J].大连海洋大学学报,2012,27(3):215-220.
[27] 栾学斌,王荻,刘红柏.恩诺沙星诱导施氏鲟药物性肝损伤模型的建立及复方中草药保肝作用研究[J].大连海洋大学学报,2017,32(1):13-19.