表1 两种药物的质量浓度
Tab.1 Test concentrations of two drugs
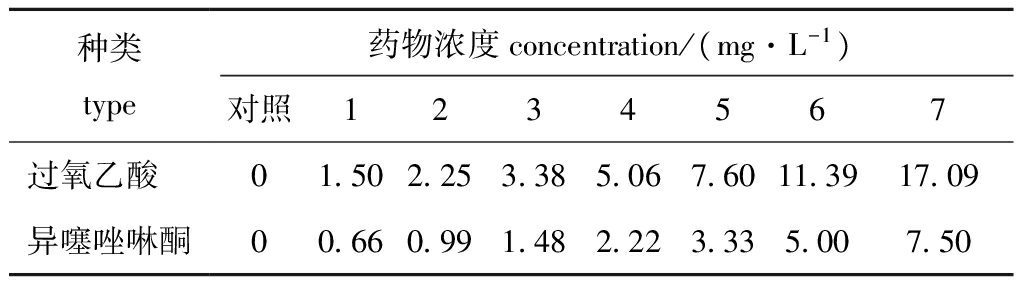
种类type药物浓度concentration/(mg·L-1)对照1234567过氧乙酸 异噻唑啉酮001 500 662 250 993 381 485 062 227 603 3311 395 0017 097 50
摘要:为寻找一种环保、高效、安全的抑藻产品,并保证用药安全,利用过氧乙酸(PAA)和异噻唑啉酮(Isothiazolone)配伍对黄丝藻Tribonema sp.进行了藻华抑制效果的研究,采用静态生物毒性试验的方法,研究了配伍用药对池塘中南美白对虾仔虾(0.043 5 g±0.000 8 g)和幼虾(2.576 8 g±0.024 0 g)的毒性。结果表明:过氧乙酸和异噻唑啉酮配伍时具有协同作用,可以提高抑藻效果,过氧乙酸和异噻唑啉酮质量浓度比为1.00 mg/L∶0.60 mg/L(配比5∶3)时除藻效果最优,96 h时对黄丝藻的抑制率可达97.40%,协同指数为0.14,对黄丝藻超氧化物歧化酶(SOD)和过氧化氢酶(CAT)具有先诱导后抑制的效果,可使丙二醛(MDA)大量积累;过氧乙酸和异噻唑啉酮配伍对南美白对虾仔虾和幼虾的安全质量浓度比分别为0.21 mg/L∶0.12 mg/L和1.17 mg/L∶0.70 mg/L。研究表明,过氧乙酸与异噻唑啉酮配伍对池塘中的黄丝藻藻华具有良好的抑制效果,但在仔虾养殖阶段要谨慎使用,避免产生药害。
关键词:过氧乙酸;异噻唑啉酮;黄丝藻藻华;南美白对虾;抗氧化酶
近年来,随着水产养殖密度的提高和生活污水的大量排放,水体富营养化程度日益加剧,并由此引发了一系列生态环境问题[1]。如丝状藻藻华大量暴发,其在稻田养虾、种草养蟹、养鱼池塘[2]和人工景观[3]等水体均有发生。黄丝藻Tribonema sp.是形成丝状藻藻华最常见的种类之一,在春、秋季大量繁殖,常因腐烂而影响水质,从而限制了养殖对象的正常生长和活动,为养殖生产带来了一定程度的困扰,特别在虾蟹养殖中表现尤为突出[2,4]。目前,生产上常使用铜制剂来控制藻华,有研究指出,使用硫酸铜浓度达到2.40 mg/L时,才能有效抑杀黄丝藻[2],在此过程中,不仅药物用量大,而且对环境二次污染严重。因此,亟待开发出绿色环保高效的抑藻产品。
过氧乙酸(Peracetic acid,PAA)别名过醋酸、过氧化乙酸,是一种强氧化性有机酸[5-6],具有易降解、无残留、对水体不会造成二次污染的特点[7-8]。有研究指出,过氧乙酸对小球藻Chlorella vulgaris和黄丝藻均具有较好的抑杀效果[6,9],有望开发成绿色的除藻剂,但在实际应用过程中用药量较大,易造成药害。异噻唑啉酮(Isothiazolone)作为一种广谱杀生剂,对细菌、真菌和藻类均有较强的杀灭能力,具有高效、低毒、在水中易降解等特点[10-11]。本研究中,利用过氧乙酸和异噻唑啉酮绿色环保的抑藻特性,控制和去除黄丝藻藻华,为提高抑藻效率,减少用药量,研究了配伍用药的抑藻效果;并为确保用药安全,进一步研究了配伍用药对水体中两种规格南美白对虾Litopenaeus vannamei的毒性,以期在实现安全用药的前提下,提高除藻效率,并为控制丝状藻藻华药物的选择提供参考。
1.1 材料
试验用黄丝藻藻华和南美白对虾均取自上海海洋大学滨海养殖基地的南美白对虾养殖池塘。
过氧乙酸(15%)由索尔维有限公司提供;异噻唑啉酮(14%)购自上海三博水化学有限公司;丙酮(分析纯)和碳酸镁(分析纯)均购自国药集团化学试剂有限公司;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)和考马斯亮蓝蛋白试剂盒均购自南京建成生物工程研究所。
1.2 方法
1.2.1 培养条件 黄丝藻选取颜色鲜亮翠绿的藻丝体,分离纯化后在光照培养箱中利用BG11培养基,在光照强度为2000 lx、光暗比为12 h∶12 h、温度为22 ℃条件下充气培养。从每组取0.50 g的黄丝藻藻丝体置于250 mL透明锥形瓶中,加入BG11培养基至250 mL进行试验。
选取体表干净、健康活力的南美白对虾个体,在试验室中暂养备用,仔虾和幼虾的体质量分别为(0.043 5±0.000 8)、(2.576 8±0.024 0) g。养殖用水取自上海海洋大学滨海养殖基地南美白对虾养殖池塘,水温为(22±1) ℃,pH为(7.40±0.10),溶解氧为(5.00±0.30) mg/L,总氨氮为(0.03±0.01) mg/L。试验前2 d停食。从每组取相同规格的南美白对虾20尾于25 cm×30 cm×30 cm的玻璃缸中进行试验,并加入黄丝藻藻华1.0 g以模仿池塘环境。
1.2.2 单一药物对黄丝藻的抑制试验 根据预试验结果,按等对数间距设定药物的浓度梯度,每种药物设7个浓度组和1个空白对照组,记为1~7组和对照组(表1),每组设3个重复,试验周期为96 h,测定每组叶绿素a总量和药物对黄丝藻的抑制率。
表1 两种药物的质量浓度
Tab.1 Test concentrations of two drugs

种类type药物浓度concentration/(mg·L-1)对照1234567过氧乙酸 异噻唑啉酮001 500 662 250 993 381 485 062 227 603 3311 395 0017 097 50
1.2.3 配伍用药对黄丝藻的抑制试验 根据单一药物抑制效果和预试验结果,设定过氧乙酸(1.40、1.20、1.00 mg/L)和异噻唑啉酮(0.60、0.50、0.40 mg/L)两种药物配伍浓度比例,并设置空白对照组,每组设3个重复,试验周期为96 h,测定每组叶绿素a总量、药物对黄丝藻的抑制率和协同指数,确定最适配伍浓度。
1.2.4 配伍用药对黄丝藻藻丝体抗氧化酶活性和脂质过氧化程度的影响 通过定量分析黄丝藻藻丝体的SOD、CAT活性和MDA含量来评价抗氧化酶活性和脂质过氧化程度。根据确定的最适药物配伍浓度对黄丝藻藻丝体进行胁迫,并设置空白对照组,每组设3个重复,试验周期为96 h,每隔24 h测定1次。
1.2.5 配伍用药对南美白对虾的毒性试验 根据确定的最适药物配伍浓度及预试验结果,按等对数间距设定过氧乙酸和异噻唑啉酮配伍浓度。其中,仔虾毒性试验中,氧乙酸和异噻唑啉酮的6个配伍浓度(mg/L∶mg/L)分别为0.67∶0.40、1.00∶0.60、1.50∶0.90、2.25∶1.35、3.38∶2.03、5.07∶3.35;幼虾毒性试验中,两种药物的6个配伍浓度(mg/L∶mg/L)分别为2.25∶1.35、3.38∶2.03、5.07∶3.05、7.61∶4.58、11.42∶6.87、17.12∶10.31。采用静态生物毒性试验方法[12]分别对南美白对虾仔虾和幼虾进行毒性试验,并设置空白对照组,每组设3个重复,每24 h更换1次药液,前24 h连续观察对虾的活动情况,试验过程中记录24、48、72、96 h对虾的死亡率,及时捞出死亡个体,死亡标准为玻璃棒轻触虾体腹部不产生应激反应[13]。
1.2.6 抑制率及协同指数的测定与计算 采用叶绿素a总量评价对黄丝藻的抑制效果[14],试验过程中用滤布对黄丝藻进行过滤,离心后称重,采用丙酮法测定叶绿素a含量[15],以质量浓度的对数(x)和抑制率的机率值(y)计算毒力回归方程及半数有效浓度(EC50)[16]。黄丝藻藻丝体形态结构的变化通过显微镜进行观察。各指标计算公式分别为
叶绿素a总量(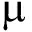 g)=黄丝藻质量(g)×黄丝藻叶绿素a含量(
g)=黄丝藻质量(g)×黄丝藻叶绿素a含量(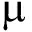 g/g),
g/g),
(1)
抑制率=(对照组叶绿素a总量-试验组叶绿素a总量)/对照组叶绿素a总量×100%,
(2)
协同指数SI=Ca/CA+Cb/CB。
(3)
其中:SI[10]为配伍用药效果;Ca 和Cb 分别为药物A和B配伍达到某一抑制率时药物A和B 的浓度;CA 和CB 分别为药物 A和B 单独使用时达到相同抑制率时的浓度;SI>1时表示没有协同效应, SI<1时表示有协同效应,SI=1时表示两者只有加和作用[17]。
1.2.7 SOD、CAT活性和MDA含量的测定 参照实验室已有的试验方法[2],每隔24 h取0.10 g黄丝藻藻丝体,加入预冷的磷酸缓冲溶液(pH 7.8),在冰浴条件下,用超声波细胞粉碎仪进行破碎,在4 ℃下以8000 r/min 离心20 min,收集上清液,参照试剂盒说明书测定SOD、CAT活性和MDA含量,24 h内测定完毕。
1.2.8 半数致死浓度和安全浓度的计算 采用寇氏法(Karber)[13]计算药物对南美白对虾的半数致死浓度(LC50)和安全浓度(SC),计算公式为
LC50=Xm-d(∑P-0.5),
(4)
SC=![]() 。
。
(5)
其中:Xm为最大剂量的常用对数;d为相邻剂量组比值的常用对数;P为死亡率;∑P为各组死亡率之和。
1.3 数据处理
试验数据利用SPSS 20.0和Excel 2000软件处理,并进行单因素方差分析(One-way ANOVA),采用Duncan’s法进行多重比较,显著性水平设为0.05[13]。
2.1 藻丝体形态结构变化
试验结束时,利用显微镜对试验组藻丝体进行观察,可以发现藻丝体的形态结构均发生了较大的变化(图1),高浓度试验组锥形瓶底部均出现白色絮状沉淀(图2)。这说明两种药物对黄丝藻均有一定的抑制效果。由图1可见,黄丝藻藻丝体细胞壁结构完整,均未遭到破坏,而经药物胁迫的试验组藻丝体叶绿素被破坏,带状结构减少,细胞结构出现自溶现象,叶绿体由绿变白,且配伍用药对藻细胞结构破坏最为严重,细胞结构基本消失。

注:A为空白对照组藻丝体;B为过氧乙酸(17.09 mg/L)试验组藻丝体;C为异噻唑啉酮(7.50 mg/L)试验组藻丝体;D为配伍比为(过氧乙酸∶异噻唑啉酮)1.00 mg/L∶0.60 mg/L的试验组藻丝体
Note:A, the blank control group;B, the test group of peracetic acid(17.09 mg/L);C, the test group of isothiazolinone(7.50 mg/L);D, the test group of the ratio of peracetic acid to isothiazolinone=1.00 mg/L∶0.60 mg/L
图1 96 h后黄丝藻藻丝体显微结构图(×40)
Fig.1 Microscopic structure of alga Tribonema sp.exposed to the drugs for 96 h(×40)

注:A为过氧乙酸试验组藻丝体,1~7组浓度分别为1.50、2.25、3.38、5.06、7.06、11.39、17.09 mg/L;B为异噻唑啉酮试验组藻丝体,1~7组浓度分别为0.66、0.99、1.48、2.22、3.33、5.00、7.50 mg/L
Note:A, the test group of peracetic acid,1-7, the concentrations of 1.50, 2.25, 3.38, 5.06, 7.06, 11.39 mg/L and 17.09 mg/L, respectively; B, the test group of isothiazolinone, 1-7, the concentrations of 0.66, 0.99, 1.48, 2.22, 3.33, 5.00 mg/L and 7.50 mg/L, respectively
图2 96 h后黄丝藻藻丝体外部形态图
Fig.2 External morphology of the Tribonema sp. exposed to the drugs for 96 h
2.2 过氧乙酸对黄丝藻的抑制效果
由图3可知:过氧乙酸对黄丝藻的抑制率与其浓度呈正相关;当过氧乙酸浓度达到3.38 mg/L时,其对黄丝藻的抑制率为57.5%,产生了一定的抑制效果,随着过氧乙酸浓度的继续升高,抑制效果越好;但当浓度达到7.60 mg/L时,抑制率变化幅度变小,并趋于稳定。通过毒力回归方程(表2),可计算出过氧乙酸对黄丝藻的半数有效浓度(EC50)为2.81 mg/L。
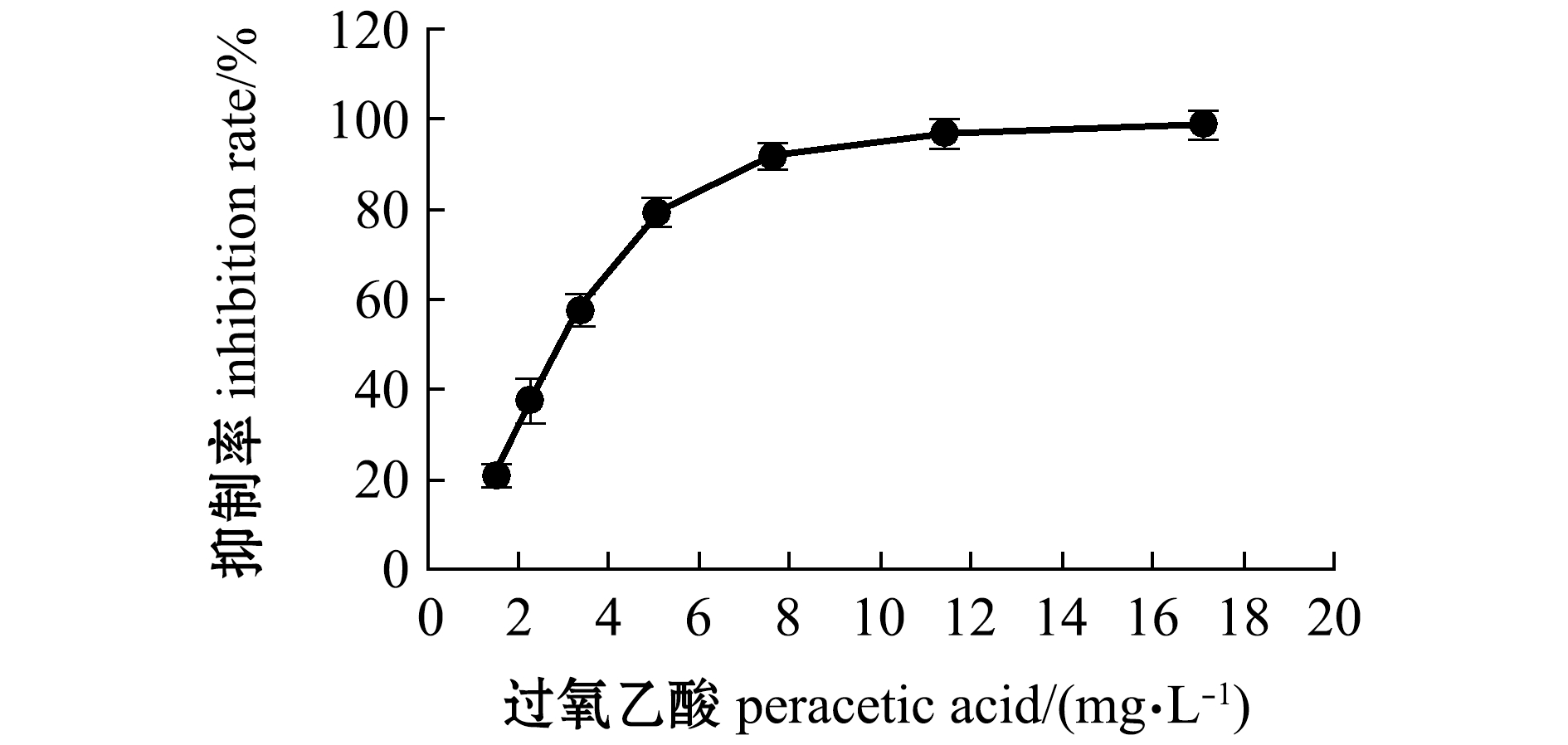
图3 过氧乙酸对藻体的抑制效果
Fig.3 Inhibitory effect of peracetic acid on alga Tribonema sp.
2.3 异噻唑啉酮对黄丝藻的抑制效果
由图4可知:异噻唑啉酮对黄丝藻具有明显的抑制效果,随着异噻唑啉酮浓度的升高,其对黄丝藻的抑制率也随之升高;当异噻唑啉酮浓度达到3.33 mg/L时,其对黄丝藻的抑制率达到82.5%,具有较好的抑藻效果,但随着浓度的继续升高,抑制率变化幅度不大;当异噻唑啉酮浓度低于0.99 mg/L时,抑制率低于50%,抑藻效果不明显。通过毒力回归方程(表2),可计算出异噻唑啉酮对黄丝藻的半数有效浓度(EC50)为1.20 mg/L。

图4 异噻唑啉酮对藻体的抑制效果
Fig.4 Inhibitory effect of isothiazolone on alga Tribonema sp.
表2 两种药物抑制黄丝藻的半数有效浓度
Tab.2 The 50% effective concentration(EC50) of two drugs on alga Tribonema sp.
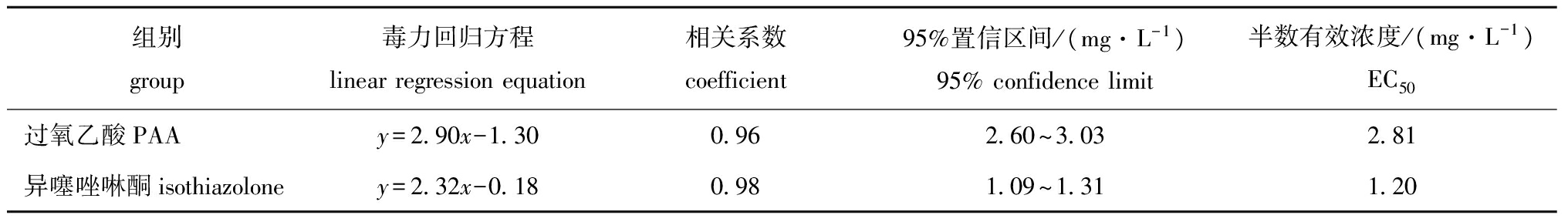
组别group毒力回归方程linearregressionequation相关系数coefficient95%置信区间/(mg·L-1)95%confidencelimit半数有效浓度/(mg·L-1)EC50过氧乙酸PAA异噻唑啉酮isothiazoloney=2 90x-1 30y=2 32x-0 180 960 982 60~3 031 09~1 312 811 20
2.4 过氧乙酸和异噻唑啉酮配伍用药最适配比浓度的确定
由表3可知:过氧乙酸和异噻唑啉酮配伍后对黄丝藻表现出协同抑制效果,但在不同配伍浓度条件下,抑藻效果存在差异;当过氧乙酸和异噻唑啉酮的配伍浓度为1.40 mg/L∶0.50 mg/L时,其对黄丝藻的抑制率为78.77%,显著低于其他配伍浓度组(P<0.05),协同指数为0.46,显著高于其他配伍浓度组(P<0.05);当过氧乙酸和异噻唑啉酮的配伍浓度分别为1.40 mg/L∶0.60 mg/L、1.00 mg/L∶0.60 mg/L和1.20 mg/L∶0.50 mg/L时,对黄丝藻的抑制率较高,分别为96.94%、97.40%和94.28%,抑藻效果较好,同时,协同指数较低,分别为0.19、0.14和0.21,协同效果较好。综合分析配伍后的抑藻效果、协同效果和药物使用量,将过氧乙酸和异噻唑啉酮配伍浓度1.00 mg/L∶0.60 mg/L确定为抑藻的最适配比。
表3 过氧乙酸和异噻唑啉酮复配对黄丝藻的作用效果
Tab.3 Effect of PAA and isothiazolone in combination on alga Tribonema sp.
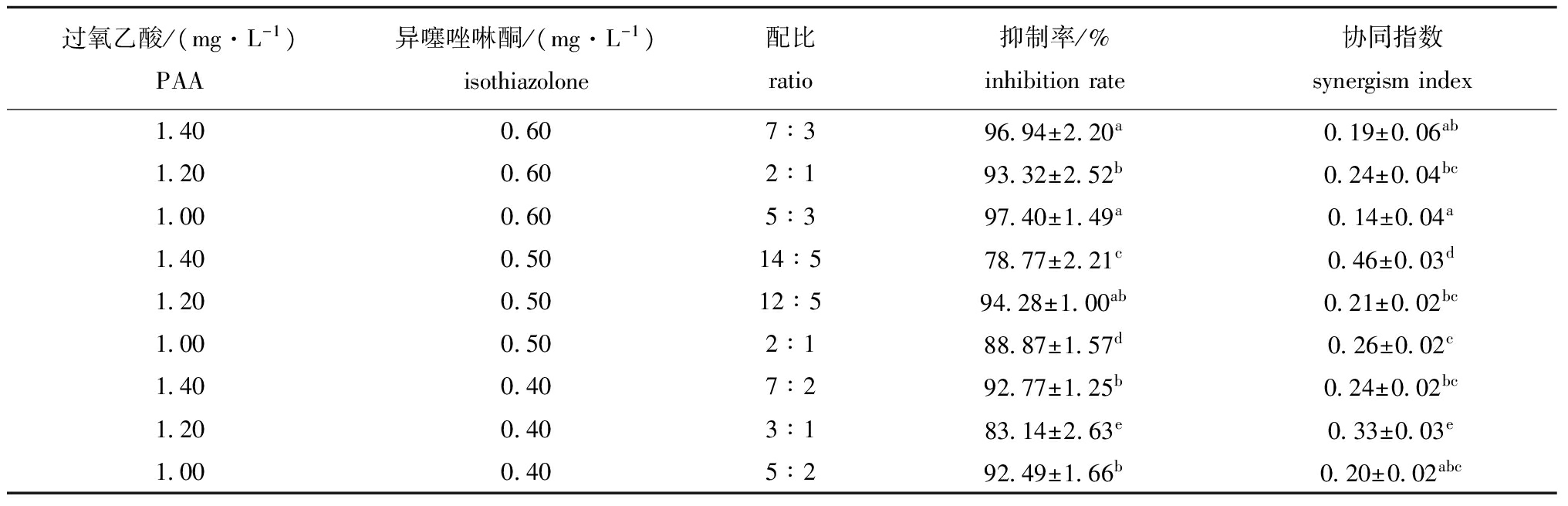
过氧乙酸/(mg·L-1)PAA异噻唑啉酮/(mg·L-1)isothiazolone配比ratio抑制率/%inhibitionrate协同指数synergismindex1 400 607∶396 94±2 20a0 19±0 06ab1 200 602∶193 32±2 52b0 24±0 04bc1 000 605∶397 40±1 49a0 14±0 04a1 400 5014∶578 77±2 21c0 46±0 03d1 200 5012∶594 28±1 00ab0 21±0 02bc1 000 502∶188 87±1 57d0 26±0 02c1 400 407∶292 77±1 25b0 24±0 02bc1 200 403∶183 14±2 63e0 33±0 03e1 000 405∶292 49±1 66b0 20±0 02abc
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences
2.5 过氧乙酸和异噻唑啉酮配伍用药对黄丝藻SOD、CAT活性和MDA含量的影响
在过氧乙酸和异噻唑啉酮最适配伍浓度1.00 mg/L∶0.60 mg/L胁迫下,测定了黄丝藻藻丝体的SOD、CAT活性和MDA含量。
2.5.1 配伍用药对SOD活性的影响 由图5可知:随着胁迫时间的延长,试验组黄丝藻SOD活性呈先增加后降低趋势,对照组变化趋势与试验组相似,但变化幅度较小;配伍用药胁迫48 h时,SOD活性升至最大,之后随着胁迫时间的延长,SOD活性开始逐渐下降;胁迫72 h以上时,试验组SOD活性已低于对照组,并有持续下降的趋势。
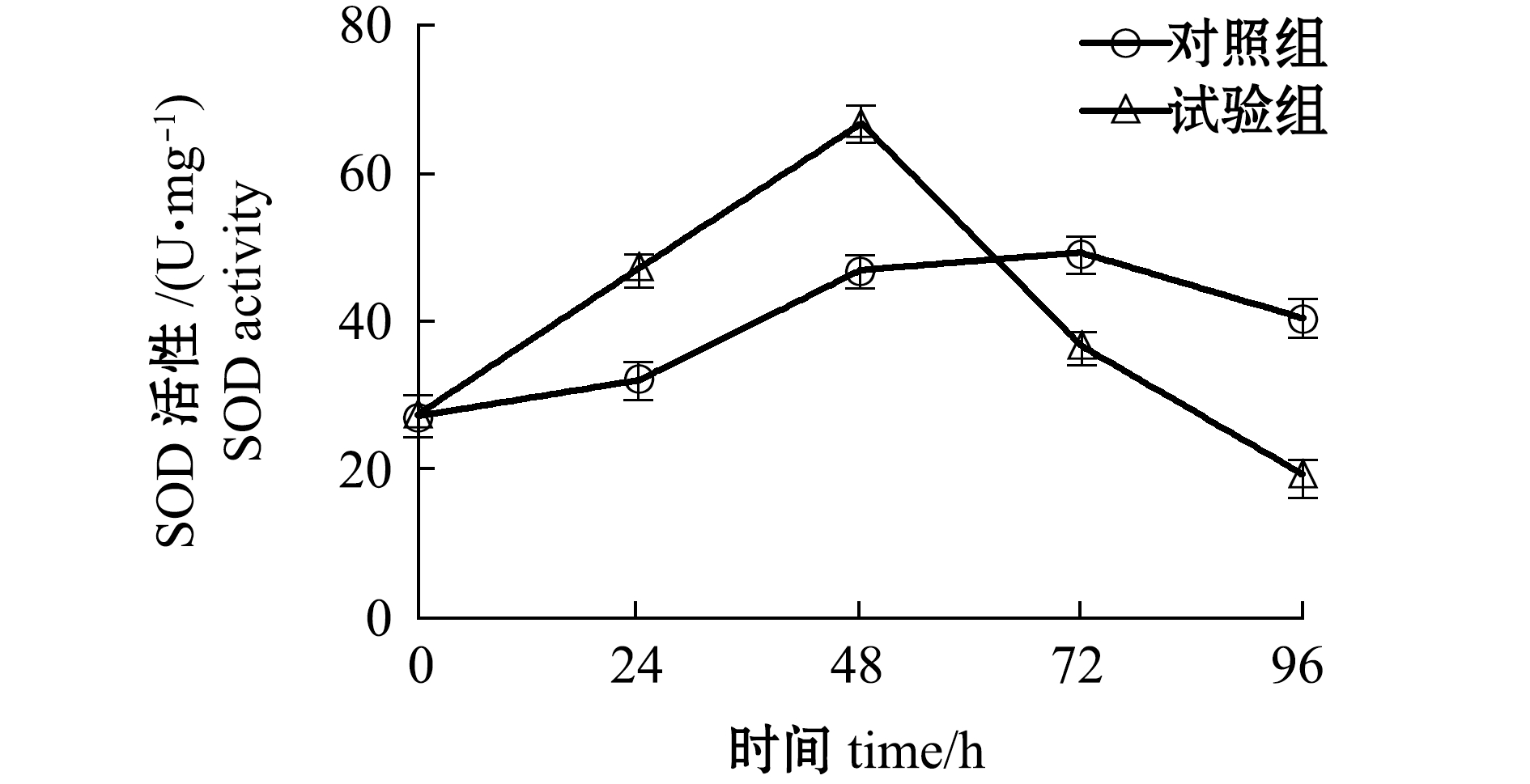
图5 配伍用药对黄丝藻SOD活性的影响
Fig.5 Effect of compound drugs on the SOD activity
2.5.2 配伍用药对CAT活性的影响 由图6可知:随着胁迫时间的延长,试验组黄丝藻CAT活性呈先增加后降低趋势,对照组变化趋势与试验组相似,但变化幅度较小,对照组黄丝藻在24 h时CAT活性升至最大;配伍用药胁迫48 h时,试验组黄藻丝CAT活性升至最大,随着胁迫时间的延长,CAT活性开始逐渐下降;胁迫96 h时,试验组CAT活性已低于对照组,并有持续下降的趋势。
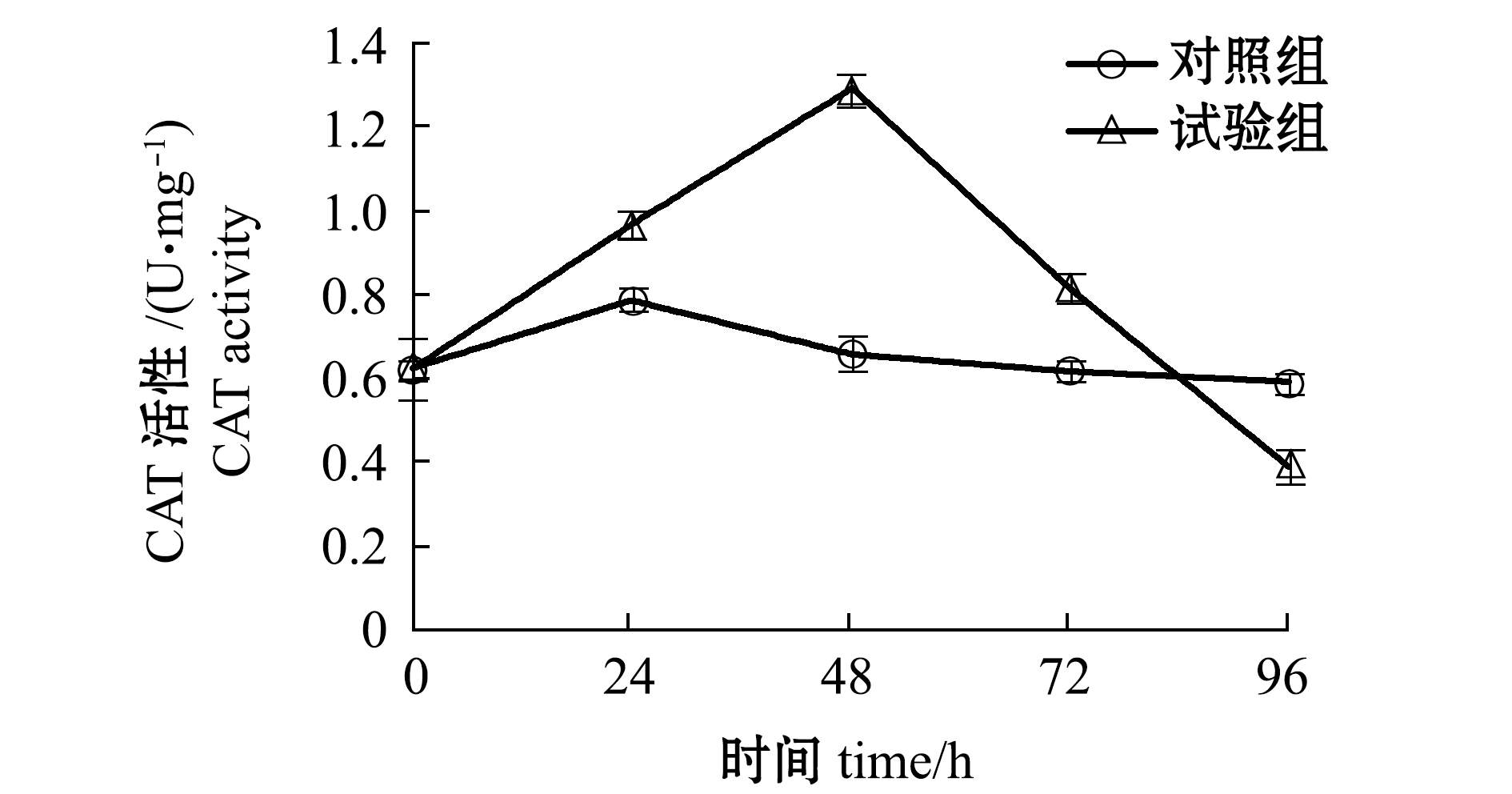
图6 配伍用药对黄丝藻CAT活性的影响
Fig.6 Effect of compound drugs on the CAT activity
2.5.3 配伍用药对MDA含量的影响 由图7可知,随着胁迫时间的延长,试验组黄丝藻MDA含量呈逐渐上升的趋势,对照组MDA含量变化则不明显。
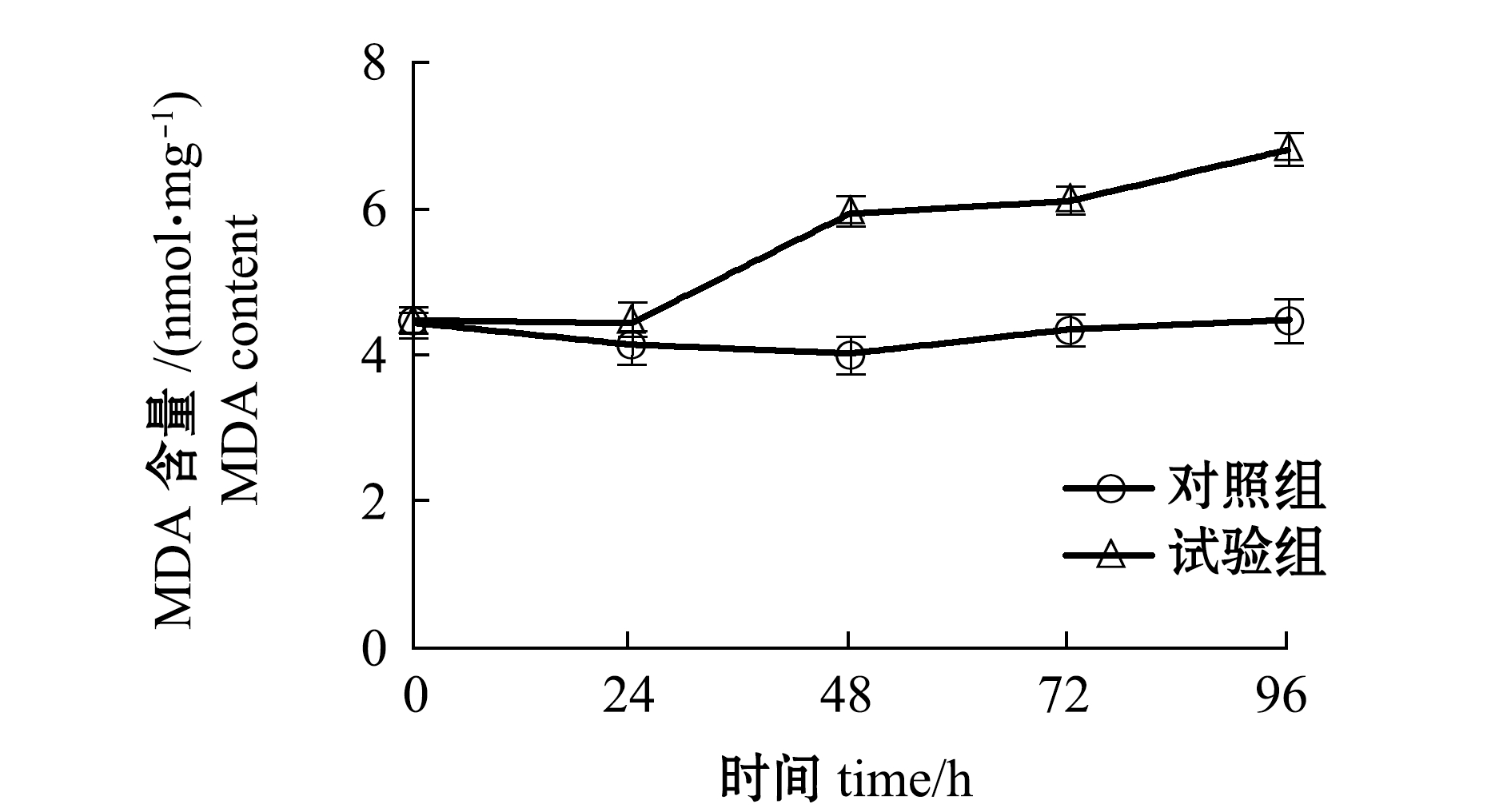
图7 配伍用药对黄丝藻MDA含量的影响
Fig.7 Effect of compound drugs on the MDA contents
2.6 过氧乙酸和异噻唑啉酮配伍用药对南美白对虾的毒性影响
在不同配伍用药浓度对仔虾毒性试验中,通过前24 h的连续观察发现,南美白对虾仔虾受胁迫时开始急躁狂游,最后沉底死亡。由表4可知,当过氧乙酸和异噻唑啉酮以1.00 mg/L∶0.60 mg/L的浓度配伍时,胁迫24 h时仔虾开始出现死亡,当浓度配伍增加到3.38 mg/L∶2.03 mg/L时,胁迫48 h时仔虾全部死亡。经统计分析,过氧乙酸和异噻唑啉酮配伍用药对仔虾的24 h LC50、48 h LC50和安全浓度分别为1.86 mg/L∶1.11 mg/L、1.35 mg/L∶0.80 mg/L和0.21 mg/L∶0.12 mg/L。
由表5可知,在不同配伍用药浓度对幼虾的毒性试验中,当过氧乙酸和异噻唑啉酮以3.38 mg/L∶2.03 mg/L的浓度配伍时,胁迫24 h时幼虾开始出现死亡,当浓度配伍增加到11.42 mg/L∶6.87 mg/L时,胁迫48 h时幼虾全部死亡,经统计分析,过氧乙酸和异噻唑啉酮配伍用药对幼虾的24 h LC50、48 h LC50和安全浓度分别为5.62 mg/L∶3.38 mg/L、4.97 mg/L∶2.99 mg/L和1.17 mg/L∶0.70 mg/L。
表4 过氧乙酸和异噻唑啉酮配伍对南美白对虾仔虾的毒性试验结果
Tab.4 Acute toxicity test of PAA and isothiazolone in combination on the post-larval Pacific white leg shrimp Litopenaeus vannamei
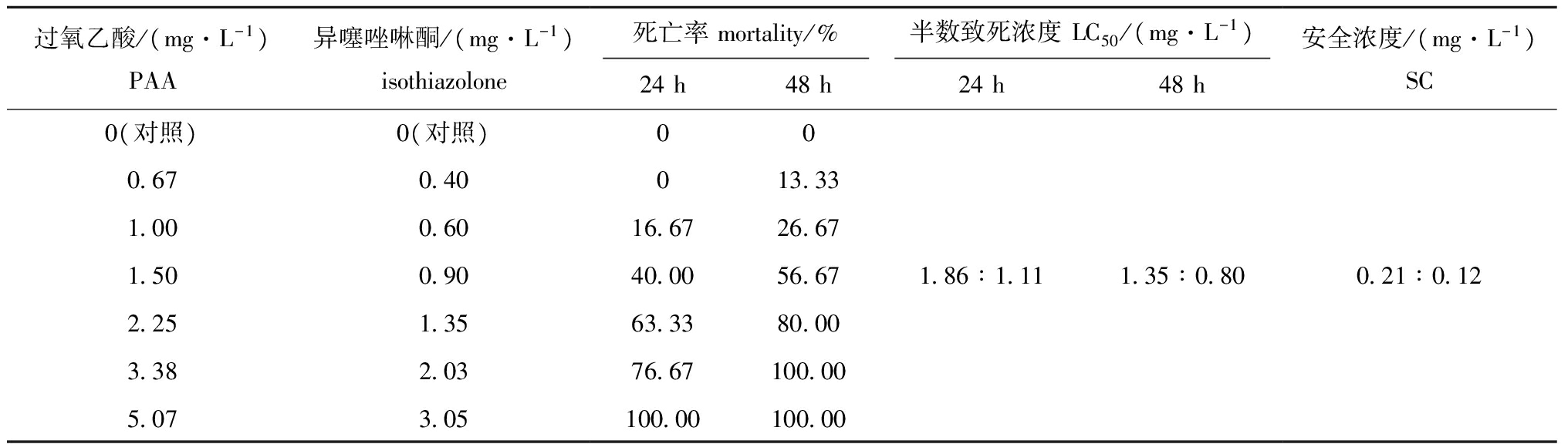
过氧乙酸/(mg·L-1)PAA异噻唑啉酮/(mg·L-1)isothiazolone死亡率mortality/%半数致死浓度LC50/(mg·L-1)24h48h24h48h安全浓度/(mg·L-1)SC0(对照)0 671 001 502 253 385 070(对照)0 400 600 901 352 033 050016 6740 0063 3376 67100 00013 3326 6756 6780 00100 00100 001 86∶1 111 35∶0 800 21∶0 12
表5 异噻唑啉酮和过氧乙酸配伍对南美白对虾幼虾的毒性试验结果
Tab.5 Acute toxicity test of PAA and isothiazolone in combination on the juvenile Pacific white leg shrimp Litopenaeus vannamei
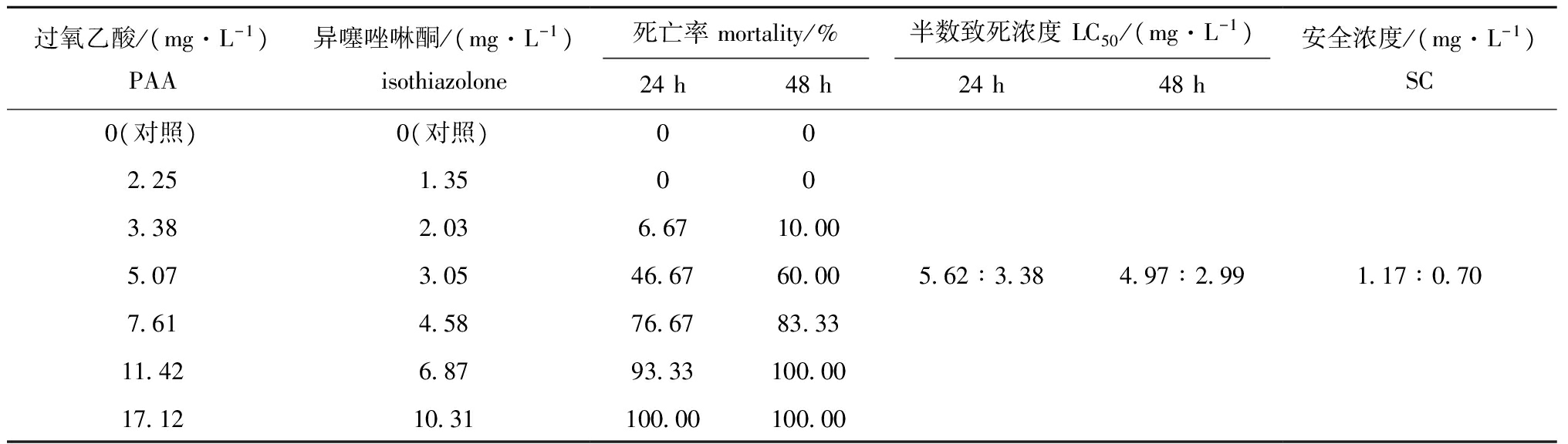
过氧乙酸/(mg·L-1)PAA异噻唑啉酮/(mg·L-1)isothiazolone死亡率mortality/%半数致死浓度LC50/(mg·L-1)24h48h24h48h安全浓度/(mg·L-1)SC0(对照)2 253 385 077 6111 4217 120(对照)1 352 033 054 586 8710 31006 6746 6776 6793 33100 000010 0060 0083 33100 00100 005 62∶3 384 97∶2 991 17∶0 70
3.1 过氧乙酸对黄丝藻的抑制作用
过氧乙酸作为一种强氧化性酸,既能表现出强氧化性又有极强的酸性。Axelesson等[18]研究表明,水体中氢离子达到一定浓度后对藻体内部结构会有直接的破坏作用。本试验结果表明,浓度为17.09 mg/L的过氧乙酸在96 h内可破坏藻丝体内部结构。推测其抑藻机理可能是酸性作用的结果。李静会等[19]研究表明,当乙酸浓度达到26.87 mg/L时,可以有效治理蓝藻水华,王爱卿等[20]研究指出,利用柠檬酸调节水体pH值可间接有效控制黄丝藻藻华,这可能与本试验中过氧乙酸的抑藻机理相似,均是利用酸性来抑制藻类生长。其作用机理存在两种推测:其一,叶绿体内pH值的降低,阻碍了卡尔文循环,抑制了藻体的光合作用,从而达到抑藻效果[21];其二,碳酸酐酶活性受到酸性破坏,阻碍了CO2 的浓缩机制,从而达到抑藻效果[22]。陈孝华等[2]研究表明,过氧乙酸对黄丝藻中的SOD、CAT和MDA具有低浓度诱导和高浓度抑制的效果。这与本试验结果相似,本试验中随着胁迫时间的延长,过氧乙酸对SOD和CAT具有先促进后抑制的效果。SOD和CAT在短时间内活性增加以消除氧化胁迫,随着时间的延长,藻丝体内酶系统被破坏,SOD和CAT活性下降,MDA大量积累,达到抑藻的效果。 因此,推测过氧乙酸利用酸性和强氧化性起到了抑藻效果。
3.2 异噻唑啉酮对黄丝藻的抑制作用
异噻唑啉酮作为一种亲电子型杀生剂,对细胞膜和细胞壁的穿透性极强,能够抑制细胞中电子的转移,从而阻碍呼吸链中能量代谢,引起细胞死亡[20,23]。这与本试验结果一致,并未对细胞壁膜造成损伤。陈孝华等[2]研究表明,异噻唑啉酮对黄丝藻的96 h EC50为1.20 mg/L,48 h EC50为9.858 mg/L,这与本试验结果差异较大,这可能与试验设计和培养条件不同有关。异噻唑啉酮对球形棕囊藻Phaeoecystis globosa的72 h EC50为0.54 mg/L[11],对三角褐指藻Phaeodactylum triconutum的96 h EC50为1.95 mg/L[24],对于海水中生长的藻类如塔胞藻Pyramidomonas sp.、青岛大扁藻Platymonas hegolandica、叉鞭金藻Dicrateria inornata和新月菱形藻Nitzschiaceae closteriun等在2.40 mg/L条件下的抑制效果较好[25]。虽然不同藻类对异噻唑啉酮的耐受性存在差异,但是异噻唑啉酮在较低浓度条件下就能对常见藻类产生明显的抑制效果。由此可见,异噻唑啉酮是一种高效的抑藻药物。
3.3 过氧乙酸和异噻唑啉酮配伍用药对黄丝藻的抑制作用
本试验结果显示,过氧乙酸和异噻唑啉酮配伍时会产生显著的协同抑藻效果。江涛等[11]研究表明,利用新洁尔灭和异噻唑啉酮以1.3 mg/L∶0.3 mg/L配伍可有效杀灭球形棕囊藻,具有较强的协同抑藻效果的原因是异噻唑啉酮作为一种亲电子型杀生剂可快速聚集到藻细胞膜上,产生穿透作用,使新洁尔灭快速进入细胞内产生杀灭效果。洪爱华等[10,26]研究指出,利用碘伏和异噻唑啉酮以1.0 mg/L∶0.15 mg/L复配时,对球形棕囊藻具有较好的协同抑制效果,异噻唑啉酮可有效穿透藻细胞壁,协同碘伏增强抑藻效果。本试验结果表明,当过氧乙酸和异噻唑啉酮的浓度配比为1.00 mg/L∶0.60 mg/L时,对黄丝藻的协同抑制效果较好。基于两种药物的作用机理,推测当两种药物配伍使用时,异噻唑啉酮对藻细胞的细胞膜结构产生穿透作用,使过氧乙酸能顺利进入细胞膜内,利用酸性和强氧化性直接破坏细胞内的结构和酶系统,从而加强了抑藻的效果。
3.4 过氧乙酸和异噻唑啉酮配伍用药对SOD、CAT和MDA的影响
在外界氧化因子的作用下,植物体内可产生活性氧(ROS),从而对其产生氧化伤害[2],而植物体出于对自身的保护会诱导产生一系列抗氧化酶来清除过多的ROS。本研究中,随着药物胁迫时间的延长,SOD、CAT的活性均大幅提高,随后又开始降低,可能是在药物胁迫的短时间内,诱导黄丝藻产生SOD和CAT以抵御产生的ROS,但随着胁迫时间的延长,SOD和CAT活性下降至对照组水平以下,可能是黄丝藻在药物作用下开始死亡的结果。陈孝华等[2]研究表明,黄丝藻在异噻唑啉酮的胁迫作用下,SOD和CAT活性均呈现出低浓度诱导、高浓度抑制的现象;陆长梅等[27]研究表明,水绵Spirogyra sp.在渗透压变化和百草枯的胁迫作用下,SOD活性呈现出先升高后降低的变化,这些与本试验结果相似。MDA作为膜脂过氧化的重要产物,在本试验药物胁迫作用下一直呈上升趋势,说明黄丝藻在96 h试验过程中,膜脂过氧化程度不断加剧。王丽平等[28]研究表明,中肋骨条藻Skeletonema costatum和三角褐指藻Phaeodactylum tricornutum Bohlin在Cu2+胁迫作用下,MDA含量持续上升,与本试验结果相似。陈孝华等[2]研究表明,黄丝藻在Cu2+和异噻唑啉酮的胁迫作用下,MDA含量呈现先上升后下降的现象,与本试验结果不同,可能与药物种类和浓度设定有关。
3.5 过氧乙酸和异噻唑啉酮配伍用药对两种规格南美白对虾的毒性比较
本试验结果显示,南美白对虾仔虾的用药安全浓度小于幼虾的安全浓度,说明幼虾对药物具有较强的耐受能力,幼虾的体质量远大于仔虾,出现这种情况可能与对虾的规格和抵抗能力有关。李仁伟等[29]研究表明,南美白对虾各关键发育阶段对4种常见药物的敏感性依次为比双灵>硫酸铜>高锰酸钾>漂白粉,并且随着对虾规格的增大,对药物的抵抗能力也逐渐增强,这与本试验结果相似。还有报道指出,中华绒螯蟹耐苯扎溴铵毒性能力依次为幼蟹>Ⅲ期仔蟹>Ⅰ期仔蟹>河蟹大眼幼体,表明苯扎溴铵对中华绒螯蟹毒性大小与其个体大小成反比关系[30-31],在甲醛对中华绒螯蟹毒性的研究[32]中也得到了与本试验相似的结论。此结果可为用药范围提供参考。
过氧乙酸和异噻唑啉酮配伍使用时对黄丝藻的抑制具有明显的协同效果。可在短时间内诱导提高黄丝藻SOD和CAT活性,使MDA大量积累。随着药物胁迫时间的延长,脂质过氧化程度加剧,引起藻细胞死亡。当过氧乙酸和异噻唑啉酮的配伍浓度为1.00 mg/L∶0.60 mg/L时,协同抑藻效果最为显著,比起单一用药,大大减少了用药量,提高了抑藻的效率。
利用确定的最适配伍比例对水体中两种规格的南美白对虾进行毒性试验,结果表明,在仔虾阶段使用配伍药物抑藻可能引起对虾死亡,在幼虾阶段使用配伍药物抑藻比较安全。因此,在生产中应避免在仔虾阶段用药,以免产生药害。
此外,今后还可利用配伍药物对鱼、蟹等养殖生物进行毒性研究,为药物的推广和安全使用提供参考。
参考文献:
[1] 陈孝花,潘连德,张饮江.水中丝状藻类有害藻华的形成与对策[J].南方水产科学,2011,7(2):77-82.
[2] 陈孝花,王爱卿,潘连德,等.两种除藻剂对黄丝藻藻华叶绿素a含量和抗氧化酶活性的影响[J].广东农业科学,2014,41(18):136-140.
[3] Phillips J A.Drifting blooms of the endemic filamentous brown alga Hincksia sordida at Noosa on the subtropical east Australian coast[J].Marine Pollution Bulletin,2006,52(8):962-968.
[4] 钟恒,谢永泉,刘伟灵,等.衣藻与黄丝藻在硫酸铜污水中的富集效应[J].中山大学学报:自然科学版,1995,34(3):84-88.
[5] Wagner M,Brumelis D,Gehr R.Disinfection of waste water by hydrogen peroxide or peracetic acid:development of procedures for measurement of residual disinfectant and application to a physicochemically treated municipal effluent[J].Water Environment Research,2002,74(1):33-50.
[6] 张帅,潘连德,郑串.过氧乙酸对池塘水体的增氧抑菌抑藻效果研究[J].大连海洋大学学报,2016,31(6):651-657.
[7] Bounoure F,Fiquet H,Arnaud P.Comparison of hydrogen peroxide and peracetic acid as isolator sterilization agents in a hospital pharmacy[J].American Journal of Health-System Pharmacy,2006,63(5):451-455.
[8] Zanetti F,De Luca G,Sacchetti R,et al.Disinfection efficiency of peracetic acid (PAA):inactivation of coliphages and bacterial indicators in a municipal wastewater plant[J].Environmental Technology,2007,28(11):1265-1271.
[9] 王秀芹,孙万胜.消毒剂过氧乙酸及其在水产养殖业的应用探讨[J].天津水产,2003(1):36-38.
[10] 洪爱华,尹平河,赵玲,等.碘伏和异噻唑啉酮对球形棕囊藻去除的研究[J].应用生态学报,2003,14(7):1177-1180.
[11] 江涛,江天久,李鹏,等.湛江球形棕囊藻赤潮除藻试验[J].热带亚热带植物学报,2006,14(1):14-18.
[12] 李西雨,王德忠,潘连德,等.两种杀虫药物对黄颡鱼鱼苗的急性毒性试验及其临床应用效果[J].淡水渔业,2015,45(2):67-71,84.
[13] 徐滨,朱祥云,魏开金,等.四种稻田农药对克氏原螯虾的急性毒性研究[J].淡水渔业,2014,44(5):38-42.
[14] 魏朝辉,艾桃山,郑程鹏,等.36种药物对青苔的抑杀作用[J].淡水渔业,2015,45(2):79-84.
[15] 陈宇炜,高锡云.浮游植物叶绿素a含量测定方法的比较测定[J].湖泊科学,2000,12(2):185-188.
[16] 武怀恒,万鹏,黄民松.毒力回归计算方法及相应软件使用介绍[J].安徽农业科学,2014,42(27):9335-9338,9340.
[17] 赵晓蕾,杨德红,严莲荷,等.复配杀菌剂协同效应的研究[J].工业水处理,1999,19(6):31.
[18] Axelsson L,Mercado J,Figueroa F.Utilization of HC![]() at high pH by the brown macroalga Laminaria saccharina[J].European Journal of Phycology,2000,35(1):53-59.
at high pH by the brown macroalga Laminaria saccharina[J].European Journal of Phycology,2000,35(1):53-59.
[19] 李静会,高伟,张衡,等.除藻剂应急治理玄武湖蓝藻水华实验研究[J].环境污染与防治,2007,29(1):60-62.
[20] 王爱卿,杨仕豪,李西雨,等.柠檬酸调节水体酸碱度抑制黄丝藻藻华的研究[J].淡水渔业,2016,46(3):52-59.
[21] 程丽华,张林,陈欢林,等.微藻固定CO2研究进展[J].生物工程学报,2005,21(2):177-181.
[22] Satoh A,Kurano N,Miyachi S.Inhibition of photosynthesis by intracellular carbonic anhydrase in microalgae under excess concentrations of CO2[J].Photosynthesis Research,2001,68(3):215-224.
[23] 王磊,武绍峰,顾学斌.异噻唑啉酮类杀菌剂的应用研究[J].工业微生物,2015,45(5):60-64.
[24] 杨翠云,夏传海,刘苏静,等.异噻唑啉酮类化合物对三角褐指藻的抑制效应[J].中国环境科学,2011,31(8):1341-1346.
[25] 张硕慧,陈轩,公维民,等.异噻唑啉酮的灭藻效应及其生物毒性试验[J].海洋环境科学,2004,23(4):64-66.
[26] 洪爱华,尹平河,赵玲,等.碘伏和异噻唑啉酮灭杀球形棕囊藻机理的初步研究[J].暨南大学学报:自然科学版,2005,26(3):396-400.
[27] 陆长梅,吴国荣,陶明煊,等.渗透胁迫与百草枯对普通水绵SOD的影响[J].植物资源与环境,1999,8(2):13-17.
[28] 王丽平,郑丙辉,孟伟.重金属Cu对两种海洋微藻的毒性效应[J].海洋环境科学,2007,26(1):6-9.
[29] 李仁伟,王志铮,王海岳,等.几种常用药物对南美白对虾幼体关键发育阶段的毒性影响[J].浙江海洋学院学报:自然科学版,2002,21(4):344-347,356.
[30] 朱磊,陆宏达,余伟楠.蟹寄江氏伪钟虫Pseudovorticella jiangi防治药物的筛选[J].广东农业科学,2013,40(11):119-123.
[31] 余伟楠,陆宏达,朱磊,等.苯扎溴铵对几种淡水水生动物的急性毒性[J].广东农业科学,2014,41(15):111-115,120.
[32] 沈和定,蒋宏雷.甲醛对中华绒螯蟹各期溞状幼体及隐藻的急性毒性[J].上海水产大学学报,1998,7(1):25-32.
Abstract:The combined inhibition effects of peracetic acid and isothiazolone on alga Tribonema sp. bloom and acute toxicity of both chemicals to Pacific white leg shrimp Litopenaeus vannamei with body weight of (0.043 5±0.000 8)g and (2.576 8±0.024 0) g were studied by a static method to search a safe, environmental friend and efficient algae inhibiting products. The results showed that synergistic alga-removal effects of both peracetic acid and isothiazolone were observed, the best at proportion of peracetic acid to isothiazolone=5∶3,with the alga Tribonema sp. bloom inhibition rate of 97.40% and the synergistic index of 0.14 in 96 h. The activities of superoxide dismutase (SOD) and catalase(CAT)re were shown to be elevated first and then declined, and the content of malondialdehyde (MDA) to be increased in the alga exposed to the drugs. The safe concentration was found to be the ratio peracetic acid to isothiazolone=0.21 mg/L∶0.12 mg/L for the Pacific white leg shrimp post larvae and 1.17 mg/L∶0.70 mg/L for the juveniles. The findings indicate that peracetic acid and isothiazolone are applied in Pacific white leg shrimp culture ponds with causation even though they have good inhibitory effect on Tribonema bloom.
Key words:peracetic acid; isothiazolone; Tribonema sp. bloom; Litopenaeus vannamei; antioxidant enzyme
DOI:10.16535/j.cnki.dlhyxb.2017.05.005
文章编号:2095-1388(2017)05-0526-08
中图分类号:S946.3
文献标志码:A
收稿日期:2016-12-09
基金项目:水产动物遗传育种上海市协同创新中心项目(ZF1206)