雌二醇对中间球海胆生长、性腺发育及胆固醇代谢的影响
吕德亮1,李敏1,吴反修2,左然涛1,常亚青1
(1.大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023; 2.全国水产技术推广总站,中国水产学会,北京 100125)
摘要:为探讨雌二醇(estradiol)对体质量为(13.58±0.79)g的中间球海胆Strongylocentrotus intermedius性腺发育的调控机制,在室内水槽(200 L)中进行为期60 d的注射试验。试验分对照组、雌二醇(5 μg/mL)注射组和他莫昔芬(tamoxifen)(25 μg/mL)注射组,每3 d注射1次,并于第30天和第60天时两次取样测定海胆增重率(WGR)、性腺指数(GSI)、性类固醇激素含量和胆固醇合成相关基因的表达量。结果表明:注射雌二醇或他莫昔芬并未显著影响海胆的生长速率,却显著影响试验末期海胆的性腺指数,雌二醇组海胆性腺指数显著高于对照组和他莫昔芬组(P<0.05);试验结束时,雌二醇组和他莫昔芬组海胆体腔液中雌二醇含量和性腺中胆固醇含量均显著高于对照组(P<0.05),雌二醇组海胆性腺中雌二醇含量最高,显著高于对照组和他莫昔芬组(P<0.05);雌二醇组海胆性腺和消化道中主要卵黄蛋白(MYP)基因均高于对照组,但均未有显著性差异(P>0.05);雌二醇组和他莫昔芬组海胆性腺和消化道中性类固醇激素合成关键基因CYP17和胆固醇合成关键基因CYP51表达量均显著高于对照组(P<0.05);他莫昔芬组海胆性腺中CYP17和CYP51基因表达量均低于雌二醇组(P>0.05)。研究表明,注射雌二醇显著提高了中间球海胆性腺指数、体内雌二醇含量和雌二醇合成相关基因的表达量,这可能是雌二醇促进海胆性腺发育的调控机制。
关键词:中间球海胆;类固醇激素;基因表达;性腺发育
中间球海胆Strongylocentrotus intermedius又称虾夷马粪海胆,原产于日本北海道及俄罗斯萨哈林岛等沿海区域,因其性腺色泽好、味道鲜美,深受消费者喜爱,是价值较高的海胆经济种类之一[1]。1989 年,大连海洋大学从日本引进中间球海胆,并率先开展了该品种的人工繁殖、养殖技术、病害防治和营养生理等相关研究[2-5]。目前,中间球海胆已经成为中国北方沿海重要的经济海胆种类,发展前景良好。
生殖腺是海胆唯一可食用部分,兼具生殖和储存营养的双重作用。性腺发育的关键是卵黄发生,而卵黄发生的关键是卵黄蛋白的合成。已有研究发现,类固醇激素(雌二醇等)具有促进卵黄蛋白原合成的作用,并且对水产动物生长发育也具有一定的影响。温茹淑等[6]研究发现,水体中含17β-雌二醇(1 mg/mL)可促进雄性剑尾鱼Xiphophorus hellerii卵黄蛋白原的产生。水体中添加雌二醇(50 ng/L)可促进菲律宾蛤仔Ruditapes philippinarum卵原蛋白原的合成[7]。在对棘皮动物的研究中发现,海星和海胆性腺中均含有雌二醇,且含量呈季节性变化[8]。与其他水产动物不同,海胆的卵黄蛋白称为主要卵黄蛋白(MYP)[9-12],在海胆的精巢和卵巢中均有表达[13-15]。与其他水产动物类似,外源性的雌二醇也会促进海胆体内MYP蛋白的合成[16],进而促进卵巢发育和卵子发生[17]。
目前,有关雌二醇对水产动物胆固醇合成及分解代谢相关基因表达的研究至今未见报道。胆固醇是性类固醇激素合成的底物,胆固醇的合成和分解代谢会直接影响动物体内胆固醇的水平,进而决定性类固醇激素的含量。CYP51 基因是P450超基因家族重要的成员,该基因编码的14α-去甲基酶是胆固醇合成过程中的关键酶之一[18]。细胞色素P450 家族的另外一个重要成员是CYP17,该基因编码的细胞色素17α羟化酶和17,20-裂解酶在类固醇激素合成过程中发挥重要作用,该基因的表达水平可在一定程度上决定动物体内雌二醇和睾酮的水平[19]。他莫昔芬是一种选择性雌激素受体调节剂,其活性代谢产物可与雌二醇竞争受体结合形成复合物,改变雌激素受体的空间构型,从而使雌激素的功能不能有效发挥[20]。
本研究中,以中间球海胆为研究对象,通过向海胆体内注射雌二醇或他莫西芬,检测海胆性腺指数和体腔液中胆固醇、性激素含量,以及胆固醇合成和分解代谢相关基因的表达,以期阐明雌二醇影响海胆性腺发育的调控机制,进而为通过营养途径调控中间球海胆性腺发育提供理论依据。
1 材料与方法
1.1 材料
试验材料为大连龙王塘海域人工养殖的1龄中间球海胆,体质量为(13.58±0.79)g。试验前,将中间球海胆在水槽中暂养7 d,每3 d换水1次,投喂饵料为海带。
1.2 方法
1.2.1 试验设计 试剂配制:取10 mg 17β-雌二醇溶解于10 mL无水乙醇,制成1 mg/mL的母液,然后用葵花油稀释成5 μg/mL的应用液。取10 mg他莫昔芬溶解于10 mL无水乙醇,制成1 mg/mL的母液,然后用葵花油稀释成25 μg/mL的应用液。
试验设3个处理组,对照组、雌二醇组和他莫昔芬组,将海胆随机分配于3种处理模式下,每组设3个平行,每一平行放入20枚海胆,共180枚。试验在室内水槽(280 L)内进行,试验开始前测量所有海胆的初始体质量、壳高、壳径。试验期间投喂足量海带,每3 d半量换水1次,全天充氧。每隔2 d使用1 mL注射器对每只海胆注射10 μL葵花油(对照组)、雌二醇应用液(雌二醇组)和他莫昔芬应用液(他莫昔芬组)。试验期间,水温为9~12 ℃,氨氮含量为0.009~0.013 mg/L,溶氧在6 mg/L以上,盐度为28~30。
1.2.2 样本的采集 试验时间从2017年3月1日—2017年4月29日,共60 d,每30 d取样1次。取样时对每个网笼中的全部海胆进行称重,并随机取6只海胆,通过称量其性腺湿质量计算性腺指数。收集6只海胆的性腺和消化道于无酶离心管中,用液氮速冻后保存于冰箱(-80 ℃)中用于检测基因表达。收集6只海胆的海胆体腔液,于4 ℃下以2500 r/min离心10 min,分离体腔液上清,保存于冰箱(-80 ℃)中用于检测胆固醇、雌二醇和睾酮含量。
1.2.3 激素测定 采用酶联免疫吸附技术(Enzyme-Linked Immunosorbent Assay,ELISA)对性腺和体腔液中雌二醇、睾酮含量的变化进行检测。选用Molluscs Estradiol(E2)Elisa 测定试剂盒(南京建成生物工程研究所)检测雌二醇含量,选用Molluscs Testosterone(T)Elisa 测定试剂盒(南京建成生物工程研究所)检测睾酮含量,测定步骤严格按照试剂盒说明书步骤进行操作。
利用分光光度法检测性腺和体腔液中的总胆固醇含量(mmol/mg prot),计算公式为
总胆固醇含量=(测定管OD值-空白管OD值)/(标准管OD值-空白管OD值)×标准品浓度(5.17 mmol/L)×样本测定前稀释倍数/待测样本蛋白含量(mg prot/mL)×1000。
1.2.4 相关基因表达量的测定
(1)总RNA提取。用 RNA 提取试剂盒[天根生化科技(北京)有限公司)],分别提取对照组和不同试验处理组海胆性腺、消化道的总RNA。用核酸测定仪和琼脂糖凝胶电泳进行浓度和完整性检测。
(2)反转录。反转录按照PrimeScriptTM RT Master Mix(Perfect Real Time)试剂盒(TaKaRa)说明书步骤,在Eppendorf Mastercycler gradient型PCR仪上进行。反转录总反应体系(共20 μL):5×PrimeScript RT Master Mix 2 μL,Total RNA 500 ng,用RNase Free ddH2O补足反应体系。
反应条件:37 ℃ 下反应15 min(反转录反应);85 ℃下反应5 s(反转录酶的失活反应)。将反应产物立即用于PCR反应。
(3)引物筛选。试验所用引物信息见表1。
通过聚合酶链式反应(Polymerase Chain Reaction,PCR)对引物进行验证,反应按照TksGflexTM DNA Polymerase试剂盒(TaKaRa)说明书步骤在Eppendorf Mastercycler gradient 型 PCR 仪上进行。
PCR反应条件:94 ℃下预变性5 min;94 ℃下变性30 s,51 ℃下退火30 s(18S基因和MYP基因的退火温度均为51 ℃),72 ℃下延伸30 s,共进行35个循环;最后在72 ℃下再延伸10 min。
表1 实时定量PCR的引物信息
Tab.1 Primers used for real time PCR in this study

引物primer序列sequence(5′-3′)目的片段/bptargetregion退火温度/℃annealingtemperature参考文献reference18S-FGTTCGAAGGCGATCAGATAC18S-RCTGTCAATCCTCACTGTGTC25152周遵春等[21]MYP-FACCATATGGACTGACGTMYP-RGGGTTCTACCTCGGAGTTGAC22451秦艳杰等[22]CYP17-FGAACGGACCTAGACGGACAACYP17-RTCATCGGGTCTTTCCAGTTC8158郭晓黎等[19]CYP51-FGAGAGATGACATTGGCAGCACYP51-RAGTGTGGAGGGAGTTTGACG10458仇雪梅等[18]
用胶回收试剂盒(EasyPure©Quick Gel Extraction Kit,北京全式金生物技术有限公司)对PCR产物进行回收,按照pEASY©-T1 Cloning Kit试剂盒(北京全式金生物技术有限公司)说明书步骤对胶回收产物进行连接转化,用2×EasyTap PCR SuperMix(+dye)和M13引物对连接转化得到的菌液进行验证,送至北京华大基因研究中心进行测序,并将测序结果进行比对,确定目的基因。
(4)实时定量PCR(RT-PCR)。采用优化好的条件以反转录产物为模板,使用ABI7500型荧光定量PCR仪。根据 SYBR© Fast qPCR Mix试剂盒(TaKaRa)所示,对反应体系略加调整。
总反应体系(共20 μL):SYBR Fast qPCR Mix(2×)10 μL,正、反向引物 各0.8 μL,ROX Reference DyeⅡ 0.4 μL,模板 cDNA 2 μL,ddH2O 6 μL。反应条件:采用两步法,95 ℃ 下预变性10 s;95 ℃ 下变性5 s,51 ℃ 下退火32 s,共进行40个循环。
1.2.5 生长指标的计算
增重率(WGR)=(Wf-W0)/W0×100%,
性腺指数(GSI)=Wx/Wf×100%。
其中:W0为海胆初始体质量(g);Wf为每一次取样时海胆的体质量(g);Wx为每一次取样时海胆的性腺质量(g)。
1.3 数据处理
采用Excel 2007软件对数据进行初步整理,利用SPSS 22.0软件,以注射模式为影响因素,对各测量和计算性状进行单因素方差分析(ANOVA),当有显著性差异时,采用Tukey法对平均值进行两两比较,显著性水平设为0.05。试验数据均以平均值±标准误(mean ± S.E.)的形式表示。
2 结果与分析
2.1 中间球海胆的生长和性腺指数
从表2可见:第30天(第1次取样)时,3个处理组的WGR和GSI均无显著性差异(P>0.05);第60天(第2次取样)时,雌二醇组GSI(18.59%)显著高于对照组(13.51%)和他莫昔芬组(11.8%)(P<0.05)。第60天时,各处理组的WGR和GSI均显著高于第30天时的对应值(P<0.05)。
表2 激素注射对中间球海胆增重率及性腺指数的影响
Tab.2 Effect of hormone injection on weight gain rate(WGR) and gonado-somatic index (GSI) in sea urchin Strongylocentrotus intermedius
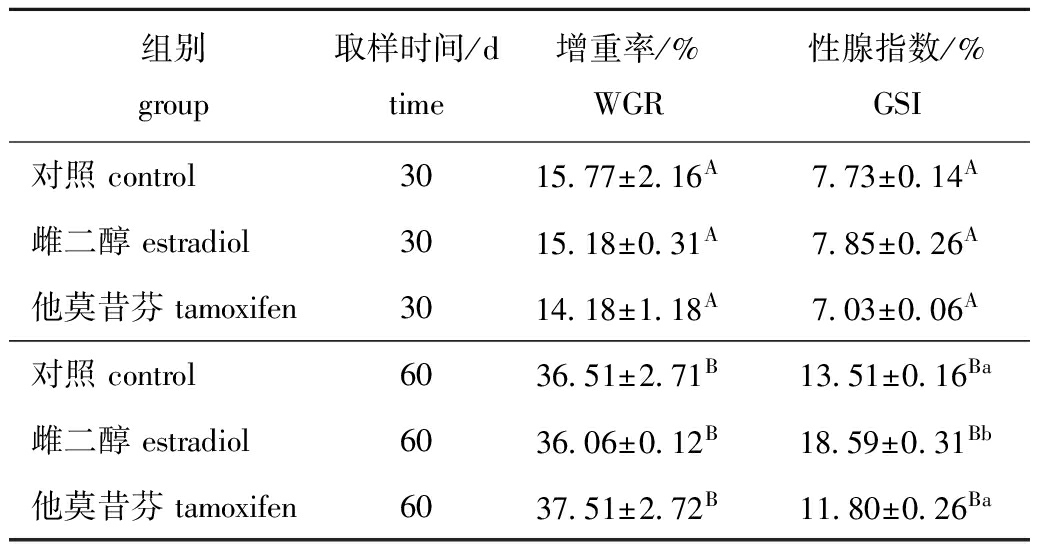
组别group取样时间/dtime增重率/%WGR性腺指数/%GSI对照control3015 77±2 16A7 73±0 14A雌二醇estradiol3015 18±0 31A7 85±0 26A他莫昔芬tamoxifen3014 18±1 18A7 03±0 06A对照control6036 51±2 71B13 51±0 16Ba雌二醇estradiol6036 06±0 12B18 59±0 31Bb他莫昔芬tamoxifen6037 51±2 72B11 80±0 26Ba
注:同列中标有不同小写字母者表示同一次取样中3个处理组间有显著性差异(P<0.05),标有不同大写字母者表示同一处理组在两次取样间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:Means with different letters within the same column are significant differences in the same samples among the three treatments(P<0.05);Means with different capital letters are significant differences in the same treatment between the two samples(P<0.05);Means with the same letters are significant differences(P>0.05),et sequentia
2.2 中间球海胆体腔液和性腺中雌二醇、胆固醇和睾酮含量
中间球海胆体腔液和性腺中的胆固醇、雌二醇及睾酮含量如表3所示。
第30天时,雌二醇组海胆体腔液中雌二醇含量(47.85 ng/L)均显著高于对照组(40.24 ng/L)和他莫昔芬组(42.02 ng/L)(P<0.05);他莫昔芬组海胆体腔液中的胆固醇含量(0.55 mmol/g prot)均显著高于对照组(0.23 mmol/g prot)和雌二醇组(0.25 mmol/g prot)(P<0.05);他莫昔芬组海胆性腺中雌二醇、胆固醇和睾酮含量均最高,但与其他两组间无显著性差异(P>0.05)。
第60天时,雌二醇组海胆体腔液中雌二醇含量(53.44 ng/L)显著高于对照组(43.68 ng/L)(P<0.05),但与他莫昔芬组(48.75 ng/L)无显著性差异(P>0.05);他莫昔芬组海胆体腔液中胆固醇含量(0.52 mmol/g prot)均显著高于对照组(0.15 mmol/g prot)和雌二醇组(0.22 mmol/g prot)(P<0.05);雌二醇组海胆体腔液中睾酮含量高于他莫昔芬组和对照组,但无显著性差异(P>0.05)。雌二醇组海胆性腺中雌二醇、胆固醇和睾酮含量均最高,但与其他两组均无显著性差异(P>0.05)。
第60天时,雌二醇组和他莫昔芬组海胆性腺中雌二醇、胆固醇和睾酮含量均高于第30天时的对应值,但只有胆固醇含量在两次取样间有显著性差异(P<0.05)。
表3 中间球海胆体腔液和性腺中雌二醇、胆固醇和睾酮的含量(n=3)
Tab.3 Concentrations of estradiol, testosterone and cholesterol in the coelomic fluid and gonad of sea urchin Strongylocentrotus intermedius(n=3)
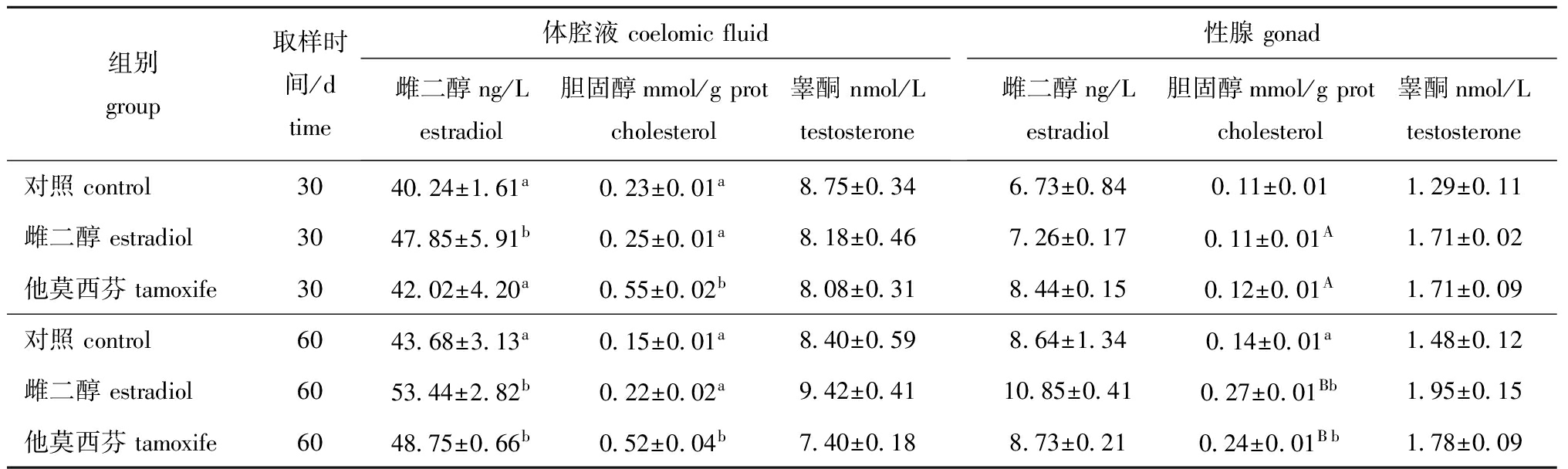
组别group取样时间/dtime体腔液coelomicfluid雌二醇ng/Lestradiol胆固醇mmol/gprotcholesterol睾酮nmol/Ltestosterone性腺gonad雌二醇ng/Lestradiol胆固醇mmol/gprotcholesterol睾酮nmol/Ltestosterone对照control3040 24±1 61a0 23±0 01a8 75±0 346 73±0 840 11±0 011 29±0 11雌二醇estradiol3047 85±5 91b0 25±0 01a8 18±0 467 26±0 170 11±0 01A1 71±0 02他莫西芬tamoxife3042 02±4 20a0 55±0 02b8 08±0 318 44±0 150 12±0 01A1 71±0 09对照control6043 68±3 13a0 15±0 01a8 40±0 598 64±1 340 14±0 01a1 48±0 12雌二醇estradiol6053 44±2 82b0 22±0 02a9 42±0 4110 85±0 410 27±0 01Bb1 95±0 15他莫西芬tamoxife6048 75±0 66b0 52±0 04b7 40±0 188 73±0 210 24±0 01Bb1 78±0 09
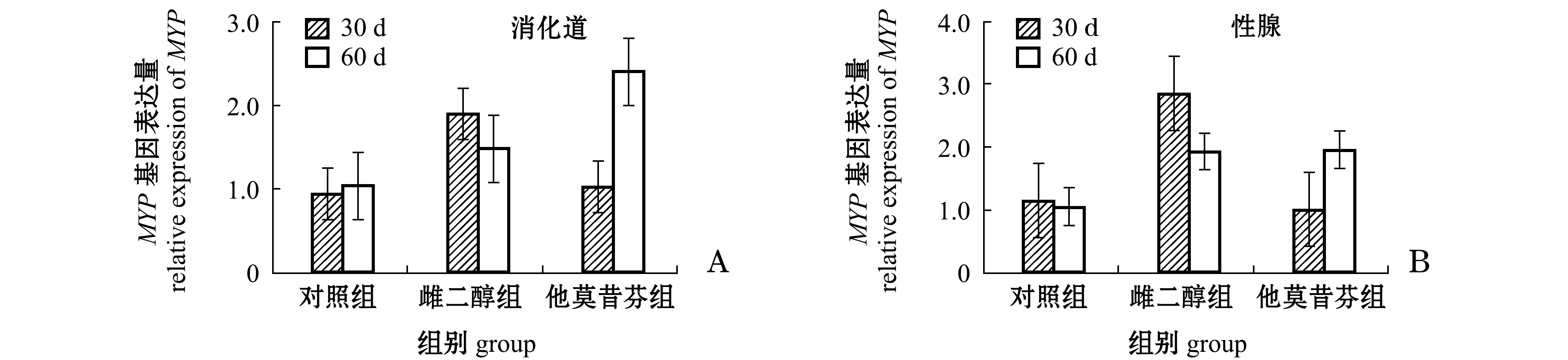
2.3 中间球海胆消化道和性腺中MYP基因表达量
由图1-A可知,两次取样中雌二醇组和他莫昔芬组海胆消化道中MYP基因的表达量均较对照组有所提高,但均无显著性差异(P>0.05),同一处理组在两次取样间未见有显著性差异(P>0.05)。
由图1-B可知:第30天时,雌二醇组海胆性腺中MYP基因的表达量较对照组有较大幅度提高,他莫昔芬组海胆性腺中MYP基因的表达量较对照组有所下降,但均无显著性差异(P>0.05);第60天时,雌二醇组和他莫昔芬组海胆性腺中MYP基因的表达量与对照组相比均有少量增加,但无显著性差异(P>0.05)。同一处理组在两次取样之间也未见有显著性差异(P>0.05)。
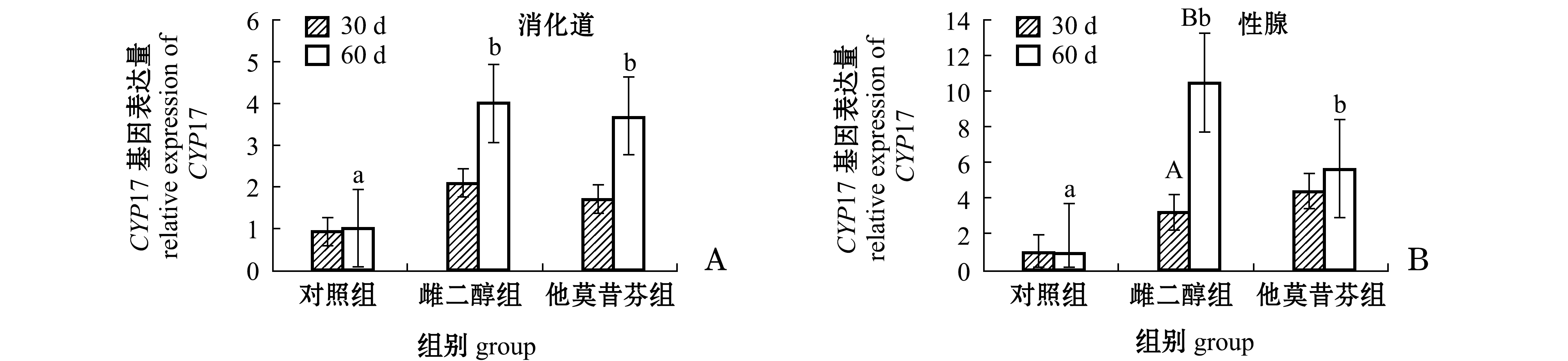
2.4 中间球海胆消化道和性腺中CYP17基因表达量
由图2-A可知:第30天时,雌二醇组和他莫昔芬组海胆消化道中CYP17基因的表达量较对照组均有所提高,但差异均不显著(P>0.05);第60天时,雌二醇组和他莫昔芬组海胆消化道中CYP17基因的表达量分别较对照组显著提高3.91倍和2.59倍(P<0.05)。第60天时,雌二醇组和他莫酚组海胆消化道中CYP17基因的表达量均较第30天时有所提高,但均无显著性差异(P>0.05)。
由图2-B可知:第30天时,雌二醇组和他莫昔芬组海胆性腺中CYP17基因的表达量与对照组相比均有所提高,但均无显著性差异(P>0.05);第60天时,雌二醇组和他莫昔芬组海胆性腺中CYP17基因的表达量分别较对照组显著提高9.82倍和4.82倍(P<0.05)。随着时间的延长,第60天时,对照组海胆性腺中CYP17基因的表达量与第30天时相比基本不变(P>0.05),雌二醇组海胆性腺中CYP17基因的表达量为第30天时的3.24倍,且有显著性差异(P<0.05),而他莫昔酚组海胆性腺中CYP17基因的表达量较第30天时略有提高(P>0.05)。
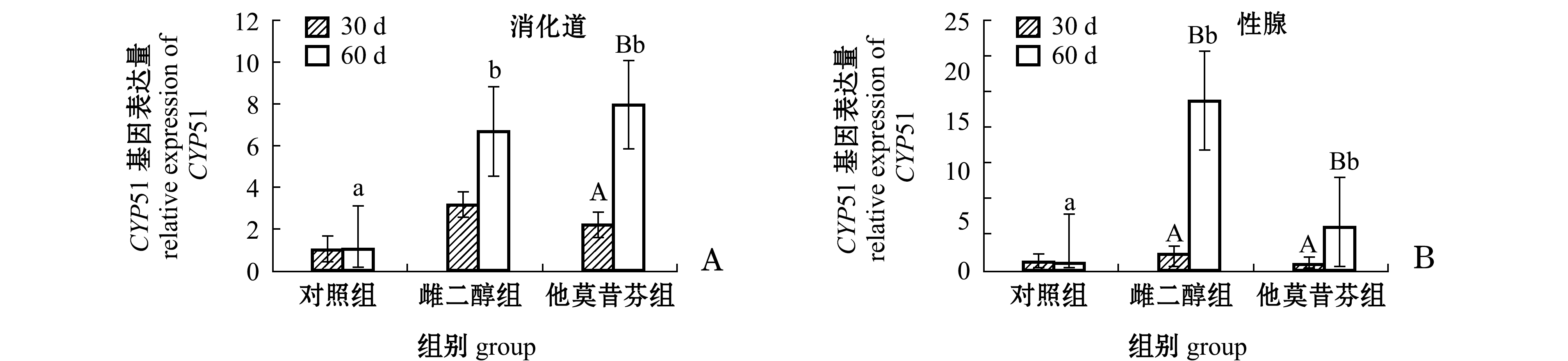
2.5 中间球海胆消化道和性腺中CYP51基因表达量
由图3-A可知:第30天时,雌二醇组海胆消化道中CYP51基因的表达量是对照组的2.97倍,他莫昔芬组消化道中CYP51基因的表达量是对照组的2.07倍,但均无显著性差异(P>0.05);第60天时,雌二醇组和他莫昔芬组消化道中CYP51基因的表达量分别较对照组显著提高5.45倍和6.67倍(P<0.05)。随着试验时间的延长,第60天时,对照组消化道中CYP51基因的表达量较第30天时基本不变(P>0.05),雌二醇组消化道中CYP51基因的表达量较第30天时有所提高(P>0.05),他莫昔酚组海胆消化道中CYP51基因的表达量较第30天时显著提高2.56倍(P<0.05)。
由图3-B可知:第30天时,雌二醇组海胆性腺中CYP51基因的表达量较对照组有所提高,他莫昔芬组性腺中CYP51基因的表达量较对照组有所下降,但各组间均无显著性差异(P>0.05);第60天时,雌二醇组和他莫昔芬组性腺中CYP51基因的表达量分别较对照组显著提高19.60倍和4.46倍(P<0.05)。随着试验时间的延长,第60天时,对照组性腺中CYP51基因的表达量较第30天时略有减少,但未有明显差异(P>0.05),雌二醇组和他莫昔酚组性腺中CYP51基因的表达量较第30天时分别显著提高4.49倍和5.31倍(P<0.05)。
3 讨论
3.1 雌二醇可促进卵黄蛋白的合成
本试验结果显示,第60天时的取样与第30天时相比,雌二醇组海胆的性腺指数增长最大。这说明注射雌二醇提高了海胆消化道和性腺中MYP的表达量,也提高了其性腺和体腔液中雌二醇的含量,这与之前诸多研究结果一致。陈家长等[23]研究发现,17β-雌二醇具有较强的雌激素效应,能够显著提高罗非鱼Oreochromis mossambicus血清中雌二醇和卵黄蛋白原的含量。此外,雌激素浸泡也可以诱导太平洋牡蛎Crassostrea gigas[24]、虾夷扇贝Patinopecten yessoensis[25]体内卵黄蛋白原基因的表达和蛋白合成。Schoenmakers等[8]也发现,17β-雌二醇可促进海星卵黄蛋白的形成。
3.2 他莫西芬可抑制雌二醇功能的发挥
在脊椎动物中,性类固醇激素是通过激素受体(Estrogen receptor, ER)发挥作用的。而ER是一种E2依赖型转录因子,其通过与靶基因上的启动子直接结合,参与雌激素靶细胞中的生理效应[26]。在对美国扇贝Placopecten magellanicus的研究中发现,3H标记的性激素可与组织匀浆中某些蛋白稳定结合,说明性激素受体可能存在于贝类等无脊椎动物中[27]。本试验结束时,他莫西芬组海胆的性腺指数低于对照组,这与Wang 等[28]的研究结果一致,该研究发现,性类固醇激素诱导美国扇贝性腺发育和配子排放的作用可被他莫昔芬抑制。本研究中,他莫昔酚组的海胆体腔液和性腺中雌二醇含量均高于对照组。这可能是由于他莫昔酚通过竞争雌激素受体,抑制了雌二醇功能的正常发挥,致使机体胆固醇和雌二醇应激性合成增加。本研究中也发现,他莫西芬组海胆体内胆固醇合成的关键基因CYP51和性激素合成关键基因CYP17表达量确实较对照组有较大幅度提高,这进一步支持了上述假设。因此,他莫西芬组海胆应激性的雌二醇合成导致了MYP较对照组略有升高。另外,本研究中MYP定量为转录水平而非蛋白水平,这也可能是造成MYP表达量与性腺指数结果不一致的原因。其次,MYP被氧化不能被正常转运至性腺也可能是导致MYP表达量与性腺指数不一致的原因。MYP蛋白是由海胆消化管道和性腺合成的,消化道合成的MYP蛋白需经体腔中营养吞噬细胞运输至性腺并以卵黄小体的形式贮存起来[29-30]。体内氧化水平过高会导致MYP蛋白或营养吞噬细胞功能发生改变,从而导致MYP蛋白不能正常转运至性腺组织。但是,本研究中并未测定海胆体内抗氧化水平和体腔液中MYP的含量,上述推测还需要进一步验证。
3.3 他莫西芬可促进胆固醇的合成
本试验中,他莫西芬组海胆体内胆固醇含量高于对照组。胆固醇和三酰甘油等脂质在肝细胞内聚集被认为是非酒精性脂肪肝病(NAFLD)发生的前提和必要条件[31]。Cole等[32]分别用他莫昔芬(0.5 mg/kg)或芝麻油对小鼠Mus musculus连续注射5 d,结果显示,与对照组相比,他莫昔芬组小鼠肝脏三酰甘油的量增加了72%,说明他莫昔芬短期处理可诱导小鼠肝脏脂肪变性,引起NAFLD。这表明他莫西芬会造成动物体内胆固醇和三酯酰甘油含量的升高,同时说明雌二醇在体内脂肪代谢过程中发挥着重要作用。国内外相关研究表明,在利用他莫西芬治疗卵巢癌等疾病的过程中会造成患者体内胆固醇和三酯酰甘油含量的升高,进而增加了其患糖尿病和NAFLD等疾病的风险。Sun等[33]在22257例乳腺癌患者的研究中发现,相对于未使用他莫昔芬的乳腺癌患者组,他莫昔芬治疗组的乳腺癌患者的糖尿病发病风险显著提高。此外,长期使用他莫昔芬治疗会增加人体新陈代谢紊乱,引起并提高女性NAFLD的发病率[34]。
3.4 睾酮与雌二醇之间存在稳态关系
当海胆体内雌二醇含量增加时,睾酮含量也随之增加,这说明海胆可通过自身调节来保持体内睾酮与雌二醇间的稳态。动物体内睾酮与雌二醇间的稳态对于动物正常生长和繁殖至关重要。Shang等[35]研究发现,睾酮和雌二醇两种类固醇激素的比率变化会显著影响斑马鱼类性腺发育和配子发生。袁汉文[36]研究发现,当饲料中雌二醇添加量为20 mg/kg时,在15个月内,黄鳝幼苗血清中雌二醇和睾酮浓度的变化规律基本一致。Park等[37]研究发现,向斑纹隐小鳉鱼腹腔注射甲基睾酮,连续注射7 d后鳉鱼血清中雌二醇的浓度均有小幅度的升高。
综上所述,外源性的雌二醇会促进主要卵黄蛋白的合成,提高中间球海胆性腺指数,提高其性腺和体腔液中胆固醇和性激素的含量,对胆固醇的合成与分解过程具有显著影响。
参考文献:
[1] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[2] 王子臣,常亚青.经济类海胆增养殖研究进展及前景[J].海洋科学,1997,21(6):20-22.
[3] 韩奋杰,张伟杰,秦宇博,等.中间球海胆幼体及稚海胆生长性状的遗传参数估计[J].大连海洋大学学报,2017,32(2):145-149.
[4] 侯受权,左然涛,常亚青,等.饲料脂肪水平对中间球海胆幼胆生长、消化酶和热胁迫后抗氧化酶活力的影响[J].大连海洋大学学报,2016,31(5):538-543.
[5] 左然涛,侯受权,常亚青,等.海胆营养生理研究进展[J].大连海洋大学学报,2016,31(4):463-468.
[6] 温茹淑,方展强,江世贵,等.17β-雌二醇对剑尾鱼卵黄蛋白原的诱导研究[J].中国实验动物学报,2007,15(4):280-284.
[7] Matozzo V,Marin M G.Can 17-β estradiol induce vitellogenin-like proteins in the clam Tapes philippinarum?[J].Environmental Toxicology and Pharmacology,2008,26(1):38-44.
[8] Schoenmakers H J N,Dieleman S J.Progesterone and estrone levels in the ovaries,pyloric ceca,and perivisceral fluid during the annual reproductive cycle of starfish,Asterias rubens[J].General and Comparative Endocrinology,1981,43(1):63-70.
[9] Harrington F E,Easton D P.A putative precursor to the major yolk protein of the sea urchin[J].Developmental Biology,1982,94(2):505-508.
[10] Kari B E,Rottmann W L.Analysis of changes in a yolk glycoprotein complex in the developing sea urchin embryo[J].Developmental Biology,1985,108(1):18-25.
[11] Yokota Y,Kato K H.Degradation of yolk proteins in sea urchin eggs and embryos[J].Cell Differentiation,1988,23(3):191-199.
[12] Scott L B, Lennarz W J.Structure of a major yolk glycoprotein and its processing pathway by limited proteolysis are conserved in echinoids[J].Developmental Biology,1989,132(1):91-102.
[13] Shyu A B,Blumenthal T.Expression of the vitellogenin gene in female and male sea urchin[J].Proceedings of the National Academy of Sciences of the United States,1986,83(11):3865-3869.
[14] Unuma T,Suzuki T,Kurokawa T,et al.A protein identical to the yolk protein is stored in the testis in male red sea urchin Pseudocentrotus depressus[J].The Biological Bulletin,1998,194(1):92-97.
[15] Brooks J M,Wessel G M.Selective transport and packaging of the major yolk protein in the sea urchin[J].Developmental Biology,2003,261(2):353-370.
[16] Harrington F E,Ozaki H.The effect of estrogen on protein synthesis in echinoid coelomocytes[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1986,84(3):417-421.
[17] Wasson K M,Gower B A,Watts S A.Responses of ovaries and testes of Lytechinus variegatus(Echinodermata:Echinoidea) to dietary administration of estradiol,progesterone and testosterone[J].Marine Biology,2000,137(2):245-255.
[18] 仇雪梅,吴领知,郭晓黎,等.虾夷马粪海胆CYP51基因cDNA的克隆及其SNPs分析[J]. 大连海洋大学学报,2012,27(4):294-299
[19] 郭晓黎,仇雪梅,常亚青,等.虾夷马粪海胆CYP17基因的克隆及其表达差异[J]. 大连海洋大学学报,2013,28(1):1-6.
[20] 李晓诗,吕青,陈洁,等.他莫昔芬的药理作用机制及其对卵巢功能的影响[J].中国普外基础与临床杂志,2015,22(11):1397-1404.
[21] 周遵春,包振民,董颖,等.MYP基因在中间球海胆及杂交海胆生殖腺不同发育时期的转录表达差异[J].遗传,2008,30(11):1453-1458.
[22] 秦艳杰,孙博林,李霞,等.饥饿对中间球海胆MYP基因转录表达的影响[J].生态学报,2012,32(6):1755-1761.
[23] 陈家长,王泽镕,瞿建宏,等.17β-雌二醇与1-萘酚对雄性罗非鱼(GIFT Oreochromis niloticus)雌激素效应的比较[J].生态环境学报,2012,21(4):754-759.
[24] Li Qi,Osada M,Suzuki T,et al.Changes in vitellin during oogenesis and effect of estradiol-17β on vitellogenesis in the Pacific oyster Crassostrea gigas[J].Invertebrate Reproduction & Development,1998,33(1):87-93.
[25] Osada M,Takamura T,Sato H,et al.Vitellogenin synthesis in the ovary of scallop,Patinopecten yessoensis:control by estradiol-17β and the central nervous system[J].Journal of Experimental Zoology Part A:Comparative Experimental Biology,2003,299A(2):172-179.
[26] Zhao Yue,Lang G,Ito S,et al.A TFTC/STAGA module mediates histone H2A and H2B deubiquitination,coactivates nuclear receptors,and counteracts heterochromatin silencing[J].Molecular Cell,2008,29(1):92-101.
[27] Wang Chunde,Croll R P.Estrogen binding sites in the sea scallop:characterization and possible involvement in reproductive regulation[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2007,148(3):303-313.
[28] Wang C,Croll R P.Effects of sex steroids on in vitro gamete release in the sea scallop,Placopecten magellanicus[J].Invertebrate Reproduction & Development,2003,44(2-3):89-100.
[29] Unuma T,Okamoto H,Konishi K,et al.Cloning of cDNA encoding vitellogenin and its expression in red sea urchin,Pseudocentrotus depressus[J].Zoological Science,2001,18(4):559-565.
[30] Shyu A B,Blumenthal T,Raff R A.A single gene encoding vitellogenin in the sea urchin Strongylocentrotus purpuratus:sequence at the 5′end[J].Nucleic Acids Research,1987,15(24):10405-10417.
[31] Puri P,Baillie R A,Wiest M M,et al.A lipidomic analysis of nonalcoholic fatty liver disease[J].Hepatology,2007,46(4):1081-1090.
[32] Cole L K,Jacobs R L,Vance D E.Tamoxifen induces triacylglycerol accumulation in the mouse liver by activation of fatty acid synthesis[J].Hepatology,2010,52(4):1258-1265.
[33] Sun L M,Chen H J,Liang J A,et al.Association of tamoxifen use and increased diabetes among Asian women diagnosed with breast cancer[J].British Journal of Cancer,2014,111(9):1836-1842.
[34] Bruno S,Maisonneuve P,Castellana P,et al.Incidence and risk factors for non-alcoholic steatohepatitis:prospective study of 5408 women enrolled in Italian tamoxifen chemoprevention trial[J].British Medical Journal,2005,330(7497):932-935.
[35] Shang E H H,Yu R M K,Wu R S S.Hypoxia affects sex differentiation and development,leading to a male-dominated population in zebrafish (Danio rerio)[J].Environmental Science & Technology,2006,40(9):3118-3122.
[36] 袁汉文.不同外源因子对黄鳝性逆转的影响研究[D].武汉:华中农业大学,2011.
[37] Park C B,Soyano K,Kiros S,et al.Transient effects of methyltestosterone injection on different reproductive parameters of the hermaphrodite fish Kryptolebias marmoratus[J].Ecotoxicology,2013,22(7):1145-1154.
Effects of 17β-estradiol on growth, gonadal development and cholesterol metabolism in sea urchin Strongylocentrotus intermedius
LÜ De-liang1, LI Min1, WU Fan-xiu2, ZUO Ran-tao1, CHANG Ya-qing1
(1.Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023, China; 2.The National Fisheries Technology Extension Center, China Fisheries Society, Beijing 100125, China)
Abstract:Sea urchin Strongylocentrotus intermedius with body weight of (13.58±0.79)g reared in a 200 L tank in a laboratory were injected with 17β-estradiol (5 μg/mL), tamoxifen (inhibitor of estradiol receptor) (25 μg/mL) or sunflower oil (as control group ) once every 3 days, and weight gain rate (WGR), gonado-somatic index (GSI), gonadal hormone content related to development, and expression of cholesterol synthase-related genes were analyzed 30 d and 60 d after administration to investigate the effects of estradiol on growth performance, gonad development and cholesterol metabolism in sea urchin. The results showed that there was no significant difference in weight gain rate among the three treatments (P>0.05). However, statistical significance was detected in GSI among three treatments, with the maximum in the sea urchins injected with 17β-estradiol at the end of the experiment (P<0.05). There were significantly higher estradiol concentration in the coelomic fluid in the sea urchin in the estradiol and tamoxifen groups than that in the control group (P<0.05). The estradiol concentration in the gonad was significantly higher in sea urchin in the estradiol group than that in the control and tamoxifen groups (P<0.05).The higher transcription of major yolk protein (MYP) in both gonad and digestive tract was observed in the sea urchin injected with 17β-estradiol than that in the other groups (P>0.05). Similarly, there were significantly higher expressions of CYP17 and CYP51 gene in the gonad and digestive tract in the sea urchins injected with estradiol and tamoxifen than that in the control group. It is concluded that estradiol has positively promoting effects on the gonado-somatic index, estradiol concentration and expression of the genes related to estradiol synthesis. The findings could contribute to elucidate the mechanism of estradiol regulating the gonad development of sea urchins.
Key words:Strongylocentrotus intermedius; steroid hormone; gene expression; gonadal development
DOI:10.16535/j.cnki.dlhyxb.2017.05.001
文章编号:2095-1388(2017)05-0501-08
中图分类号:S917
文献标志码:A
收稿日期:2017-08-28
基金项目:国家自然科学基金资助项目(41606180);中国科协“青年人才托举工程”研究项目(YESS20150157)
作者简介:吕德亮(1992—),男,硕士研究生。E-mail:nalanqingzhu@126.com
通信作者:左然涛(1985—),男,博士,讲师。E-mail:rtzuo@dlou.edu.cn