捕后虾夷扇贝闭壳肌免疫因子与活品品质评价初探
郑尧1,刘俊荣1,周晏琳1,刘慧慧1,宋扬1,田元勇1,赵学伟2
(1.大连海洋大学食品科学与工程学院,辽宁大连116023;2.獐子岛集团股份有限公司,辽宁大连116001)
摘要:为探索采捕后活品贝类的品质变化规律,以虾夷扇贝Patinopecten yessoensis为对象,研究了其闭壳肌中酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)、溶菌酶(LSZ)、过氧化氢酶(CAT)等4个非特异性免疫因子的变化规律,试验基于活品虾夷扇贝的商品流通链分别进行湿藏和干藏处理,捕后贮藏分为离水至甲板、运输船中转、港口卸货、基地缓冲池和净化等5个关键环节,共设10个采样点。结果表明:虾夷扇贝闭壳肌中表现出ACP及SOD活力,CAT活力很低,LSZ则未检出活力;在捕后106 h内,ACP活力呈现出先下降再升高的趋势,而SOD活力则呈先升高再下降再升高的趋势,二者与虾夷扇贝所受胁迫强度均有相关性。研究表明,闭壳肌中非特异性免疫因子ACP及SOD可以作为活品扇贝的胁迫应答因子及品质评价指标进行深入研究。
关键词:虾夷扇贝;捕后;闭壳肌;活品
虾夷扇贝Patinopecten yessoensis是中国重要的海水养殖贝类之一,据《中国渔业统计年鉴2015》发布[1],2014年中国贝类海水养殖产量达到1316.55万t,其中扇贝产量为164.94万t,占养殖总量的12.5%。虾夷扇贝主要以活品形式流通。采捕后的虾夷扇贝因各种胁迫因素导致其正常代谢受到干扰,最终影响其活品品质。近年来,国内有关活品虾夷扇贝捕后品质的研究陆续有所报道。最初的研究围绕底播养殖虾夷扇贝供应链可追溯现状展开,涵盖了活品虾夷扇贝从育苗、养殖、采捕、加工到销售的全过程[2];随后,有关活品虾夷扇贝的感官品质及其评价方法、活品流通过程中的风味品质变化规律等陆续见报道[3-4],甚至还出现了专门针对其挥发性气味特征的研究[5-8];此外,从肠道菌群角度针对活品供应链各环节安全性的研究也有报道[9]。
作为无脊椎动物的非特异性免疫因子,酸性磷酸酶(ACP)与溶菌酶(LSZ)等溶酶体酶,以及超氧化物歧化酶(SOD)与过氧化氢酶(CAT)等抗氧化酶共同参与了活品虾夷扇贝的代谢调节及胁迫应答。ACP与LSZ连同其他水解酶类参与异物的降解及清除,ACP能够催化表面带有磷酸酯的异物水解并参与细胞能量供应[10],LSZ通过溶解细菌细胞壁中的肽聚糖,从而裂解细菌细胞[11]。SOD与CAT连同其他抗氧化酶可清除由呼吸爆发产生的大量氧自由基,SOD可以使超氧阴离子歧化为过氧化氢和氧气,CAT进一步将过氧化氢分解为氧气和水[12-13]。因此,研究活品贝类供应过程中其非特异性免疫因子的变化规律有重要意义。
本研究中,以底播虾夷扇贝作为研究对象,探索了捕后活品虾夷扇贝闭壳肌中具有代表性的胁迫应答因子及其变化规律,以及捕后处置方式对其的影响,旨在探索采捕后活品贝类品质的变化规律。
1 材料与方法
1.1 材料
本试验所用样品为2015年11月采于大连海域(北纬39°)的底播活品虾夷扇贝。
试验用主要试剂:十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂购自美国Sigma公司;蛋白标准品购自美国BioLabs公司;过氧化氢酶试剂盒、超氧化物歧化酶试剂盒、酸性磷酸酶试剂盒、溶菌酶试剂盒购自南京建成生物工程研究所;三磷酸腺苷购自上海华蓝化学科技有限公司;其他试剂均为分析纯。
试验用主要仪器:高速离心机购自德国HERMLE Labortechnik GmbH公司;800 s匀浆机购自美国WARING公司;PB-10pH计购自德国Sartorius公司;IMS-40全自动雪花制冰机购自常熟市雪科公司;AE-6500垂直电泳槽购自日本ATTO公司;Synergy H1酶标仪购自美国柏腾公司;721型分光光度计购自上海光谱仪器有限公司;HG-200均质机购自日本HSIANGTAI公司;电热恒温水浴锅购自上海一恒科学仪器有限公司。
1.2 方法
1.2.1 样品采集与处理 全程跟踪试验样品的采捕流程,并在关键环节进行采样。从捕捞到净化车间流程为:捕捞船→运输船→港口→缓冲池→净化池。目前,中国捕后活品虾夷扇贝主要以湿藏为主,即在采捕后放入船内循环海水箱中,直至到达港口后迅速转移到净化车间的缓冲池中,因此,除转运、卸货等短时操作外,活品虾夷扇贝基本处于湿藏状态。捕后贮藏的关键环节包括离水至甲板、运输船中转、港口卸货、基地缓冲池和净化等5个环节。10个采样点覆盖上述各个环节,样品信息详见表1。
采样的起点始于捕捞船,对拖网捕捞上的虾夷扇贝立刻进行分选,选择大小相似、生理状态良好的虾夷扇贝270枚。其中取10枚立刻进行开壳处理,取出闭壳肌,在自封袋中压碎并用干冰冻结,作为初始点(样品编号C0);剩余的260枚虾夷扇贝分为两组,每组130枚,分别为湿藏组和低温干藏组。湿藏组全程依照活品虾夷扇贝商品流通模式进行运输,低温干藏组放置在事先准备好的冰盒中,在低温干露状态下一直运送至码头,然后和湿藏组一同转移至基地缓冲池中暂养。采样时刻和样本编号如表1所示,活贝经现场开壳分离闭壳肌后,迅速置于干冰中冻藏,运回实验室于冰箱(-40℃)中保存备用。
表1 活品虾夷扇贝采样信息
Tab.1 Sampling information on live Yesso scallopPatinopecten yessoensis
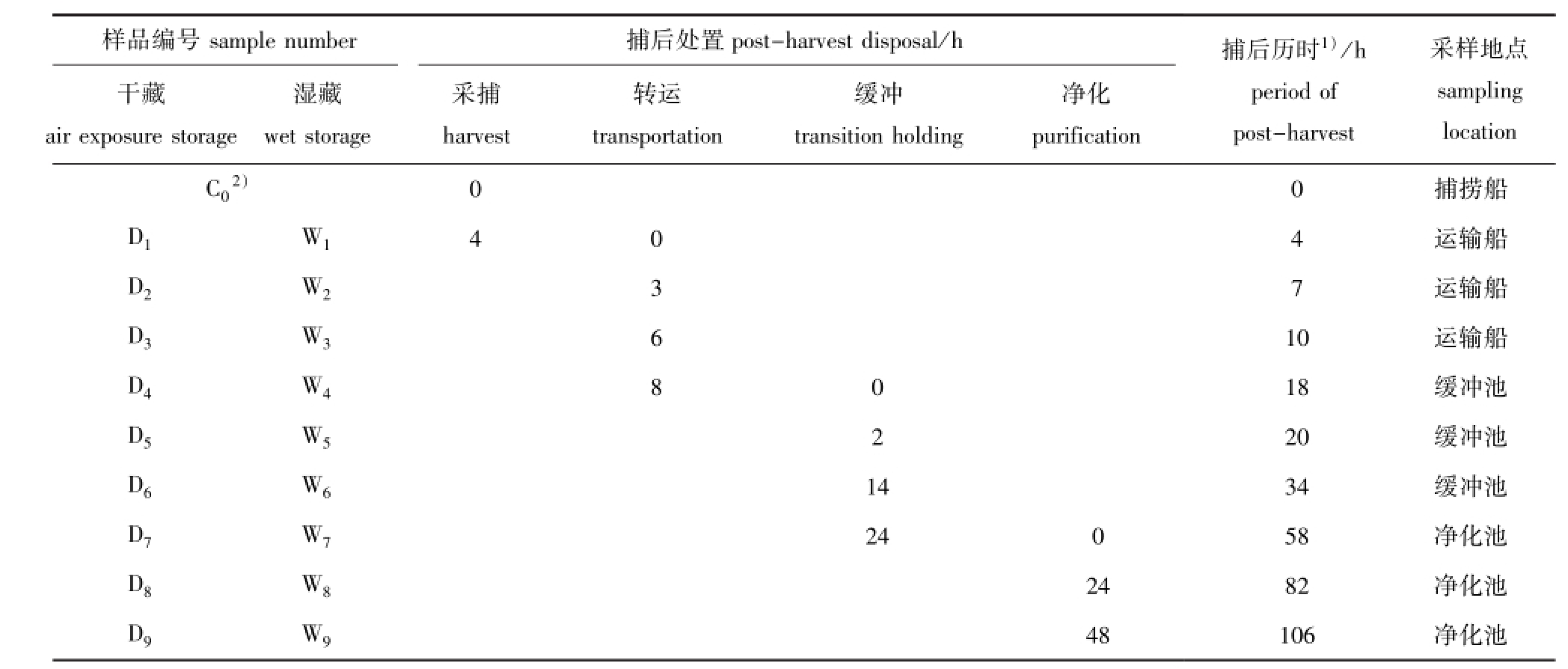
注:1)捕后历时指从采捕至采样样品经历的总时长;2)C0为采样初始点
Note:1)period of post-harvest,the whole time from harvesting to sampling;2)C0is the initial sampling point
post-harvest disposal/h干藏ir exposure storage样品编号sample number捕后处置采样地点sampling湿藏wet storage采捕harvest转运transportation缓冲transition holding净化purification捕后历时1)/h period of post-harvest location捕捞船D1W1404运输船D2W237运输船D3W3610运输船D4W48018缓冲池D5W5220缓冲池D6W61434缓冲池D7W724058净化池D8W82482净化池D9W948106 a净化池C02)00
1.2.2 闭壳肌中粗酶的提取 粗酶提取参考Wongso等[14]的方法并稍作修改。取冷冻的闭壳肌4 g,加入5倍体积的0.1 mol/L NaCl、20 mmol/L Tris-HCl缓冲液(pH 7.5)进行均质(10 000 r/min,每次均质30 s,间隔30 s,共3次)。在4℃、10 000 g条件下离心10 min,取上清液即为粗酶。采用双缩脲法测定蛋白浓度。
1.2.3 酶活力的测定 对粗酶提取液中的超氧化物岐化酶(SOD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)和溶菌酶(LSZ)活力进行测定。
采用羟胺法[15]测定SOD酶活力,按照试剂盒说明书操作步骤进行测定。黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基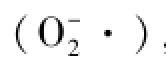 ,后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,而SOD酶可以减少亚硝酸的生成。加入3倍体积的缓冲液稀释样品,再加入其余各试剂,混匀后,在室温下放置10 min,用双蒸水调零,在550 nm处测定其吸光值。SOD酶活力单位定义为:在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)。
,后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,而SOD酶可以减少亚硝酸的生成。加入3倍体积的缓冲液稀释样品,再加入其余各试剂,混匀后,在室温下放置10 min,用双蒸水调零,在550 nm处测定其吸光值。SOD酶活力单位定义为:在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)。
参考Góth[16]的方法测定CAT酶活力,按照试剂盒说明书操作步骤进行测定。钼酸铵可以迅速终止过氧化氢酶与H2O2的反应,并与反应体系中剩余的H2O2反应生成一种淡黄色的络合物,并在405 nm处测定其吸光值。CAT酶活力单位定义为:每秒分解1 μmol的H2O2的量为一个酶活力单位(U)。
参考Zurier等[17]的方法测定ACP酶活力,按照试剂盒说明书操作步骤进行测定。酸性磷酸酶分解磷酸苯二钠,产生游离酚和磷酸,酚在碱性溶液中与4-氨基安替吡啉作用经铁氰化钾氧化生成红色醌衍生物,并在520 nm处测定其吸光度值。ACP酶活力单位定义为:在37℃下基质作用30 min产生1 mg酚为一个活力单位(U)。
采用比浊法[18]测定LSZ酶活力,按照试剂盒说明书操作步骤进行测定。将一定浓度的混浊菌液与溶菌酶混合,使溶菌酶水解细菌细胞壁上肽聚糖裂解细菌,从而使溶液浓度降低,透光度增强,可根据溶液透光度的变化来判断溶菌酶的含量。将样品倒入比色皿后,在20 s时读取透光度值T0,在2 min 20 s时读取透光度值T2,观察2次透光度的差值ΔT。
1.2.4 粗酶的分子量分布 采用SDS-PAGE[19]测定粗酶的分子量分布,其中浓缩胶质量分数为5%,分离胶质量分数为12.5%,采用考马斯亮蓝R-250染色法检验,用醋酸-甲醇溶液进行脱色。
1.3 数据处理
试验结果均以平均值±标准差表示,试验数据采用SPSS软件进行处理,用单因素分析法进行方差分析,显著性水平设为0.05。
2 结果与讨论
2.1 采捕后活品虾夷扇贝的胁迫状态
本研究中全程跟踪活品虾夷扇贝的采捕流程,并对其关键环节的胁迫状态进行分析。由表2可知,湿藏条件下的活品虾夷扇贝主要受温度、压力、氧气、机械振动和干露等胁迫因子的影响。样品C0为刚捕捞到甲板上的活品虾夷扇贝,此时刚脱离其自然生长环境,所以各种胁迫均达到最大。随着扇贝进入循环海水池并开始适应新环境,各种胁迫均有所下降。W4为刚进入缓冲池的样品,因为刚经历了码头卸货和短时转运,各种胁迫均有所上升。随后样品处于一个相对稳定的环境中,各种胁迫开始下降。
表3为冷却干藏条件下活品虾夷扇贝的胁迫状态,D1、D2和D3处于冷却的冰盒中,温度胁迫较低,但有较强的干露胁迫。从D4(W4)开始,干藏和湿藏进入相同的处置条件(表2、表3)。
2.2 活品虾夷扇贝闭壳肌中4种胁迫应答因子的分布
闭壳肌是虾夷扇贝的主要可食部位,本研究中从食品原料学出发,探讨闭壳肌中主要胁迫应答因子的分布及其变化规律,从而探索与贝类活品品质相关的生物指标的可能性。
表2 湿藏条件下活品虾夷扇贝所处环境及胁迫状态分析
Tab.2 The circumstance and stress state of live Yesso scallopPatinopecten yessoensisduring wet storage
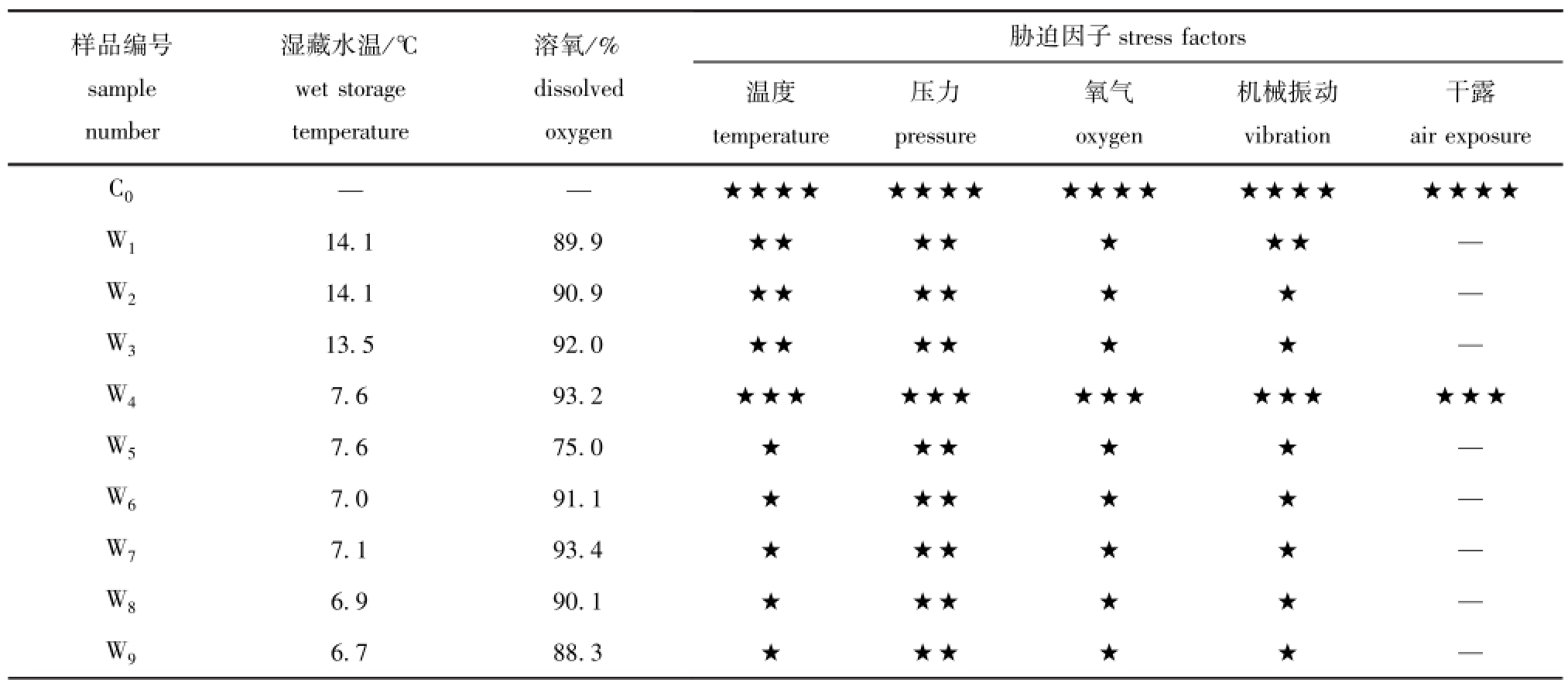
注:★★★★代表胁迫强度最大,★★★、★★及★依次递减,下同
Note:★★★★shows the maximum stress intensity and★★★,★★,and★indicates the intensity range in a descending order,et sequentia
样品编号sample number胁迫因子湿藏水温/℃wet storage temperature溶氧/% dissolved oxygen干露★★★★★★★★★★★★★★★★★★★★W114.189.9★★★★★★★—W214.190.9★★★★★★—W313.592.0★★★★★★—W47.693.2★★★★★★★★★★★★★★★W57.675.0★★★★★—W67.091.1★★★★★—W77.193.4★★★★★—W86.990.1★★★★★—W96.788.3★★★★★air exposure C0——stress factors温度temperature压力pressure氧气oxygen机械振动vibration—
研究中发现,虾夷扇贝闭壳肌中存在SOD及ACP活力,相比之下CAT活力较低,几乎未检测到LSZ活力。经测定,采捕初始点闭壳肌中CAT、SOD活力分别为(0.11±0.03)、(170.1±4.69) U/mg,ACP活力为(97.64±9.64)U/g。前期对这几种胁迫应答因子的研究主要以肝脏组织和血淋巴等为主,如王丽丽等[20]通过测定虾夷扇贝内脏团中的SOD及CAT活力,研究镉胁迫对其酶活力的影响;李石磊等[21]通过测定虾夷扇贝血液中ACP及SOD活力,研究饥饿胁迫对其酶活力的影响;徐大伦等[22]通过测定华贵栉孔扇贝血淋巴中的SOD及LSZ活力,研究浒苔多糖对其酶活力的影响。目前,关于扇贝闭壳肌中这几种胁迫应答因子的报道还较为少见。本研究中根据这4种胁迫应答因子在闭壳肌中的分布结果,选取SOD和ACP作为检测指标,进一步跟踪活品虾夷扇贝在流通过程中的代谢变化。
2.3 捕后活品虾夷扇贝闭壳肌中ACP活力的变化
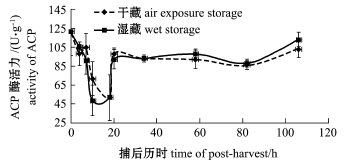
软体动物缺乏特异性免疫球蛋白,以ACP为标志酶的溶酶体酶尤为重要,具有防御和消化的双重作用[10]。如图1所示,干藏和湿藏两种条件下, ACP活力均在捕后均呈现先下降再升高的趋势, ACP在起点时酶活力最高,此时扇贝刚脱离其自然生长环境,随之而来的胁迫也达到最大。随着其自身开始适应新环境以及一系列的生理调节开始启动,ACP活力迅速下降,捕后10 h降至最低。当活贝在捕后14 h进入净化池之后,此时扇贝刚刚经历了码头卸货等一系列处置,酶活力又开始上升,直至捕后20 h酶活力开始趋于稳定。两次ACP活力迅速上升均恰好发生在外界环境剧烈变化之后,由此推测,ACP活力与采捕后虾夷扇贝所受胁迫有良好的相关性,可以作为一种胁迫应答因子进行深入研究。以往对ACP的研究主要集中在扇贝生长阶段,栗志民等[23]在实验室条件下模拟华贵栉孔扇贝的生长环境,发现当其面临温度、盐度胁迫时,ACP活力也呈先下降再升高的趋势。李石磊等[21]对虾夷扇贝采取自然海水充气暂养,发现短期饥饿胁迫对虾夷扇贝ACP活力无显著影响,但25 d后酶活力出现显著下降(P<0.05)。Jiang等[24]在实验室条件下模拟温度胁迫,发现温度波动对ACP活力有显著影响(P<0.05)。需要指出的是,本研究中针对的是采捕后贝类面临环境胁迫时的应答规律。相比生长阶段而言,贝类捕后所面临的胁迫周期较短,引起胁迫的因素也比较明确,且均与实际操作相关联,这正是研究捕后胁迫规律的意义所在。
表3 干藏条件下活品虾夷扇贝所处环境及胁迫状态分析
Tab.3 The circumstance and stress state of live Yesso scallopPatinopecten yessoensisduring air exposure storage
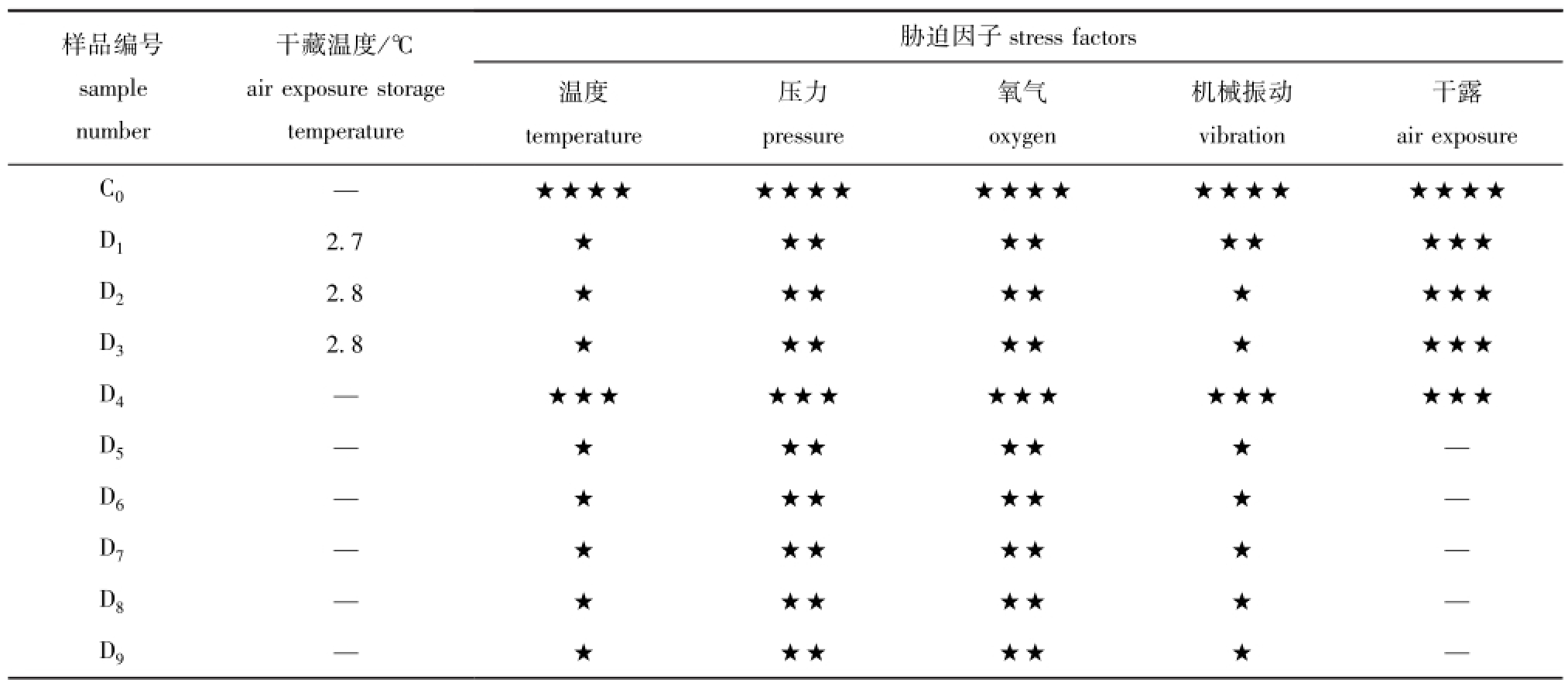
样品编号sample number胁迫因子干藏温度/℃air exposure storage temperature干露air exposure C0—stress factors温度temperature压力pressure氧气oxygen机械振动vibration★★★★★★★★★★★★★★★★★★★★D12.7★★★★★★★★★★D22.8★★★★★★★★★D32.8★★★★★★★★★D4—★★★★★★★★★★★★★★★D5—★★★★★★—D6—★★★★★★—D7—★★★★★★—D8—★★★★★★—D9—★★★★★★—
2.4 捕后活品虾夷扇贝闭壳肌中SOD活力的变化
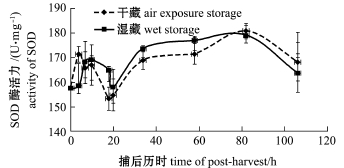
水生脊椎动物和无脊椎动物在面临环境胁迫时均会产生氧自由基,其中最先形成的就是超氧阴离子。为了减少氧自由基对机体的损伤,SOD等一系列抗氧化酶共同发挥作用维持机体内自由基平衡[25]。如图2所示,干藏和湿藏两种条件下, SOD活力均呈现先上升后下降再上升的趋势。与ACP不同的是,SOD在起点时并未达到最大值,可能是超氧阴离子未立刻产生,或是SOD没有立刻发挥作用;随后酶活力开始上升,说明SOD开始逐渐发挥作用,并在捕后4 h达到最大。接着随着胁迫强度降低,SOD活力也开始下降,在捕后20 h降到最低,然后开始下一次上升。研究表明, SOD活力变化与ACP基本相同,也是在环境剧烈变化之后出现酶活力上升,只是作用时间略滞后于ACP。由此推测,SOD活力与虾夷扇贝所受胁迫也具有良好的相关性,同样可以作为一种胁迫应答因子进行后续研究。研究表明,虾夷扇贝[21]、日本沼虾[26]在面临饥饿胁迫时,SOD活力均出现显著上升(P<0.05)。长江刀鲚幼鱼[27]在面临盐度胁迫时,SOD活力也会出现显著上升(P<0.05)。
值得注意的是,在干藏和湿藏两种处置条件下,无论是ACP还是SOD二者均未有明显差异,而一般认为,在活品保藏中湿藏应该明显优于干藏。初步推测这种差异可能有以下两种原因:第一,在本研究监测的捕后106 h之内,干露造成的影响可能还未显现出来;第二,本研究中所采用的干藏是基于碎冰冷却条件下的,活贝环境温度较低且时间较短,可能接近虾夷扇贝的生态冰温,使其处于一种休眠状态,从而应对胁迫[28]。
2.5 捕后活品虾夷扇贝闭壳肌中粗酶分子量分布
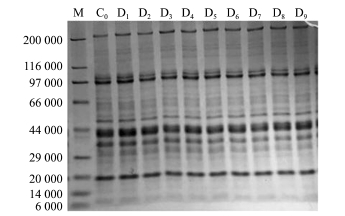
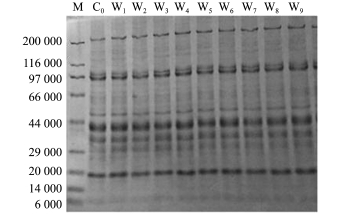
由图3、图4可知,在干藏及湿藏条件下,粗酶分子量分布在流通过程中均无明显变化。酶作为一种大分子物质,短时间的环境胁迫很难使其降解。SOD酶根据其所含金属离子主要分为3类,包括Cu/Zn-SOD、Mn-SOD、Fe-SOD,其二聚体相对分子质量分别为32 000、42 000和42 000,其四聚体相对分子质量分别为65 000、85 000和85 000[29]。结合本研究电泳条带分析,初步推测虾夷扇贝闭壳肌中存在的可能是Mn-SOD的二聚体或Fe-SOD的二聚体;不同物种中的ACP相对分子质量相差很大,小葱、甘薯和长毛对虾中ACP的相对分子质量分别为57 800、41 200和73 000[30-32],关于虾夷扇贝中ACP的分离纯化还未见报道;LSZ在动物体中主要以c型和g型存在,其相对分子质量分别为14 000和22 000[33],但在这两个相对分子质量附近均无清晰条带,说明虾夷扇贝闭壳肌中可能没有c型及g型溶菌酶;有关研究表明,CAT的相对分子质量为200 000~340 000[34],本研究中粗酶相对分子质量分析图谱在200 000均有一条明显条带,但CAT活力极低,该条带以及CAT活力有必要进一步研究核实。以上关于粗酶相对分子质量分布的结果与酶活力分析结果基本吻合,但要证实仍需进一步分离纯化及免疫印迹分析。
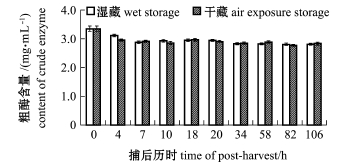
最后,本研究中对捕后活品虾夷扇贝闭壳肌中粗酶含量的变化情况也作了跟踪分析(图5)。结果发现,采捕初期活贝的粗酶含量显著下降(P<0.05),而在后续的贮藏过程中粗酶含量相对稳定,且两种贮藏方式下粗酶含量无明显区别。该现象的原因有待进一步探讨,但由此可以推测,由采捕引起的某些胁迫效应在后续的活品贮藏过程中是无法补偿的。
3 结论
本试验中,经过对采捕后活品虾夷扇贝闭壳肌中ACP、SOD、CAT和LSZ等4种胁迫应答因子的研究探索,初步发现活品虾夷扇贝闭壳肌有ACP和SOD活力,在捕后性106 h内,ACP活力呈现出先下降再升高的趋势,而SOD活力则呈先升高再下降再升高趋势,二者与虾夷扇贝所受胁迫强度均有相关性;此外,CAT活力极微且未检测出LSZ活力;值得注意的是,在本试验条件下,干藏和湿藏处理对酶活力、粗酶分子量分布和粗酶含量未表现出明显差异,但需进一步探讨。总之,活品虾夷扇贝闭壳肌中ACP和SOD活力对于捕后品质变化具有一定的科学意义,值得研究者深入探索。
参考文献:
[1] 农业部渔业渔政管理局.中国渔业统计年鉴2015[M].北京:中国农业出版社,2015.
[2] 于笛,刘俊荣,杨君德,等.海水养殖虾夷扇贝供应链可追溯管理体系的探讨[J].水产科学,2013,32(2):117-124.
[3] 杨婷婷,刘俊荣,俞微微,等.活品流通过程中虾夷扇贝风味品质的变化[J].水产学报,2015,39(1):136-146.
[4] 杨婷婷.采捕后活品虾夷扇贝(Patinopecten yessoensis)的风味变化[D].大连:大连海洋大学,2014.
[5] 傅润泽,沈建,王锡昌,等.GC-MS鉴别保活流通过程中虾夷扇贝气味特征变化[J].食品科学,2016,37(4):93-97.
[6] 傅润泽,王锡昌,沈建,等.定量描述分析与GC-MS关联鉴别不同保活流通时间的虾夷扇贝[J].中国食品学报,2016,16 (6):203-211.
[7] 傅润泽,沈建,王锡昌.底播虾夷扇贝活品流通前后挥发性成分的对比分析[J].食品科学,2015,36(2):110-113.
[8] 傅润泽,沈建,王锡昌,等.基于神经网络及电子鼻的虾夷扇贝鲜活品质评价及传感器的筛选[J].农业工程学报,2016,32 (6):268-275.
[9] 刘世永,刘俊荣,马永生,等.底播虾夷扇贝活品供应链各环节中肠道菌群分析[J].水产科学,2014,33(10):626-630.
[10] 牟海津,江晓路,刘树青,等.免疫多糖对栉孔扇贝酸性磷酸酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J].青岛海洋大学学报,1999,29(3):463-464.
[11] 张鹏,江明锋,王永.动物源溶菌酶研究进展[J].中国生物工程杂志,2012,32(8):87-93.
[12] De La Fuente M,Victor V.Anti-oxidants as modulators of immune function[J].Immunology&Cell Biology,2000,78(1): 49-54.
[13] Livingstone D R,Lips F,Martinez P G,et al.Antioxidant enzymes in the digestive gland of the common mussel Mytilus edulis[J]. Marine Biology,1992,112(2):265-276.
[14] Wongso S,Ushio H,Yamanaka H.Glycolytic enzymes in the tissues of three species of scallop(Bivalvia:Pectinidae)[J].Fisheries Science,1999,65(1):123-128.
[15] Park C K,Lee J H,Cheong H T,et al.Effect of superoxide dismutase(SOD)on pronucleus formation of porcine oocytes fertilized in vitro[J].Theriogenology,1997,48(7):1137-1146.
[16] Góth L.A simple method for determination of serum catalase activity and revision of reference range[J].Clinica Chimica Acta; International Journal of Clinical Chemistry,1991,196(2-3): 143-151.
[17] Zurier R B,Krakauer K.Lysosomal enzymes[M].Vane J R,Ferreira S H.Inflammation.Springer:Berlin Heidelberg,1978.
[18] 洪潇,余若黔.溶菌酶的活性测定方法[J].生物技术通报, 2004(5):40-42.
[19] 张龙,刘俊荣,田元勇,等.菲律宾蛤仔(Ruditapes philippina-rum)软体部位含氮物的组成及其分布[J].食品科学,2015, 36(24):95-100.
[20] 王丽丽,夏斌,陈碧鹃,等.镉胁迫对虾夷扇贝抗氧化防御系统的影响[J].海洋环境科学,2012,31(1):39-42.
[21] 李石磊,李文姬,付成东,等.饥饿胁迫对虾夷扇贝几种免疫因子的影响[J].水产科学,2011,30(8):441-444.
[22] 徐大伦,黄晓春,欧昌荣,等.浒苔多糖对华贵栉孔扇贝血淋巴中SOD酶和溶菌酶活性的影响[J].水产科学,2006,25 (2):72-74.
[23] 栗志民,钱佳慧,劳翠英,等.温度和盐度对华贵栉孔扇贝免疫相关酶的联合效应[J].海洋科学进展,2015,33(2):227-238.
[24] Jiang Weiwei,Li Jiaqi,Gao Yaping,et al.Effects of temperature change on physiological and biochemical responses of Yesso scallop,Patinopecten yessoensis[J].Aquaculture,2016,451:463-472.
[25] 方春华,乔琨,刘智禹,等.海洋生物中抗氧化酶的研究进展[J].渔业研究,2016,38(4):331-342.
[26] 李志华,谢松,王军霞,等.饥饿对日本沼虾生长和部分免疫功能的影响[J].上海海洋大学学报,2007,16(1):16-21.
[27] 邓平平,施永海,汪洋,等.盐度对长江刀鲚幼鱼非特异性免疫酶和消化酶活力的影响[J].大连海洋大学学报,2016,31 (5):533-537.
[28] 米红波,侯晓荣,茅林春.鱼虾类保活运输的研究与应用进展[J].食品科学,2013,34(13):365-369.
[29] 徐靖.超氧化物歧化酶及其应用的研究进展[J].食品工业科技,2013,34(12):387-391.
[30] 陈素丽,陈清西,胡天惠,等.长毛对虾酸性磷酸酶的纯化与性质[J].厦门大学学报:自然科学版,1997,36(1):121-125.
[31] 李星.甘薯叶酸性磷酸酶的分离纯化、部分性质和功能基团研究[D].重庆:西南大学,2014.
[32] 任美凤.小葱酸性磷酸酶的分离纯化及性质和功能基团研究[D].重庆:西南大学,2013.
[33] 傅立元.虾夷扇贝beta-actin基因和G型溶菌酶基因的克隆与表达研究[D].大连:辽宁师范大学,2010.
[34] Switala J,Loewen P C.Diversity of properties among catalases [J].Archives of Biochemistry and Biophysics,2002,401(2): 145-154.
Immunologic factors in adductors and quality evaluation in live and air exposure and wet stored Yesso scollap Patinopecten yessoensis
ZHENG Yao1,LIU Jun-rong1,ZHOU Yan-lin1,LIU Hui-hui1, SONG Yang1,TIAN Yuan-yong1,ZHAO Xue-wei2
(1.College of Food Science and Engineering,Dalian Ocean University,Dalian 116023,China;2.Zhangzidao Group Company Limited,Dalian 116001,China)
Abstract:To explore the quality change of post-harvested commercial bivalves,the metobolic profiles of Yesso scallop Patinopecten yessoensis were studied under stress during live storage.The regualr pattern of four nonspecific immunity factors,including acid phosphatase(ACP),superoxide dismutase(SOD),catalase(CAT)and lysozyme (LSZ)were monitored following the change of time.Wet storage and air exposure storage,two current commercial live storage ways,were carried out at five key links including boarding,transporting,landing,transition holding and purification.The results showed that,during the 106h of post-harvest,ACP activities were first declined and then increased and that SOD activities were first increased and then deceased,indicating that ACP and SOD have good connection with stress intensity of Yesso scallop.CAT activity was detected at a negligible level and LSZ activity was not detected.In a word,nonspecific immunity factors,ACP and SOD activities in the adductor of scallop are needed for further investigation as stress-response indicators and for quality evaluation index of live product.
Key words:Patinopecten yessoensis;post-harvest;adductor;live product
DOI:10.16535/j.cnki.dlhyxb.2017.02.016
文章编号:2095-1388(2017)02-0217-07
中图分类号:S984.3
文献标志码::A
收稿日期:2016-10-14
基金项目:国家自然科学基金资助项目(31271980,31671790)
作者简介:郑尧(1992—),男,硕士研究生。E-mail:zhengyao20111@163.com
通信作者:刘俊荣(1963—),女,博士,教授。E-mail:ljunrong@dlou.edu.cn