饲料中添加壳寡糖对刺参肠壁菌群的影响
司滨1,王轶南1,刘海映2,曹海龙3,张建强4,吕绘倩1,孙梦蕾1,姜志强1
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连海洋大学海洋科技与环境学院,辽宁大连116023;3.中国科学院大连化学物理研究所,辽宁大连116023;4.大连市水产产业技术创新联合会,辽宁大连116023)
摘要:为研究饲料中添加壳寡糖对刺参Apostichopus japonicus肠壁菌群的影响,在刺参基础饲料中分别添加0.25%(G1)、0.50%(G2)、0.75%(G3)和1.00%(G4)的壳寡糖,另设对照组(G0),养殖50 d后采集各组刺参幼参(5.03 g±0.03 g)肠壁样品,并采用高通量测序技术分析刺参肠壁菌群结构特征。结果表明:壳寡糖添加组刺参肠壁的细菌多样性和丰度均高于对照组;各组样品肠壁优势菌门均为变形菌门和厚壁菌门;壳寡糖对刺参肠壁菌群组成产生了明显影响,对照组优势菌属为希瓦氏菌属Shewanella,而壳寡糖添加组希瓦氏菌属的相对比例均下降,对照组芽孢杆菌属Bacillus的相对比例较低,而壳寡糖添加组芽孢杆菌属的相对比例均较高或成为优势菌属;1.00%壳寡糖组各类菌属相对比例均较低,高浓度壳寡糖出现抑制现象。研究表明,饲料中添加壳寡糖可提高刺参肠壁细菌多样性和丰度,明显改善刺参肠壁菌群结构。
关键词:刺参;高通量测序;壳寡糖;菌群结构
刺参Apostichopus japonicus的规模化和集约化养殖常导致刺参发病,尤其是腐皮综合征和细菌性溃烂综合征严重制约着刺参养殖业的发展[1-2]。随着化学药物和抗生素类药物的禁用,人们通过研发免疫增强剂以有效地防控疾病并提高刺参的产量及品质。壳寡糖由壳聚糖降解得到,壳寡糖与壳聚糖水相比具有溶性高、黏度低等物理特性,具有更好的抗菌和免疫能力[3-4]。研究表明,饲料中添加适量壳寡糖能够提高水产动物机体免疫力,改善生产性能[5],促进其肠道菌群增殖[6],改善幼鱼肠道菌群环境[7]。蔡雪峰等[8]在饲料中添加壳寡糖能使虹鳟肠道内肠杆菌科和假单胞菌属大量减少。目前,有关投喂添加壳寡糖的饲料对刺参肠壁菌群影响的研究尚未见报道。本研究中,采用MiSeq测序技术对投喂壳寡糖饲料的刺参肠壁菌群结构进行分析,以期为壳寡糖在刺参养殖中的应用提供参考。
1 材料与方法
1.1 材料
试验用刺参取自大连鹤圣丰养殖场。壳寡糖(chitosan oligosaccharide,COS)含量约为33%,用纤维素和卡拉胶进行双层包被,能有效降低在水中的溶失。
1.2 方法
1.2.1 试验设计 试验在大连海洋大学农业部北方海水增养殖重点实验室进行,试验中根据饲料中壳寡糖添加量分为5组,G0组(对照组)、G1组(0.25%)、G2组(0.50%)、G3组(0.75%)、G4组(1.00%),每组设3个平行,共15个水槽(200 L),每个水槽放体质量为(5.03±0.03)g的刺参幼参80头。每天投饵1次,按体质量的4%投喂,两天换水1次,换水量为1/3~1/2,并虹吸残饵及粪便。养殖期间,全天充气,水温控制在(19±2)℃,盐度为32.0,pH为8.00,养殖试验共进行60 d。养殖50 d时,采集刺参肠壁,取样前一天禁食,从每个水槽取样3头,在无菌环境中收集刺参肠道,除去肠道内容物后,合并每组样品,-80℃下冻存待用。按照分组,将肠壁样品分别记为G0、G1、G2、G3、G4组。
1.2.2 DNA提取、PCR扩增及测序 使用土壤DNA提取试剂盒(OMEGA Soil DNA Kit,D5625)提取肠壁DNA。采用16S rDNA扩增引物341F(5′CCTACGGGNGGCWGCAG 3′)和805R(5′GACTACHVGGGTATCTAATCC 3′)对样品DNA进行扩增。PCR反应体系(共30 μL):2×Phusion Master Mix 15 μL,Primer 3 μL,1 ng/μL DNA 10 μL,双蒸水2 μL。反应程序为:98℃下预变性1 min;98℃下变性10 s,50℃下退火30 s,72℃下延伸30 s,共进行30个循环;最后在72℃下再延伸5 min。根据PCR产物浓度进行等浓度混样,充分混匀后使用20 g/L的琼脂糖电泳纯化PCR产物,利用Qubit 2.0 DNA检测试剂盒对回收的DNA精确定量,混合后测序。
质量控制:采用Prinseq软件(PRINSEQ-lite 0.19.5)对所得测序序列的3′端进行质控,截掉质量低的数据;通过FLASH 1.2.7软件融合双末端序列,使其形成一条序列;采用PRINSEQ-lite 0.19.5软件对各个样品进行去引物序列、短片段、低复杂度序列、低质量序列。
非靶区域序列及嵌合体的去除:采用集成于Mothur中的Pre.cluser软件对测序校正,校正过程中允许的最大错配为1/150;采用UCHIME软件,以SILVA数据库中序列作为模版去除嵌合体。
1.3 数据处理
采用UCLUST 1.1.579软件将序列按照序列相似性为97%的阈值进行操作分类单元(Operational Taxonomic Units,OTU)聚类。对OTU进行Coverage(Good's coverage)和稀缺型曲线分析,以及丰富度指数(ACE和Chao1指数)和多样性指数(Simpson指数)分析。选择OTU里的一条代表序列(默认丰度最高),采用RDP classifier软件进行物种分类,分类阈值默认为0.8。
2 结果与分析
2.1 刺参肠壁微生物群落多样性及相关性分析
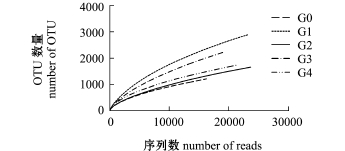
利用Mouthur软件计算在97%相似水平上的每个样品的OTU数量,此数量可代表样品物种的丰度[9]。由表1可知,各样品中,OTU数量最多可达2908,最少为1210。这表明刺参幼参肠壁的菌群丰度很高,且各样品中的丰度差异较大。同时,综合各项多样性指数分析,G1组的细菌多样性最高(ACE值和Chao1值最高,Simpson指数最低),对照组多样性最低(ACE指数和Chao1指数最低, Simpson指数最高),说明投喂壳寡糖饲料后,刺参肠壁微生物多样性高于对照组。根据序列数及其所代表的OTU数量构建稀缺性曲线(图1),结果表明,各样品稀缺性曲线趋于平缓,指数基本达到饱和,证明有效序列数量已经能够较好地覆盖细菌多样性。本研究中,当测序数相同时,壳寡糖添加组刺参的肠壁菌群OTU数量均比对照组高,表明壳寡糖添加组刺参的肠壁菌群多样性高于对照组。其中G1组刺参的肠壁菌群OTU数量最高。
表1 刺参肠壁样品高通量测序数据统计
Tab.1 Data on intestinal wall samples of sea cucumber by the high-through sequencing technique
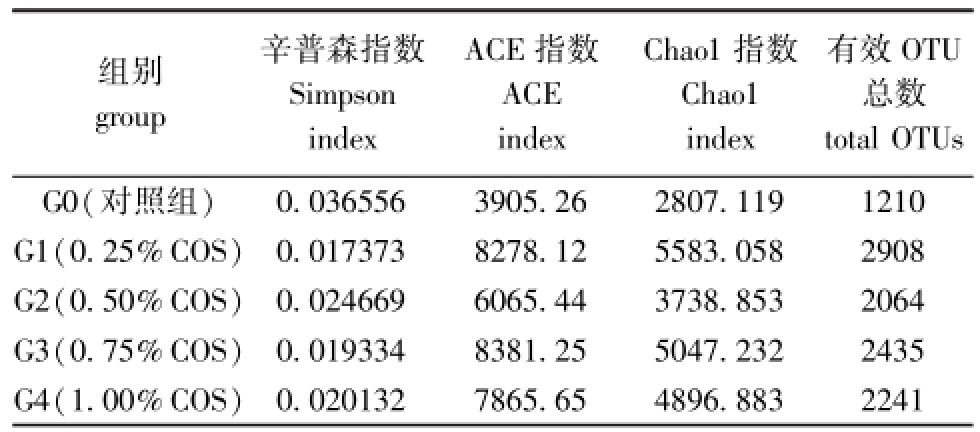
有效OTU总数0.0365563905.262807.1191210 G1(0.25%COS)0.0173738278.125583.0582908 G2(0.50%COS)0.0246696065.443738.8532064 G3(0.75%COS)0.0193348381.255047.2322435 G4(1.00%COS) total OTUs G0(对照组)组别group辛普森指数Simpson index ACE指数ACE index Chao1指数Chao1 index 0.0201327865.654896.8832241
2.2 刺参肠壁菌群结构分析
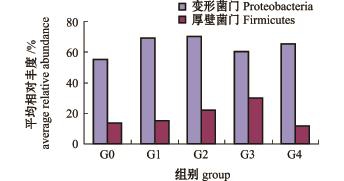
在肠壁样品检测分类结果中,检测到的细菌可归属于30门、60纲、121目、232科、834属。主要门类为变形菌门Proteobacteria、厚壁菌门Firmicutes、拟杆菌门Bacteroidetes、疣微菌门Verrucomicrobia、浮霉菌门Planctomycetes、放线菌门Actinobacteria等(图2)。另外,有24个门的细菌在水样样品中的检测量不足1%。各组肠壁样品中68.79%以上均由变形菌门和厚壁菌门组成。由图2可知:G2组刺参肠壁中变形菌门含量最高,所占相对比例为70.08%,对照组最低,为55.12%; G3组肠壁厚壁菌门比例最高,为30.23%,G4组最低,为11.51%,对照组肠壁厚壁菌门所占比例仅比G4组高。由图3可知:厚壁菌门平均相对丰度随着壳寡糖添加量的增大,呈现先升高后下降的趋势;优势菌门和次优势菌门的相对丰度比值呈现先增大后减小再增大的趋势,G1、G2、G4组优势菌门和次优势菌门的相对丰度比值均大于对照组, G3组最小,G4组最大。
在样品中选取菌群丰度最高的10个属并计算在各样品中所占的相对比例(表2)。经序列比对发现,主要隶属于变形菌门、浮霉菌门、拟杆菌门、疣微菌门和厚壁菌门。各组样品中共有且相对比例较高的菌属分别为希瓦氏菌属、假单胞菌属、不动杆菌属和芽孢杆菌属。这4种优势菌属在各组中所占比例为G0组42.64%,G1组42.45%,G2组42.06%,G3组33.62%,G4组19.28%,其中G4组各菌属比例均较低。这4种共有菌属中,壳寡糖添加组与对照组相比,优势菌属发生了较大改变。对照组中比例最高的为希瓦氏菌属,为17.23%,而壳寡糖添加组中希瓦氏菌属比例均为最低,最高比例也仅为7.29%;对照组中比例最低的芽孢杆菌属仅为5.97%,而壳寡糖添加组中此均属比例升高,成为优势菌属,最高达15.06%;假单胞菌属比例则随壳寡糖添加量的增大逐渐降低,对照组中比例最高;不动杆菌属相对比例随壳寡糖添加量的增大呈现先升高后下降的趋势。
3 讨论
本研究中利用Illu mina MiSeq平台的高通量测序技术分析了样品刺参肠壁的菌群多样性。经分析发现,除共有的几个门类细菌外,还检测到广古细菌门Euryarchaeota、脱铁杆菌门Deferribacteres、硝化螺旋菌门Nitrospira、纤维杆菌门Fibrobacteres、芽单胞菌门Gemmatimonadetes、产水菌门Aquificae等菌群,但在各样品中的检出量均不足1%[10],表明测序结果能够有效反映细菌群落。
3.1 壳寡糖对刺参肠壁菌群结构的影响
综合各项多样性指数和稀缺性曲线分析结果可知,刺参肠壁样品中,壳寡糖添加量为0.25%的组菌群多样性和菌落丰度最高,对照组最低,壳寡糖添加组菌群多样性和菌落丰度均优于对照组。由此可推断,饲料中添加壳寡糖能够对刺参肠壁菌群多样性和结构组成产生有益影响,但肠壁菌群的多样性并非随着壳寡糖添加量的增大而升高,壳寡糖添加量为0.25%时作用最佳。蔡雪峰等[8]研究表明,壳寡糖能够影响虹鳟幼鱼的肠道菌落组成; Qin等[11]研究发现,壳寡糖能够减少罗非鱼肠道中病原菌的数量,并改善肠道菌群的数量和组成。樊英等[12]指出,党参免疫增强剂能够显著增加刺参肠道的异养菌数量,抑制弧菌的数量。本研究结果与上述研究结果相类似。本研究中主要针对刺参肠壁的菌群进行研究,与以上学者的研究对象存在一定区别。
本研究结果显示,样品刺参肠壁中的优势菌门为变形菌门,与李建光等[13]在不同养殖季节对刺参肠道菌群结构的检测结果一致。王姣姣等[14]也发现,不同养殖月份刺参肠道内的优势菌群均为γ-变形菌。本研究中发现,样品刺参肠壁中的次优势菌门为厚壁菌门,厚壁菌门平均相对丰度随着壳寡糖添加量的增大呈现先升高后下降趋势,壳寡糖添加量为0.75%组的厚壁菌门的平均相对丰度最大,1.00%壳寡糖添加组最低,比对照组低15.80%。由此推断,随着壳寡糖添加量的增加,对厚壁菌门也会产生抑制现象。
3.2 壳寡糖对刺参肠壁优势菌属的影响
通过对比各样品刺参肠壁中菌群丰度前10的优势菌属发现,各组肠道优势菌属有所变化且比例不同,其中有4种优势菌属为各样品所共有,其在对照组和壳寡糖添加组中所占比例不同,对照组中比例最高的希瓦氏菌属和假单胞菌属,在壳寡糖添加组中的比例均有所下降且所占比例较低。希瓦氏菌属和假单胞菌属属于致病菌,腐败活性强,能够引起冷藏鲜鱼的腐败[15]。秦蕾等[16]研究发现,腐败希瓦氏菌作为一种潜在的病原可能对异育银鲫的养殖造成影响。Koziñska等[17]也发现,希瓦氏菌属能够引起鲤和鳟的病害。本研究中,刺参肠壁中不动杆菌属的比例也发生了变化,除壳寡糖添加量1.00%组外,其余组较对照组的比例均有升高。不动杆菌属是一群致病力较低的条件致病菌,引起的感染很少见。大西洋鲑肠道的优势菌属就有不动杆菌属,且为原驻菌群[18]。对照组中比例较低的芽孢杆菌属,反而在壳寡糖添加组中相对比例升高,在壳寡糖添加量为0.25%组中,该菌为优势度最高菌属且所占比例最大(15.06%)。在壳寡糖添加组中,芽孢杆菌属比例随壳寡糖添加量逐渐减小。芽孢杆菌属和革兰氏阳性菌对水产动物病原菌具有一定的拮抗作用[19]。另有研究发现,芽孢杆菌能够调节宿主的肠道菌群平衡,加速食物的消化和吸收[20]。芽孢杆菌属是厚壁菌门的主要菌属,具有良好的脱氮去磷活性,还能促进消化酶活性[21]。
本研究表明,壳寡糖对刺参肠壁菌群组成产生了影响,且这种影响与壳寡糖含量有关,这与对门水平的菌群研究相一致,1.00%壳寡糖添加量对芽孢杆菌属产生抑制现象。从样品肠壁菌群丰度前10的菌属可以看出,壳寡糖添加量为1.00%组刺参肠壁中各类菌属的比例均较低,由此推测,各菌属比例并未随壳寡糖添加量的增大而升高,较高添加量反而抑制肠壁菌群结构。蔡雪峰等[8]也指出,在体外抑菌试验中,壳寡糖在较高浓度时会产生抑菌作用。本研究发现,刺参饲料中添加壳寡糖在一定范围内影响菌群结构,但并未发生菌群整体结构的异常变化,只是优势菌属的相对比例发生改变。
综上所述,投喂壳寡糖饲料能够增加刺参肠壁菌群的多样性和丰度,改善肠壁菌群结构,但对刺参肠壁菌群整体结构并不会产生异常变化,故饲料中添加壳寡糖作为刺参免疫增强剂是可行的。
表2 刺参肠壁样品中优势度最高的10个属
Tab.2 The top ten genera in dominance in each intestinal wall samples of sea cucumberApostichopus japonicus
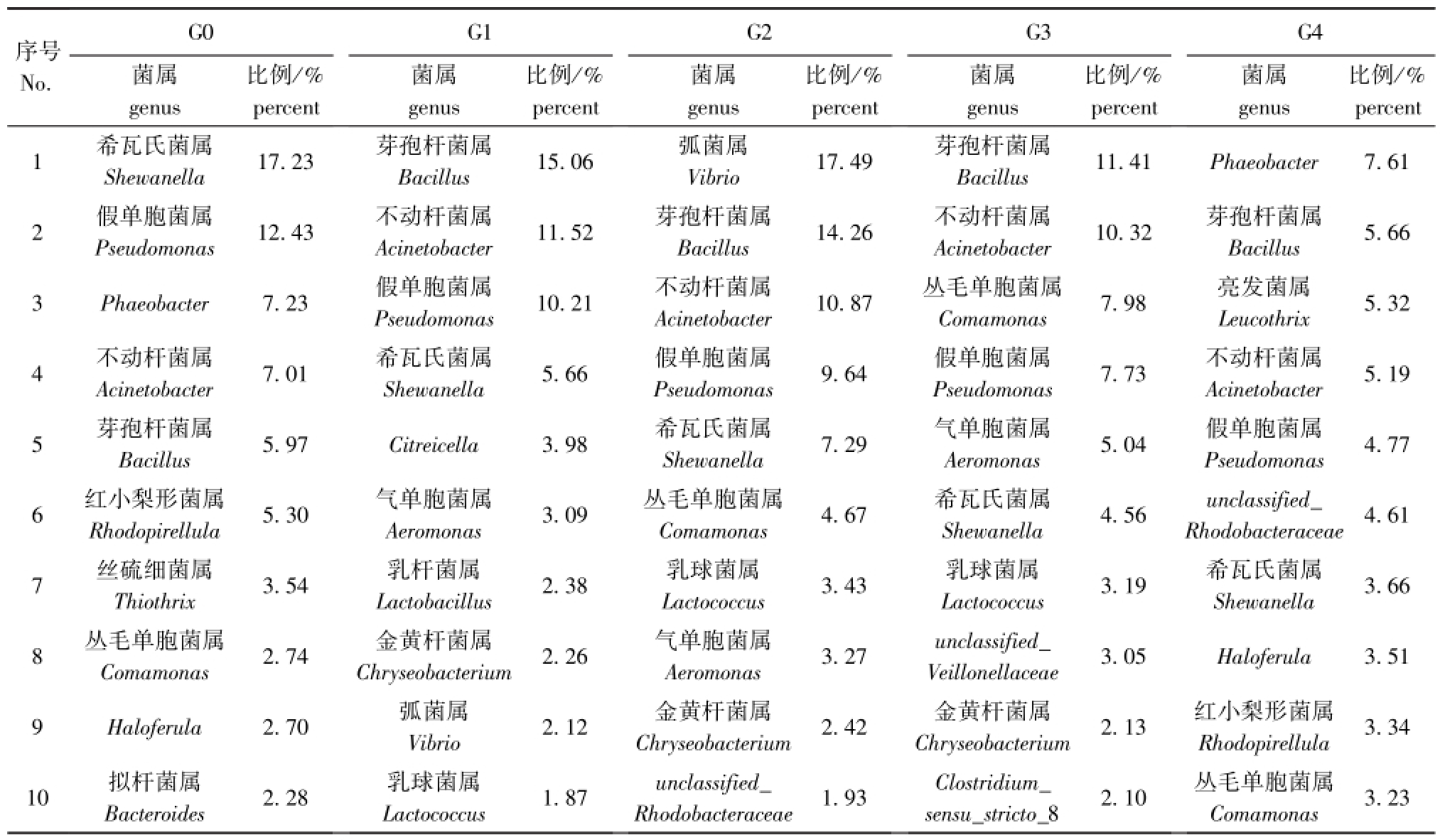
序号No. G0菌属genus比例/%比例/%比例/%比例/%比例/% percent 1希瓦氏菌属percent G1菌属genus percent G2菌属genus percent G3菌属genus percent G4菌属genus 7.61 2假单胞菌属Shewanella17.23芽孢杆菌属Bacillus15.06弧菌属Vibrio17.49芽孢杆菌属Bacillus11.41Phaeobacter Pseudomonas12.43不动杆菌属Acinetobacter11.52芽孢杆菌属Bacillus14.26不动杆菌属Acinetobacter10.32芽孢杆菌属Bacillus5.66 3Phaeobacter7.23假单胞菌属Pseudomonas10.21不动杆菌属Acinetobacter10.87丛毛单胞菌属Comamonas7.98亮发菌属Leucothrix5.32 4不动杆菌属Acinetobacter7.01希瓦氏菌属Shewanella5.66假单胞菌属Pseudomonas9.64假单胞菌属Pseudomonas7.73不动杆菌属Acinetobacter5.19 5芽孢杆菌属Bacillus5.97Citreicella3.98希瓦氏菌属Shewanella7.29气单胞菌属Aeromonas5.04假单胞菌属Pseudomonas4.77 6红小梨形菌属Rhodopirellula5.30气单胞菌属Aeromonas3.09丛毛单胞菌属Comamonas4.67希瓦氏菌属Shewanella4.56unclassified_ Rhodobacteraceae4.61 7丝硫细菌属Thiothrix3.54乳杆菌属Lactobacillus2.38乳球菌属Lactococcus3.43乳球菌属Lactococcus3.19希瓦氏菌属Shewanella3.66 8丛毛单胞菌属Comamonas2.74金黄杆菌属Chryseobacterium2.26气单胞菌属Aeromonas3.27unclassified_ Veillonellaceae3.05Haloferula3.51 9Haloferula2.70弧菌属Vibrio2.12金黄杆菌属Chryseobacterium2.42金黄杆菌属Chryseobacterium2.13红小梨形菌属Rhodopirellula3.34 10拟杆菌属Bacteroides2.28乳球菌属Lactococcus1.87unclassified_ Rhodobacteraceae1.93Clostridium_ sensu_stricto_82.10丛毛单胞菌属Comamonas 3.23
参考文献:
[1] Wang Yingeng,Zhang Chunyun,Rong Xiaojun,et al.Diseases of cultured sea cucumber,Apostichopus japonicus,in China[R].FAO Fisheries Technical Paper,2005:297-310.
[2] Li Hua,Qiao Guo,Gu Jiequan,et al.Phenotypic and genetic characterization of bacteria isolated from diseased cultured sea cucumber Apostichopus japonicus in northeastern China[J].Diseases of Aquatic Organisms,2010,91(3):223-235.
[3] Huang R L,Yin Y L,Wu G Y,et al.Effect of dietary oligochitosan supplementation on ileal digestibility of nutrients and performance in broilers[J].Poultry Science,2005,84(9):1383-1388.
[4] Kim S K,Rajapakse N.Enzymatic production and biological activities of chitosan oligosaccharides(COS):a review[J].Carbohydrate Polymers,2005,62(4):357-368.
[5] 梁新晓,綦文涛,王永伟,等.壳寡糖的生物学功能及其在动物营养中的应用研究进展[J].中国畜牧兽医,2014,41(2):78-82.
[6] Lee H W,Park Y S,Jung J S,et al.Chitosan oligosaccharides,dp 2-8,have prebiotic effect on the Bifidobacterium bifidium and Lactobacillus sp.[J].Anaerobe,2002,8(6):319-324.
[7] 田娟,孙立威,文华,等.壳寡糖对吉富罗非鱼幼鱼生长性能、前肠组织结构及肠道主要菌群的影响[J].中国水产科学, 2013,20(3):561-568.
[8] 蔡雪峰,罗琳,战文斌,等.壳寡糖对虹鳟幼鱼肠道菌群影响的研究[J].中国海洋大学学报:自然科学版,2006,36(4):606-610.
[9] Zhang Meiling,Zhang Menghui,Zhang Chenhong,et al.Pattern extraction of structural responses of gut microbiota to rotavirus infection via multivariate statistical analysis of clone library data[J]. FEMS Microbiology Ecology,2009,70(2):21-29.
[10] Amann R I,Ludwig W,Schleifer K H.Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J].Microbiological Reviews,1995,59(1):143-169.
[11] Qin Chubin,Zhang Yuting,Liu Wenshu,et al.Effects of chito-oligosaccharides supplementation on growth performance,intestinal cytokine expression,autochthonous gut bacteria and disease resistance in hybrid tilapia Oreochromis niloticus♀×Oreochromis aureus♂[J].Fish&Shellfish Immunology,2014,40(1):267-274.
[12] 樊英,李乐,于晓清,等.免疫增强剂党参对仿刺参肠道菌群结构的影响[J].动物营养学报,2015,27(2):638-646.
[13] 李建光,徐永平,李晓宇,等.不同养殖季节仿刺参肠道与养殖环境中菌群结构的特点[J].水产科学,2014,33(9):562-568.
[14] 王姣姣,李丹,王轶南,等.不同养殖时期刺参肠道内菌群结构的分析[J].大连海洋大学学报,2015,30(4):345-350.
[15] Zhang Na,Liu Junhong.Fish spoilage bacteria—problems and solution[J].Food Science,2003,24(12):150-152.
[16] 秦蕾,张晓君,毕可然.一种新的异育银鲫病原——腐败希瓦氏菌[J].微生物学报,2012,52(5):558-565.
[17] Koziñska A,Pêkala A.First isolation of Shewanella putrefaciens from freshwater fish—a potential new pathogen of fish[J].Bulletin of the European Association of Fish Pathologists,2004,24 (4):189-193.
[18] Hovda M B,Lunestad B T,Fontanillas R,et al.Molecular characterisation of the intestinal microbiota of farmed Atlantic salmon (Salmo salar L.)[J].Aquaculture,2007,272(1-4):581-588.
[19] Rengpipat S,Rukpratanporn S,Piyatiratitivorakul S,et al.Immunity enhancement in black tiger shrimp(Penaeus monodon)by a probiont bacterium(Bacillus S11)[J].Aquaculture,2000,191 (4):271-288.
[20] Gómez G D,Balcázar J L.A review on the interactions between gut microbiota and innate immunity of fish[J].FEMS Immunology&Medical Microbiology,2008,52(2):145-154.
[21] 施伟达,章文敏,周冬仁,等.芽孢杆菌研究进展及其在水产养殖中的应用[J].现代农业科技,2012(2):310-311,317.
Effect of dietary chitosan oligosaccharide on bacterial community in intestinal wall of sea cucumber Apostichopus japonicus
SI Bin1,WANG Yi-nan1,LIU Hai-ying2,CAO Hai-long3,ZHANG Jian-qiang4, LÜ Hui-qian1,SUN Meng-lei1,JIANG Zhi-qiang1
(1.Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China;2.College of Marine Science and Environment,Dalian Ocean University,Dalian 116023,China;3.Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023,China;4.Dalian Fisheries Industry Technology Innovation Association,Dalian 116023,China)
Abstract:The bacterial community in intestinal wall was investigated in sea cucumber Apostichopus japonicus(5.03 g±0.03 g)fed diets containing chitosan oligosaccharide(COS)at dose of 0(G0,as control group),0.25%(G1), 0.50%(G2),0.75%(G3)and 1.00%(G4)for 50 days by high-through sequencing technique in order to evaluate the effect of dietary COS on the bacterial community structures.The results showed that there were higher bacterial diversity and abundance in the intestinal wall of the sea cucumber fed the diets containing COS than the sea cucumber fed the control diet,with dominant Proteobacteria and Firmicutes,indicating that composition of intestinal bacteria was affected by COS.The dominant genus Shewanella was observed in the intestinal wall of the sea cucumber in the control group,while the proportion of Shewanella was found to be reduced in the intestinal wall of the sea cucumber fed the diets containing COS.It was found that Bacillus was increased in amount even became the dominant bacteria in the intestinal wall of the sea cucumber fed the diets containing COS compared with the sea cucumber fed the control diet.In group G4,however,there was lower relative proportion of various bacterial genera, high dose of COS showing inhibitory effect of bacterial diversity.The findings suggest that only optimal dose of dietary COS improve bacterial diversity and abundance in the intestinal wall of the sea cucumber.
Key words:Apostichopus japonicus;high-through sequencing technique;chitosan oligosaccharide;bacterial community
DOI:10.16535/j.cnki.dlhyxb.2017.02.008
文章编号:2095-1388(2017)02-0167-05
中图分类号:S963.7;S96
文献标志码::A
收稿日期:2016-10-14
基金项目:国家海洋局公益性行业科研专项(201405003);大连市科技计划项目(2012B11NC049)
作者简介:司滨(1991—),男,硕士研究生。E-mail:18804209975@163.com
通信作者:姜志强(1960—),男,教授。E-mail:zhqjiang@dlou.edu.cn