摘要:为进一步研究太平洋鳕Gadus macrocephalus抗冻蛋白AFP4的功能,通过RT-PCR方法克隆得到太平洋鳕4型抗冻蛋白基因(AFP4)的开放阅读框(open reading frame,ORF),构建原核表达载体并优化表达条件,利用纯化的重组蛋白制备多克隆抗体,采用间接ELISA法检测抗体的效价,用Western-blot法分析重组蛋白的免疫原性。结果表明:AFP4基因编码区长度为375 bp,编码125个氨基酸;将AFP4基因的ORF与载体pET-32a连接,构建重组体pET-32a-AFP4,并将其转入大肠杆菌BL21(DE3)感受态细胞中;经诱导、表达和条件优化,发现该重组体在37℃、0.01 mmol/L IPTG条件下诱导3 h获得最大的表达量;对该重组蛋白进行纯化,利用纯化的蛋白免疫新西兰大白兔制备多克隆抗体,采用间接ELISA法检测该抗体效价为1∶1 600 000;Western blot分析显示,重组蛋白可以与兔抗AFP4多克隆抗体发生特异性结合,表明该重组蛋白具有免疫原性。本研究结果可为深入研究太平洋鳕AFP4蛋白功能提供理论依据。
关键词:太平洋鳕;抗冻基因;原核表达;抗体
抗冻蛋白(antifreeze proteins,AFPs)是一类具有提高生物抗冻能力的蛋白质类化合物的总称,存在于多种生物体内,动物、植物、细菌和真菌等均能够产生抗冻蛋白[1-3]。抗冻蛋白的作用原理是以非依数性形式降低水溶液的冰点,但对熔点影响甚微,从而导致水溶液的熔点与冰点间出现差值,这种差值称为热滞活性或抗冻活性,差值越大,抗冻活性就越大。因而,抗冻蛋白亦称为热滞蛋白(Thermal hysteresis proteins,THPs)。目前,鱼类AFPs根据其氨基酸组成、结构特点和发现的先后顺序,分为抗冻糖蛋白(Antifreeze glycoprotein, AFGP)[1-2,4],以及1型[3,5]、2型[6-7]、3型[8-9]、4型抗冻蛋白(Antifreeze protein)[10-11]和高活性抗冻蛋白(Hyperactive antifreeze protein,HAFP)[12]。4型抗冻蛋白是Deng等[13-14]从长角杜父鱼Myoxocephalus octodecimspinosis血清中分离得到的一种新型抗冻蛋白,该蛋白含有108个氨基酸,相对分子量约为12 300,其前体蛋白为128个氨基酸,Gln含量高达17%,其N末端被焦谷氨酰基团所封闭。鱼类AFP4蛋白中α螺旋的含量很高(1℃时高达60%),由4个螺旋折叠成一个螺旋束[14-16],其氨基酸序列与载脂蛋白具有一定的同源性[17]。
目前,关于AFP4蛋白的研究只在异育银鲫Carassiusauratus gibelio[18]、大黄鱼Larimichthys crocea[19]、斑马鱼Danio rerio[20]等少数鱼类中曾有报道,且对于AFP4蛋白的功能仍存在争议,研究认为其可能含有抗冻活性,除具有结合冰晶的功能外,AFP4还可能具有结合配体和保护尚未产生血液循环系统的胚胎的功能。
太平洋鳕Gadus macrocephalus又名大头鳕,分布于太平洋北部沿岸海域,是中国北方乃至世界的重要海洋经济鱼类之一[4]。太平洋鳕属冷水性底层鱼类[21],之所以能在低温环境中生活,可能与其体内的某些抗冻蛋白相关。已有研究从太平洋鳕肝组织转录组中获得了AFP4(GenBank:KX-430014)基因的片段序列[22],为进一步研究AFP4蛋白的功能,本试验中利用RT-PCR技术克隆得到太平洋鳕AFP4的ORF,对序列进行初步分析,将其与原核表达载体pET-32a连接,成功构建原核表达载体,并进行了原核表达条件优化以及多克隆抗体的制备等,旨在为深入研究太平洋鳕AFP4蛋白的功能提供理论参考。
1.1 材料
试验鱼为野生太平洋鳕成年雌鱼,捕捞于大连市黑石礁海域,体质量为1.74 kg。
TriPure Isolation Reagent购自Roche公司;反转录试剂盒(PrimeScriptRTreagentKit)、pMD18-T vector、限制性核酸内切酶购自宝生物工程(大连)有限公司;亲和层析柱(ProteinISOTMNi-NTA Resin)、IPTG、2×EasyTaq PCR SuperMix、Easy Pure Plasmid MiniPrep质粒提取试剂盒购自北京全氏金生物技术有限公司;琼脂粉(Agar)、氨苄青霉素(Amp)、San Prep柱式DNA胶回收试剂盒、AP标记的羊抗兔IgG购自生工生物工程(上海)股份有限公司;弗式完全佐剂、弗式不完全佐剂购自Sigma公司;HRP-DAB底物显色试剂盒购自天根生化(北京)科技有限公司;PVDF膜、NBT/BCIP显色试剂盒购自北京索莱宝生物科技有限公司;其他试剂均为国产分析纯;表达载体pET-32a、感受态细胞DH5α及BL21(DE3)为辽宁省北方鱼类应用生物学与增养殖重点实室保存。
1.2 方法
1.2.1 总RNA提取 取太平洋鳕肝组织20 mg,按照TriPure Isolation Reagent使用说明书提取总RNA,经10 g/L琼脂糖凝胶电泳检测、紫外可见分光光度计鉴定(确定)RNA质量和浓度,于超低温冰箱(-80℃)中保存备用。将完整性较好的RNA按照PrimeScript RT reagent Kit说明书进行反转录,反应产物置于-20℃下保存备用。
1.2.2 AFP4基因的克隆及生物信息学分析 根据太平洋鳕肝组织转录组数据中的AFP4基因片段序列[23],运用Primer Premier 5.0软件设计一对特异性引物,AFP4-F:5′ATGAAATACACACTCATCGC 3′,AFP4-R:5′CTGGGCGATGGCCTTGGCCTGG 3′。以太平洋鳕肝组织RNA反转录产物为模板进行PCR扩增,PCR反应程序为:95℃下预变性5 min;94℃下变性30 s,62℃下退火复性30 s,72℃下延伸1 min,共进行34个循环;最后在72℃下再延伸10 min。PCR产物经10 g/L琼脂糖凝胶电泳检测后,用胶回收试剂盒进行纯化回收。将回收纯化的目的片段AFP4与pMD18-T载体连接,连接产物转化至大肠杆菌DH5α感受态细胞中,转化产物涂布于含Amp抗性的LB固体培养基中培养。挑取单克隆,利用通用引物M13(M13-F:5′CGCCAGGGTTTTCCCAGTCACGAC 3′,M13-R:5′AGCGGATAACAATTTCACACAGGA 3′)对菌落进行PCR鉴定,取阳性克隆送生工生物工程(上海)股份有限公司进行测序。利用DNAMAN和ORF Finder软件进行分析并推测其氨基酸序列;利用ExPASy服务器(http://www.expasy.org/proteomics)在线ProtParam、Compute pI/Mw工具预测AFP4蛋白的理化性质和亲疏水性。
1.2.3 重组质粒的构建 根据AFP4基因的核苷酸序列设计一对特异性引物,AFP4-F1:![]()
![]() (下划线部分为BamHⅠ酶切位点),
(下划线部分为BamHⅠ酶切位点),![]() CTGGGCGATGGCCTTGGCCT 3′(下划线部分为HandⅢ酶切位点),克隆太平洋鳕AFP4的ORF。将“1.2.2节”中克隆测序确认有外源基因插入的正确质粒菌液进行质粒PMD-AFP4抽提,以抽提的质粒为模板,以AFP4-F1、AFP4-R1为上下游引物进行PCR扩增。PCR反应程序为:94℃下预变性5 min;94℃下变性30 s,58℃下退火复性30 s,72℃下延伸1 min,共进行34个循环;最后在72℃下再延伸10 min。将AFP4的PCR产物与载体pET-32a分别进行BamHⅠ和HandⅢ双酶切后,经T4 DNA连接酶连接后转入大肠杆菌DH5α中,利用通用引物T7对菌落进行PCR检测并将阳性克隆送生工生物工程(上海)股份有限公司测序。
CTGGGCGATGGCCTTGGCCT 3′(下划线部分为HandⅢ酶切位点),克隆太平洋鳕AFP4的ORF。将“1.2.2节”中克隆测序确认有外源基因插入的正确质粒菌液进行质粒PMD-AFP4抽提,以抽提的质粒为模板,以AFP4-F1、AFP4-R1为上下游引物进行PCR扩增。PCR反应程序为:94℃下预变性5 min;94℃下变性30 s,58℃下退火复性30 s,72℃下延伸1 min,共进行34个循环;最后在72℃下再延伸10 min。将AFP4的PCR产物与载体pET-32a分别进行BamHⅠ和HandⅢ双酶切后,经T4 DNA连接酶连接后转入大肠杆菌DH5α中,利用通用引物T7对菌落进行PCR检测并将阳性克隆送生工生物工程(上海)股份有限公司测序。
1.2.4 重组蛋白的诱导表达及其条件优化 对鉴定后的重组菌pET-32a-AFP4进行质粒抽提。将质粒pET-32a-AFP4转入大肠杆菌BL21(DE3)感受态细胞中,并涂布于含Amp抗性的LB培养基中,于37℃下过夜培养。挑取单克隆接种于新鲜的LB液体培养基中培养,待吸光度OD600nm为0.6左右时,加入终浓度为1 mmol/L的IPTG进行诱导表达,于37℃、200 r/min条件下培养6 h,以未加诱导剂的菌液为对照,诱导结束后离心并收集菌体,用PBS缓冲液悬浮,参照Mao等[22]的SDSPAGE电泳方法检测目的蛋白表达情况。
在检测重组蛋白得到表达的情况下,对重组蛋白的表达条件进行优化:
(1)在IPTG终浓度分别为0、0.01、0.05、0.10、0.50、1.00 mmol/L的条件下,于37℃下诱导6 h后收集菌体,进行SDS-PAGE电泳检测。
(2)在IPTG浓度为1 mmol/L的条件下,于37℃下分别诱导1、2、3、4、5、6 h后收集菌体,进行SDS-PAGE电泳检测。
(3)在IPTG浓度为1 mmol/L的条件下,分别于18、28、37℃条件下,诱导6 h后离心收集菌体,进行SDS-PAGE电泳检测。
1.2.5 重组蛋白的纯化 将含有重组质粒pET-32a-AFP4的BL21菌株接种到含Amp的LB液体培养基中,按最佳优化条件进行表达,离心收集菌体蛋白,冰浴超声破碎(超声5 s、暂停5 s,持续40 min),以12 000 r/min离心15 min,分别收集上清与沉淀。利用ProteinISOTMNi-NTA Resin试剂盒纯化重组蛋白,分别收集各步样品进行SDSPAGE电泳检测。
1.2.6 多克隆抗体的制备 取2只新西兰大白兔分成A、B两组,用纯化后的蛋白免疫兔子。将纯化所得的AFP4重组蛋白与弗式完全佐剂等体积完全混合,经乳化后在兔子背部进行皮下多点注射,以后每隔7 d取300 μg的AFP4重组蛋白与弗氏不完全佐剂等体积完全混合,同样方法加强免疫6次,于第6次免疫后的第7天从兔子颈动脉采血(兔子在采血前禁食1 d)。血液收集于经灭菌的1.5 mL离心管中,4℃下静置过夜,再以1500 r/min离心10 min,收集血清于冰箱(-20℃)中保存备用。
1.2.7 多克隆抗体效价检测及特异性分析 将纯化所得重组蛋白AFP4作为抗原包被ELISA板, BSA在4℃下封闭过夜,血清按1∶3.125×103/ 6.25×103/12.5×103/25×103/50×103/100×103/200× 103/400×103/800×103/1600×103/3200×103/6400× 103的比例进行稀释,并加入到反应孔中,37℃下孵育2 h,同时用His抗体作为阳性对照,以BSA作为阴性对照。用去离子水冲洗干净后,加入HRP标记的羊抗兔二抗,37℃下孵育2 h。用去离子水洗涤后加入显色液,37℃下反应15 min,加入硫酸终止反应,于450 nm波长下测定吸光值。参照Mao等[23]的Western-blot方法,将纯化所得重组蛋白经SDS-PAGE电泳,转移至PVDF膜上(100 V,2 h),4℃下封闭过夜。兔抗AFP4重组蛋白血清为一抗,羊抗兔IgG-AP为二抗,进行抗原抗体反应,经NBT/TCIP显色液处理显色,用去离子水洗涤停止反应,观察结果并拍照。
2.1 AFP4基因的克隆及分析
利用RT-RCR方法扩增得到太平洋鳕AFP4基因ORF序列。序列分析结果显示,AFP4的ORF长度为375 bp,编码125个氨基酸(图1)。Prot-Param预测PI/MW显示:该蛋白的理论分子量约为13 975,理论等电点PI为4.68;不稳定系数为44.18,表明该蛋白性质不稳定;总平均疏水指数为-0.145,表明该蛋白可能是一种亲水蛋白。
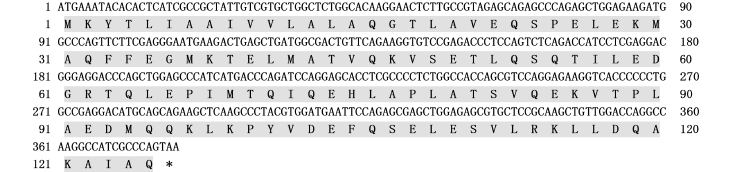
图1 太平洋鳕AFP4基因的开放阅读框及其推导的氨基酸序列(*终止密码子)
Fig.1 The open reading frame and deduced amino acid sequence of theAFP4 in Pacific cod(*termination codon)
2.2 重组质粒pET-32a-AFP4的构建与鉴定
将重组质粒pET-32a-AFP4转化至大肠杆菌DH5α感受态细胞后,以T7为通用引物进行菌落PCR检测(图2),菌液PCR检测9个单菌落有1000 bp左右的条带,仅一个未出现任何条带。取阳性单克隆菌落进行测序验证,结果显示,AFP4正确连接到表达载体pET-32a中,表明原核表达载体构建成功。
2.3 重组蛋白的表达与鉴定
将重组质粒pET-32a-AFP4转化至大肠杆菌BL21(DE3)感受态细胞中,以空载pET-32a的菌液和无诱导剂IPTG诱导的pET-32a-AFP4菌液作为阴性对照,在浓度为1 mmol/L IPTG诱导6 h的情况下,经SDS-PAGE电泳检测,结果显示,在31 000处出现特异性条带(图3),条带大小与预期结果一致,阴性对照则无此条带,结果表明, AFP4在大肠杆菌BL21(DE3)感受态细胞中得到正确表达。
采用Quantity one软件对外源蛋白的表达量进行预测,结果显示,外源蛋白表达量占菌体蛋白表达量的10.55%左右。
通过诱导时间、诱导剂浓度和诱导温度3方面的改变,对pET-32a-AFP4的表达条件进行优化。在其他条件一致的情况下,诱导时间为3 h时融合蛋白表达量最高(图4);不同诱导剂对融合蛋白表达量的影响结果显示,在IPTG浓度为0.01 mmol/L时,蛋白表达量最高(图5);在其他条件一致的情况下,融合蛋白的表达量并未随温度的改变而发生改变(图6),该结果表明,融合蛋白表达量对温度的改变不敏感。一般来说,在25~37℃诱导下,外源蛋白易于以活性存在,在37℃以上诱导,则易形成包涵体[24],故选择37℃作为最佳诱导浓度。
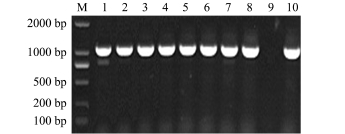
图2 重组质粒菌落PCR检测
Fig.2 Identification of recombinant plasmid pET-32a-AFP4 using PCR
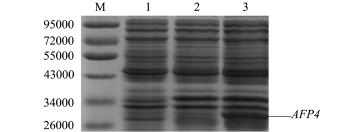
图3 pET-32a-AFP4 SDS-PAGE电泳结果
Fig.3 SDS-PAGE analysis of recombinant pET-32a-AFP4 expression

图4 pET-32a-AFP4在不同诱导时间下表达的SDSPAGE分析
Fig.4 SDS-PAGE analysis of recombinant plasmid pET-32a-AFP4 induced for different time

图5 重组质粒pET-32a-AFP4在不同浓度IPTG诱导下表达的SDS-PAGE分析
Fig.5 SDS-PAGE analysis of recombinant plasmid pET-32a-AFP4 expression under various concentrations of IPTG
2.4 重组蛋白纯化、抗体效价检测和特异性分析
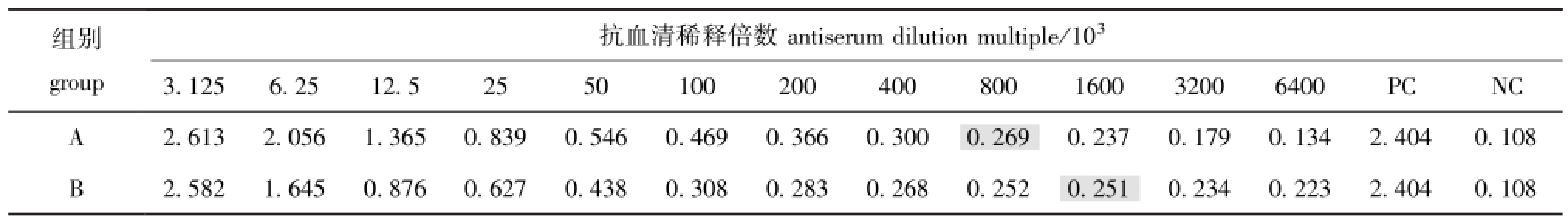
由于表达载体pET-32a中融合了6个His标签,便于纯化,利用蛋白纯化试剂盒纯化重组蛋白,纯化后的样品经SDS-PAGE电泳检测,约在相对分子质量为31 000处出现特异性条带(图7-A)。重组蛋白免疫新西兰大白兔获得兔抗AFP4抗体后,利用间接ELISA方法检测抗体效价,结果如表1所示。从表1可知,免疫的两只新西兰大白兔均产生免疫反应。大于NC两倍且大于并接近0.25的OD450nm值对应的稀释度值即为该抗体的效价,因此,A组效价为1∶800 000,B组效价较高,为1∶1 600 000。选择效价高的B组新西兰大白兔的抗血清进行Western-blot分析,结果(图7-B)表明,免疫后的抗血清出现明显的特异性条带,而阴性对照未出现特异性条带。表明该重组蛋白具有免疫原性。
表1 间接ELISA检测兔血AFP4血清效价
Tab.1 Serum titer detected using indircet ELISA
注:PC为阳性对照,NC为阴性对照
Note:PC is positive control,NC is negative control
组别抗血清稀释倍数antiserum dilution multiple/103group 00PCNC A2.6132.0561.3650.8390.5460.4690.3660.300 3.1256.2512.525501002004008001600320064 0.2510.2340.2232.4040.108 0.2690.2370.1790.1342.4040.108 B2.5821.6450.8760.6270.4380.3080.2830.2680.252

图6 重组质粒pET-32a-AFP4在不同温度条件下诱导表达的SDS-PAGE分析
Fig.6 SDS-PAGE analysis of pET-32a-AFP4 expression at different temperature
注:M为Marker;1为载体pET-32a;2为pET-32a-AFP4未诱导全蛋白;3~5分别为18、28、37℃下诱导的全蛋白
Note:M,Marker;1,vector pET-32a;2,pET-32a-AFP4 without of IPTG induction;3-5,total protein induced under temperature of 18,28 and 37℃,respectively
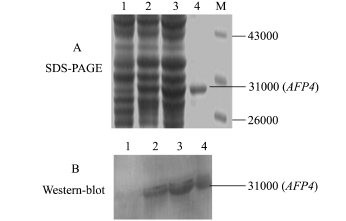
图7 Western-blot法检测AFP4重组蛋白
Fig.7 Recombinant AFP4 detection using Westernblot
3.1 表达系统的选择及表达条件优化
极地海洋和北温带沿岸水域的冬季水温一般在-1.9℃左右,这一温度远远低于一般海洋鱼类血液的冰点(-0.8℃)[25],但许多海洋鱼类冬季能够在极地及北方沿海水域生存,是因为它们能分泌一种抗冻蛋白[13],这些蛋白能够改变鱼体体液的冰点,以保持鱼类在海水冰点之下保持体液的流动性。自AFP4被发现以来,在多种生物体内均有报道,但在太平洋鳕中未见相关报道,本试验中利用RT-PCR技术成功获得太平洋鳕AFP4的ORF序列,并实现了其在大肠杆菌中的表达。
大肠杆菌具有遗传背景清晰、操作简单、转化转导效率高、生长繁殖快、成本低廉和可快速大规模生产目的蛋白等优点[25],其表达外源基因产物远高于其他表达系统,已成为应用最广泛的表达系统[26]。pET系统是在大肠杆菌中克隆和表达重组蛋白的最强大系统,最初由Studier等利用与启动子配套能高效转录特定基因的外源RNA聚合酶构建的T7 RNA聚合酶/启动子系统[27-28]。外源基因表达的产物可能会对大肠杆菌有一定的毒害作用,并影响其生长,一般采用在酵母中表达或融合表达[29]的方法。本研究中,采用了融合表达的方法,用pET-32a作为表达载体,因T7噬菌体信号控制着目标基因的转录和翻译,因此,T7 RNA聚合酶未加入之前,AFP4基因几乎不被转录和表达,这将保证BL21能够很好地生长到一定量;当BL21长到一定数目时,加入IPTG诱导剂,致使其产生大量T7 RNA聚合酶,它能特异性地识别pET-32a表达载体中的T7强启动子序列,从而使目的重组蛋白得以高效表达。同时表达载体中的硫氧还蛋白TrxA与目的基因融合表达,增加了融合蛋白的溶解性,同时降低了对宿主细胞的毒害作用。在pET-32a表达载体的C端含有6个His标签序列, His标签序列较短,与其他标签载体相比,在降低对抗体特异性影响的同时还对Ni-NTA层析介质上的Ni2+具有特异吸附能力,可以达到分离、纯化重组蛋白的目的。由于在诱导过程中蛋白极易以包涵体形式存在于沉淀中而不易纯化,本试验中通过对诱导时间、诱导剂浓度和诱导温度3个条件进行优化,以研究在哪种条件下融合蛋白易在上清中表达。结果表明,诱导温度为37℃、IPTG浓度为0.01 mmol/L、诱导3 h条件下,融合蛋白的表达量最高。SDS-PAGE电泳检测表明,AFP4基因以可溶性形式在大肠杆菌中高效表达。
3.2 融合蛋白的鉴定
关于抗冻基因的表达,张晓等[19]对大黄鱼4型抗冻蛋白基因进行了原核表达及功能研究。但该研究中试验对象与本研究不同,在大黄鱼类中该基因的开放阅读框编码124个氨基酸,本研究中,太平洋鳕AFP4基因的开放阅读框编码125个氨基酸。张晓等[19]所表达的大黄鱼4型抗冻蛋白是以可溶性形式存在,本试验中太平洋鳕AFP4抗冻蛋白也是以可溶形式存在。张晓等在研究中所采用的原核表达载体为pGEX-4T-1,所用感受态细胞为E.coli TOP10[19],与本研究中所采用的表达载体及感受态细胞完全不同,所以在重组蛋白的表达量上有显著差异。对于太平洋鳕AFP4表达的重组蛋白是否具有活性还需进一步试验验证。本试验中对于表达融合蛋白的检测,采用了Western-blot方法,以纯化的重组蛋白为探针,利用抗原与抗体间的反应,证明所表达的融合蛋白为太平洋鳕AFP4蛋白,用Western-blot结果显示出的条带与蛋白Marker对比,确认条带约在相对分子质量为31 000的位置,证明表达的融合蛋白为AFP4。因为目的基因AFP4编码的蛋白相对分子质量约为13 975,表达载体pET-32a自身携带的硫氧还蛋白标签序列以及6个His标签序列(相对分子质量约为18 300)三者一起融合表达,融合表达产物相对分子质量是三者之和,约为31 000。这一结果与预测的抗冻蛋白氨基酸分子量大小相一致,有力地证明了太平洋鳕AFP4基因ORF的完整性和准确性。本研究中成功获得太平洋鳕抗冻基因AFP4的重组表达载体,能够有效地进行体外表达,对该重组蛋白进行纯化后获得了相应的多克隆抗体,研究结果将为后续工作中开展AFP4功能验证,以及大规模生产和应用提供了必要的基础,具有重要的参考价值。
参考文献:
[1] 李金耀,马纪,张富春.抗冻蛋白研究进展(英文)[J].中国生物化学与分子生物学报,2005,21(6):717-722.
[2] Crevel R W R,Fedyk J K,Spurgeon M J.Antifreeze proteins:characteristics,occurrence and human exposure[J].Food and Chemical Toxicology,2002,40(7):899-903.
[3] Barrett J.Thermal hysteresis proteins[J].The International Journal of Biochemistry&Cell Biology,2001,33(2):105-117.
[4] Nelson J S.Fishes of the World[M].4th ed.New Jersey:John Wiley&Sons,2006.
[5] 张强,谢锋,江建平,等.冷血脊椎动物冷适应研究[J].四川动物,2006,25(2):433-438.
[6] Devries A L.Glycoproteins as biological antifreeze agents in Antarctic fishes[J].Science,1971,172(3988):1152-1155.
[7] Komatsu S K,DeVries A L,Feeney R E.Studies of the structure of freezing point-depressing glycoproteins from an Antarctic fish[J]. The Journal of Biological Chemistry,1970,245(11):2909-2913.
[8] DeVries A L,Vandenheede J,Feeney R E.Primary structure of freezing point-depressing glycoproteins[J].The Journal of Biological Chemistry,1971,246(2):305-308.
[9] Duman J G,Devries A L.Freezing resistance in winter flounder Pseudopleuronectes americanus[J].Nature,1974,247(5438): 237-238.
[10] Duman J G,DeVries A L.Isolation,characterization,and physical properties of protein antifreezes from the winter flounder,Pseudopleuronectes americanus[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1976,54(3):375-380.
[11] Ng N F,Trinh K Y,Hew C L.Structure of an antifreeze polypeptide precursor from the sea raven,Hemitripterus americanus[J]. The Journal of Biological Chemistry,1986,261(33):15690-15695.
[12] Marshall C B,Fletcher G L,Davies P L.Hyperactive antifreeze protein in a fish[J].Nature,2004,429(6988):153.
[13] Deng Gejing,Laursen R A.Isolation and characterization of an antifreeze protein from the longhorn sculpin,Myoxocephalus octodecimspinosis[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1998,1388(2):305-314.
[14] Deng Gejing,Andrews D W,Laursen R A.Amino acid sequence of a new type of antifreeze protein,from the longhorn sculpin Myoxocephalus octodecimspinosis[J].FEBS Letters,1997,402(1): 17-20.
[15] 钟其旺,樊廷俊.鱼类抗冻蛋白的研究进展[J].生物化学与生物物理学报,2002,34(2):124-130.
[16] Zhao Zhihui,Deng Gejing,Lui Qiumei,et al.Cloning and sequencing of cDNA encoding the LS-12 antifreeze protein in the longhorn sculpin,Myoxocephalus octodecimspinosis[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1998,1382(2):177-180.
[17] Kondo H,Nishimiya Y,Noro N,et al.Crystal structure of Ca2+-dependent type II antifreeze protein from Japanese smelt[J]. Cryobiology,2009,59(3):372.
[18] Liu Jingxia,Zhai Yanhua,Gui Jianfang.Molecular characterization and expression pattern of AFPIV during embryogenesis in gibel carp(Carassiu auratus gibelio)[J].Molecular Biology Reports,2009,36(7):2011-2018.
[19] 张晓,吴海珍,卫玮,等.大黄鱼类Ⅳ型抗冻蛋白基因的克隆、表达及功能研究[J].食品与药品,2009,11(5):15-19.
[20] Xiao Qing,Xia Jianhong,Zhang Xiaojuan,et al.Type-IV antifreeze proteins are essential for epiboly and convergence in gastrulation of zebrafish embryos[J].International Journal of Biological Sciences,2014,10(7):715-732.
[21] 高天翔,武云飞,张秀梅,等.四种鳕鱼的形态学研究[J].青岛海洋大学学报,2002,32(6):884-890.
[22] Mao Mingguang,Wen Shihui,Perálvarez-Marín A,et al.Evidence for and characterization of nervous necrosis virus infection in Pacific cod(Gadus macrocephalus)[J].Archives of Virology, 2015,160(9):2237-2248.
[23] Mao Mingguang,Li Xing,Perálvarez-Marín A,et al.Transcriptomic analysis and biomarkers(Rag1 and Igμ)for probing the immune system development in Pacific cod,Gadus macrocephalus [J].Fish&Shellfish Immunology,2015,44(2):622-632.
[24] Liang Rubing,Liu Xipeng,Liu Jianhua,et al.A T7-expression system under temperature control could create temperature-sensitive phenotype of target gene in Escherichia coli[J].Journal of Microbiological Methods,2007,68(3):497-506.
[25] Nuc P,Nuc K.Recombinant protein production in Escherichia coli [J].Postepy Biochemii,2006,52(4):448-456.
[26] Dong X B,Tang B,Li J,et al.Expression and purification of intact and functional soybean(Glycine max)seed ferritin complex in Escherichia coli[J].Journal of Microbiology and Biotechnology,2008,18(2):299-307.
[27] Hoffmann-Sommergruber K,Susani M,Ferreira F,et al.Highlevel expression and purification of the major birch pollen allergen,Bet v 1[J].Protein Expression and Purification,1997,9 (1):33-39.
[28] Kang Yun,Son M S,Hoang T T.One step engineering of T7-expression strains for protein production:increasing the host-range of the T7-expression system[J].Protein Expression and Purification,2007,55(2):325-333.
[29] Bischoff D S,Slavicek J M.Molecular analysis of an enhancin gene in the Lymantria dispar nuclear polyhedrosis virus[J].Journal of Virology,1997,71(11):8133-8140.
Prokaryotic expression and polyclonal antibody preparation of antifreeze protein gene AFP4 in Pacific cod Gadus macrocephalus
Abstract:The open reading frame(ORF)of typeⅣantifreeze protein was cloned from Pacific cod Gadus macrocephalus using RT-PCR to investigate the function of typeⅣantifreeze protein.The result showed that the ORF of AFP4 had 375 bp in length,encoding a polypeptide of 125 amino acids.The recombinant pET-32a-AFP4 was constructed by linking the AFP4 ORF with the pET-32a vector,and transformed into Escherichia coli BL21 (DE3).The expressing conditions of the recombinant plasmid were optimized under various concentrations of thermal hysteresis protein(THP),induction time and temperature with the optimal expressing induction conditions of 0.01 mmol/L IPTG,3 h and 37℃.The recombinant protein was purified and used to immunize New Zealand white rabbit.The polyclonal antibody was obtained and tested using indirect ELISA,with the titer of 1∶1 600 000.The specific binding between recombinant protein and Rabbit anti-AFP4 polyclonal antibody indicated that the recombinant protein had high immunogenicity.The findings will provide the foundations for further understanding of AFP4 functions in Pacific cod.
Key words:Gadus macrocephalus;antifreeze gene;prokaryotic expression;antibody
DOI:10.16535/j.cnki.dlhyxb.2017.02.001
文章编号:2095-1388(2017)02-0127-07
中图分类号:Q786
文献标志码::A
收稿日期:2016-05-18
基金项目:国家自然科学基金资助项目(31302202);辽宁省教育厅科研项目(L2015076,L2013276);农业部北方海水增养殖重点实验室开放课题(2014-MSENC-KF-12,2015-MSENC-KF-04)