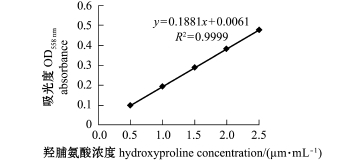
图1 羟脯氨酸标准曲线
Fig.1 Standard curve for hydroxyproline(Low ry method)
摘要:为探索虾夷扇贝Patinopecten yessoensis加工副产物的高附加值利用,从副产物外套膜中提取经济价值较高的胶原蛋白,并对其理化性质(分子量、溶解性、黏度、紫外吸收、氨基酸组成)和结构特性(圆二色谱、傅里叶红外光谱)进行研究。结果表明:外套膜干基中胶原蛋白含量为13.16%;外套膜胶原蛋白分子主要由α亚基和少量的β、γ亚基组成,外套膜胶原蛋白为典型的Ⅰ型胶原;酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC)均富含甘氨酸、谷氨酸、脯氨酸和羟脯氨酸;胶原蛋白的变性温度约为20℃,与其他物种有所差异;PSC的溶解度高于ASC,二者的等电点均在pH为4左右,且二者的盐溶性变化趋势相似;红外光谱表明,PSC和ASC二级结构间有细微差异,但胃蛋白酶没有影响胶原蛋白的三螺旋结构;圆二色谱显示,ASC的三级结构比PSC的更加稳定,温度升高会影响二者的三级结构。
关键词:虾夷扇贝;外套膜;理化特性;胶原蛋白
虾夷扇贝Patinopecten yessoensis隶属于软体动物门Mollusca、双壳纲Lamelli branchia、莺蛤目Pterioida、扇贝科Pectinidae,原产于日本、俄罗斯和朝鲜等海域,为冷水性贝类,现今虾夷扇贝已成为中国重要的高值经济贝类养殖品种。
在虾夷扇贝的加工过程中会产生大量副产物,目前,对这些副产物的利用仍然是困扰行业发展的问题之一。外套膜作为主要的副产物,富含蛋白质,具有较高的开发价值。当前,国内对外套膜的研究主要集中于开发发酵制品[1]、调味料[2]、生物活性物质[3]、水解多肽制品[4]等方面,而对于外套膜中较为丰富的胶原蛋白的研究则较少,仅刘聪等[5]研究了外套膜胶原蛋白的酶解物清除超氧阴离子能力。国外对虾夷扇贝外套膜胶原蛋白的研究中,Shen等[6]研究了日本产虾夷扇贝外套膜胶原蛋白分子的分布;Choi等[7]研究了韩国产虾夷扇贝外套膜胶原蛋白的理化性质;Mizuta等[8]研究了日本产虾夷扇贝外套膜胶原蛋白的含量、组织分布和热变性规律。国内至今对养殖虾夷扇贝外套膜胶原蛋白的研究还较为欠缺,为此,本研究中对虾夷扇贝外套膜中的胶原蛋白进行了探究,以期为虾夷扇贝外套膜的高附加值利用提供参考依据。
1.1 材料
试验用活品虾夷扇贝购于大连市长兴水产品交易市场,原料产于春季大连市獐子岛海域,运抵实验室后取外套膜,用冰水冲洗后沥干,切碎备用。
1.2 方法
1.2.1 胶原蛋白含量测定 结合GB/T 9695.23—2008/ISO 3496:1994和Mizuta等[9]的方法并略做调整后进行试验。
(1)羟脯氨酸标准曲线的制作。称取50 mg羟脯氨酸于100 mL容量瓶中,用水溶解后加入一滴3 mol/L H2SO4,用水定容并于4℃下贮存。取上述溶液5.0 mL定容至500 mL,分别吸取该溶液10.0、20.0、30.0、40.0、50.0 mL于100 mL容量瓶中用水定容,所得标准溶液中羟脯氨酸浓度分别为0.5、1.0、1.5、2.0、2.5μg/mL,现用现配。取4mL上述溶液于比色管中,加入2mL氯氨T试剂,混合后放置20 min,再加入2.0 mL对二甲氨基苯甲醛显色剂,并于60℃下水浴20 min,取出比色管,用流动水冷却并在室温下放置30 min,而后采用721分光光度计于558 nm处测定吸光值。羟脯氨酸标准曲线如图1所示。

图1 羟脯氨酸标准曲线
Fig.1 Standard curve for hydroxyproline(Low ry method)
(2)样品的测定。取100 g闭壳肌与100 g外套膜分别绞混均匀,取4 g样品置于100 mL锥形瓶中,而后加入30 mL 3 mol/L H2SO4,置于130℃烘箱中消化3.5 h,趁热过滤,采用10 mL 3 mol/L H2SO4洗脱至250 mL容量瓶中后定容,重复以上操作。测得的羟脯氨酸含量乘以换算系数10.23[10],即为胶原蛋白含量。
1.2.2 外套膜胶原蛋白的提取 采用Shen等[6]的方法并做调整。取20 g外套膜加入20倍体积的0.1 mol/LNaOH,搅拌过夜,而后以10 000g离心20 min,取沉淀,此碱洗步骤重复3次,以脱除非胶原蛋白组分和胶原蛋白酶。所得沉淀用蒸馏水洗至中性,采用10倍体积的0.5 mol/L乙酸搅拌溶解2 d,以12 000g离心20 min,所得上清液加入NaCl至终浓度为0.7 mol/L,使胶原蛋白盐析,沉淀即为酸溶性胶原蛋白(ASC),将ASC采用适量0.5 mol/L乙酸复溶后透析完全,而后冻干。
在ASC提取后的残余沉淀中加入猪胃蛋白酶以提取酶溶性胶原蛋白(PSC),酶与底物质量比为1∶20,4℃下酶解3 d,溶液以12 000g离心20 min,在上清液中加入NaCl至终浓度为0.7 mol/L,使胶原蛋白盐析,离心回收沉淀,沉淀即为PSC。
上述所有操作均在4℃条件下进行。
1.2.3 胶原蛋白的氨基酸组成分析 采用杨婷婷[11]的方法并做调整。准确称取25 mg样品(块状需粉碎)于消解管中,加入5mL 6mol/LHCl封口,于烘箱(110℃)中水解24 h。水解后样品于蒸发皿中水浴蒸干。用衍生缓冲液将蒸干后的物质洗脱并定容至25 mL。样品衍生:采用滤膜滤取2 mL衍生溶液并转至10mL容量瓶中,加入1mL氨基酸衍生试剂后于60℃下水浴1 h,再用平衡缓冲液定容,滤取适量定容后的溶液上样备用。
1.2.4 不同pH下胶原蛋白的溶解性 参考Zeng等[12]的方法并做调整。用0.5 mol/L乙酸配制浓度为1.5 mg/mL的胶原蛋白溶液,分别取5 mL溶液于离心管中,采用6 mol/L NaOH和6 mol/L HCl调节pH为1.00~10.00,误差为±0.03,加入蒸馏水使溶液体积至10 mL,pH保持不变,在4℃下搅拌30 min,以13 000g冷冻离心20 min。采用Folin-酚法测定上清中蛋白含量。
胶原蛋白相对溶解度=(某pH下蛋白的溶解度/最高溶解度)×100%。
1.2.5 不同NaCl浓度下胶原蛋白的溶解性 参考Zeng等[12]的方法并做调整。各取5 mL 1.5 mg/mL胶原蛋白溶液7份,分别加入5 mL浓度为0、2%、4%、6%、8%、10%、12%的NaCl溶液,至终浓度为0、1%、2%、3%、4%、5%、6%,NaCl浓度相当于0、10、20、30、40、50、60 g/L。溶液在4℃下搅拌30 min,而后以13 000g冷冻离心20 min,采用Folin-酚法测定上清中蛋白含量。
胶原蛋白相对溶解度=(某NaCl浓度下蛋白的溶解度/最高溶解度)×100%。
1.2.6 胶原蛋白的紫外光谱分析(UV) 用0.5 mol/L乙酸溶液配制1 mg/mL胶原蛋白溶液,用紫外分光光度计在190~400 nm区间内扫描并记录。
1.2.7 胶原蛋白的热变性 通过测定胶原蛋白溶液黏度的变化来测定其变性温度。本试验中采用Zhang等[13]的方法并做适当调整。用0.5 mol/L乙酸配制0.1%的胶原蛋白溶液,将黏度计和循环水浴锅联用,在温度为8~30℃下测定胶原蛋白黏度的变化,升温速度为2℃/min。以温度为横坐标、相对黏度为纵坐标,绘制黏度变化曲线。
1.2.8 傅里叶红外光谱扫描(FT-IR) 采用Kiew等[14]的方法并做适当调整。称取1 mg胶原蛋白干品,加入200 mg KBr手动压片,采用傅里叶红外光谱仪在400~4000 cm-1波数区间内扫描,扫描信号累加32次,仪器分辨率为0.5 cm-1。
1.2.9 远紫外圆二色谱(CD)分析 样品处理参考Pati等[15]和Ogawa等[16]的方法并做调整。将胶原蛋白溶解于0.5 mol/L乙酸中并稀释至1 mg/mL,于15、30、45℃水浴中加热30 min。采用圆二色谱仪(日本JASCO)在波长为190~250 nm远紫外区扫描,扫描速度2 nm/s,石英比色皿采用0.1 cm光程。
1.3 数据处理
采用Excel 2007软件进行统计分析并作图。
2.1 外套膜胶原蛋白的分布与特性
2.1.1 外套膜和闭壳肌的胶原蛋白含量 从表1可见,外套膜湿基和干基中胶原蛋白含量分别为2.006%和13.163%,闭壳肌湿基和干基中胶原蛋白含量分别为0.234%和0.936%,可见在外套膜中胶原蛋白含量较为丰富。Mizuta等[8]研究表明,月份、纬度和海域的差异会影响外套膜胶原蛋白的含量,且随月份的变化,虾夷扇贝外套膜湿基和干基中胶原蛋白含量分别在0.98%~1.72%和7.7%~12.6%之间波动;Ebitani等[17]研究表明, 6—10月,Monbetsu和Yakumo两个海域中虾夷扇贝外套膜湿基中胶原蛋白含量变化分别为1.5%~1.8%和1.3%~2.0%。
表1 虾夷扇贝外套膜和闭壳肌肌肉中的胶原蛋白含量
Tab.1 Collagen content of adductor and mantlemuscle in yesso scallopPatinopecten yessoensis%

组织tissue湿基wet basis干基mantle 2.006±0.163 13.163±0.701闭壳肌dry basis外套膜adductor 0.234±0.007 0.936±0.057
2.1.2 外套膜胶原蛋白分子量分布 图2为外套膜中酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC)的分子量分布规律。从ASC图谱中可明显发现,虾夷扇贝外套膜的胶原蛋白属于典型的Ⅰ型胶原蛋白,具有明显的α、β和γ3种多肽链,且ASC呈现较高的纯度。另外,从PSC图谱可以发现,PSC具有与ASC相同的肽链组分(α、β和γ),但是3个多肽链均发生轻度降解,除α、β和γ肽链外,还出现一些低分子条带。在酶法提取过程中,胃蛋白酶将各肽链的端肽切除[18],同时也不排除多肽链发生部分降解,在PSC图谱出现的多条低分子蛋白条带,就是被剪切下的端肽、小部分肽链降解组分[19]和胃蛋白酶组分。
对于ASC而言,其γ链的相对分子质量高于220 000,β链约为220 000,α链在105 000左右。ASC的相对分子质量分布与合浦珠母贝Pinctada fucata闭壳肌、紫贻贝Mytilus galloprovincialis、条纹隔贻贝Septifer virgatus软体部、虾夷扇贝闭壳肌、长牡蛎Crassostrea gigas闭壳肌与外套膜、丽文蛤Meretrix lusoria外套膜胶原蛋白[9],以及海蜇Rhopilema asamushi[20]胶原蛋白的相对分子质量分布相似,与日本虾夷扇贝外套膜中胶原蛋白相对分子质量分布相同[6-7]。
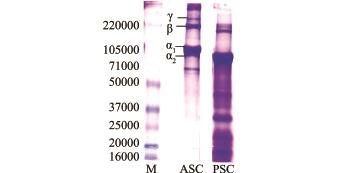
注:M为Marker
Note:M,Marker
图2 外套膜胶原蛋白的分子量分布
Fig.2 M olecular weight distribution of scallop mantle collagen
2.1.3 外套膜胶原蛋白的紫外光谱扫描分析 图3为外套膜胶原蛋白(ASC和PSC)的紫外扫描图谱。从图3可知,ASC和PSC均在234 nm处有最大特征吸收,这主要是由C=O基团中电子的n→π*跃迁产生的。外套膜胶原蛋白的紫外特征吸收和水产动物Ⅰ型胶原蛋白一致,如斑点叉尾鮰Ictaluruspunctaus[21]、罗非鱼Oreochromisniloticus[12]、刺参Apostichopus japonisus[22]、中华鳖Pelodiscus sinensis[23]。紫外光谱的苯丙氨酸和酪氨酸的吸收带在波长250~290 nm之间,而外套膜胶原蛋白在这个范围内吸收较弱,表明胶原蛋白中芳香族氨基酸含量较低,胶原蛋白纯度较高。
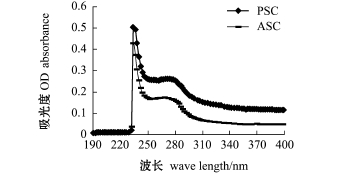
图3 外套膜胶原蛋白紫外光谱扫描图谱
Fig.3 Ultraviolet spectrum of scallop mantle
2.1.4 外套膜胶原蛋白的氨基酸组成 从表2可见:ASC中主要氨基酸组成依次为Gly 15.336%、Glu 10.373%、Pro 6.736%、Hyp 5.706%、Asp 5.465%、Arg 5.120%、Ala 3.266%;PSC的主要氨基酸组成依次为Gly 11.391%、Glu 8.042%、Asp 6.385%、Pro 5.623%、Hyp 3.694%、Arg 3.097%、Ala 2.679%。现有对贝类外套膜胶原蛋白的研究报道不多,Choi等[7]对韩国产虾夷扇贝外套的研究表明,其主要氨基酸组成为Gly 23%、Glu 14%、Pro 9%、Asp 9%、Hyp 8%、Arg 7%、Ala 4%;Shen等[6]对日本北海道产虾夷扇贝外套膜胶原蛋白的研究表明,其氨基酸中Gly为33.1%、Glu为11.1%。本研究中,PSC和ASC中的氨基酸含量与Choi[7]、Shen等[6]研究结果有一定差异。首先,不排除产地因素对外套膜氨基酸组成的影响,不同产地因生长环境及饵料组成的差异对扇贝生长的影响不能忽视;此外,因处理方式不同,所得胶原蛋白的化学组分也存在一定差异,本研究中PSC的提取原料来自于ASC提取后的沉淀,此沉淀仍混有胶原蛋白酶解后的端链、微量杂蛋白和胃蛋白酶,而Choi[7]、Shen等[6]已将酶解后的端链和胃蛋白酶脱除。
表2 虾夷扇贝外套膜ASC和PSC的氨基酸组成
Tab.2 Am ino acid composition of acid soluble collagen and pepsin soluble collagen from mantle of yesso scallopPatinopecten yessoensis%
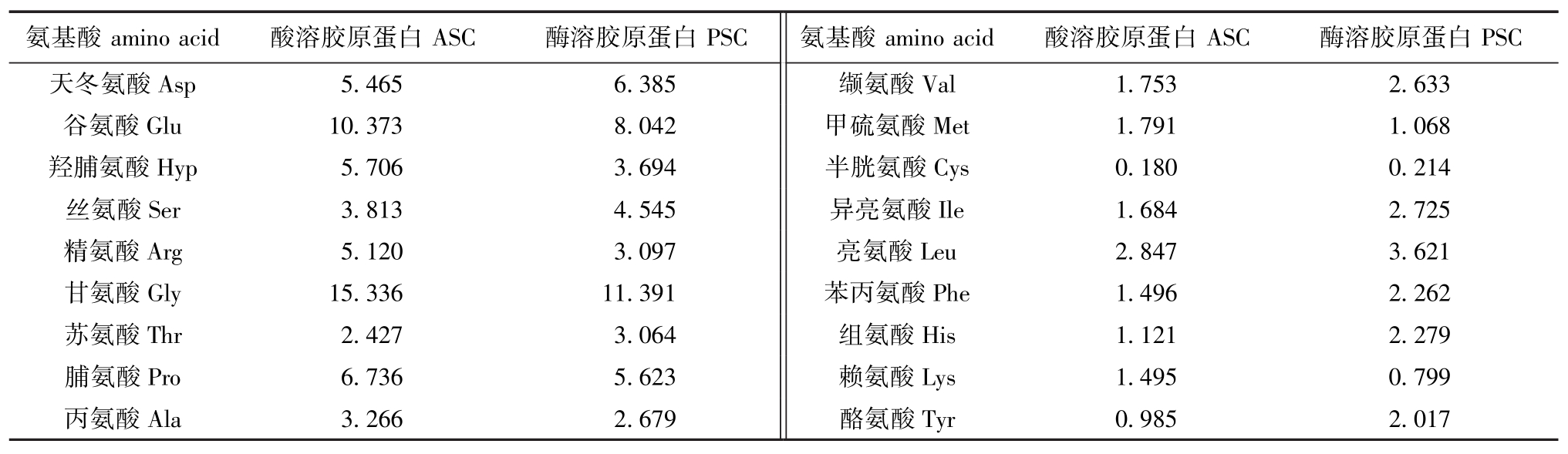
氨基酸amino acid酸溶胶原蛋白ASC酶溶胶原蛋白PSC氨基酸amino acid酸溶胶原蛋白ASC酶溶胶原蛋白PSC天冬氨酸Asp 5.465 6.385缬氨酸Val 1.753 2.633谷氨酸Glu 10.373 8.042甲硫氨酸Met 1.791 1.068羟脯氨酸Hyp 5.706 3.694半胱氨酸Ile 1.684 2.725精氨酸Arg 5.120 3.097亮氨酸Cys 0.180 0.214丝氨酸Ser 3.813 4.545异亮氨酸Leu 2.847 3.621甘氨酸Gly 15.336 11.391苯丙氨酸Phe 1.496 2.262苏氨酸Thr 2.427 3.064组氨酸Lys 1.495 0.799丙氨酸Ala 3.266 2.679酪氨酸His 1.121 2.279脯氨酸Pro 6.736 5.623赖氨酸Tyr 0.985 2.017
2.1.5 外套膜胶原蛋白溶解度的变化 从图4-A可知,ASC和PSC在不同pH下的溶解度变化趋势相似,PSC的溶解度总体上高于ASC,这主要是由于胃蛋白酶将胶原蛋白的端肽切除和微量降解使得分子量降低,导致PSC溶解性高于ASC。ASC和PSC的溶解度在pH为1~3时几乎没有变化,在pH为4时则均为最低,这表明二者的等电点在pH为4左右。与外套膜胶原蛋白不同,有学者研究表明,脊椎动物鱼类如褐蓝子鱼Siganus fuscescens、南方舵鱼Kyphosus bigibbus、鸢鲼Myliobatis tobijei、赤魟Dasyatisakajei、光魟Dasyatis laevigatus[24]、狭鳕Theragra chalcogramma鱼皮[25]和军曹鱼Rachycentron canadum[19]鱼皮胶原蛋白等电点均在pH为7左右。而对于无脊椎动物胶原蛋白等电点的研究尚未发现。外套膜胶原蛋白和鱼皮间等电点的差异可能源于物种、提取方法等因素。
从图4-B可知,ASC和PSC在不同NaCl浓度下的溶解度变化趋势相似,PSC的溶解度总体上高于ASC,这与对脊椎动物鱼类[24-25]的研究结果相似。随着NaCl浓度的升高,ASC溶解度急剧下降,在浓度达到30 g/L时最低;而PSC在NaCl浓度为10~20 g/L时溶解度急剧下降,浓度高于30 g/L时,大部分PSC析出。胶原蛋白盐溶性的变化因鱼种的差异而不同,如鳙Hypophthalmichthys nobilis和军曹鱼[19]胶原蛋白溶解度在NaCl浓度为40 g/L时最低,而褐蓝子鱼、南方舵鱼、鸢鲼、赤魟、光魟[24]、狭鳕鱼皮[25]胶原蛋白则在NaCl浓度为60 g/L时最低。

图4 pH和NaCl浓度对外套膜ASC和PSC溶解度的影响
Fig.4 Influences of pH and NaCl concentration on solubility ofmantle ASC and PSC
2.1.6 外套膜胶原蛋白的热变性 从图5可知, ASC和PSC相对黏度随温度升高而降低,这是黏度随温度变化的一般规律。当相对黏度降为50%时,此时的温度即为胶原蛋白的变性温度。由图5可知,ASC和PSC的变性温度均为20℃左右,低于韩国虾夷扇贝外套膜胶原蛋白(27.4℃)[7]和日本产虾夷扇贝外套膜胶原蛋白(30~35℃)[8]变性温度,同时也低于大部分脊椎动物胶原蛋白的变性温度,如草鱼(28.4℃)、大眼鲷(28.7℃)、猪皮(37℃)、日本鲈鱼(26.5℃)胶原蛋白,但高于真鳕(15℃)[26]和阿拉斯加狭鳕(16.8℃)[27]胶原蛋白变性温度,这些差异性来源于物种、生活环境和地域的不同。ASC热变性温度略高于PSC,蓝点马鲛Scomberomorous niphonius皮和骨的胶原蛋白也具有此特点[28],ASC在12℃前相对黏度几乎没有变化,而PSC却在下降,这进一步说明ASC的热稳定性高于PSC。
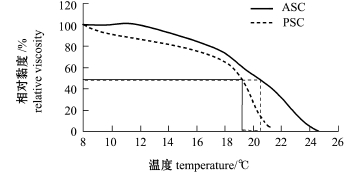
图5 外套膜ASC和PSC相对黏度随温度的变化规律
Fig.5 Relative viscosity variation in ASC and PSC w ith tem perature changes
2.2 外套膜胶原蛋白的结构分析
2.2.1 胶原蛋白傅里叶红外光谱扫描分析 图6为虾夷扇贝ASC和PSC的FT-IR扫描图谱,从中可以观察到胶原蛋白的几个特征吸收峰,包括酰胺A、B、Ⅰ、Ⅱ和Ⅲ带,这与斑点叉尾鮰[21]、鲶Hybrid clariassp.[14]鱼皮和老鼠尾部[29]的胶原蛋白相同。
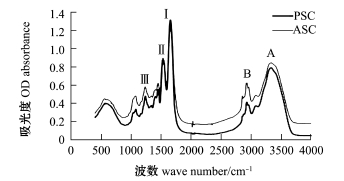
注:Ⅰ、Ⅱ、Ⅲ、A、B分别为胶原蛋白红外特征吸收峰
Note:Ⅰ,Ⅱ,Ⅲ,A and B represents characteristic peaks of collagen
图6 外套膜ASC和PSC傅里叶红外光谱图谱
Fig.6 Fourier transform infrared spectroscopy of m antle ASC and PSC
胶原蛋白的特征吸收峰的详细说明见表3。酰胺A带主要反映了N-H伸缩振动,一般情况下, N-H自由伸缩振动在3400~3440 cm-1有吸收峰[30],而本试验中ASC与PSC在3330 cm-1附近有吸收峰,据Doyle等[30]报道,当多肽中NH基团参与氢键的形成时吸收峰波数会降低,一般在3300 cm-1波数附近;ASC和PSC的酰胺B带吸收波数分别为2958 cm-1和2959 cm-1,这主要反映了CH2非对称伸缩振动,在2855、2853 cm-1处反映了CH2对称伸缩振动[15];酰胺Ⅰ带的特征吸收一般在1600~1700 cm-1,ASC和PSC在1657、1658 cm-1处的吸收峰为酰胺Ⅰ带,主要是由肽骨架中C=O伸缩与COO-形成的氢键引起的[15],酰胺Ⅰ带反映了蛋白质二级结构的敏感区域[31];由N-H弯曲振动和C-N伸缩振动引起的酰胺Ⅱ带一般在1550~1600 cm-1有最大吸收,ASC和PSC的酰胺Ⅱ带吸收峰分别为1536 cm-1和1533 cm-1,酰胺Ⅱ带向低波数迁移表明蛋白分子中氢键的存在[32];酰胺Ⅲ带吸收峰在1220~1320 cm-1,是由N-H弯曲振动和C-N伸缩振动所引起,在酰胺Ⅲ带和1450 cm-1间有强烈的吸收峰,这表明ASC和PSC具有稳定的三螺旋结构[33-34]。
表3 红外光谱中ASC和PSC基团峰位置及振动方式
Tab.3 Peak locations and assignment for ASC and PSC in FT-IR
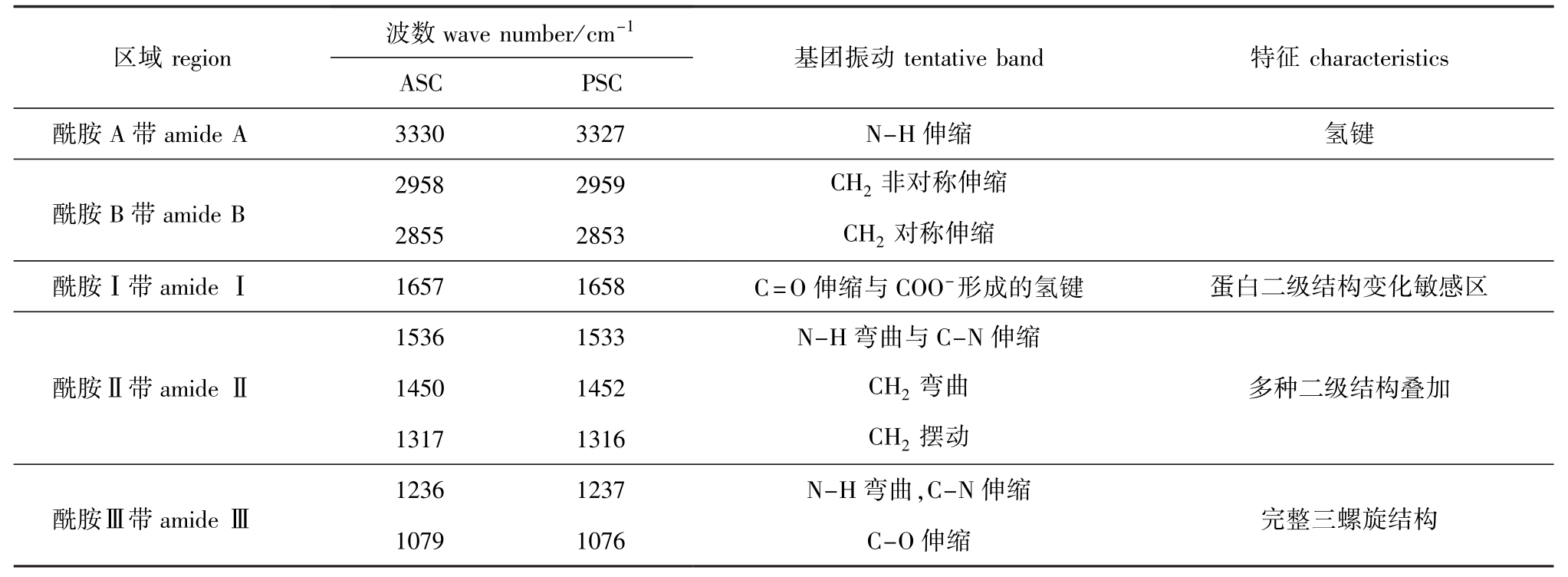
区域region波数wave number/cm-1ASC PSC基团振动tentative band特征characteristics酰胺A带amide A 3330 3327 N-H伸缩氢键非对称伸缩2855 2853 CH2对称伸缩酰胺Ⅰ带amideⅠ1657 1658 C=O伸缩与COO-形成的氢键2958 2959 CH2酰胺B带amide B伸缩酰胺Ⅱ带amideⅡ1450 1452 CH2弯曲多种二级结构叠加1317 1316 CH2摆动蛋白二级结构变化敏感区1536 1533 N-H弯曲与C-N 1236 1237 N-H弯曲,C-N伸缩酰胺Ⅲ带amideⅢ完整三螺旋结构1079 1076 C-O伸缩
2.2.2 胶原蛋白圆二色谱分析 图7为外套膜ASC和PSC的圆二色谱图谱。圆二色谱反映了胶原蛋白的三螺旋结构特点[15]。从图7可知,ASC和PSC图谱的趋势相似,且与胶原蛋白标准图谱相似。ASC和PSC分别在222~224、202~210 nm处有最大和最小摩尔椭圆率,不同温度处理后的胶原蛋白圆二图谱一致交叉在212 nm左右。在15℃时,ASC和PSC最小摩尔椭圆率均出现在206 nm处,在30、45℃时蓝移至202 nm附近,且随温度升高摩尔椭圆率不断增大;各温度下,ASC和PSC的最大摩尔椭圆率均出现在222 nm处。ASC和PSC在15℃时椭圆率最大,且随温度的升高椭圆率不断降低,表明在30、45℃时胶原蛋白发生变性,这与黏度变化相符,且胶原蛋白的热变性是不可逆的。以上结论与对多须石首鱼Pogonias cromis、羊头鲷Archosargus probatocephalus鱼皮[16]和拉鱼巴Catla catla鱼鳞胶原蛋白[15]的研究结果相同。。

图7 在15、30、45℃时ASC和PSC的圆二色谱图谱
Fig.7 CD spectra ofm antle ASC and PSC at 15,30℃,and 45℃
本研究结果表明,虾夷扇贝外套膜与其他无脊椎贝类相同,含有较丰富的胶原蛋白(13%),具有典型的Ⅰ型胶原蛋白的三螺旋结构,其热变性温度在20℃左右,等电点在pH为4左右。ASC与PSC二者在纯度、热稳定性、结构等方面具有部分差异。与国外同类研究结论相比,中国虾夷扇贝外套膜胶原蛋白的热稳定性有较大差异,有待进一步研究探索
参考文献:
[1]孔繁东,丁琦,祖国仁,等.扇贝裙边酱油的开发与研究[J].中国酿造,2008(5):57-60.
[2]郑丽,汪秋宽.扇贝加工废弃物海鲜调味料的加工利用[J].水产科学,2005,24(1):34-37.
[3]崔金会.虾夷扇贝裙边水解蛋白的制备工艺与生物活性研究[D].青岛:中国科学院研究生院(海洋研究所),2012.
[4]汪涛,曾庆祝,谢智芬.内肽酶与端肽酶水解扇贝边蛋白质工艺的研究[J].大连水产学院学报,2003,18(2):125-129.
[5]刘聪,赵前程,李智博,等.扇贝裙边胶原蛋白酶解物清除超氧阴离子能力的研究[J].食品与生物技术学报,2009,28(3): 338-341.
[6]Shen Xuanyi,Hideyuki K,Koretaro T.Characterization ofmolecular species of collagen in scallop mantle[J].Food Chemistry, 2007,102(4):1187-1191.
[7]Choi JH,Behnam S,Kim SM.Physico-biochemical characteristics of scallop mantle collagen soluble in pepsin[J].Journal of Agricultural Science and Technology,2013,15(2):293-302.
[8]Mizuta S,Nakanishi Y,Shiraishi M,et al.Properties of scallop mantle collagen:its content,tissue distribution and thermal behavior[J].Fisheries Science,2007,73(6):1353-1361.
[9]Mizuta S,Miyagi T,Nishimiya T,et al.Partial characterization of collagen in several bivalvemolluscs[J].Food Chemistry,2004,87 (1):83-88.
[10]Mizuta S,Miyagi T,Nishimiya T,et al.Partial characterization of collagen inmantle and adductor of pearl oyster(Pinctada fucata) [J].Food Chemistry,2002,79(3):319-325.
[11]杨婷婷.采捕后活品虾夷扇贝(Patinopecten yessoensis)的风味变化[D].大连:大连海洋大学,2014.
[12]Zeng Shaokui,Zhang Chaohua,Lin Hong,et al.Isolation and characterisation of acid-solubilised collagen from the skin of Nile tilapia(Oreochromis niloticus)[J].Food Chemistry,2009,116 (4):879-883.
[13]Zhang Yan,Liu Wentao,Li Guoying,et al.Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp(Ctenopharyngodon idella)[J].Food Chemistry,2007,103 (3):906-912.
[14]Kiew P L,Mashitah M D.Isolation and characterization of collagen from the skin ofMalaysian catfish(HybridClariassp.)[J]. Journal of the Korean Society for Applied Biological Chemistry, 2013,56(4):441-450.
[15]Pati F,Adhikari B,Dhara S.Isolation and characterization of fish scale collagen of higher thermal stability[J].Bioresource Technology,2010,101(10):3737-3742.
[16]Ogawa M,Moody M W,Portier R J,et al.Biochemical properties of black drum and sheepshead seabream skin collagen[J].Journal of Agricultural and Food Chemistry,2003,51(27):8088-8092.
[17]Ebitani K,Narita M,Takahashi H,et al.Fundamental investiga-tion for effective utilization of collagen in scallop mantle[C]// Annu Rep Hokkaido Abashiri Fish Exp Sta.Tokyo:Tokai University Press,2003:93-96.
[18]˙Zelechowska E,Sadowska M,Turk M.Isolation and some properties of collagen from the backbone of Baltic cod(Gadusmorhua) [J].Food Hydrocolloids,2010,24(4):325-329.
[19]Zeng Shaokui,Yin Juanjuan,Yang Shuqi,et al.Structure and characteristics of acid and pepsin-solubilized collagens from the skin of cobia(Rachycentron canadum)[J].Food Chemistry, 2012,135(3):1975-1984.
[20]Nagai T,Worawattanamateekul W,Suzuki N,et al.Isolation and characterization of collagen from rhizostomous jellyfish(Rhopilema asamushi)[J].Food Chemistry,2000,70(2):205-208.
[21]Liu Haiying,Li Ding,Guo Shidong.Studies on collagen from the skin of channel catfish(Ictalurus punctatus)[J].Food Chemistry,2007,101(2):621-625.
[22]王哲平,刘淇,曹荣,等.温度对刺参胶原蛋白结构和分子量变化的影响[J].渔业科学进展,2011,32(6):80-84.
[23]陆剑锋,万全,殷章敏,等.中华鳖裙边胶原蛋白的提取及其特征[J].水产学报,2010,34(6):981-988.
[24]Bae I,Osatomi K,Yoshida A,et al.Biochemical properties of acid-soluble collagens extracted from the skins of underutilised fishes[J].Food Chemistry,2008,108(1):49-54.
[25]闫鸣艳.狭鳕鱼皮胶原蛋白结构和物理特性的研究[D].青岛:中国海洋大学,2009.
[26]Rigby B J.Amino-acid composition and thermal stability of the skin collagen of the Antarctic ice-fish[J].Nature,1968,219: 166-167.
[27]Kimura S,Ohno Y,Miyauchi Y,et al.Fish skin type I collagen: wide distribution of anα3subunit in teleosts[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 1987,88(1):27-34.
[28]Li Zhongrui,Wang Bin,Chi Changfeng,et al.Isolation and characterization of acid soluble collagens and pepsin soluble collagens from the skin and bone of Spanish mackerel(Scomberomorous niphonius)[J].Food Hydrocolloids,2013,31(1):103-113.
[29]Sionkowska A.Modification of collagen films by ultraviolet irradiation[J].Polymer Degradation and Stability,2000,68(2):147-151.
[30]Doyle B B,Bendit E G,Blout E R.Infrared spectroscopy of collagen and collagen-like polypeptides[J].Biopolymers,1975,14 (5):937-957.
[31]Liu Dasong,Liang Li,Regenstein JM,et al.Extraction and characterisation of pepsin-solubilised collagen from fins,scales, skins,bones and swim bladders of bighead carp(Hypophthalmichthys nobilis)[J].Food Chemistry,2012,133(4):1441-1448.
[32]Ahmad M,Benjakul S.Extraction and characterisation of pepsinsolubilised collagen from the skin of unicorn leatherjacket (Aluterusmonocerous)[J].Food Chemistry,2010,120(3):817-824.
[33]Guzzi Plepis A M D,Goissis G,Das-Gupta D K.Dielectric and pyroelectric characterization of anionic and native collagen[J]. Polymer Engineering&Science,1996,36(24):2932-2938.
[34]Matmaroh K,Benjakul S,Prodpran T,et al.Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish(Parupeneus heptacanthus)[J].Food Chemistry, 2011,129(3):1179-1186.
Extraction and characterization of collagen from yesso scallopPatinopecten yessoensismantle
Abstract:Themantle collagen were extracted and its physicochemical properties includingmolecularweight,solubility,viscosity,ultraviolet(UV)absorption,and amino acid composition and structural characteristics(CD,FTIR)were studied in yesso scallopPatinopecten yessoensisin order to explore the high value-added use of scallop byproducts.The results showed that there was 13.16%of collagen in drymantle.Collagen moleculeswere primarily consisted ofαsubunit and a small amountofβ,γsubunits,and the peptidemolecularweightwas reduced because the pepsin removed the telopeptide of subunits.Mantle collagen was characterized by a typical type I collagen, whose acid soluble collagen(ASC)and enzymatic soluble collagen(PSC)were rich in glycine,glutamic acid, proline and hydroxyproline.The collagen had denatured temperature of about 20℃,and was different from collagens of other species in that PSC had a higher solubility than ASC did.They had isoelectric point of pH 4 and the similar salt solubility.Fourier transform infrared spectroscopy revealed that there was subtle difference in secondary structure between PSC and ASC.However,pepsin did not affect the triple helical structure of the collagen.Circular dichroism spectrum indicated that the ASC had more stable tertiary structure than PSC and that increase in temperature undermined the tertiary structure.
Key words:Patinopecten yessoensis;mantle;physicochemical property;collagen
中图分类号:Q954.4
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.06.016
文章编号:2095-1388(2016)06-0678-07
收稿日期:2015-06-02
基金项目:国家自然科学基金资助项目(31271980)