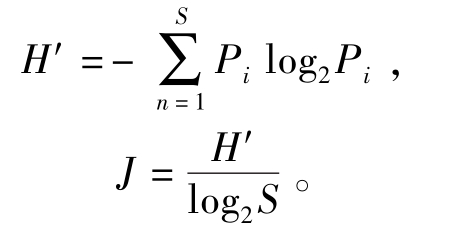两种混养模式海水池塘浮游生物的群落结构及其粒径特征
蔡志龙,秦美川,赵 文,郭 凯,张 晨,李 黎,张家卫
(大连海洋大学水产与生命学院,辽宁省水生生物学重点实验室,辽宁大连116023)
摘要:为了解“海蜇–缢蛏–牙鲆–对虾”和“刺参–对虾”两种混养模式海水池塘生态系统特征,于2013年4月—2014年3月采用野外调查方法研究了辽宁省两种混养模式的池塘浮游生物群落结构及其粒径特征。结果表明:“海蜇–缢蛏–牙鲆–对虾”混养池塘共检出浮游植物48种,以硅藻门和绿藻门种类为主,浮游植物平均密度和生物量分别为26.50×105ind./L、0.90 mg/L,共检出浮游动物24种,主要为原生动物和桡足类,浮游动物平均密度和生物量分别为81.57 ind./L、0.51 mg/L,浮游植物、浮游动物的多样性指数平均值分别为2.28、1.49;“刺参–对虾”混养池塘共检出浮游植物57种,也以硅藻门和绿藻门种类为主,浮游植物平均密度和生物量分别为3.99×105ind./L、0.41 mg/L,共检出浮游动物33种,主要为原生动物和桡足类,浮游动物平均密度和生物量分别为73.19 ind./L、0.13 mg/L,浮游植物、浮游动物的多样性指数平均值分别为2.20、0.93;两种混养池塘浮游植物粒径为2.50~69.62μm,浮游动物粒径为11.09~560.41μm。研究表明,“海蜇–缢蛏–牙鲆–对虾”混养池塘的浮游生物种类相对较少,但其密度和生物量较大。
关键词:群落结构;粒径特征;浮游生物;混养模式;海水池塘
在海水养殖池塘中,浮游生物在养殖生态系统物质循环和能量流动过程中具有重要作用[1],其群落结构与池养动物健康养殖、水质调控等密切相关。近年来,海水池塘混养模式研究已引起广泛重视,且在北方地区有较快发展,其中,对“海蜇–缢蛏–牙鲆–对虾”(以下简称海蜇池塘)和“刺参–对虾”(以下简称刺参池塘)两种池塘混养模式比较的研究较多[2-5],但是对两种模式浮游生物群落结构特点的研究较少。
本研究中,针对“海蜇–缢蛏–牙鲆–对虾”和“刺参–对虾”两种混养模式,通过测定和比较两种池塘水体理化特征、浮游生物密度与生物量的季节变化、浮游生物与水体理化因子间的相关性、浮游生物粒径与其密度及生物量之间的关系等方面分析两种池塘模式的优缺点,探索池塘养殖模式的不足之处,并寻求合理的解决措施,以期为养殖池塘水质的科学管理及构建资源节约型、环境友好型的海水综合养殖模式提供科学依据。
1 材料与方法
1.1 采样时间及采样点
于2013年5月—10月在东港市昱达水产养殖有限公司选取两个海蜇池塘(1#和2#,N39°51′、E124°09′),2013年4月—2014年3月在大连金坨水产食品有限公司选取两个刺参池塘(8#和9#, N39°41′、E123°05′)进行试验(其中8#池塘采样时间为2013年8月至2014年3月)。1#、2#池塘面积分别为6.0、8.5 hm2,平均水深均为1.6 m; 8#、9#池塘面积分别为5.4、6.4 hm2,平均水深均为1.5 m,2个池塘养殖过程中均不投饵。每个池塘的采样点均设置3个,即池塘的进水口、中心和出水口,其中,进水口和出水口各采一个混合水样,池塘中心采表层和底层2个水样。除2013年7月和8月对1#、2#池塘水样按2次/月采集外,其余月份均对池塘水样按1次/月采集。
1.2 方法
1.2.1 水质指标的测定及样品的处理 海水池塘水质指标测定方法如表1所示。浮游生物样品参照《水生生物学》[1]中的方法进行采集及浓缩处理。
表1 试验池塘水质监测指标及测定方法
Tab.1 Item s and detection methods of water quality in the experimental ponds
序号No.指标item测定方法detectionmethod 1水温(WT)水温计法2透明度(SD)萨氏盘法3酸碱度(pH)便携式pH计法4盐度(S)便携式盐度计法5溶解氧(DO)碘量法6磷酸盐(PO3-4-P)磷钼蓝法氨氮(NH+4-N)次溴酸钠法8硝酸氮(NO-3-N)锌镉还原法9亚硝酸氮(NO-2-N)磺胺-盐酸萘乙二胺法10总磷(TP)过硫酸盐联合消化法11总氮(TN)过硫酸盐联合消化法12总菌AODC法13叶绿素a分光光度法14 7初级生产力黑白瓶测氧法
1.2.2 多样性指数的计算 香农-威纳多样性指数(H′)和均匀性指数(J)的计算公式[6-7]为
其中:Pi为第i物种的个体数与该群落中总个体数之比;S为总物种数。
优势度(Y)的计算公式为
其中:ni为第i物种的个体数;N为群落中的总个体数;fi为第i物种的出现频率。
等效球体直径(ESD)即粒径的计算公式为
其中V为拟合图形体积。
1.3 数据处理
运用Excel和SPSS 17.0软件对试验数据进行处理和统计分析。
2 结果与分析
2.1 试验池塘理化环境
两种混养模式海水池塘水体理化因子及其动态变化见表2。从表2可见:海蜇池塘(1#、2#)溶解氧含量最高值出现在10月的1#池塘,最低值出现在7月的1#池塘,且两个池塘10月的溶解氧明显高于其他各月,这与10月采样前主养的海蜇已经捕捞完毕密切相关;刺参池塘(8#、9#)结冰期(12月至翌年2月)的溶解氧含量明显高于其他各月,最高值出现在2月的9#池塘,最低值出现在6月的9#池塘,造成这种现象的原因主要是结冰期间冰下浒苔等大型海藻及其他小型浮游植物光合作用所产氧气不能有效逸出,使水体中溶解氧过饱和。刺参池塘(8#、9#)透明度均高于同期的海蜇池塘(1#、2#)。
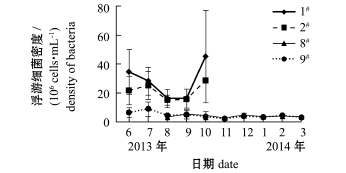
各池塘浮游细菌的季节变化如图1所示,其中1#海蜇池塘浮游细菌密度变化范围为(1.62~4.54)×107cells/mL,平均为(2.82±1.25)×107cells/mL;2#海蜇池塘变化范围为(1.51~2.87)× 107cells/mL,平均为(2.13±0.59)×107cells/mL; 8#刺参池塘变化范围为(2.75~5.42)×106cells/mL,平均为(4.00±0.85)×106cells/mL;9#刺参池塘变化范围为(2.04~8.99)×106cells/mL,平均为(4.55±1.97)×106cells/mL。可以看出,海蜇池塘的浮游细菌密度明显高于刺参池塘。
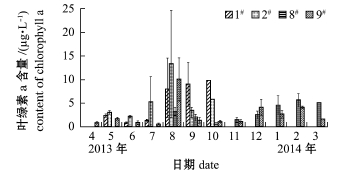
各池塘水体叶绿素a含量的变化如图2所示。1#池塘的叶绿素a含量平均为(5.20±4.13) μg/L,变化范围为0.77~9.79μg/L;2#池塘平均为(5.49±4.05)μg/L,变化范围为2.17~13.27 μg/L;8#池塘平均为(3.16±1.78)μg/L,变化范围为0.71~5.60μg/L;9#池塘平均为(2.48± 2.66)μg/L,变化范围为0.59~10.01μg/L。海蜇池塘叶绿素a含量仅出现夏季一个高峰值,而刺参池塘则出现夏季和冬季双峰型特点。
调查发现,1#和2#海蜇池塘水体初级毛产量(P)平均值(以O2计)分别为(2.63±1.07)、(3.56±2.75)g/(m2·d),呼吸量(R)分别为(2.87±1.20)、(2.31±1.32)g/(m2·d);8#和9#刺参池塘水体初级毛产量平均值分别为(1.26± 0.86)、(1.45±1.33)g/(m2·d),呼吸量分别为(0.64±0.41)、(0.65±0.46)g/(m2·d)。可以看出,海蜇池塘的初级毛产量和呼吸量均远高于刺参池塘。
2.2 浮游生物群落结构特征
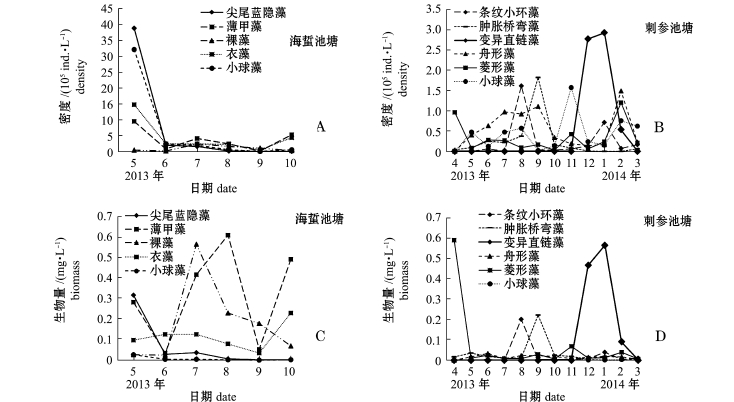
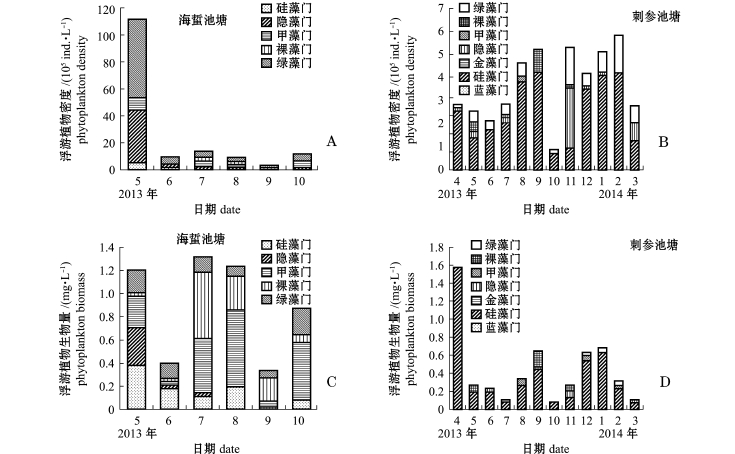
调查期间,海蜇池塘共出现浮游植物48种,隶属于6个门,其中硅藻门26种,占总种数的54.17%,绿藻门10种,甲藻门6种,裸藻门4种,金藻门和隐藻门各1种。刺参池塘共出现浮游植物57种,隶属于7个门,其中硅藻门35种,占总种数的61.40%,绿藻门9种,裸藻门5种,甲藻门4种,金藻门2种,蓝藻门和隐藻门各1种。海蜇池塘浮游植物的优势种为尖尾蓝隐藻Chroomonas acuta、薄甲藻Glenodinium pulvisculus、裸藻Euglena、衣藻Chlamydomonas、小球藻Chlorella、十字藻Crucigenia(图3-A、C);刺参池塘的优势种为卵形藻Cocconeis、条纹小环藻Cyclotella striata、肿胀桥弯藻Cymbella tumida、变异直链藻Melosira varians、舟形藻Navicula、菱形藻Nitzschia、长菱形藻Nitzschia longissima、中肋骨条藻Skeletonema costatum、裸藻Euglena、衣藻Chlamydomonas、小球藻Chlorella(图3-B、D)。
表2 试验池塘水体的理化因子
Tab.2 The physiochem ical factors in the experim ental ponds
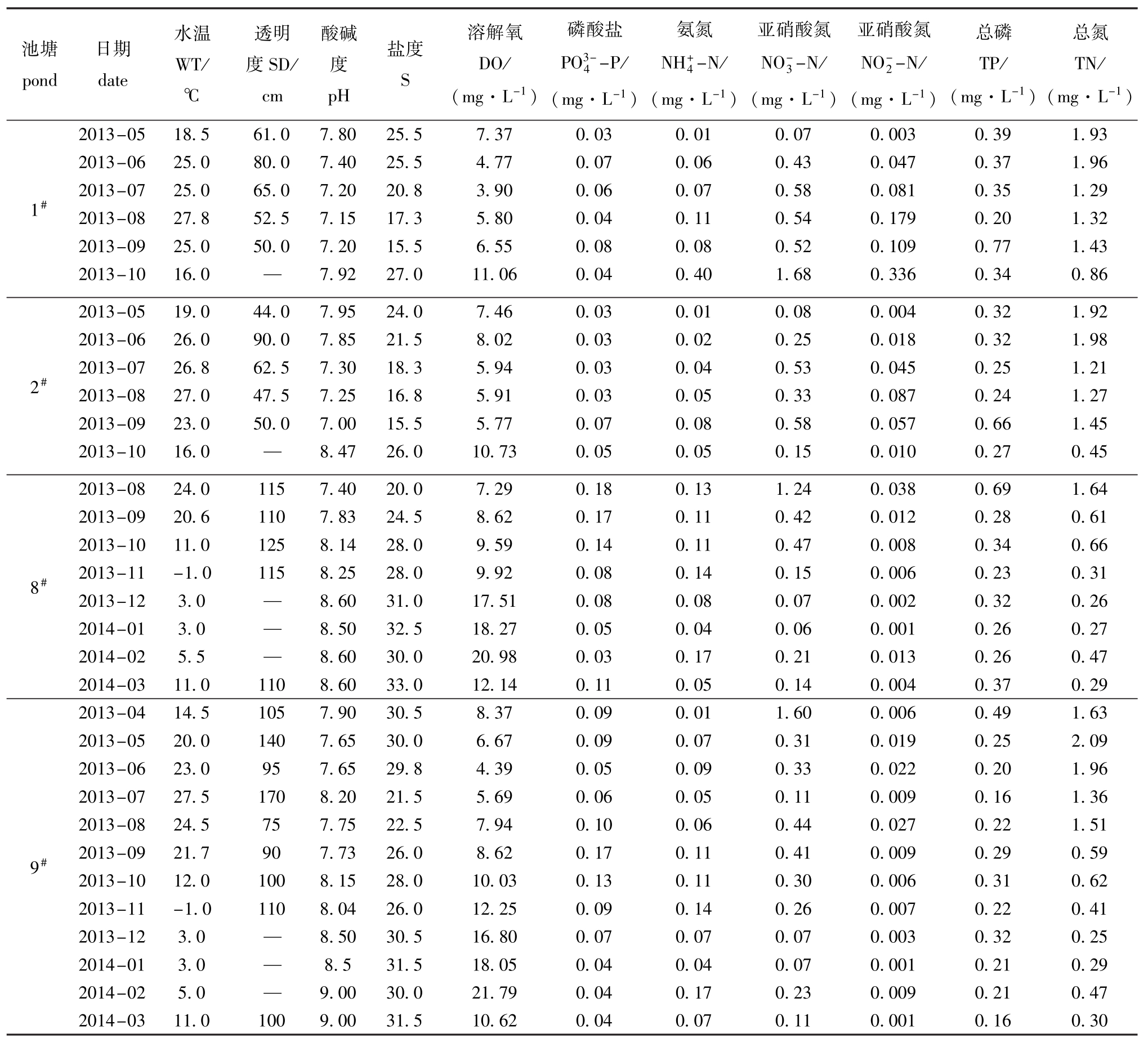
磷酸盐池塘pond日期date水温WT/℃透明度SD/ cm酸碱度pH盐度S溶解氧DO/ (mg·L-1) PO3-4-P/ (mg·L-1)氨氮NH+4-N/ (mg·L-1)亚硝酸氮NO-3-N/ (mg·L-1)亚硝酸氮NO-2-N/ (mg·L-1)总磷TP/ (mg·L-1)总氮TN/ (mg·L-1) 1# 2013-05 18.5 61.0 7.80 25.5 7.37 0.03 0.01 0.07 0.003 0.39 1.93 2013-06 25.0 80.0 7.40 25.5 4.77 0.07 0.06 0.43 0.047 0.37 1.96 2013-07 25.0 65.0 7.20 20.8 3.90 0.06 0.07 0.58 0.081 0.35 1.29 2013-08 27.8 52.5 7.15 17.3 5.80 0.04 0.11 0.54 0.179 0.20 1.32 2013-09 25.0 50.0 7.20 15.5 6.55 0.08 0.08 0.52 0.109 0.77 1.43 2013-10 16.0—7.92 27.0 11.06 0.04 0.40 1.68 0.336 0.34 0.86 2# 2013-05 19.0 44.0 7.95 24.0 7.46 0.03 0.01 0.08 0.004 0.32 1.92 2013-06 26.0 90.0 7.85 21.5 8.02 0.03 0.02 0.25 0.018 0.32 1.98 2013-07 26.8 62.5 7.30 18.3 5.94 0.03 0.04 0.53 0.045 0.25 1.21 2013-08 27.0 47.5 7.25 16.8 5.91 0.03 0.05 0.33 0.087 0.24 1.27 2013-09 23.0 50.0 7.00 15.5 5.77 0.07 0.08 0.58 0.057 0.66 1.45 2013-10 16.0—8.47 26.0 10.73 0.05 0.05 0.15 0.010 0.27 0.45 8# 2013-08 24.0 115 7.40 20.0 7.29 0.18 0.13 1.24 0.038 0.69 1.64 2013-09 20.6 110 7.83 24.5 8.62 0.17 0.11 0.42 0.012 0.28 0.61 2013-10 11.0 125 8.14 28.0 9.59 0.14 0.11 0.47 0.008 0.34 0.66 2013-11-1.0 115 8.25 28.0 9.92 0.08 0.14 0.15 0.006 0.23 0.31 2013-12 3.0—8.60 31.0 17.51 0.08 0.08 0.07 0.002 0.32 0.26 2014-01 3.0—8.50 32.5 18.27 0.05 0.04 0.06 0.001 0.26 0.27 2014-02 5.5—8.60 30.0 20.98 0.03 0.17 0.21 0.013 0.26 0.47 2014-03 11.0 110 8.60 33.0 12.14 0.11 0.05 0.140.004 0.37 0.29 9# 2013-04 14.5 105 7.90 30.5 8.37 0.09 0.01 1.60 0.006 0.49 1.63 2013-05 20.0 140 7.65 30.0 6.67 0.09 0.07 0.31 0.019 0.25 2.09 2013-06 23.0 95 7.65 29.8 4.39 0.05 0.09 0.33 0.022 0.20 1.96 2013-07 27.5 170 8.20 21.5 5.69 0.06 0.05 0.11 0.009 0.16 1.36 2013-08 24.5 75 7.75 22.5 7.94 0.10 0.06 0.44 0.027 0.22 1.51 2013-09 21.7 90 7.73 26.0 8.62 0.17 0.11 0.41 0.009 0.29 0.59 2013-10 12.0 100 8.15 28.0 10.03 0.13 0.11 0.30 0.006 0.31 0.62 2013-11-1.0 110 8.04 26.0 12.25 0.09 0.14 0.26 0.007 0.22 0.41 2013-12 3.0—8.50 30.5 16.80 0.07 0.07 0.07 0.003 0.32 0.25 2014-01 3.0—8.5 31.5 18.05 0.04 0.04 0.07 0.001 0.21 0.29 2014-02 5.0—9.00 30.0 21.79 0.04 0.17 0.23 0.009 0.21 0.47 2014-03 11.0 100 9.00 31.5 10.62 0.04 0.07 0.110.001 0.16 0.30
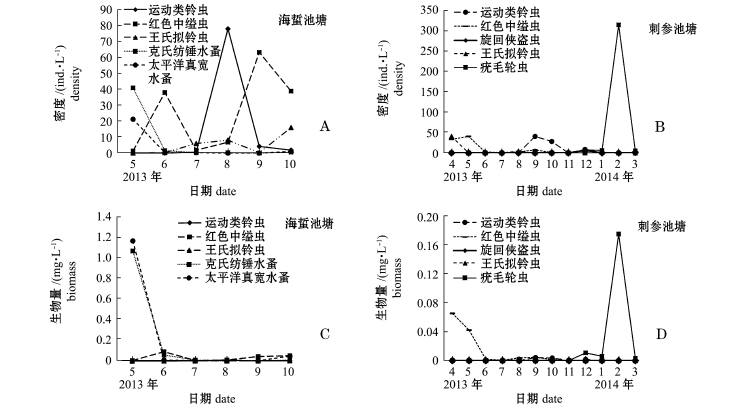
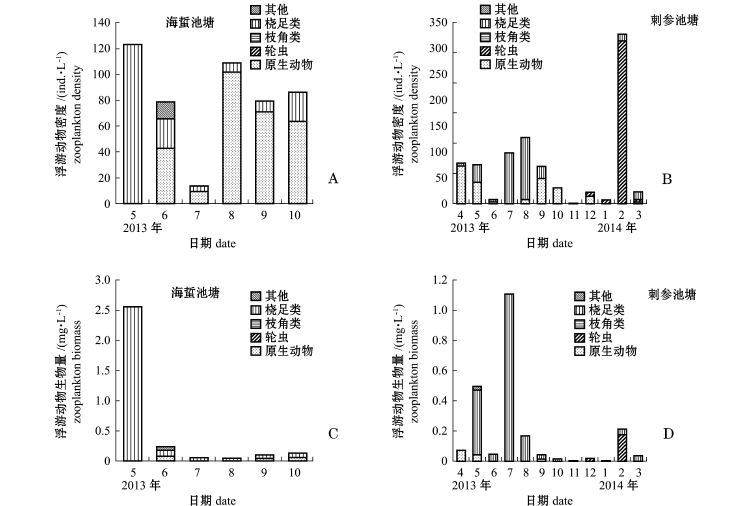
海蜇池塘共出现浮游动物24种,其中原生动物10种,占41.67%,桡足类9种,占37.50%,轮虫和枝角类各2种,其他种类幼体1种。刺参池塘共出现浮游动物33种,其中原生动物12种,占36.36%,桡足类10种,占30.30%,轮虫5种,枝角类1种,其他种类幼体5种。海蜇池塘浮游动物的优势种为运动类铃虫Codonellopsismobilis、红色中缢虫Mesodinium rubrum、王氏拟铃虫Tinitionnopsiswangi、克氏纺锤水蚤Acartia clausi、太平洋真宽水蚤Eurytemora pacifica(图4-A、C);刺参池塘的优势种为运动类铃虫Codonellopsismobilis、王氏拟铃虫Tinitionnopsiswangi、红色中缢虫Mesodinium rubrum、旋回侠盗虫Strobilidium gyrans、疣毛轮虫Synchaeta(图4-B、D)。海蜇池塘浮游植物粒径较小的优势种在5月份时密度相对较高,随着养殖经济种类的生长,密度呈降低趋势。两种模式海水池塘浮游动物的优势种类差别很大,5月份时,海蜇池塘克氏纺锤水蚤和太平洋真宽水蚤的生物量均超过1 mg/L,而其余月份二者生物量均不足0.1 mg/L;在结冰期间,刺参池塘疣毛轮虫密度、生物量骤增,2月份时优势度高达0.96。
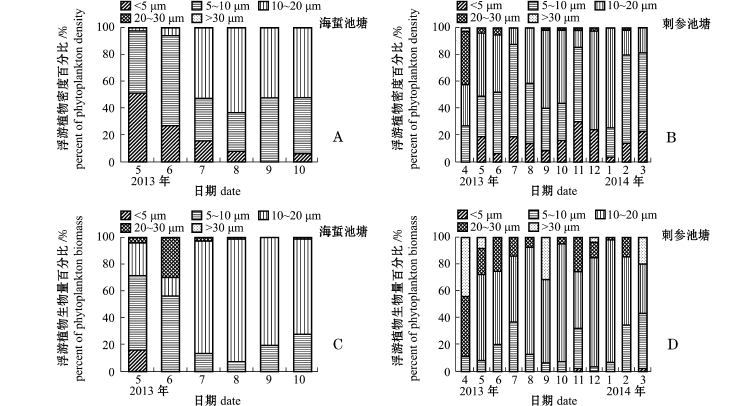
“海蜇–缢蛏–牙鲆–对虾”混养池塘浮游植物平均密度和生物量分别为26.50×105ind./L、0.90 mg/L,密度以绿藻门为主,其次为隐藻门(图5-A),生物量以裸藻门、硅藻门、甲藻门为主(图5-C);浮游动物平均密度和生物量分别为81.57 ind./L、0.51 mg/L,密度以原生动物居多,其次为桡足类(图6-A),生物量则主要以桡足类为主(图6-C)。“刺参–对虾”混养池塘浮游植物平均密度和生物量分别为3.99×105ind./L、0.41 mg/L,密度以硅藻门为主,其次为绿藻门(图5-B),生物量以硅藻门为主(图5-D);浮游动物平均密度和生物量分别为73.19 ind./L、0.13 mg/L,密度以轮虫为主(图6-B),生物量则以桡足类为主(图6-D)。
调查期间,海蜇池塘浮游植物和浮游动物的多样性指数平均值分别为2.28、1.49,刺参池塘分别为2.20、0.93。
2.3 浮游生物粒径特征
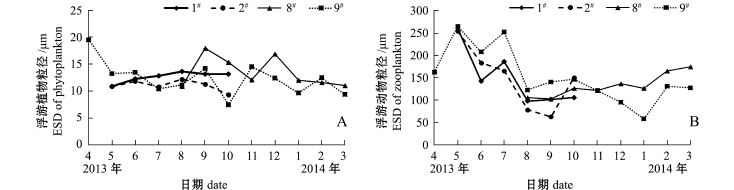
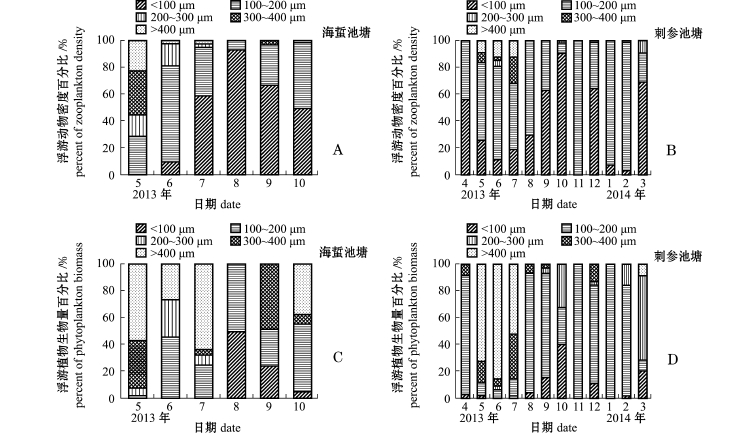
调查期间,两种混养模式海水池塘出现的所有浮游植物种类粒径变化范围为2.50~69.62μm (小球藻、美丽曲舟藻),其中1#、2#、8#、9#池塘浮游植物粒径平均分别为(12.65±0.99)、(11.04± 1.01)、(13.47±2.81)、(12.31±3.11)μm。从各池塘浮游植物平均粒径的季节变化(图7-A)可知,海蜇池塘浮游植物粒径变化幅度略低于刺参池塘。
调查期间,两种混养模式海水池塘出现的所有浮游动物种类粒径变化范围为11.09~560.41μm (旋回侠盗虫、溞状幼体),其中1#、2#、8#、9#池塘浮游动物粒径平均分别为(149.10±64.09)、(149.08±70.52)、(132.52±25.94)、(152.55± 60.93)μm。从各池塘浮游动物平均粒径的季节变化(图7-B)可知,其变化明显,在春夏达到最大,在秋冬季较小,这与春夏季粒径大的桡足类大量繁殖有关。
两种混养模式海水池塘浮游生物密度、生物量与其粒径的关系如图8、图9所示。可以看出,海蜇池塘粒径小于20μm的浮游植物密度所占比例随时间的延长呈先降低后增加的趋势,相应的粒径小于200μm浮游动物密度所占比例则呈先增加后降低的趋势,而刺参池塘无明显的变化规律。
3 讨论
3.1 两种混养模式池塘的水质特点
调查期间发现,刺参池塘结冰期间pH要高于其他各月份,这与其溶解氧的变化规律相吻合。因受降水等因素的影响,两种模式海水池塘夏季盐度较低。经水质测定,两种模式海水池塘氮磷指标无明显季节变化规律,此结果主要是因人工管理造成的。
1#、2#、8#、9#养殖池塘的综合营养状态指数(MTSI)分别为5.34、5.22、5.51、5.28,均属于轻度富营养水体。另外,已有研究表明,磷是淡水浮游植物生长的限制性因子,而海水和河口生态系统中,氮是浮游植物生长的限制性因子[8]。Boyer等[9]研究表明,最适合浮游植物生长的N/P值为7,若高于7,磷是浮游植物生长的限制性因子;反之,则氮是浮游植物生长的限制性因子。本研究中,1#、2#、8#、9#养殖池塘的N/P值分别为3.16、4.22、1.05、0.92,均低于7,因而,氮是海蜇池塘和刺参池塘养殖的限制性因子,适当的施肥、投饵和补充氮源可以提高养殖产量。这与王海雷等[8]的研究结果相同。
本研究中得出,海蜇池塘的浮游细菌平均密度为2.48×107cells/mL,与刘国才等[10]对海水养虾池的研究结果相近,略高于田相利等[11]对“对虾-罗非鱼-缢蛏”封闭式养殖模式的研究结果。本试验中,刺参池塘的浮游细菌密度平均为4.28×106cells/mL,高于赵文等[12]对刺参养殖池塘浮游细菌现存量的研究结果,其原因可能与入水水源有机质增加以及使用某些菌类药物等有关,但其明显低于本试验中海蜇池塘的浮游细菌密度,这主要是水体盐度较高影响细菌的生长繁殖,泼洒杀草药使其密度大幅降低,以及全年不投饵不能补充足够的有机质等因素所致。除此之外,海蜇池塘受养殖经济种类的滤食等因素影响,浮游细菌密度呈降低趋势,而后随着海蜇等经济种类的收获又逐渐增加。
初级毛产量与呼吸量的比值(P/R)是反映初级生产力特征的一个重要指标,它可反映生物群落的代谢特征及外来有机质的作用。P/R值<1或接近1,表明水体外来有机质起了较大作用;P/R>1,只有在大量营养盐进入时才会出现,如大量使用无机肥料,或有机肥料与无机肥料兼用[6]。本研究中,1#、2#、8#、9#池塘的P/R值分别为0.97、1.64、2.49、2.68,海蜇池塘的P/R值约为1,而刺参池塘的P/R值则明显高于海蜇池塘,与高青盐碱池[13]相近。这表明海蜇池塘中水体初级生产力受外来有机质的影响较大;而刺参池塘则由于受到外来无机营养盐的影响,再加上水体自身微生物分解慢,物质循环速率低,刺参对浮游植物利用率不高,导致初级生产力不能得到充分利用。
另外,由于二者受养殖管理的影响较大,两种模式海水池塘的叶绿素a未出现特别明显的变化规律。
3.2 两种混养模式池塘浮游生物的群落结构特征
本次调查期间,两个海蜇池塘浮游生物分别为48种和24种,两个刺参池塘分别为57种和33种。两种混养模式的池塘浮游植物组成均以硅藻门占优势,其次为绿藻门;浮游动物则均以原生动物占优势,其次为桡足类。从丰度上观察,海蜇池塘浮游植物的密度远高于刺参池塘,但其浮游动物的密度则与刺参池塘相近。从生物量上观察,海蜇池塘浮游生物的生物量均明显高于刺参池塘。这主要是刺参池塘养殖管理中不施肥、不投饵和两种混养模式所养殖的生物种类不同所致。另外,光照、水温、理化因子等环境和人为因素也起到较大的影响作用。
本研究中发现,从海蜇和刺参池塘鉴定出的浮游动植物种数低于自然海水[14]、大型水源水库[15]、盐碱池塘[16],但高于南美白对虾高位池[17]、河口区斑节对虾淡化养殖池塘[18]和中国对虾养殖池塘[19],这两种养殖池塘出现的浮游生物种类以淡、海水中均有分布的广盐性种类为主。与其他养殖池塘[16-20]相比,本研究中两个试验池塘浮游生物的密度及生物量偏低。此结果表明,浮游生物群落结构特征与这两种养殖池塘的非生物环境及养殖管理有关,更与混养模式和放养的生物种类及数量密切相关,另外,养殖动物的摄食状况也是影响浮游生物群落结构特征的重要因素之一。
1#池塘浮游植物密度与NO-2-N呈极显著正相关(r=0.959,P=0.003),与NO-3-N、NH+4-N呈显著正相关(r=0.890,P=0.017;r=0.907,P= 0.013);2#池塘浮游植物密度与NO-3-N呈显著正相关(r=0.815,P=0.048),浮游植物生物量与TP呈显著正相关(r=0.815,P=0.048)。此外,海蜇池塘和刺参池塘浮游植物密度、生物量与DO、pH、盐度、温度等因子相关性不显著。这表明,氮是海蜇池塘的第一限制性因子,其次是磷。海蜇池塘与刺参池塘的差异主要是由于养殖生物种类不同以及人工管理(施肥、投饵)不同造成的。2#池塘浮游动物生物量与NO-3-N呈显著正相关(r=0.902,P=0.014);8#池塘浮游动物密度、生物量均与温度呈显著正相关(r=0.739,P= 0.036;r=0.702,P=0.050);9#池塘浮游动物密度与温度呈显著正相关(r=0.648,P=0.023),浮游动物生物量与温度呈极显著正相关(r= 0.784,P=0.003),浮游动物生物量与TN呈显著正相关(r=0.647,P=0.023)。此外,两种池塘模式浮游动物密度和生物量与pH、盐度、NO-2-N、NH+4-N、TP等因子相关性不显著。这表明,温度对刺参池塘浮游动物的影响非常大,另外,氮对两种模式海水池塘浮游动物的生长繁殖作用较明显。
本次调查发现,海蜇池塘的浮游植物优势种主要出现在隐藻门、甲藻门、裸藻门和绿藻门,这几个门出现的藻类比较单一,但数量在某一时间段内较大;而硅藻门出现的种类较多,但每种的数量有限,形不成优势种。刺参池塘的浮游植物优势种则主要是硅藻门、隐藻门、裸藻门和绿藻门,且硅藻门的优势种数量占到总数的一半以上。海蜇池塘由于养殖期在夏秋季节,优势种的季节变化不太明显;而通过对刺参池塘的周年调查发现,春季和秋季优势种是硅藻门、隐藻门、裸藻门和绿藻门的种类,夏季和冬季优势种则只出现在硅藻门和绿藻门中。海蜇池塘浮游动物优势种主要集中在原生动物和桡足类,且季节变化不明显;刺参池塘优势种则分布于原生动物、桡足类和轮虫中,且有较明显的季节变化,其中,春秋季优势种出现在原生动物和桡足类,夏季主要以桡足类种类为主,结冰期则主要是轮虫和原生动物。两种混养模式池塘优势种的差异主要是由于混养经济种类的不同造成的,另外,盐度、施肥、投饵、水源等因素也会对优势种的分布产生重要影响。引起刺参池塘优势种季节变化的原因主要与藻类的季节演替规律(水温、盐度、光照等)、养殖生物的滤食状况和泼洒杀草药等人为因素有关。
经过方差分析发现,相同采样期内,海蜇池塘中浮游植物均匀度指数显著低于刺参池塘,表明海蜇池塘浮游植物种类间数量的差异性远大于刺参池塘,更易形成优势种。此外,海蜇池塘浮游动植物多样性指数、浮游动物均匀度指数均与刺参池塘无显著性差异。经相关性分析得出,9#池塘浮游植物多样性指数与均匀度指数呈显著正相关(r= 0.650,P=0.022),8#池塘相关性接近显著;8#和9#池塘浮游动物多样性指数与均匀度指数呈极显著正相关(r=0.974,P=0.000;r=0.727,P= 0.007);而1#和2#池塘浮游动植物多样性指数与均匀度指数相关性不显著。由此表明,刺参池塘浮游动植物群落数越多,其物种间个体的分布越均匀,而海蜇池塘则无此特点,其原因主要与池塘养殖生物种类及人工管理有关。
3.3 两种混养模式池塘浮游生物粒径的变化特点
浮游植物的粒径大小与水中营养盐含量等理化因子有密切关系,在营养盐含量较低时,浮游植物粒径变小,而随着营养盐含量升高,粒径会变大[21]。经过相关性分析得出:1#池塘浮游植物粒径与NO-2-N呈极显著正相关(r=0.951,P= 0.004),与NO-3-N、NH+4-N呈显著正相关(r= 0.849,P=0.032;r=0.833,P=0.040),浮游动物粒径与NO-2-N、NH+4-N呈显著正相关(r= 0.876,P=0.022;r=0.819,P=0.046);2#池塘浮游植物粒径与TN相关性接近显著(r=0.801,P=0.055),与温度呈显著正相关(r=0.843,P= 0.035),浮游动物与NO-2-N、NH+4-N呈显著正相关(r=0.813,P=0.049;r=0.892,P=0.017); 9#池塘浮游植物与NO-3-N呈显著正相关(r= 0.600,P=0.039),浮游动物粒径与NO-2-N、TP呈显著正相关(r=0.662,P=0.019;r=0.658,P=0.020),与TN呈极显著正相关(r=0.778,P=0.003)。这表明氮是浮游生物生长的限制性因子,另外,温度对其生长也起到至关重要的作用。
生物粒径的大小能够体现食物和消费者间的关系,同时又与生物的生理、生物过程,以及生态系统的结构和功能密切相关[6,22]。陈怀清等按照浮游植物粒径的大小将浮游植物划分为超微型(0.2~2μm)、微型(3~20μm)、小型浮游植物(20~200μm)3种[23]。本研究中,通过对浮游植物粒径的研究发现,海蜇池塘和刺参池塘粒径小于20 μm的浮游植物数量和生物量相对较多,而大于20 μm的浮游植物数量和生物量较少,组成上以微型浮游植物为主。两种池塘模式浮游动物粒径小于200μm的数量相对较多,大于200μm的浮游动物数量较少,组成上以小型浮游动物为主。其原因主要是小型及微型浮游动物是超微型和微型浮游植物的主要摄食者[24]。此外,池塘的非生物环境及养殖生物的摄食状况也是影响浮游生物群落结构的重要因素[15]。另外,海蜇池塘和刺参池塘浮游植物、浮游动物密度和生物量在不同粒径上的分布差异较大,这与两种池塘模式所养生物的不同也有密切关系,即养殖生物的滤食也是影响浮游生物粒径变化的重要因素。
通过本研究发现,高效、科学地人工管理是混养模式海水池塘成功的关键,合理地搭配混养种类,以及适当补充氮源,是提高池塘经济效益和生态效益的重要手段。
参考文献:
[1]赵文.水生生物学[M].北京:中国农业出版社,2005:5-8.
[2]Guo Kai,ZhaoWen,Wang Shan,et al.Study of food web structure and trophic level in the sea ponds of an optimized culture model (jellyfish-shellfish-fish-prawn)[J].Aquaculture International, 2014,22(6):1783-1791.
[3]Guo Kai,Zhao Wen,LiWenkuan,et al.Food web structure and trophic levels in polyculture rice-crab fields[J].Chinese Journal of Oceanology and Limnology,2015,33(3):735-740.
[4]刘铁钢,赵文,郭凯.刺参养殖过程中毒物的毒理及毒性研究概况[J].北京农业,2011(21):11-13.
[5]赵文,张义伟,魏杰,等.刺参养殖池塘颗粒悬浮物结构及其沉积作用[J].生态学报,2009,29(11):5749-5757.
[6]董双林,赵文.养殖水域生态学[M].北京:中国农业出版社, 2004:89.
[7]霍堂斌,王野,栗铁柱,等.鸭绿江与图们江流域大型底栖动物群落结构的比较研究[J].大连海洋大学学报,2015,30(4): 398-404.
[8]王海雷,赵文,李晓东,等.不同氮、磷比施肥对多混盐水池塘浮游植物群落定向演替的影响[J].大连水产学院学报,2005, 20(3):238-243.
[9]Boyer JN,Christian R R,Stanley D W.Patterns of phytoplankton primary productivity in the Neuse River estuary,North Carolina, USA[J].Marine Ecology Progress Series,1993,97:287-297.
[10]刘国才,李德尚,徐怀恕,等.海水养虾池细菌数量动态及细菌生产力的研究[J].应用与环境生物学报,1997,3(4):340-344.
[11]田相利,李德尚,董双林,等.对虾-罗非鱼-缢蛏封闭式综合养殖的水质研究[J].应用生态学报,2001,12(2):287-292.
[12]赵文.刺参池塘养殖生态学及健康养殖理论[M].北京:科学出版社,2009:39-99.
[13]赵文,董双林,李德尚,等.盐碱池塘围隔生态系统的悬浮物结构及有机碳库储量[J].生态学报,2002,22(12):2133-2140.
[14]程济生.黄渤海近岸水域生态环境与生物群落[M].青岛:中国海洋大学出版社,2004:15-26.
[15]刘丙阳,赵文,郭凯,等.辽宁汤河水库浮游动物的群落结构及其时空格局[J].大连海洋大学学报,2011,26(6):526-531.
[16]赵文,董双林,张美昭,等.盐碱池塘浮游动物的种类组成和生物量[J].水产学报,2001,25(1):26-31.
[17]申玉春,熊邦喜,叶富良,等.南美白对虾高位池浮游生物和初级生产力的研究[J].水利渔业,2004,24(3):7-10.
[18]王丽卿,王为东,臧维玲,等.河口区斑节对虾淡化养殖塘浮游生物状况[J].上海水产大学学报,2002,11(2):118-123.
[19]赵文,刘国才.海水养虾池浮游动物对浮游植物牧食力的研究[J].生态学报,1999,19(2):217-222.
[20]戴习林,朱正国,臧维玲,等.河口区中国对虾虾塘浮游生物调查研究报告[J].海洋渔业,1992,14(3):111-113.
[21]Hein M,Riemann B.Nutrient limitation of phytoplankton biomass or growth rate:an experimental approach usingmarine enclosures [J].Journal of Experimental Marine Biology and Ecology,1995, 188(2):167-180.
[22]杨茹君,王修林,韩秀荣,等.海洋浮游植物粒径组成及其生物粒径效应研究[J].海洋科学,2003,27(11):5-9.
[23]陈怀清,钱树本.青岛近海微型、超微型浮游藻类的研究[J].海洋学报,1992,14(3):105-113.
[24]张江涛,殷克东,董丽华.春季黄海微型浮游动物对不同粒径浮游植物的摄食速率研究[J].海洋科学,2011,35(9):1-7.
Community structure and particle sizes of plankton in marine ponds w ith two polyculturemodels
CAIZhi-long,QIN Mei-chuan,ZHAOWen,GUO Kai,ZHANG Chen,LILi,ZHANG Jia-wei
(Key Laboratory of Hydrobiology in Liaoning Province,College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China)
Abstract:The community structure and particle size of plankton were studied inmarine pondswith two of polyculturemodels(jellyfish-shellfish-fish-shrimp and sea cucumber-shrimp)from April 2013 to March 2014 bymeans of field surveymethod in order to know the ecological feature in the two polyculturemodels.The results showed that 48 species of phytoplankton and 24 species of zooplankton were found in polyculture ponds of jellyfish-shellfishfish-shrimp,with dominant phytoplankton species in Bacillariophyta and Chlorophyta,and dominant zooplankton species in protozoa and copepods.There were average phytoplankton density of 26.50×105ind./L and biomass of 0.90 mg/L,and average zooplankton density of 81.57 ind./L and biomass of 0.51 mg/L,with average phytoplankton diversity index of2.28 and average zooplankton diversity index of1.49,in polyculture ponds of jellyfishshellfish-fish-shrimp.In polyculture ponds of sea cucumber-shrimp,however,57 species of phytoplankton and 33 species of zooplankton were observed,with dominant phytoplankton species in Bacillariophyta and Chlorophyta, and dominant zooplankton species in protozoa and copepods.There were average phytoplankton density of 3.99× 105ind./L and biomass of 0.41 mg/L,and average zooplankton density of 73.19 ind./L and biomass of 0.13 mg/L,with average phytoplankton diversity index of 2.20 and average zooplankton diversity index of 0.93.The particle size was ranged from 2.50μm to 69.62μm in phytoplankton,and from 11.09μm to 560.41μm in zooplankton in the twomodes of polyculture.The findings indicated that high density and biomass of plankton,even less species,in polyculture ponds of jellyfish-shellfish-fish-shrimp.
Key words:community structure;particle size feature;plankton;polyculturemodel;marine pond
中图分类号:S967
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.06.014
文章编号:2095-1388(2016)06-0663-10
收稿日期:2016-03-13
基金项目:国家海洋公益项目(201305005);国家“十二五”科技支撑计划项目(2011BAD13B03)
作者简介:蔡志龙(1989—),男,硕士研究生。E-mail:840797863@qq.com
通信作者:赵文(1963—),男,教授,博士生导师。E-mail:zhaowen@dlou.edu.cn