摘要:为探究重铬酸钾的毒性机制,建立适合监测铬污染的体外检测系统,以体外培养的泥鳅Misgurnus anguillicaudatus鳍细胞系(DIMF)为试验材料,研究了重铬酸钾的毒性效应。结果表明:通过噻唑蓝(MTT)比色法测定重铬酸钾染毒后细胞的24 h半致死浓度为(25.3±1.2)μmol/L;暴露在浓度为0~30 μmol/L的重铬酸钾中,细胞超氧化物歧化酶(SOD)活性随着染毒浓度的增加而增大;谷胱甘肽超氧化物酶(GSH-Px)在重铬酸钾浓度为0~20μmol/L时活性升高,当染毒浓度为30 mol/L时,活力开始下降;谷胱甘肽S-转移酶(GST)活性则随重铬酸钾浓度的升高而降低;微核试验显示,DIMF微核率随染毒浓度的增加呈先升高后降低的趋势,其中最大微核率为0.733%;实时定量PCR结果显示,对照组的金属硫蛋白(MT)基因表达量很低,经重铬酸钾诱导后MT基因表达量显著升高(P<0.01)。研究表明,重铬酸钾可对细胞的酶系统和遗传物质造成一定的损伤。
关键词:泥鳅;重铬酸钾;细胞系;酶活力;微核率;金属硫蛋白
近年来,电镀、染印等工业中的铬污染对水体的严重危害已引起人们的广泛关注。铬的常见形态是三价铬(Cr3+)和六价铬(Cr6+),其中Cr3+是人和动物的必需微量元素,因此,铬在毒理学研究中主要是指六价铬,Cr6+会造成消化道、呼吸道病变,皮肤过敏,恶性肿瘤等[1],故探讨铬对细胞的毒性效应是非常必要的。目前,相关研究在哺乳动物方面报道较多[2],对水生生物影响的研究主要以鱼类为主。
鱼类个体具有免疫功能,自身可排毒解毒,会掩盖有毒物质的毒性[3-4],而体外培养的细胞系均一性好,细胞可与污染物直接接触,且反应迅速灵敏,试验结果便于观察[5]。当前,利用鱼类细胞系研究铬的毒理作用的报道不多,Tan等[6]比较了6种细胞系对重铬酸钾的敏感性,认为鲤Cyprinus carpio上皮瘤细胞系对铬最为敏感;Torre等[7]通过实时定量PCR方法发现,重铬酸钾可使光若花鳉Poeciliopsis lucida肝细胞系PLHC-1中ABC转运蛋白基因表达量升高,证实了铬与鱼类ABC转运蛋白的相互作用。
泥鳅Misgurnus anguillicaudatus是中国重要的淡水养殖鱼类[8],本试验中以二倍体泥鳅鳍细胞系为试验材料,研究了重铬酸钾对细胞的毒理效应,旨在探究Cr6+的毒性机理,建立适合监测其污染情况的细胞模型。
1.1 材料
试验用二倍体泥鳅鳍细胞系(DIMF)为大连海洋大学细胞工程实验室于2012年建立。细胞系所用培养基均为含20%胎牛血清的DMEM/F12培养液,并于25℃、5%CO2条件下培养。
试验用培养基、胎牛血清、胰酶均由Hyclone公司生产;重铬酸钾、噻唑蓝(MTT)、二甲基亚砜(DMSO)、磷酸缓冲液(PBS)等均购自上海生工生物工程有限公司;酶学检测试剂盒购自南京建成生物工程研究所;实时定量所用试剂盒购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 染毒处理试验中重铬酸钾浓度分别设置为取生长良好的60~80代DIMF,以1×105cells/mL密度接种于96孔板或25 mL培养瓶中,接种量分别为0.2、5.0 mL,24 h后,弃去原培养基,加入等体积不同浓度的重铬酸钾,每个浓度重复3次,置于25℃CO2恒温培养箱中培养24 h。
1.2.2 MTT比色法测定细胞存活率 在96孔板的染毒细胞中,加入40μL的5 mg/mL MTT孵育4 h,弃去原培养基,用PBS缓冲液快速清洗两次,加入150μL DMSO震荡10 min,用酶标仪在570 nm处测定吸光值。其中,设阳性对照组的重铬酸钾浓度为0,空白对照组中只加等体积培养基不加细胞。

1.2.3 酶活力检测 取0、10、20、30、40μmol/L染毒浓度组细胞,按照南京建成生物工程研究所试剂盒说明书测定细胞的总蛋白质含量及超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽S-转移酶(GST)的酶活力。
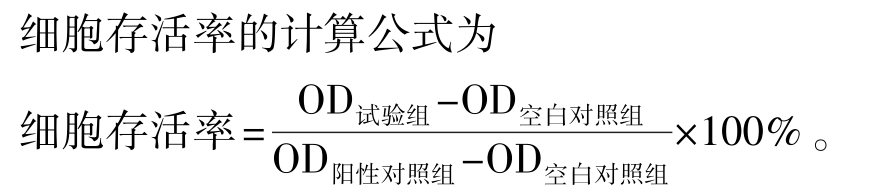
1.2.4 微核率的测定与计算 收集0、10、20、30、40、50μmol/L染毒浓度组细胞,滴片、推片、自然晾干后,用甲醇固定10 min,姬姆萨染色5 min,然后用蒸馏水冲洗,空气干燥,中性树胶封片,最后用油镜观察并统计。微核率计算公式为
微核率=有微核的细胞数/细胞总数×100%。
1.2.5 实时定量PCR测定金属硫蛋白(MT)基因表达量 引物设计以泥鳅Actinβ基因为内参,参照李彩娟等[9]的方法设计引物如下:
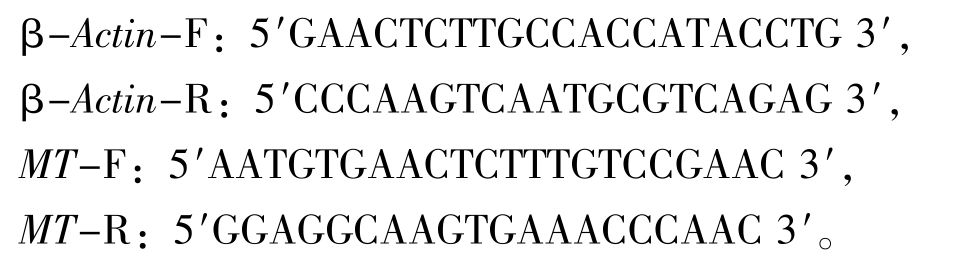
收集细胞,按TRIzol方法提取细胞总RNA,检验RNA完整性、浓度和纯度,并调整RNA浓度为500 ng/μL。按照全式金试剂盒说明书,反转录成cDNA第一条链,以反转录出来的cDNA为标准品,10倍梯度稀释为模板,设置5个浓度,按照全式金技术有限公司说明书,制作内参基因Actinβ和目的基因MT的标准曲线,并以稀释10倍的模板进行Real-time PCR。不加cDNA模板,以ddH2O补足的体系为阴性对照。其反应体系(共20μL)为:1μL Templat,0.4μL Forward Primer, 0.4μL Reverse Primer,10μL 2×TransScript©Top Green qPCR SuperMix,0.4μL Passive Reference Dye(50×),7.8μL ddH2O。反应条件为:94℃下预变性30 s;94℃下变性5 s,60℃下退火30 s,共进行40个循环。用2-ΔΔCT方法计算目的基因的表达量。
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示。试验数据用SPSS 17.0软件进行分析,显著性水平设为0.05。
2.1 细胞的存活率
泥鳅鳍细胞系经重铬酸钾处理后,其存活率变化如图1所示。从图1可见:DIMF的存活率随重铬酸钾浓度的增加而逐渐降低,二者存在着明显的剂量效应关系;存活率与浓度的自然对数关系方程为y=-45.64 lnx+202.94(R2=0.991),根据方程可求出细胞的半致死浓度为(25.3±1.2)μmol/L;当重铬酸钾浓度为90μmol/L时,细胞全部死亡。
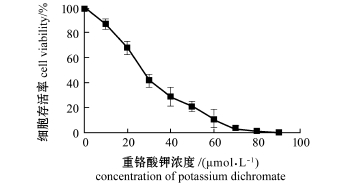
图1 重铬酸钾对泥鳅鳍细胞系存活率的影响
Fig.1 Effect of potassium dichromate on cell viability in loach fin cell line(DIMF)
2.2 细胞酶活力的变化
DIMF暴露于重铬酸钾24 h后,其酶活性变化如表1所示。从表1可见:当重铬酸钾浓度为0~30μmol/L时,细胞系的SOD活性随重金属浓度的逐渐升高不断升高,当重铬酸钾浓度为30μmol/L时,SOD的活性达到最大值,为47.10 U/mg,且与对照组存在极显著性差异(P<0.01),当重铬酸钾浓度为40μmol/L时,SOD活性显著下降(P<0.01);GSH-Px活性随染毒浓度的升高呈现先升高后降低的趋势,当重铬酸钾浓度为20μmol/L时,GSH-Px活性达到最大,为60.73 U/mg,且与对照组存在极显著性差异(P<0.01);GST活性随着染毒浓度的增加逐渐降低,当重铬酸钾浓度为20μmol/L时,GST活性显著下降(P<0.01),当重铬酸钾浓度为40μmol/L时,细胞系的GST活性最低,为22.5 U/mg。
表1 重铬酸钾对泥鳅鳍细胞系酶活力的影响
Tab.1 Effects of potassium dichromate on the activities of enzymes in DIM F U/mg
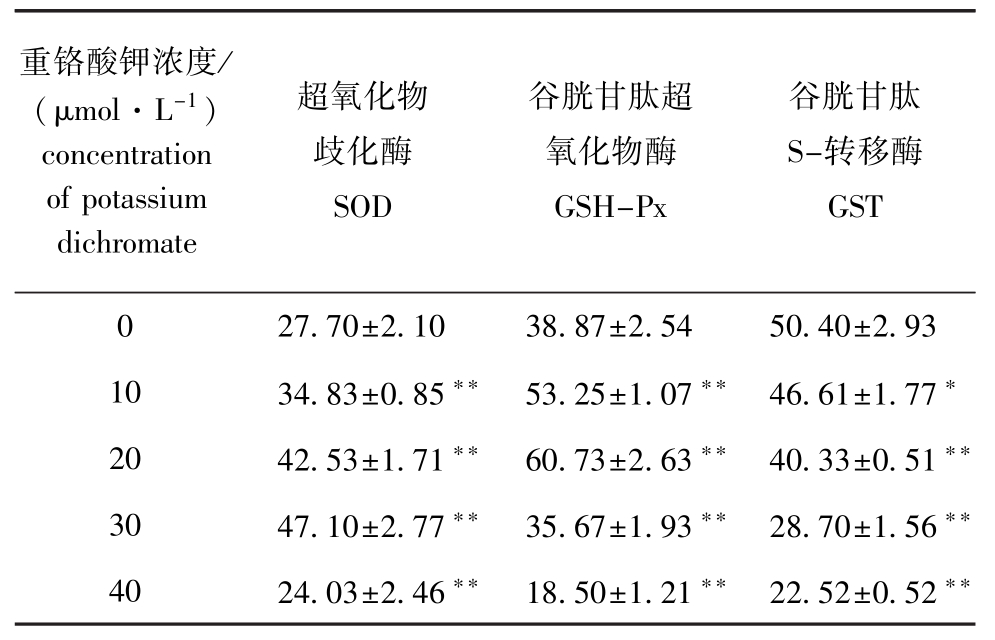
注:*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01),下同
Notes:*means significant difference compared with the control(P<0.05);**means very significant difference compared with the control (P<0.01),et sequentia
重铬酸钾浓度/ (μmol·L-1) concentration of potassium dichromate超氧化物歧化酶SOD谷胱甘肽超氧化物酶GSH-Px谷胱甘肽S-转移酶GST 27.70±2.10 38.87±2.54 50.40±2.93 10 34.83±0.85**53.25±1.07**46.61±1.77*20 42.53±1.71**60.73±2.63**40.33±0.51**30 47.10±2.77**35.67±1.93**28.70±1.56**40 24.03±2.46**18.50±1.21**22.52±0.52 0 **
2.3 微核率的变化
当重铬酸钾处理24 h后,DIMF出现微核,微核位于细胞质中,呈圆形,颜色与细胞核相同(图2)。
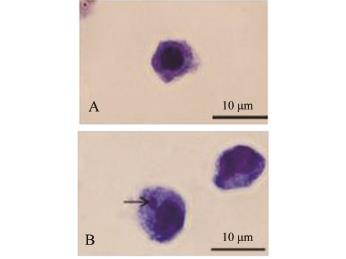
注:A为正常细胞;B为带有微核的细胞,箭头示微核
Notes:A,the normal cell;B,cells with micronucleus,arrow showing themicronucleus
图2 泥鳅鳍细胞系中微核率的变化
Fig.2 Change in m icronucleus rate in DIM F
由表2可见,用0~40μmol/L重铬酸钾处理细胞时,微核率随染毒浓度的升高呈先升高后降低的趋势,当重铬酸钾浓度为40μmol/L时,微核率最高,为0.733%。
表2 重铬酸钾对泥鳅鳍细胞系微核率的影响
Tab.2 Effects of potassium dichromate on them icronucleus rate in DIMF

重铬酸钾浓度/(μmol·L-1) concentration of potassium dichromate DIMF微核率/% micronucleus rate in DIMF 0.033±0.033 10 0.267±0.067**20 0.300±0.145**30 0.600±0.088**40 0.733±0.067**50 0.567±0.088 0 **
2.4 Real-time PCR结果
MTmRNA相对表达量的试验结果见图3,研究表明,DIMF对照组的MT基因表达量较低,经重铬酸钾刺激后,MT基因表达量均较对照组有极显著升高(P<0.01)。

注:**表示与对照组有极显著性差异(P<0.01)
Note:**means very significant difference compared with the control(P<0.01)
图3 不同重铬酸钾处理DIMF的MT基因相对表达量
Fig.3 RelativeMTexpression of DIM F by potassium dichromate treatment
3.1 铬对细胞系存活率的影响
本试验中,重铬酸钾对DIMF的半致死浓度为(25.3±1.2)μmol/L,与谭凤霞[10]测得的重铬酸钾对虹鳟Oncorhynchusmykiss性腺细胞系(RTG-2)的半致死浓度相近,但明显低于以活体生物为监测指标制定的国家渔业水质标准(GB11607-89)。这表明,本试验中所用泥鳅鳍细胞系对重铬酸钾反应比较敏感,可作为铬污染监测生物,尤其适用于铬污染的机理研究。
3.2 铬对细胞系酶活力的影响
本试验结果显示,泥鳅鳍细胞中SOD活性变化为先升后降,符合Stebbing[11]的“毒物刺激效应”,即低浓度毒物可引起酶活性升高,并与张迎梅等[12]关于重金属对泥鳅肝胰脏SOD的影响结果相似。SOD可以清除体内的自由基,是体内唯一能将自由基作为反应底物的抗氧化酶[13],可灵敏反映出机体的损伤情况。Cr6+进入细胞后,可还原成低价铬,但这一过程会产生大量的活性氧(ROS),同时Cr6+还能促进细胞合成新的ROS[14],并对细胞造成损伤。当染毒浓度较低时,可对SOD起到诱发作用,细胞中ROS逐渐增多时, SOD活性也相应升高,清除ROS,保护细胞免受损伤。当重铬酸钾浓度较高时,细胞中ROS过多,抗氧化酶系统不能及时清除氧自由基,从而导致细胞各种代谢系统遭到破坏,SOD活性相应降低。高浓度的Cr6+产生的ROS已造成了抗氧化酶的大量消耗,过量的ROS超出了其防御水平,加重了对细胞的毒害。此外,Cr6+还能导致SOD的结构和功能发生改变,破坏其原有的反应机制,降低其活性。
谷胱甘肽过氧化物酶(GSH-Px)可清除自由基参与解毒,特异性地催化还原型谷胱甘肽(GSH)与H2O2的还原反应,可起到保护细胞膜结构和功能完整的作用[15]。当重铬酸钾浓度较低时,泥鳅鳍细胞系中的GSH-Px活性显著升高,而在高浓度铬胁迫下,其活性均显著降低。当受到铬胁迫时,SOD歧化O-2·并产生H2O2,细胞中的GSHPx迅速作出防御,联合CAT清除H2O2,防止氧化胁迫,表现为活力升高,此外,当铬浓度超出其可控范围,可导致GSH-Px的结构和功能发生改变,破坏其原有的反应机制,降低其活性。
谷胱甘肽S-转移酶(GST)存在于各种组织细胞中,可消除体内自由机,并具有解毒功能[16]。GST能催化GSH与某些亲电基团结合,还可清除脂质过氧化过程中的产物,达到解毒的目的。GST的活性可表示机体的氧化应激,反映细胞对污染物的敏感性,可作为水体污染的生物标志物[17],是一类敏感的毒理学指标。本研究结果显示,泥鳅鳍细胞系中GST活力均随Cr6+浓度的增加而降低,其原因一方面可能是反应底物GSH经过GSH-Px催化,与H2O2发生还原反应,含量降低,GST无法诱导相关反应;另一方面是过量的Cr6+直接破坏了GST的结构和功能。
3.3 铬对细胞系微核率的影响
目前,利用泥鳅红细胞微核作为环境中重金属、农药的生物监测指标的报道较多[18-20]。微核是细胞分裂后滞留在细胞质中的染色体片段,与细胞核相似,但其体积要远小于细胞核。Cr6+在细胞中被还原成低价铬,其中Cr5+或Cr4+可与DNA形成复合物,对遗传物质造成损伤,同时产生大量的ROS,攻击核酸等大分子物质,促使细胞系的微核率升高。本试验中发现,泥鳅鳍细胞系微核率出现先升高后降低的变化趋势,这与李倩等[20]报道的Cu2+胁迫后泥鳅外周血红细胞微核的变化一致,其原因可能是由于Cr6+浓度过高时,抑制细胞的正常分裂或使细胞核完全裂解,造成微核率降低。
3.4 铬对细胞系MT基因表达量的影响
在水生生物中应用实时定量PCR方法检测重金属染毒后金属硫蛋白基因表达的变化,目前研究主要集中在个体水平,利用培养细胞所做的工作不多。谭淑雯[21]研究发现,受镉胁迫的草鱼Ctenopharyngodon idellus肾细胞系(CIK)中MT基因表达量会显著增加,Cheuk等[22]报道,Cr6+可诱导斑马鱼Danio rerio尾鳍细胞系MT基因表达量升高。本试验中,对照组泥鳅鳍细胞系中MT表达量很低,与王磊[23]报道的MT基因在正常泥鳅鳍组织中的表达量相近;而染毒后的细胞MT表达量出现先升高后降低的现象,但均极显著高于对照组(P<0.01)。可能是由于MT在转录水平上被Cr6+诱导并大量表达,螯合过量的Cr6+,清除自由基,从而达到解毒的目的,但铬浓度过高后,细胞代谢系统受损严重,超出机体的防御范围,无法再生成金属硫蛋白。本研究表明,细胞系MT的表达受铬的影响较为敏感,可作为检测铬毒性的重要指标。
参考文献:
[1]Gupta V K,Pathania D,Agarwal S,et al.Removal of Cr(VI)onto Ficus carica biosorbent from water[J].Environmental Science and Pollution Research,2013,20(4):2632-2644.
[2]金立方,袁翊朦,胡袆瑞,等.六价铬的细胞毒理效应及其机制研究进展[J].中国细胞生物学学报,2013,35(3):387-392.
[3]李文峰,麦康森,黄倢,等.鱼类细胞培养及其在病毒学研究中的应用[J].动物医学进展,2010,31(5):107-110.
[4]张博,陈松林.近10年鱼类细胞培养研究进展及应用展望[J].海洋科学,2011,35(7):113-121.
[5]Wang N,Wang X L,Sha ZX,et al.Development and characterization ofa newmarine fish cell line from turbot(Scophthalmusmaximus)[J].Fish Physiology and Biochemistry,2010,36(4):1227-1234.
[6]Tan Fengxia,Wang Min,Wang Weimin,et al.Comparative evalua-tion of the cytotoxicity sensitivity of six fish cell lines to four heavy metalsin vitro[J].Toxicology in Vitro,2008,22(1):164-170.
[7]Torre C D,Zaja R,Loncar J,et al.Interaction of ABC transport proteinswith toxicmetals at the level of gene and transport activity in the PLHC-1 fish cell line[J].Chemico-Biological Interactions,2012,198(1-3):9-17.
[8]马辰,王福景,李霞,等.泥鳅鳍细胞系的构建及特性分析[J].大连海洋大学学报,2014,29(2):109-113.
[9]李彩娟,王磊,凌去非.镉胁迫对泥鳅金属硫蛋白基因表达的影响[J].水生态学杂志,2014,35(3):88-93.
[10]谭凤霞.三株鱼类细胞系的建立和十二株鱼类细胞系对重金属毒性的敏感性研究[D].武汉:华中农业大学,2008.
[11]Stebbing A R D.Hormesis-the stimulation of growth by low levels of inhibitors[J].Science of the Total Environment,1982,22(3): 213-234.
[12]张迎梅,王叶菁,虞闰六,等.重金属胁迫对泥鳅肝胰脏ATPase和SOD活性的影响[J].甘肃科学学报,2008,20(3): 55-59.
[13]金芬芬,徐团,秦圣娟,等.镉对长江华溪蟹肝胰腺线粒体抗氧化酶活力和脂质过氧化水平的影响[J].水生生物学报, 2011,35(6):1019-1024.
[14]Wang Xin,Son Y O,Chang Qingshan,et al.NADPH oxidase activation is required in reactive oxygen species generation and cell transformation induced by hexavalent chromium[J].Toxicological Sciences,2011,123(2):399-410.
[15]刘洋,凌去非,于连洋,等.氨氮胁迫对泥鳅不同组织SOD和GSH-PX活性的影响[J].安徽农业科学,2011,39(2):1069-1072.
[16]李娟,陈洁文,甘居利,等.三氯杀螨醇对泥鳅血清GST和AChE活力的影响[J].生态毒理学报,2011,6(5):551-556.
[17]王宽,靳春鹏,张晓梅,等.谷胱甘肽硫转移酶作为生物标记物在环境风险评估中的应用进展[J].食品安全质量检测学报,2015,6(6):2235-2240.
[18]刘敬禹.Cr6+对泥鳅外周血细胞微核率的影响[J].水生态学杂志,2011,32(5):119-121.
[19]韩杰,郭萌,牛花花,等.Cd2+对泥鳅外周血红细胞微核及核异常的影响[J].水产科学,2010,29(12):739-741.
[20]李倩,胡廷尖,王雨辰,等.Cu2+对泥鳅外周血红细胞微核及核异常的影响[J].水产养殖,2011,32(10):44-47.
[21]谭淑雯.镉胁迫对草鱼MT2和ABCC2基因表达的影响[D].广州:华南师范大学,2013:48-49.
[22]Cheuk W K,Chan PC Y,Chan K M.Cytotoxicities and induction ofmetallothionein(MT)and metal regulatory element(MRE)-binding transcription factor-1(MTF-1)messenger RNA levels in the zebrafish(Danio rerio)ZFL and SJD cell lines after exposure to variousmetal ions[J].Aquatic Toxicology,2008,89(2): 103-112.
[23]王磊.镉胁迫对泥鳅的毒理效应及金属硫蛋白基因表达的影响[D].苏州:苏州大学,2012.
Cytotoxicity of potassium dichromate to loach fin cell linesin vitro
Abstract:LoachMisgurnus anguillicaudatusfin cell line(DIMF)was used to assess toxicity of potassium dichromate in vitro to study toxicitymechanism of potassium dichromate and establish suitable for chrome pollution detection system.The results showed that themedian lethal concentration(LC50)was(25.3±1.2)μmol/L in DIMF exposed to potassium dichromate for 24 h measured by thiazole blue(MTT)method.The activities of superoxide dismutase(SOD)in DIMF were increased with the increase in concentration within potassium dichromate concentration of0-30μmol/L and the activities of glutathione peroxidase(GSH-Px)were increased at0-20μmol/L potassium dichromate,and then decreased at concentration of 30μmol/L,with gradual decrease in glutathione S-transferase(GST)activity.Micronucleus test revealed that the rate ofmicronucleuswas increased first and then decreased with the increase in potassium dichromate concentration,with themaximum micronucleus rate of0.733%. Real-time PCR showed thatmetallothionein(MT)gene expression quantity was very low in control group,and increased significantly due to the induction by potassium dichromate(P<0.01).The findings indicate that potassium bichromate can damage enzyme system and genetic materials in cells.
Key words:Misgurnus anguillicaudatus;potassium dichromate;cell line;enzyme activity;micronucleus rate; metallothionein
中图分类号:S917.4
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.06.011
文章编号:2095-1388(2016)06-0646-05
收稿日期:2016-03-25
基金项目:国家自然科学基金资助项目(31272650)