养殖鲟鱼肝硬化病的器官和组织病理学观察
杨仕豪,潘连德,郑 串
(上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海201306)
摘要:为了明确养殖鲟鱼Acipenser sinensis肝硬化的致病因素及诊治方法,在3批次现场采集病样(共计41尾)中,选取9尾具典型症状的患病鲟鱼,对其重要组织器官进行采样,制作石蜡切片,H-E染色,对自然发病的疑似肝硬化杂交鲟进行了病理解剖观察和组织病理学研究,并对其组织病理变化及发病机理进行了分析。结果表明:1、2、3、9号病样表现出明显肝组织病变,肝组织内出现弥漫性纤维增生等典型肝纤维化症状;脾充血,空泡变性、坏死;胃、肠充血,炎性细胞浸润,肠绒毛坏死甚至脱落;其他器官(鳃、心等)组织轻微淤血、炎症;结合各器官症状和组织病变及参考相关研究,确定本病例为鲟鱼肝病,具体诊断为鲟鱼肝硬化。研究表明,鲟鱼肝硬化的器官和组织病理学诊断特征为肝淤血和溃疡,肝腹水,肝血窦扩张、炎性细胞浸润、组织空泡化、组织纤维化。
关键词:鲟鱼;肝硬化;组织病理;器官病理
近年来,随着鲟鱼Acipenser sinensis养殖业在国内的兴起和发展,施氏鲟A.schrenckiiBrandt、西伯利亚鲟A.baeriBrandt、俄罗斯鲟A.gueldenstaedtiBrandt和杂交鲟等品种均已进入大规模养殖阶段[1-3],高密度、工厂化的养殖模式常常导致疾病的频繁暴发和蔓延,严重制约了鲟鱼养殖业的健康发展。目前,关于养殖鲟鱼常见疾病及药物作用的组织病理学及病理生理学研究国内外已有较深入的报道[4-10]。
近年来,养殖环境的污染、苗种和饲料的参差不齐等因素均为养殖动物肝脏疾病的暴发埋下了隐患,在对动物如鼠、鸡等的研究中已有较多有关饲料、环境等因素对养殖对象肝组织病理影响的报道[11-14],而对水产动物肝病方面的研究也越来越被重视,已有的病理研究包括对大黄鱼Larimichthys crocea脂肪肝的病理诊断、对草鱼Ctenopharyngodon idellus肝胆综合征的病理学研究、重金属和黄曲霉素B1等对鲤Cyprinus carpio、异育银鲫Carassius auratus gibelio的组织毒性病理研究、对施氏鲟肝性脑病的病理研究等[15-19],但对于鱼类肝硬化方面的研究还仅限于斑马鱼Barchydanio rerio肝纤维化及肝硬化模型的建立[20-22]。疾病的病因往往不是单方面的,常由多种因素构成,模式动物致病因素与自然发病因素有一定的差别,其组织病理与自然发病组织病理也自然存在差异[23]。本研究中,对某流水鲟鱼养殖场自然发病的疑似肝硬化杂交鲟病例进行了病理解剖观察和组织病理学研究,以期为相关研究提供临床诊断依据,同时也为鲟鱼的临床病理诊断和病因分析提供参考。
1 材料与方法
1.1 材料
患病杂交鲟采自安徽泾县某流水鲟鱼养殖场, 2015年8月底(17尾)、9月初(10尾)和9月中旬(14尾)先后分三批(共计41尾)送至上海海洋大学水族宠物医学实验室,病鱼体质量为362~617 g,体长为42~59 cm。采集时根据病鱼临床症状和病理解剖进行初步诊断,并排除其他疾病病鱼。试验时选取具有典型器官病变和腹水症状的9尾病鱼,随机编号1~9号(其中1~3号来自第一批样品,4~5号来自第二批样品,6~9号来自第三批样品)作为本试验的样品。另从上海市水产市场购买健康杂交鲟作为对照组。
1.2 方法
1.2.1 病鱼的临床症状与病理解剖观察 试验开始时取病鱼(1~9号)进行临床解剖观察,并与正常鱼体比较,记录鱼体表及各脏器的病理变化,以确定具体病变部位或器官。最后采集相关图片,做出初步临床症状诊断。
1.2.2 组织病理学切片制备和观察 病理解剖过程中,取病鱼的肝脏、脾脏、肾脏、肠道、心脏和鳃,用手术刀切至0.5 cm3小块置于10%中性甲醛中固定24 h以上,用体积分数为50%~100%的乙醇溶液逐级脱水,二甲苯透明,于56~58℃下用石蜡包埋,切片厚度为5μm,并于45℃下烘片数小时,用H-E染色,中性树胶封片,在徕卡DM3000摄像显微镜下观察、拍照,作出组织病理诊断。同时采集病原菌,分离、纯化,保存待用。
2 结果与分析
2.1 患病鲟鱼临床症状和病理解剖特征
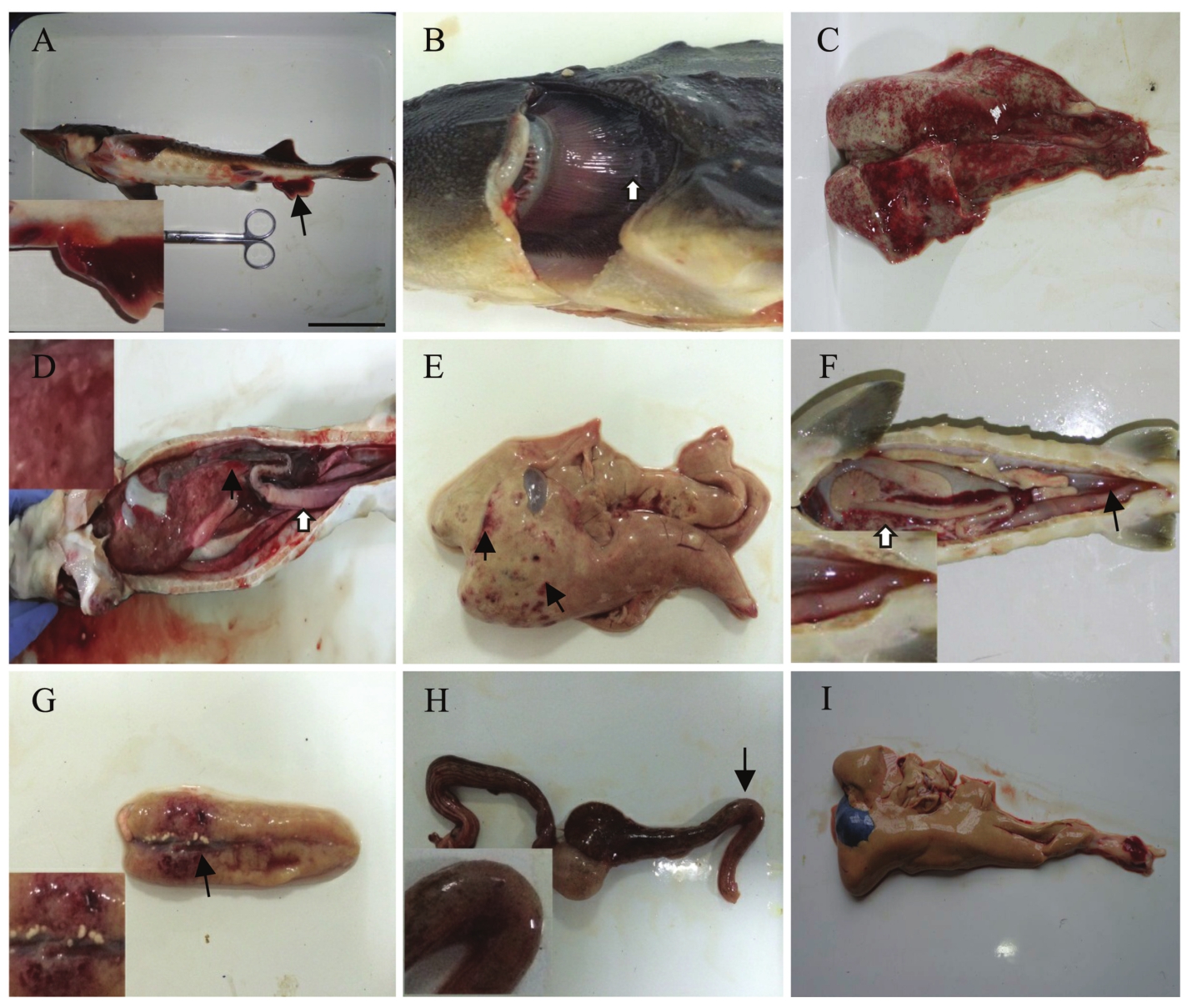
患病鱼发病初期及中期无明显临床症状,可正常进食,偶有独游现象;发病末期患病鱼浮于水面,对外界刺激不敏感,逐渐失去平衡并侧翻漂浮于水面,不日死亡。所有池塘均有发病,但鱼体规格为(450±70)g的池塘发病较为严重,起初每日每池平均死亡数尾,半月后达到70尾左右。9尾试验鱼中,除1、9号病鱼体色较浅外其他病鱼体色正常,6号病鱼唇部、胸鳍、尾鳍、肛门均有出血现象(图1-A),显微镜检病鱼鳃部、体表和内脏黏液,未发现大量寄生虫附着。
临床解剖观察,所有病样鳃丝末端发黑(图1-B),1、2、3、5号病样鳃丝有不同程度淤血。1~9号病样肝脏均出现不同程度淤血(图1-C),其中1、3号病样肝脏呈花斑状且肿大,质地稍硬(图1-D),1、3、4、9号病样肝脏出现溃疡孔(图1-E);1、2、3号病样有血样腹水,且腹水量越来越多(图1-F);除1号病样外其他病样脾脏均有不同程度的充血,4、6号病样脾脏轻微肿大; 1、2、5、6、8、9号病样肾脏淤血,8、9号病样肾脏表面有数个黄米粒大小的白色结节,9号病样肾脏表面有数个溃疡孔(图1-G);4、6号病样肠道正常,其他病样肠壁均不同程度充血、肿胀(图1-H)。从图1可知,鲟鱼患病初期肝组织表现出轻微淤血、肿大等临床症状,至发病中期则呈花肝状,病程末期肝脏表面出现若干溃疡孔,质地偏硬,伴随血样腹水。此外,部分病鱼肾组织有相对统一的病变,脾、肠、鳃未呈现出明显的临床症状。
病理解剖初步诊断,肝脏病变最严重,其次为脾、肠、肾、鳃,心脏基本正常。腹水(1、2、3号病样)为肝性腹水。
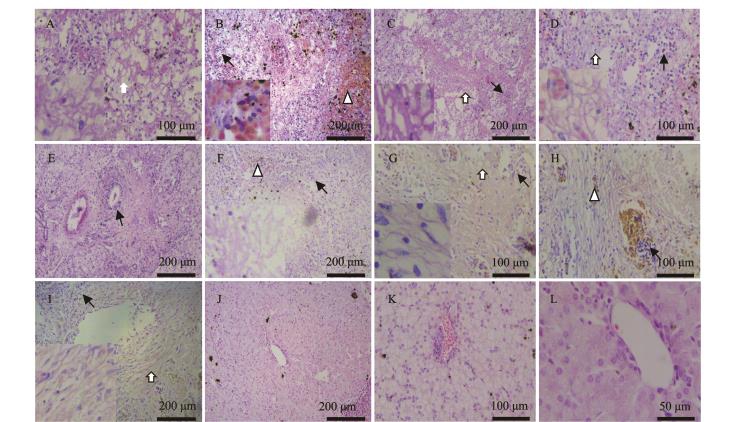
注:A为1号病样,肝组织严重坏死,肝细胞空泡化、肝组织纤维化(⇧)(大图200 ×,小图400 ×);B为9号病样,肝组织大面积淤血(△),肝组织坏死严重,组织结构依稀可辨(大图100 ×,小图400 ×);C为2号病样,肝组织结构模糊不清,出现大量纤维增生(⇧)(100×,小图400 ×);D为9号病样,肝组织出现大量空泡,淤血,组织纤维增生(⇧)(大图200 ×,小图400 ×);E为2号病样,肝组织汇管区大面积纤维化(⇧)(100×);F为9号病样,肝组织淤血(△),中央静脉上皮细胞坏死、纤维化(100×,小图400 ×); G为3号病样,肝组织大面积纤维化(⇧),肝细胞空泡变性(↑)(大图200 ×,小图400 ×);H为3号病样,肝汇管区严重纤维化,组织淤血(△)(大图200 ×,小图400 ×);I为3号病样,肝组织中央静脉上皮细胞严重纤维化(⇧)(大图100 ×,小图400 ×);所有肝组织均有大量炎性细胞浸润(↑);J为健康鲟鱼肝组织(100×);K为健康鲟鱼肝组织(200×);L为健康鲟鱼肝组织(400×)
Note:severe liver necrosis,vacuolization of hepatocytes and liver fibrosis(⇧)in sample No.1(200×,inserted 400×);B,liver tissue congestion (△),and severe hepatic necrosis,in sample No.9(100×,inserted 400×);C,liver tissue structure obscure in sample No.2,showing a large number of fibrous hyperplasia(⇧)(100×,inserted 400×);D,liver tissue vacuoles,blood stasis,tissue fiber hyperplasia(⇧)in sample No.9 (200×,inserted 400×);E,large portal area fibrosis(⇧)(100×)in sample No.2;F,liver tissue congestion(△),and the central vein of liver tissue epithelial cells in severe fibrosis in sample No.9(100×,inserted 400×);G,large areasof liver fibrosis(⇧),and vacuolar degeneration of liver cells(↑)in sample No.3(200×,inserted 400×);H,large portal area fibrosis,and tissue congestion(△)in sample No.3(200×,inserted 400×);I,the central vein of liver tissue epithelial cells in severe fibrosis(⇧)(100×,inserted 400×)in sample No.3;all liver tissues have a large number of inflammatory cell infiltration(↑);J,liver tissues of healthy sturgeon(100×);K,liver tissues of healthy sturgeon(200×);L, liver tissues of healthy sturgeon(400×)
图2 患病鲟鱼肝脏组织病理变化
Fig.2 Pathological changes in liver tissue in morbid sturgeon
2.2 患病鲟鱼的肝组织病理变化
组织切片观察结果显示,9尾病鱼肝脏均出现不同程度淤血、炎性细胞浸润等病理变化。肝小叶的中央静脉及肝血窦扩张,在视野中呈现局域性弥漫(图2-A、B);1、2、3、9号病样大量肝组织细胞空泡或脂肪变性,充满视野(图2-A、B),部分肝细胞胞浆淡染,细胞核固缩、裂解,肝细胞弥漫性坏死,肝索结构模糊不清(图2-A、C);肝组织均有不同程度的纤维化(图2-D),纤维化区域以汇管区扩张最为明显(图2-E、F),3号病样肝组织纤维化最为严重;肝组织内纤维状物质大量增生(图2-G、H、I),但淤血不明显,且较其他病样肝组织着色较浅;4~8号病样肝组织结构相对完整、清晰,但中央静脉、肝血窦和胆管等上皮细胞轻微增生,大量肝细胞核偏向边缘,少量细胞核固缩、裂解。几尾病鱼肝组织均表现出不同程度的纤维化,严重者肝脏组织完全被破坏,导致其功能低下甚至衰竭,初步认为,肝组织病变对本病贡献最大。本病例鲟鱼肝组织病理变化与对人类和高等动物及国外其他鱼类相关研究中的肝硬化或纤维化组织病理特征相近[6,24-26],故作出肝硬化的病理诊断。
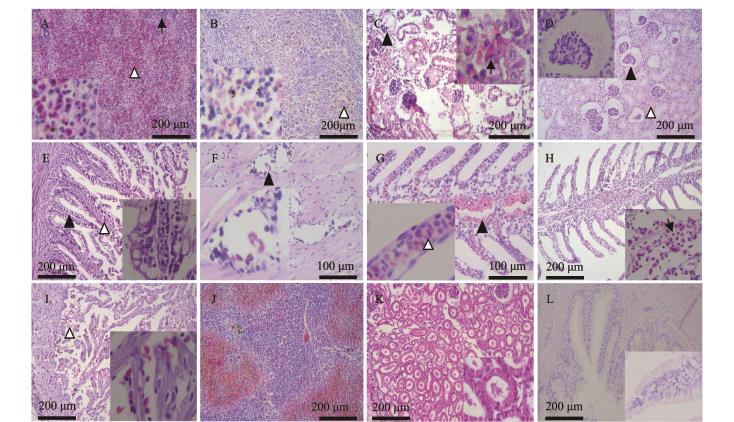
注:A为1号病样,脾组织大面积淤血(△),炎性细胞浸润(↑)(大图100 ×,小图400 ×);B为2号病样,脾组织淤血(△)(大图100×,小图400 ×);C为9号病样,肾组织结构破坏,淤血、炎性细胞浸润(↑),肾小球严重萎缩(▲)(大图100 ×,小图400 ×);D为4号病样,肾小球萎缩(▲),轻微淤血(△)(大图100 ×,小图400 ×);E为1号病样,肠绒毛空泡变性、裂解(▲),充血(△) (大图100 ×,小图400 ×);F为3号病样,肠肌肉层间隙扩张,充血(▲)(大图200 ×,小图400 ×);G为9号病样,鳃丝软骨淤血、肿胀(▲),鳃小片淤血(△)(大图200 ×,小图400 ×);H为8号病样,鳃丝淤血、炎性细胞浸润(↑),(100×,小图400 ×);I为7号心脏淤血(△)(100×,小图400 ×);J为健康鲟鱼脾组织(100×);K为健康鲟鱼肾组织(大图100 ×,小图400 ×);L为健康鲟鱼肠组织(大图100 ×,小图400 ×)
Note:A,spleen congestion(△),and infiltration of inflammatory cells(↑)in sample No.1(100×,inserted 400×);B,spleen congestion(△) in sample No.2(100×,inserted 400×);C,the structure of renal damage,and congestion and inflammatory cell infiltration(↑),glomerular atrophy(▲)in sample No.9(100×,inserted 400×);D,glomerular atrophy(▲),slight congestion(△)in sample No.4(100×,inserted 400×);E,vacuolar degeneration and lysis of intestinal villus(▲)congestion(△)in sample No.1(100×,inserted 400×);F,the intestinal muscle layer gap expansion and congestion(▲)in sample No.3(200×,inserted 400×);G,gill cartilage congestion and swelling(▲),and gill lamellae congestion(△)in sample No.9(200×,inserted 400×);H,gill congestion and inflammatory cell infiltration(↑)in sample No.8 (100×,inserted 400×);I,the heart blood stasis(△)in sample No.7(100×,inserted 400×);J,Healthy sturgeon spleen(100×);K,kidney of healthy sturgeon(100×,inserted 400×);L,healthy sturgeon intestine(100×,inserted 400×)
图3 患病鲟鱼脾、肠、肾脏、鳃、心脏组织病理变化
Fig.3 Pathological changes in spleen,intestine,kidney,gill,and heart in morbid sturgeon
2.3 患病鲟鱼其他组织器官的病理变化
脾脏:1~9号病样脾均有不同程度的充血,血管扩张、管壁增厚,嗜酸性粒细胞浸润(图3-A);1、2、6、7、9号病样脾组织部分细胞出现空泡变性甚至坏死,细胞萎缩,组织与细胞间隙扩张呈空白样结构,脾组织淤血(图3-B),2、9号病样坏死较为严重,脾组织结构已模糊不清。脾组织病变程度仅次于肝组织,对本病也有较大贡献。
肾脏:9个病样肾组织结构均基本完整、清晰;除7号病样外其他病样均有不同程度的淤血、嗜酸性粒细胞浸润;1、2、5、8、9号病样肾小管上皮细胞胞浆淡染,核轻微固缩,少量坏死,组织结构较为紊乱,病变较重(图3-C);4号病样肾小球明显萎缩(图3-D)。故认为肾组织病变对该病也有一定的贡献。
肠道:1、2、3、8、9号病样病变较为明显,表现为充血,肠绒毛细胞坏死、脱落,大量炎性细胞浸润,黏液细胞附着(图3-E);3号病样肠肌肉层间隙扩张,充血(图3-F);4、5、6号病样表现出轻微充血、炎性细胞浸润等病理变化;7号病样肠组织结构正常。肠病变与高等动物及人类患肝硬化病呈现的门脉高压症有一定的相似性。初步认为肠道充血、炎症等病变是受累于肝、脾组织病变。
鳃:5~9号病样鳃组织淤血(图3-G);2、3、8、9号病样鳃组织炎性细胞浸润(图3-H); 1、4号病样鳃组织结构正常。可以认为,鳃组织淤血、炎症等病变是受累于肝、脾组织病变,鳃组织病变对该病影响较小。
心脏:3、5、7号病样心肌组织轻微淤血(图3-I),其他病样心肌组织正常。可以认为,心肌组织淤血等病变是受累于肝、脾组织病变,心肌组织病变对该病影响较小。
2.4 鲟鱼肝硬化病理诊断的特征
综合病理解剖和组织病理研究结果,得到鲟鱼肝硬化病理诊断的3个特征,并作为临床诊断的参考标准。
2.4.1 肝淤血和溃疡 临床解剖可见,9尾病样均出现不同程度的肝脏淤血症状,肝组织纤维化较为严重的1、3、4、9号病样还出现溃疡孔。推断肝淤血和溃疡为鲟鱼患肝硬化病的一个临床症状。
2.4.2 肝性腹水 1、2、3号病样病变较严重,病样均出现血样腹水。
2.4.3 肝血窦扩张、炎性细胞浸润、组织空泡化、组织纤维化 本试验中均观察到肝血窦扩张、炎性细胞浸润、组织空泡化、组织纤维化等病变,可以认为是鲟鱼罹患肝硬化的主要组织病理变化。
3 讨论
3.1 鲟鱼肝硬化的组织病理学诊断
在对人类及其他高等动物的研究中,肝硬化病理诊断标准为:肝实质广泛破坏;肝组织内弥漫性纤维增生;肝细胞结节状再生并由纤维间隔分割为假小叶[24-25]。此外有研究证实,肝硬化过程中增生的胶原纤维最初由汇管区间或汇管区与中央静脉间延伸[26]。本试验结果表明,1、2、3、9号病样,尤其是3号病样呈现明显的肝细胞广泛坏死,肝组织弥漫性纤维增生,且汇管区及中央静脉纤维化最为显著,但未见假小叶生成。对鱼类肝脏组织结构研究表明,鱼类肝小叶间的结缔组织极少,相邻肝小叶间也没有明显界线,故很难分辨肝小叶的形状[27],肝硬化形成的假小叶就更加难以辨认,故没有类似于高等动物及人类的假小叶形成。研究发现,重度脂肪肝可导致大黄鱼结缔组织异常增生、纤维化等病理变化,并认为是大黄鱼肝硬化[15]。而大黄鱼肝硬化的病理组织与本试验中鲟鱼肝脏的病理组织相似。使用基亚硝胺(DEN)成功建立的斑马鱼肝纤维化模型,可观察到其肝脏组织结构紊乱、肝细胞变性坏死、炎症反应严重、肝脏组织胶原纤维过度沉积等与本试验鲟鱼肝脏相似的病理现象[20]。
研究表明,肝硬化的临床症状包括肝脏质地变硬、腹水,以及由此引起的慢性淤血性脾肿大、胃肠道淤血、水肿等[28-29],本试验中1、2、3、9号病样均不同程度地表现出此类症状。相关研究显示,鲟鱼肝胆综合征也有类似肝硬化的肝脏肿大、腹水,以及脾肾水肿、淤血等临床症状[30],但对其治疗方法却多采用药物消毒、中草药调理等措施,易忽略饵料、水质等致病因素[30-31],这与肝硬化的治疗方法大相径庭。若对鲟鱼肝硬化没有统一的病理学诊断标准,通通归结为肝胆综合征,其治疗效果不会理想。
3.2 肝硬化对鲟鱼的致死机理
研究表明,肝纤维化为肝硬化的必经阶段[32]。肝脏在肝炎病毒、酒精、毒性物质、缺氧和免疫损伤等因素作用下,可引起急、慢性炎症和肝细胞坏死[33],同时激活单核巨噬细胞系统,产生各种细胞因子作用于肝星状细胞,促进其分化增生并生成、分泌大量胶原纤维[34]。Sherman等[35]对大鼠肝硬化病理观察中发现,胶原纤维最开始沉积于汇管区,并使其最先纤维化,这与本试验中观察到大部分肝组织汇管区纤维化严重这一病理变化相吻合。汇管区纤维化可导致门脉压力增高,进而造成肝性腹水、脾慢性淤血性肿大、胃肠道淤血水肿等病理变化[35]。本试验中观察到的鲟鱼脾脏淤血肿大、坏死,肠道淤血、水肿等其他组织器官的病理变化也印证了这一极为相似的结论。郭健滨[36]指出,在肝硬化过程中,肝脏纤维化,硬化病变反复、恶化,肝实质及血管结构不断被破坏,导致肝内外血流动力学障碍及肝功能低下甚至衰竭,直至死亡。由此推断,该养殖场鲟鱼的致死机理为:某致病物质作用于肝组织引起肝星状细胞的活化并分泌大量胶原纤维,最先散布于汇管区并逐渐弥漫到整个肝组织。汇管区纤维化导致的门脉高压又引起腹水,脾、肠等组织器官水肿、淤血。肝脏硬化的反复、恶化导致其失去正常生理功能,最终导致鲟鱼死亡。
3.3 发病原因分析及治疗建议
经检测,发病池塘水体常规水质指标均在正常范围内,养殖水源上、下游养殖场均未暴发此类疾病。发病期间,养殖者反复施用多种杀虫及抗菌消毒药物,均无明显效果。经了解,养殖鲟鱼所投喂饲料为首次使用,并长时间堆放于阴暗潮湿处,投喂时部分饲料已经过期,且鲟鱼病死趋势随着停止投喂有所平稳,再次投喂后又急剧上升,故饲料不能排除为致病因素。
现代医学研究发现,高等动物肝纤维化甚至肝硬化在去除致病因子后均有逆转的可能性[37]。本试验中,从养殖场采回的活体病鱼在实验室内停止喂食、饲养,仍然存活,取存活鲟鱼做病理组织观察,发现肝组织较之前发病时趋于完整、清晰,且淤血、炎灶等症状得到改善。故推断此类疾病发生时应立即停止投喂,换用其他饵料,可使肝硬化、肝纤维化症状得到缓解甚至治愈。但此推测尚缺乏足够的试验验证,有待于进一步研究证实。
参考文献:
[1]席庆凯,张颖,刘晓勇,等.施氏鲟胚胎发育阶段可溶性蛋白、性激素含量和免疫相关指标的变化[J].大连海洋大学学报, 2015,30(4):357-362.
[2]王巍,朱华,胡红霞.4种鲟鱼养殖亲鱼群体遗传多样性分析[J].动物学杂志,2012,47(1):105-111.
[3]李融.中国鲟鱼养殖产业可持续发展研究[D].青岛:中国海洋大学,2008.
[4]陈弟伟,潘连德,刘健,等.中华鲟烂鳃并发胃充气病的组织病理观察[J].上海海洋大学学报,2010,19(3):352-357.
[5]王荻,李绍戊,冯娟,等.诺氟沙星在西伯利亚鲟体内蓄积规律及其对组织的病理损伤[J].中国水产科学,2015,22(6): 1209-1218.
[6]Ostaszewska T,ChojnackiM,KamaszewskiM,etal.Histopathological effects of silver and copper nanoparticles on the epidermis, gills,and liver of Siberian sturgeon[J].Environmental Science and Pollution Research,2016,23(2):1621-1633.
[7]Zee J,Patterson S,Gagnon D,et al.Adverse health effects and histological changes in white sturgeon(Acipenser transmontanus)exposed to dietary selenomethionine[J].Environmental Toxicology and Chemistry,2016,35(7):1741-1750.
[8]潘连德,李淑云,夏永涛.鲟鱼心外膜脓肿的病理学初步研究[J].水生生物学报,2000,24(5):563-566.
[9]郑跃平,刘健,陈锦辉,等.“狂游症”中华鲟幼鱼血液生化指标初步研究[J].淡水渔业,2013,43(5):85-88.
[10]潘连德,刘健,陈锦辉,等.中华鲟主要病害临床诊断及控制技术[J].渔业现代化,2009,36(6):29-33.
[11]叶兰,熊陶,黄能慧,等.高脂饲料和酒精诱导大鼠肝纤维化的实验研究[J].贵阳医学院学报,2003,28(2):152-154.
[12]张秀竹.饲料中黄曲霉毒素B1监测及其对蛋鸡肝脏脂类代谢和抗氧化功能的影响[D].泰安:山东农业大学,2012.
[13]李宣海,汪余勤,程五凤,等.不同硒水平饲料对大鼠抗氧化和肝纤维化的影响[J].中华消化杂志,1999,19(5):309-311.
[14]吴薇,刘元佼,陈独腾,等.高脂饲料和异种血清联合诱导小鼠肝纤维化模型的实验研究[J].现代免疫学,2014,34(3): 216-219.
[15]刘振勇,谢友佺,林小金.大黄鱼肝脏病变组织病理学观察[J].海洋水产研究,2007,28(5):7-11.
[16]刘迁.草鱼“肝胆综合症”病理变化及菜籽粕对其肝脏毒性的研究[D].武汉:华中农业大学,2009.
[17]曲明志,潘连德.池塘养殖锦鲤体表溃疡病的组织病理学观察[J].大连海洋大学学报,2016,31(1):44-49.
[18]黄莹,朱晓鸣,韩冬,等.饲喂不同浓度黄曲霉毒B1饲料对异育银鲫成鱼的生长和毒素积累的影响[J].水生生物学报, 2012,36(5):817-825.
[19]潘连德,孙玉华,陈辉,等.施氏鲟幼鱼肝性脑病组织病理学与细胞病理学研究[J].水产学报,2000,24(1):56-60.
[20]王坤元,刘莉,戴文聪,等.二乙基亚硝胺诱导建立斑马鱼肝纤维化模型[J].南方医科大学学报,2014,34(6):777-782.
[21]Rekha R D,Amali A A,Her G M,et al.Thioacetamide accelerates steatohepatitis,cirrhosis and HCC by expressing HCV core protein in transgenic zebrafishDanio rerio[J].Toxicology,2008, 243(1-2):11-22.
[22]LiuWangta,Chen JR,Hsu CH,etal.A zebrafishmodel of intrahepatic cholangiocarcinomaby dual expression of hepatitis B virus X and hepatitis C virus core protein in liver[J].Hepatology, 2012,56(6):2268-2276.
[23]Shin JT,Fishman M C.From zebrafish to human:modularmedicalmodels[J].Annual Review of Genomics and Human Genetics,2002,3:311-340.
[24]刘晖,丁惠国,王泰玲.肝硬化(二):肝硬化的病理诊断[J].北京医学,2011,33(6):502-506.
[25]Calès P,Boursier J,Oberti F,et al.Cirrhosis diagnosis and liver fibrosis staging:transient elastometry versus cirrhosis blood test [J].Journal of Clinical Gastroenterology,2015,49(6):512-519.
[26]甘天福,阎成玉,苏风华,等.早期肝硬化临床与病理诊断的对应关系[J].实用医药杂志,2007,24(6):643-645.
[27]徐豪,马淑懿.几种淡水养殖鱼类肝脏组织的细胞结构和亚显微结构[J].中山大学学报:自然科学版,1980(3):93-99.
[28]Kakisaka K,Endo K,Suzuki A,et al.Hypothyroidism enhanced portal hypertension in a patient with alcoholic liver cirrhosis,resulting in the development of ascites[J].Internal Medicine, 2015,54(18):2327-2331.
[29]董刚,凌宾芳,任波.肝硬化时器官血液循环的病理生理改变[J].临床肝胆病杂志,2011,27(3):328-329,336.
[30]张文革,耿军.俄罗斯鲟肝病及肝性综合症防治方法[J].河北渔业,2007(2):39.
[31]李斌,唐毅,王志干,等.复方中草药制剂对草鱼肝胆综合症的防治研究[J].南方水产科学,2011,7(2):35-41.
[32]Friedman S L.Molecular regulation of hepatic fibrosis,an integrated cellular response to tissue injury[J].The Journal of Biological Chemistry,2000,275(4):2247-2250.
[33]丁晓玲.不同病因肝硬化临床特征对比分析[D].银川:宁夏医科大学,2013.
[34]Friedman S L.Hepatic stellate cells:protean,multifunctional,and enigmatic cells of the liver[J].Physiological Reviews,2008,88 (1):125-172.
[35]Sherman I A,Pappas S C,Fisher M M.Hepatic microvascular changes associated with developmentof liver fibrosis and cirrhosis [J].American Journal of Physiology,1990,258(2):460-465.
[36]郭健滨.早期肝硬化临床与病理诊断的对应关系分析[J].中国实用医药,2014(14):38-39.
[37]Ismail M H,Pinzani M.Reversal of liver fibrosis[J].The Saudi Journal of Gastroenterology,2009,15(1):72-79.
Pathology of organ and tissue in farmed sturgeons w ith hepatocirrhosis
YANG Shi-hao,PAN Lian-de,ZHENG Chuan
(Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,Ministry of Education,Shanghai Ocean University,Shanghai201306,China)
Abstract:The pathoanatomy and histopathology were investigated in 9 samples(41 individuals)of cultured hybrid sturgeon suffered from hepatocirrhosis collected from flowingwater sturgeon farms in order to evaluate the pathological changes and pathogenesis of hepatocirrhosis in farmed Chinese sturgeonAcipensersinensis.Itwas that therewere obvious pathological changes in liver including fiber diffusion,hyperplasia,and atypical hepatic fibrosis in No.1, No.2,No.3,and No.9 samples.The splenic hyperemia,vacuolar degeneration,and necrosis,stomach and intestinal hyperemia,inflammatory cell infiltration,and necrosis of the intestinal villi,even shedding,were also observed,with slight congestion and inflammation in other organs tissues(gill and heart).Based on the organ symptoms and tissue lesion,the case for sturgeon liver diseasewas considered as sturgeon hepatocirrhosis.The findings indicate that sturgeon hepatocirrhosis is characterized by liver congestion and ulcer,liver ascites,liver blood sinus dilation,inflammatory cell infiltration,tissue degeneration and tissue fibrosis.
Key words:Acipenser sinensis;hepatocirrhosis;histopathology;organ pathology
中图分类号:S941
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.06.007
文章编号:2095-1388(2016)06-0623-07
收稿日期:2016-03-28
基金项目:水产动物遗传育种上海市协同创新中心项目(ZF1206)
作者简介:杨仕豪(1988—),男,硕士研究生。E-mail:ohyeah7@qq.com
通信作者:潘连德(1960—),男,教授。E-mail:ldpan@shou.edu.cn