达氏鳇养殖群体的胚胎发育研究
郭长江1,赵 文1,石振广2、3,魏 杰1,鲁宏申2、3,刘建魁2、3
(1.大连海洋大学水产与生命学院,辽宁省水生生物学重点实验室,辽宁大连116023;2.云南阿穆尔鲟鱼集团有限公司,云南昆明650228;3.北京鲟龙种业有限公司,北京101400)
摘要:为了解达氏鳇Huso dauricus养殖群体的胚胎发育过程,采用人工半干法受精获取受精卵,研究了在水温为(16.0±0.2)℃条件下达氏鳇养殖群体的胚胎发育过程及其特征。结果表明:达氏鳇成熟卵呈圆球形,为黄褐色或灰褐色,不透明,平均卵径为3.19 mm,属沉性黏性卵;达氏鳇受精卵历时136 h孵化出膜,所需总积温为2148~2592℃·h;达氏鳇受精卵的卵裂方式为特殊的辐射状卵裂;原肠中期时动物极细胞覆盖胚胎2/3,心跳期心脏呈“c”型,尾末端到达间脑或中脑时大量仔鱼出膜;根据胚胎发育过程的形态特征,可将达氏鳇胚胎分为受精卵、卵裂、囊胚、原肠、神经胚、器官形成、心跳和出膜期8个发育阶段,共36个时期。研究表明,达氏鳇胚胎发育过程中所需积温略高于鲟科其他鱼类。
关键词:达氏鳇;胚胎发育;发育分期;形态特征
达氏鳇Huso dauricus隶属于脊索动物门Chordata、硬骨鱼纲Osteichthyes、辐鳍亚纲Actinopterygii、软骨硬鳞总目Chondrostei、鲟形目Acipenseriformes、鲟亚科Acipenseryini、鳇属Huso,又名黑龙江鳇,是鲟科鱼类中个体最大的一种。在20世纪初期,达氏鳇地理分布广,数量较少,常见于中国黑龙江干流、松花江、乌苏里江和兴凯湖等水域[1]。21世纪以来,由于环境污染和人工捕捞等原因,达氏鳇的自然分布水域变得非常狭窄,目前,达氏鳇野生种群几乎只栖息在黑龙江干流,其他水域均已近绝迹。
达氏鳇的经济价值较高,鱼卵、鱼肉、内脏、鱼皮等均有相应的营养价值和实用价值。用其鱼卵加工的鱼子酱,被誉为“黑色黄金”,主要销售市场为东亚及欧美地区。达氏鳇成鱼个体硕大(体质量可达1000 kg以上),性成熟晚(一般在14~20龄),分布数量较少。其卵巢属于裸卵巢,排卵时卵全部排入腹腔内,雌鱼的怀卵量通常在(25~400)万粒不等,人工繁殖期间,雌鱼对水温的要求较高,取卵时机较难把控。因此,达氏鳇的人工繁殖难度较大。早在20世纪50年代,俄罗斯学者金兹堡等[2]就对闪光鲟Acipenser stellatus、史氏鲟A.schrenckii、欧洲鳇Huso huso等鲟科鱼类胚胎发育进行了详细研究,对今后的此类研究具有重要指导作用。目前,国内外对达氏鳇的繁殖生物学、生物化学、分子生物学、营养成分分析和剥制标本技术的相关研究较多[3-8],但尚未见有关达氏鳇胚胎发育的详细报道。本试验中,对养殖达氏鳇胚胎发育过程进行了观察记录,并对其特点进行分析,旨在为提高达氏鳇人工繁殖率,推进其健康养殖、资源增殖和保护提供基础资料。
1 材料与方法
1.1 材料
试验用达氏鳇亲鱼取自云南阿穆尔鲟鱼集团有限公司河北省邯郸市涉县鲟鱼养殖生态基地,每年的5—7月份是达氏鳇的繁殖季节,在此期间,选择全人工繁殖的16龄达氏鳇雌鱼4尾,体质量为104~206 kg,14~16龄雄性8尾,体质量为36~74 kg。平均水温为17.6℃。
1.2 方法
1.2.1 成熟度鉴定 从外观上观察,雌鱼腹部膨胀、生殖孔红润外翻时,用取卵器取出的达氏鳇卵子呈黄褐色或灰褐色,有光泽,具弹性,此时性腺处于Ⅳ期末期,正值鳇鱼的最佳产卵期[9]。在连续变倍体视显微镜(COIC-ZSA302)下观察约1000粒此时期的卵,测得卵径为3.00~3.38 mm,在动物极可观察到1~3个暗色的色素环和位于极端的光亮极性斑点。雄鱼腹部狭长,生殖孔紧闭不外翻,皮肤黏滑,轻压腹部即能流出乳白色精液。取一滴滴入清水,呈同心圈状且快速下沉散开,镜检发现精子呈直线运动,活力较强,成熟度较高。将精液移入干燥的玻璃容器中,在2~4℃条件下保存备用。
1.2.2 人工催产和孵化 催产采用胸鳍基部二次注射法[10],通过注射LRH-A2进行人工催熟。具体方法是第一次注射总量的10%~20%,第二次注射剩余剂量,两针相隔10 h左右。注射后将雌、雄鱼分开,以防止鱼卵在池中受精。用挤压结合手术法取卵,用半干受精法进行人工受精。受精卵用200 g/L的滑石粉溶液脱黏,再用清水清洗消毒后转入尤先科孵化器。孵化水温为(16.0±0.2)℃,溶解氧为8.64~8.81 mg/L,pH为6.8~7.3。
1.2.3 胚胎发育过程观察 在连续变倍体视显微镜下观察受精卵孵化期内的外部形态变化。第一次为卵裂发生前期,每15~30 min观察1次;从第一次卵裂开始至囊胚期末期,每1~3 h观察1次;原肠期之后基本保持每3~6 h观察1次,直至仔鱼孵出。每次观察取样均在30粒以上。发育时间的确定按照至少有50%的受精卵到达该时期的时间来计算。用游标卡尺测量卵长径,用CanonA 4000IS照相机拍照并用Photoshop CS5编排照片。根据达氏鳇胚胎发育过程及形态特点,并参照其他学者的工作[11-12],对达氏鳇胚胎发育进行分期。
2 结果与分析
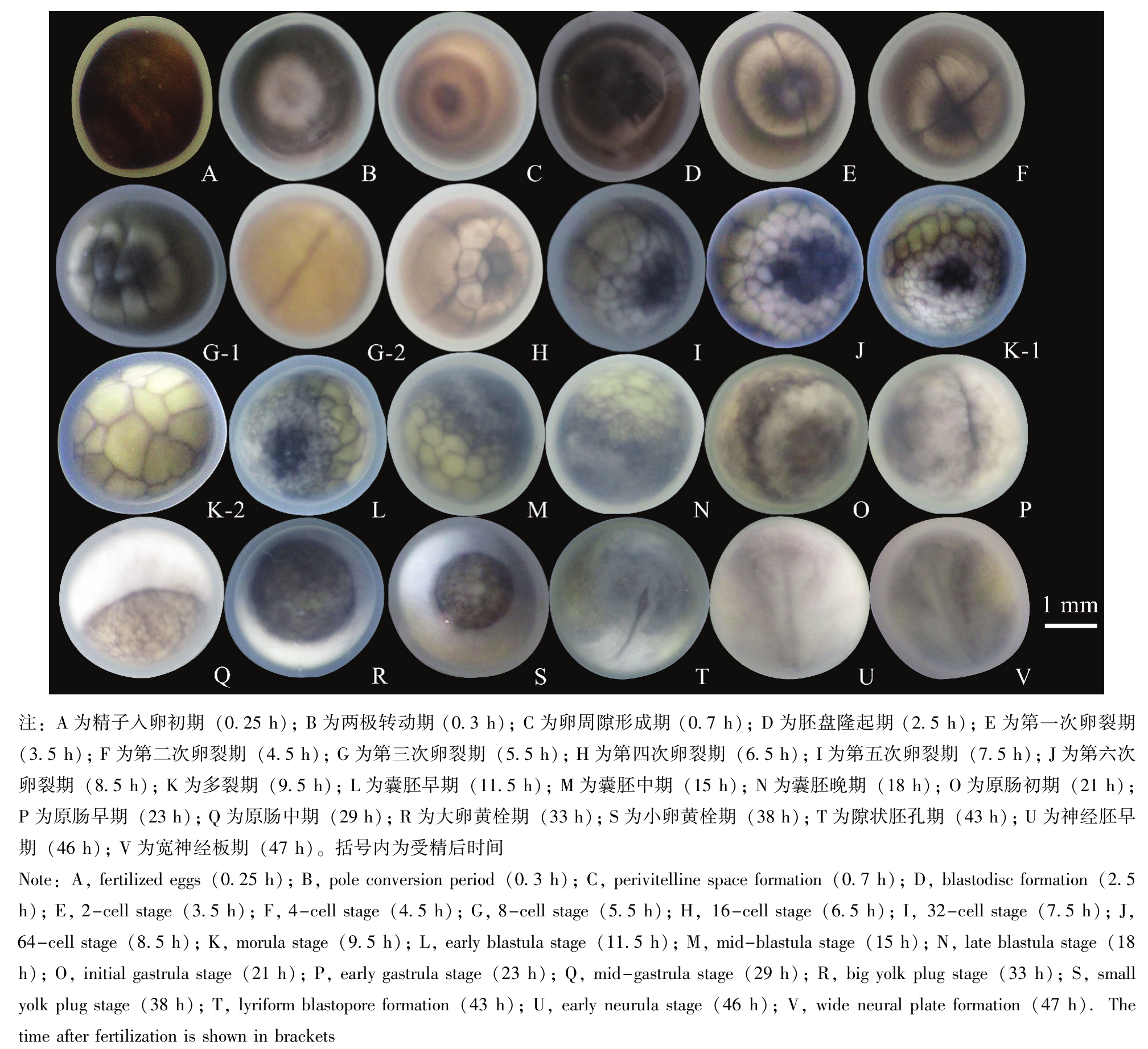
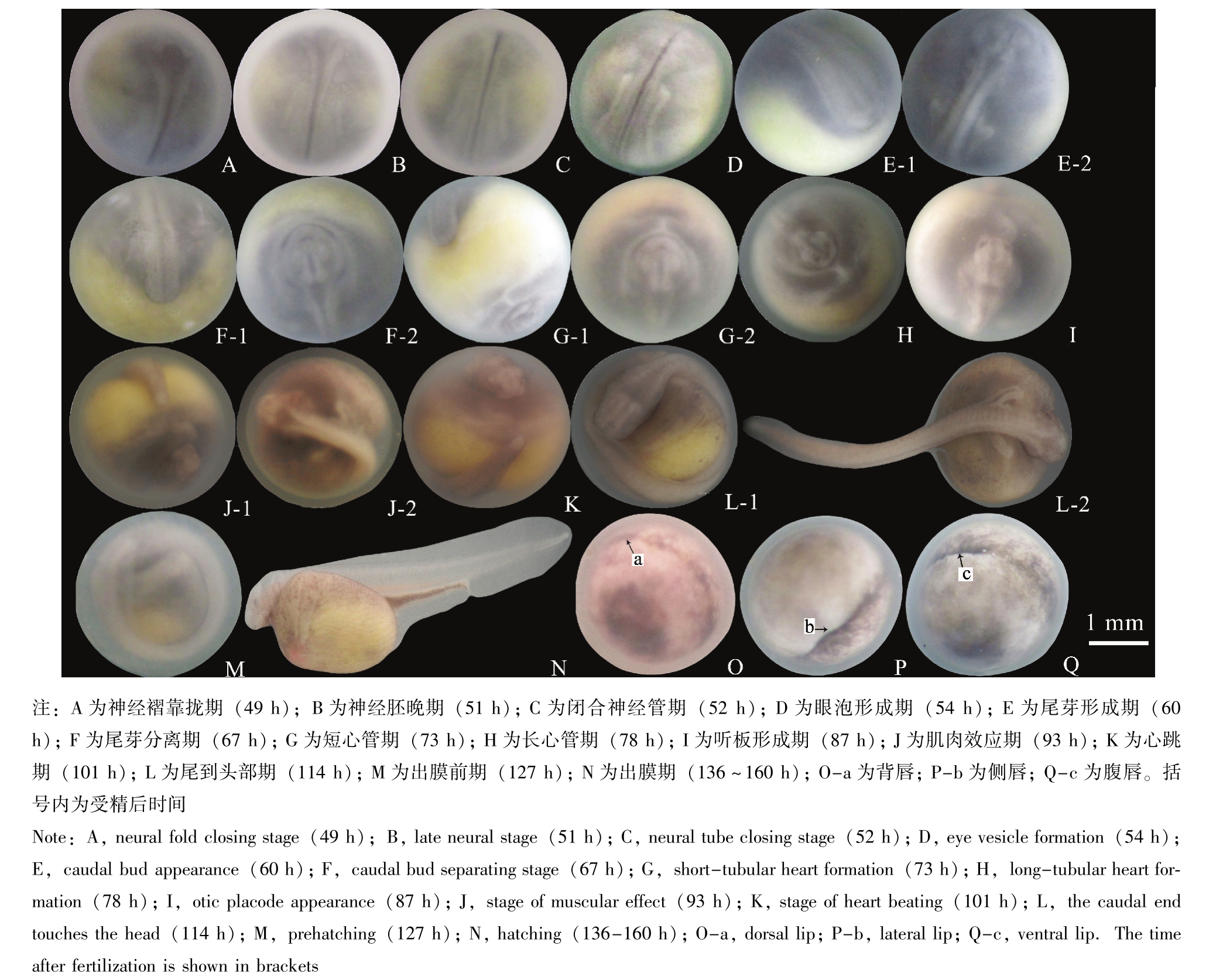
达氏鳇从受精卵到孵出仔鱼历经136~160 h,水温为15.8~16.2℃。达氏鳇的胚胎发育过程共分8个阶段,即合子(受精卵)期、卵裂期、囊胚期、原肠胚期、神经胚期、器官形成期、心跳期和出膜期。根据每个阶段的发生顺序和形态特征,又细分为36个时期,各个时期发育的主要特征和所需时间详见表1、图1和图2。
2.1 受精卵
与其他大部分鲟科鱼类相比,达氏鳇的成熟卵相对较大,呈圆球形,卵子呈黄褐色或灰褐色,有光泽,具弹性。未受精的卵卵径为3.00~3.38 mm,受精15 min之后的卵,最外面的胶膜开始膨胀,变得浑圆透亮,在体视显微镜(×0.7)下就能清楚地看到膜的成层结构。卵表面是比较厚的胶膜,具有黏着性,可附着池塘水中的泥沙,紧贴在卵上的是内卵膜,在内卵膜和胶膜之间的是外卵膜。但刚受精的卵依然侧卧水底,动物极有明亮的极性斑,动物极上环绕着1~3个暗色的同心圈,这些特点与未受精卵一致(图1-A)。受精后15~20 min,大部分受精卵在膜内开始转动,动物极转向上方,植物极富含卵黄,因而转到下方,转动缓慢的逐渐进行,最终受精卵的动物极向上,植物极向下(图1-B)。受精后40 min,原生质和卵膜吸水膨胀,细胞质从植物极流向动物极,使得动物极逐渐变成扁圆弧,与卵膜间出现了间隙即卵周隙。同时,动物极明亮的极斑消失(图1-C)。受精后2.5 h,色素堆积在动物极,胚盘隆起不明显,呈新月带状(图1-D),此时卵径为3.45~3.65mm。
2.2 卵裂
受精后3.5 h受精卵开始第一次卵裂,在动物极出现浅白色的狭窄分裂沟,分裂沟颜色逐渐加深,并沿着动物极与胚盘垂直向两侧扩展,直至扩展到卵细胞的赤道,细胞开始进入第二次卵裂。可见动物极被分裂成两个大小相等的细胞(图1-E)。受精后4.5 h出现第二次卵裂,仍为经裂,且垂直于第一次分裂沟(图1-F)。俄罗斯学者金兹堡等[2]发现,第二次卵裂沟约在从受精卵到第一次出现卵裂时间的1/3时间内(本试验中第二次卵裂沟出现的时间距第一次卵裂沟出现相隔1 h)出现。然后,经过几乎同样的时间间隔(发育温度恒定的条件下),继续进行第三次、第四次和第五次卵裂。受精后5.5 h出现第三次卵裂,仍是经裂,分裂为8个相差不大的细胞,分裂沟呈“Ж”形(图1-G-1),此时,第一次卵裂的分裂沟在植物极完全闭合(图1-G-2)。观察发现,第三次卵裂的分裂沟位置因受精卵的形状、大小不同而不同。例如,一般的圆形卵分裂沟通常经过圆心沿着半径辐射排列,大多数的长形卵与第一次分裂沟平行或者成一个小拐角,分割出长形或者圆形的细胞。受精后6.5 h出现第四次卵裂,卵裂是纬裂,分裂沟的位置为水平或辐射方向,在动物极形成16个大小不等、形状不规则的细胞(图1-H)。此时,第二次卵裂的分裂沟均延伸到了赤道下方,有一部分在植物极已经闭合。受精后7.5 h出现第五次卵裂,胚胎被分成32个大小不等的细胞,随着卵裂继续进行,植物极卵细胞的分裂程度加深。第二次分裂沟已在植物极闭合,植物极被分裂为4部分(图1-I)。受精后8.5 h开始第六次卵裂,卵裂的细胞呈细小不规则状,在高倍镜下观察其排列疏散,植物极也分裂出较小的细胞,分裂沟嵌入植物极已将其完全分开,在动物极中心出现较深的色素区,随着分裂的加剧,色素区面积逐渐扩大(图1-J)。同其他鲟科鱼类一样,鳇鱼受精卵卵裂属于完全卵裂[13]。受精后9.5 h为多裂期,动物极继续分裂成更小的细胞,植物极细胞分裂加速,但细胞体积仍大于动物极细胞(图1-K-1、K-2)。动物极中心出现较深色素并逐渐向四周扩展。
表1 达氏鳇胚胎发育各时期特征
Tab.1 Characteristics of em bryonic development of Siberian huso sturgeonHuso dauricusat various periods

序号No.图plate 1精子入卵初期fertilized eggs受精卵侧卧于水底,动物极环绕1~3个色素环,中央出现明亮的极性斑发育时期embryonic development stage关键特征key characteristics受精后时间/h time after fertilization 0.25 1-A 2两极转动期pole conversion period受精卵出现极性。动物极向上,植物极向下0.3 1-B 3卵周隙形成期perivitelline space formation卵膜膨胀,卵间隙明显,极性亮斑消失0.7 1-C 4胚盘隆起期blastodisc formation色素堆积在动物极,胚盘隆起不明显,形似新月带2.5 1-D 5第一次卵裂期2-cell stage经裂。在动物极形成2个大小形态相似的细胞3.5 1-E 6第二次卵裂期4-cell stage经裂,并与第一次分裂沟垂直。动物极分裂成4个大小形态相似的细胞。第一次卵裂的分裂沟到达卵细胞赤道4.5 1-F 7第三次卵裂期8-cell stage受精卵分裂成8个大小不等的细胞。第一次卵裂的分裂沟在植物极闭合5.5 1-G-1、G-2 8第四次卵裂期16-cell stage纬裂。分裂沟的辐射方向多样性。动物极分裂成16个大小不等的细胞。第二次卵裂的分裂沟延伸到赤道下方,部分在植物极闭合6.5 1-H 7.5 1-I 10第六次卵裂期64-cell stage动物极被分裂成越来越小的不规则细胞8.5 1-J 11多裂期morula stage动物极继续分裂成更多、更小的细胞,分裂沟已将植物极完全分裂开9第五次卵裂期32-cell stage胚胎被分裂成32个大小不等的细胞。第二次卵裂的分裂沟在植物极闭合9.5 1-K-1、K-2 12囊胚早期early blastula stage细胞越来越细小。动物极细胞之间的界限开始模糊11.5 1-L 13囊胚中期mid-blastula stage囊胚腔不大,动物极细胞呈不规则圆球,细胞间疏松靠拢15.0 1-M 14囊胚晚期late blastula stage囊胚腔形成。动物极细胞细小模糊,出现边缘带18.0 1-N 15原肠初期initial gastrula stage赤道附近出现一条深色色素带21.0 1-O 16原肠早期early gastrula stage暗色条纹的地方形成胚孔,细胞开始内卷、外包,囊胚腔扩大23.0 1-P 17原肠中期mid-gastrula stage动物极覆盖胚胎表面的2/3,背唇、腹唇和侧唇闭合形成胚环29.0 1-Q 18大卵黄栓期big yolk plug stage原肠腔初步形成,囊胚腔缩小,形成大卵黄栓33.0 1-R 19小卵黄栓期small yolk plug stage原肠腔增大,在胚孔处形成腹唇和背唇,形成小卵黄栓38.0 1-S 20隙状胚孔期lyriform blastopore formation卵黄栓消失,囊胚腔缩小至消失,胚孔两侧唇靠近成隙状。原肠腔形成43.0 1-T 21神经胚早期early neurula stage出现神经板,神经沟起始于胚孔延伸至神经板最宽处,神经板增厚,出现神经褶46.0 1-U 22宽神经板期wide neural plate formation神经板增厚,呈马蹄形。神经褶增厚、清晰,并内外分化47.0 1-V 23神经褶靠拢期neural fold closing stage头部神经褶靠近,神经板中部略陷,出现排泄系统原基49.0 2-A 24神经胚晚期late neurula stage神经沟深陷。躯体部神经管闭合,排泄系统原基清晰、伸长51.0 2-B 25闭合神经管期neural tube closing stage躯体神经管闭合,排泄系统原基增长,头尾开始分化52.0 2-C 26眼泡形成期eye vesicle formation眼的原基形成。中脑泡两侧可见上突弧形的颌弧原基54.0 2-D 27尾芽形成期caual bud appearance胚胎稍微隆起。孵化腺原基清晰可见,侧板在头前端靠近。尾芽原基逐渐增厚呈扁平状60.0 2-E-1、E-2 28尾芽分离期caual bud separating stage在侧板联合处形成心脏原基,3对新月形咽弧原基形成。尾芽呈棒状凸出67.0 2-F-1、F-2 29短心管期short-tubular heart formation心脏呈短管状,尾芽与卵黄囊略分离73.0 2-G-1、G-2 30长心管期long-tubular heart formation心管变长略有弯曲。眼晶体原基形成。输出管开口于泄殖腔。听板形成增厚78.0 2-H 31听板形成期optic placode appearance心脏呈“c”形,眼泡内有黑色素沉着,开始有不明显的心跳,血液开始循环,胚体可在卵内转动87.0 2-I 32肌肉效应期stage ofmuscular effect尾末端接近心脏,听板内陷形成听泡93.0 2-J-1、J-2 33心跳期stage of heart beating尾末端到达心脏,尾扁平。心脏开始强劲、有节律的搏动101.0 2-K 34尾到头部期the tail touches the head尾末端到达头部。肛门原基形成,胚胎在卵膜内自由转动114.0 2-L-1、L-2 35出膜前期prehatching stage尾末端盖过眼部,胚胎弯向卵黄囊侧面,囊上可见明显血管127.0 2-M 36出膜期hatching尾末端到达间脑或中脑,大量仔鱼出膜136.0~160.0 2-N
2.3 囊胚
受精后11.5 h,胚胎进入囊胚早期。随着卵裂不断进行,卵裂细胞越来越小,细胞间开始有组织液积蓄,胚胎出现囊胚腔。此时动物极中心色素越来越深。周围环绕着较浅亮的色素带,细胞越来越细小,细胞之间的界限开始模糊。相比之下,植物极色素仍很深,细胞之间界限较明显(图1-L)。
受精后15 h,胚胎进入囊胚中期。分裂腔逐渐扩大。细胞继续变小,且动物极细胞核分裂不同步,使得整个受精卵的细胞之间有明显的间隙,并表现出卵裂的不等性(图1-M)。
受精后18 h,胚胎进入囊胚晚期。动物极色素浅亮,细胞细小模糊,已分不清界限,下延至赤道。植物极细胞进一步减小。在较小的动物极细胞和较大的植物极细胞之间,有一中等大小的细胞区域,称为边缘带。动物极处的囊胚隆起,向下扩张,产生下包作用,并逐渐形成透亮的囊胚腔(图1-N)。
2.4 原肠胚
受精后21 h,胚胎进入原肠初期。外胚层细胞开始向植物极外包,在胚胎未来的背面,靠近赤道水平处出现一条暗色条纹(图1-O)。受精后23 h,胚胎进入原肠早期。此时在暗色条纹的地方形成一个狭窄且较浅的缝隙,即胚孔,胚层从该处内卷,待暗色条带处的细胞卷入囊胚腔后,边缘带的细胞也开始内卷,形成胚孔的背唇,所有新形成的细胞也依次靠近胚孔,随后从胚孔进入胚胎内部。胚孔裂隙也随之向两侧慢慢扩大。所有卷入内部的细胞向上(动物极)推进,以前处于囊胚外壁动物极的细胞明显向植物极下包。在体视显微镜下观察发现,随着胚孔裂隙的加长,明亮细胞和暗色细胞的界限向植物极移动(图1-P),此时的囊胚腔逐渐扩大,腔壁变薄,植物极顶端细胞分裂细小。受精后29 h,胚胎进入原肠中期。动物极的细胞继续内卷、外包,在胚孔处形成侧唇和腹唇。外胚层细胞通过胚孔继续内陷上移,随着胚孔裂隙向两侧慢慢扩大,逐渐形成一环形带,闭合后形成胚环,此时胚环下移至胚胎的2/3处(图1-Q)。受精后33 h,胚胎发育至大卵黄栓期。动物极细胞继续向植物极扩展,胚胎内部分化出细窄的原肠腔;植物极细胞色素积累,两极界限明显。此时的胚环约覆盖了胚胎的80%,相比之下,植物极暗色细胞好像一个栓,塞入了明亮的植物极,因此也称为卵黄栓(图1-R)。受精后38 h,胚胎发育至小卵黄栓期。卵黄栓的体积越来越小,除了植物极仍有一个很小的卵黄栓,胚胎大部分被动物极明亮的细胞覆盖。原肠腔基本形成(图1-S),此时从植物极可以看到原肠腔。
2.5 神经胚
受精后43 h,该阶段为原肠胚形成末期。胚孔边缘侧唇彼此靠近,呈隙状。卵黄栓逐渐消失,直到完全没入胚胎内部。此时原肠腔形成,胚胎在膜内转动,背面朝上,称为隙状胚孔期(图1-T)。受精后46 h,胚胎背部、原肠胚顶部外胚层加厚形成板状结构,起初板状结构扁平并不清晰,待轮廓清晰后可见神经板前端宽大,前脑、间脑和中脑的原基均位于此。神经板中部外缘轮廓增厚,形成神经褶。神经沟起始于隙状胚孔,向前延伸,终止于神经板最宽处,中脑原基位于此处(图1-U)。受精后47 h,进入宽神经板期。该时期最明显的特征是神经板和神经褶增厚,形似马蹄状,神经板结构上下伸长,形成内外两部分,神经沟清晰(图1-V)。受精后49 h,神经沟逐渐深陷,神经褶边缘升高、增厚、逐渐靠拢(图2-A)。受精后51 h,神经板下陷,变窄,躯体部神经管逐渐闭合。与此同时,顺着神经板两侧,不远处出现两条浅色条纹,且逐渐加长,即胚胎排泄系统原基(图2-B)。受精后52 h,胚胎进入神经管闭合期。此时,躯体部和头部左右的神经褶闭合,形成神经管(图2-C)。胚胎的外胚层形成神经管和体被上皮。头部逐渐扩大加长,形成前脑泡、中脑泡和后脑泡。脑的原基深陷在神经管头部,排泄系统原基显著增长,在躯体上可见横向平行排列的肌节。可清晰观察到头和尾的分化,整个胚胎体仍呈圆形。
2.6 器官形成
受精后54 h,胚胎发育至眼泡形成期。胚胎头部继续发育,脑容积变大。前脑泡形成两个侧突起即眼的原基,随着黑色素的积累,发育成眼器官。孵化腺原基接近脑的正前方,呈半月形状,在中脑泡的两侧可见上突呈弧形的浅色弧,这是颌弧原基,体节明显(图2-D)。
受精后60 h,整个胚胎稍有隆起,高出球面。脑前端半月形的孵化腺明亮可见。位于孵化腺下缘的垂体原基凹陷,第一对咽弧原基基本形成,第二对咽弧原基从中脑泡两侧发出。侧板到达胚胎腹部的前端,并在头部前方慢慢接近联合。从该时期切片观察,排泄系统原基位于神经褶两侧,前部上曲增厚,后部顺势延伸,在高倍镜下可见肾小管原基向外侧突起。胚体后端逐渐增大,形成扁平的尾原基。整个胚球逐渐变成椭圆形(图2-E-1、E-2)。
受精后67 h,胚胎发育至尾芽分离期。胚体继续向上隆起。侧板在头部从接近到完全联合。在侧板联合的地方形成心脏的原基。沿着前脑泡两侧可见上皮中形成的一对凹陷——嗅窝(图2-F-1)。同时,在中脑泡两侧第三对新月形的弧开始形成,即软骨性腮弧原基。后脑泡内扩大为延脑室,沿着后脑泡两侧形成一对听泡,它们是体被上皮的一对囊状突起。排泄原基从身体中部一直延伸到尾端,前端迅速分节,形成肾管。收集管形成典型的弯曲,在心脏开始跳动之前,前面6条肾管一端开口于体腔内,另一端开口于总的收集管,向胚体后延伸成输出管。中胚层继续分节,体节从躯干前部向后扩展至尾部,新生的体节在早生的体节后面。尾芽突出,呈棒状(图2-F-2)。受精后73 h,位于头部前下方的心脏开始呈短管状,头部已开始稍有抬起,第三对腮弧明显形成(图2-G-1)。尾芽变窄、变长,略与卵黄囊分离(图2-G-2)。受精后78 h,心管变长并略有弯曲。头部明显抬高,卵径明显增大。眼泡接近体被上皮的地方形成晶体原基。收集管的输出管开口于泄殖腔(图2-H),泄殖腔是体被上皮的一个囊状凹陷。在眼囊后方脑的第三膨大部分的两侧出现一对椭圆形听板。受精后87 h,头部继续隆起。心脏从略有弯曲的长心管期过渡到“c”形,心脏搏动微弱,为30~36次/min,尾部增大变弯曲,剥开卵胶膜可看见约有3/5的尾部离开卵黄囊,卵黄囊上开始布有微血管网。胚胎可以在卵内扭动。眼的晶体明显,眼泡内可见少量的黑色素沉着,听板颜色加深(图2-I)。受精后93 h,尾末端接近心脏,胚胎进入肌肉效应期。心跳为40~47次/min,头尾均可在胚胎内做小幅度的摆动。嗅窝颜色加深,听板内陷形成听泡,尾部继续伸长,出现鳍褶,尾尖部分仍呈棒状(图2-J-1、J-2)。
2.7 心跳
受精后101 h,尾的末端到达心脏,胚胎进入心跳期,胚胎可做大幅度摆动。孵化腺原基位于头部下表面,心脏位于其下方,呈波浪状并有节律搏动,逐渐从60次/min加快到100次/min。听泡增大,壁变薄。尾部继续增长,鳍褶明显变宽,尾的末端由棒状变得扁平(图2-K)。
2.8 出膜
受精后114 h,尾末端到达头部。尾动脉可见血液流动,卵黄囊背部和胚体之间有大量黑色素细胞颗粒出现,脊柱下可见黑色的肾脏,并可见黑色摄食栓下的肛门原基。尾部鳍褶变宽,覆盖住心脏(图2-L-1)。胚胎经常在卵膜内转动并弯向侧面,通过转动身体,胚胎可以搅动卵膜内液体冲撞卵膜,有助于顺利出膜。此时人工剥去卵膜,可观察到胚胎全长为9 mm,卵黄囊约占1/3体长(图2-L-2),因为卵黄囊较为沉重,胚胎只能像指针一样摆动,原地游泳,随着时间延长,胚胎可以摇晃着前行,但还不能做真正意义上的游动。受精后127 h,尾的末端略过头部,已有部分仔鱼的尾尖到达端脑,此时为出膜前期。胚胎和卵膜间隙明显扩大,鱼体侧盘在卵黄囊上。卵黄囊上血管明显,心脏移到孵化腺正下方(图2-M),心跳为90~110次/min。尾部鳍褶更宽,胚胎可在卵内自由转动,释放出来的胚胎可在水中自由游动。受精后136~160 h为仔鱼出膜期。通常把多于30尾仔鱼出膜看作出膜期的开始。出膜前,达氏鳇胚胎尾部末端到达间脑或中脑,黑色素颗粒分散在卵黄囊腹部下侧。大部分仔鱼从头部破膜而出,然后尾部不断摇动,将胚体推出膜外。也有部分仔鱼尾部先出膜,这样的仔鱼完全出膜不容易,它便带着包裹着头部的卵膜游泳,如果此时无法人工破膜,则这段时间需要保持水体的清洁,因为套在仔鱼头上的卵膜能吸附积聚在水中的大量杂尘,时间过久可影响仔鱼在膜内呼吸,使其窒息。从第一批仔鱼出膜开始,历经约24 h,仔鱼全部出膜。刚孵出的仔鱼全长为10.0~11.2 mm(图2-N)。
3 讨论
3.1 达氏鳇胚胎发育特征及其比较
达氏鳇受精卵为沉性黏性卵,在第一次卵裂之前卵径为3.5~3.8 mm。就现有的资料分析[11-14],该时期达氏鳇的受精卵卵径仅比中华鲟Acipenser sinensis和匙吻鲟Polyodon spathula小,相对鲟科其他鱼类则较大。达氏鳇卵膜外层的胶膜较厚,且具有很强的黏着性,推测这是因为达氏鳇野生种溯河洄游,通常将受精卵产于水流湍急的河道中,其受精卵外较厚的胶膜和黏性有助于受精卵在沙石上固定,有杂物冲击时起到保护作用。
达氏鳇和鲟科其他鱼类一样,卵裂均为辐射状卵裂,属于完全卵裂,这与大部分冷水硬骨鱼类[15-16]的盘状卵裂不同。但是由于达氏鳇卵的大部分卵黄集中在植物极,植物极的细胞比动物极大很多,所以分裂不均等。达氏鳇受精卵前三次卵裂均为经裂,第四次则为纬裂,这种卵裂方式和中国大鲵Andrias davidianus早期卵裂过程极其相似[17],早在两亿三千万年前的三叠纪,两栖动物继鱼类后出现在地球上,并占据了生物链的主要地位,而鲟鳇鱼恰好也出现在这个时期,根据平行进化理论[18],推测出达氏鳇卵裂方式和两栖动物十分相似,由此可知,达氏鳇卵裂的分裂方式介于两栖类和鱼类之间,属于过渡态原始卵裂。
达氏鳇的受精卵以椭圆形甚至长圆形居多,与圆形受精卵相比,其细胞质和卵黄分布并不均匀,这也导致在卵裂过程中,每个受精卵分裂沟的位置并不完全一致,但是前两次卵裂的分裂沟基本与卵长轴垂直。有学者研究表明,即便在卵长轴和短轴长度相差10%的情况下,第一次卵裂的分裂沟仍垂直于卵长轴[19]。本试验中观察到的大部分受精卵都符合这种情况。然而第三次卵裂的分裂沟方向便有差异,本试验中观察到,大部分长圆形的受精卵在进行第三次卵裂的时候,分裂沟距离第一次卵裂的分裂沟很远,甚至与其相平行。本试验中还观察到第三次卵裂的8个细胞体积相差不大,这与达氏鳇受精卵较大、卵黄和细胞质较多且在动物极分布较其他鲟鱼丰富有关。本试验中,存在这种分裂状态的受精卵均可以孵化出正常仔鱼。通过观察发现,在第五次卵裂时,若第二次分裂沟尚未在植物极出现,或卵裂分裂沟错乱,此类型受精卵往往不能发育到原肠胚期,即便能孵化出仔鱼,畸形胚胎比率也会较高,因此,在实际孵化时应及时挑除该类型卵。
在原肠早期,达氏鳇的受精卵便形成胚孔,随着动物极的外胚层细胞卷入胚孔进行内陷上移,胚孔部位形成背唇、侧唇和腹唇(图2-O、P、Q),通常把胚环的形成作为受精卵进入原肠中期的显著特征之一[2]。达氏鳇胚胎在原肠中期时,动物极细胞约覆盖胚胎的2/3,而处于同一时期的史氏鲟和中华鲟,其动物极细胞覆盖胚胎表面约3/4,要快于达氏鳇。从胚环的形成时期看,同为冷水鱼种的秦岭细鳞鲑Brachymystax lenok tsinlingensis在原肠早期形成胚环[15],哲罗鱼Hucho taimen和细鳞鱼Brachymystax lenok的杂交种则在囊胚晚期就已形成胚环[20]。胚环的形成意味着神经胚阶段即将到来,在神经胚期胚胎进行组织器官分化。通过比较可知,达氏鳇的胚胎发育速度较其他冷水鱼慢。
神经胚阶段是胚胎强烈进行分化的过程。大多数淡水鱼的胚胎在胚环下包胚胎的80%时便进入神经胚期[21-23],而达氏鳇只有当胚环完全覆盖胚胎(即原肠腔形成)后才会进入神经胚期,这样大大减少了因原肠尚未健全或神经系统发育不完善而产生的畸形胚胎,说明了达氏鳇系统分化的完整性和完善性。
受精后87 h,达氏鳇眼泡内便可见少量黑色素沉积,此时尾部末端未接近心脏;与此同时,达氏鳇胚胎出现微弱心跳,此时发育的有效积温达到1392℃·h,心脏呈“c”形。与之不同的是,小体鲟A.ruthenus的眼泡内出现色素时,其尾部末端已接近心脏[24],受精后68 h出现微弱的心跳;西伯利亚鲟A.cipenserbaerii眼囊出现色素时,尾末端已越过心脏到达头部[25];闪光鲟在长心管期心脏就发生了微弱的搏动[26];而欧洲鳇要等到心脏呈明显的“S”形弯曲才产生搏动。傑特拉弗等[19]指出,以上这些差别不会随着温度的变化提前或者延后,是物种先天特征和本身的属性。
鲟科鱼类产卵水温为6~25℃,产卵季节几乎覆盖了一年四季[27]。闪光鲟和西伯利亚鲟相对达氏鳇体形要小得多,喜温性,卵孵化需要较高的积温,呼吸代谢强烈,因此,其心跳出现搏动的时间较早;欧洲鳇与达氏鳇体形相似,甚至要比达氏鳇大,自然环境下产卵最适温度为9~17℃[28],较达氏鳇最适孵化温度(14~18℃)偏低,代谢相对缓慢,故达氏鳇和欧洲鳇出现心跳的时间较晚,并且心律开始较慢。总体来看,经过长时间的进化,鲟科鱼类胚胎发育阶段保持着较高的相似性。
鲟科鱼类出膜期最明显的特征是尾末端到达的位置,甚至可以由此判断出鱼的种类。本试验中观察到,达氏鳇仔鱼出膜前,胚胎尾部末端已到达间脑或中脑,出膜后的体长为10.0~11.2 mm。通过整理数据(表2)可见:鲟科鱼类在出膜期,胚胎尾部末端所到达位置与出膜仔鱼体长成正比。
表2 鲟科鱼类出膜期仔鱼尾末端到达位置和平均体长的比较
Tab.2 Com parison of position of caudal end and average body length of new ly hatched larvae in fishes in Acipenseridae
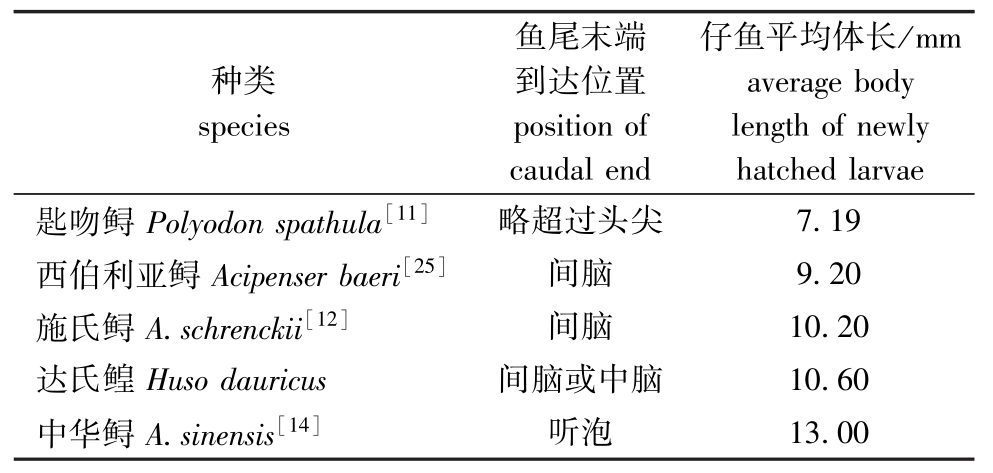
种类species仔鱼平均体长/mm average body length of newly hatched larvae匙吻鲟Polyodon spathula[11]略超过头尖鱼尾末端到达位置position of caudal end 13.00 7.19西伯利亚鲟Acipenser baeri[25]间脑9.20施氏鲟A.schrenckii[12]间脑10.20达氏鳇Huso dauricus间脑或中脑10.60中华鲟A.sinensis[14]听泡
物种的发育受个体本身和生存环境的综合影响,刚孵出的达氏鳇个体较大,开口时间较晚,胚后发育时间相对较长,这些差异从某种程度上反映出仔鱼对环境的适应性及占据生态位的能力较强,有成长为较大个体的潜力。
3.2 鲟科鱼类胚胎发育时间、积温与分期的比较
鲟科鱼类胚胎发育时间与积温的比较列于表3。从表3可知,鲟科鱼类中达氏鳇胚胎发育时间最长,积温较高。在鱼类的胚胎发育过程中,适宜的水温是主要的生态条件之一。温度升高可使胚胎的代谢加快,呼吸作用增强,发育速度提高,但过高的温度也会导致水中溶氧降低,引起胚胎死亡。鲟鱼正常孵化水温一般为14~25℃。在不同学者对鲟科不同鱼类的胚胎发育研究中发现,随孵化温度的升高,胚胎正常孵化率逐渐增高,最适温度下胚胎孵化率最高。
表3 鲟科鱼类胚胎发育情况的比较
Tab.3 Comparison of embryo development in fishes in Acipenseridae

种类species发育积温/ (℃·h) accumulative temperature达氏鳇H.dauricus孵化水温/℃water temperature发育时间/h period of embryo development 15.8~16.2 136~160 2148~2592施氏鲟A.schrenckii[12]17.0~19.0 95~104 1710~1872中华鲟A.sinensis[14]16.5~18.0 113~130 1921~2210闪光鲟A.stellatus[26]16.0~18.0 106~126 1802~2142匙吻鲟P.spathula[11]18.0~22.0 119~138 2266~2617西伯利亚鲟A.baeri[25]15.5~18.0 133~145 2173~2369达氏鲟A.dabryanus[29]18.0~20.0 129~146 2322~2920
对达氏鳇胚胎发育进行研究可知:在平均水温为15.9℃的流水中,正常孵化率为74.3%,而在平均水温为19.2℃的静水中,正常孵出率高达85.8%,出膜时间要比流水中早约24 h,且仔鱼体质更加健康;在水温为10~12℃时,胚胎发育到原肠胚中期前就已停止,升高水温后只有少部分能发育至器官形成期,继续发育下去的胚胎心跳期会延迟,仔鱼不健康,几乎无仔鱼能正常破膜而出;当水温超过25℃时,所有胚胎均无法形成胚孔,在小卵黄栓期全部死亡。推断温度的改变使胚胎孵化酶受到抑制,进而破坏了整个发育机制。
达氏鳇胚胎发育过程中所需积温略高于鲟科其他鱼类,故在养殖模式下可适当提升孵化水温,缩短孵化时间,短期内达到孵化总积温。
参考文献:
[1]石振广.达氏鳇人工繁殖和养殖关键技术研究[D].青岛:中国海洋大学,2008.
[2]金兹堡A C,傑特拉弗T A.鲟鱼类的胚胎发育[M].张贵寅,赵尔宓,译.北京:科学出版社,1957.
[3]赵文,高峰英,石振广.达氏鳇肌肉组织转录组测序和功能分析[J].水产学报,2014,38(9):1255-1262.
[4]潘伟志,尹家胜,赵春刚,等.达氏鳇人工繁殖及其与史氏鲟杂交的初步研究[J].水产学杂志,2001,14(1):3-6.
[5]胡佳,汪登强,危起伟,等.施氏鲟、达氏鳇及其杂交子代的分子鉴定[J].中国水产科学,2010,17(1):21-30.
[6]郭长江,李沂轩,赵文.小型鲟科鱼类剥制标本制作及造景研究[J].生物学杂志,2015,32(3):93-95,99.
[7]尹洪滨,孙中武,孙大江,等.6种养殖鲟鳇鱼肌肉营养成分的比较分析[J].大连水产学院学报,2004,19(2):92-96.
[8]李文龙,韩英,石振广,等.达氏鳇稚幼鱼生长特性的研究[J].大连海洋大学学报,2012,27(2):125-128.
[9]杨德国.鲟鱼高效生态养殖新技术[M].北京:海洋出版社, 2012.
[10]庄平,李大鹏,王立金.史氏鲟的人工繁殖及养殖技术[M].武汉:湖北科学技术出版社,2001.
[11]陈静,梁银铨,胡小建,等.匙吻鲟胚胎发育的观察[J].水利渔业,2008,28(3):34-36,96.
[12]刘洪柏,宋苏祥,孙大江,等.施氏鲟的胚胎及胚后发育研究[J].中国水产科学,2000,7(3):5-10.
[13]Zotin A I.Themechanism of cleavage in amphibian and sturgeon eggs[J].Journal of Embryology and Experimental Morphology, 1964,12:247-262.
[14]陈细华.中华鲟胚胎发育和性腺早期发育的研究[D].广州:中山大学,2004.
[15]施德亮.秦岭细鳞鲑早期发育研究[D].武汉:华中农业大学,2012.
[16]许静.雅鲁藏布江四种特有裂腹鱼类早期发育的研究[D].武汉:华中农业大学,2011.
[17]骆剑,肖亚梅,罗凯坤,等.中国大鲵(Andrias davidianus)的胚胎发育[J].自然科学进展,2007,17(11):1492-1499.
[18]吕昊敏,周仁超,施苏华.生态物种形成及其研究进展[J].生物多样性,2015,23(3):398-407.
[19]傑特拉弗T A,金兹堡A C.鲟鱼类的胚胎发育与其养殖问题[M].张贵寅,赵尔宓,译.北京:科学出版社,1958.
[20]徐革锋,杜佳,张永泉,等.哲罗鱼(♀)与细鳞鱼(♂)杂交种胚胎及仔稚鱼发育[J].中国水产科学,2010,17(4):630-638.
[21]潘炯华,郑文彪.胡子鲶的胚胎和幼鱼发育的研究[J].水生生物学集刊,1982,7(4):437-444.
[22]常剑波,王剑伟,曹文宣.稀有鮈鲫胚胎发育研究[J].水生生物学报,1995,19(2):97-103.
[23]宋天祥,马骏.华鳈人工繁殖和早期发育的研究[J].湖泊科学,1996,8(3):260-267.
[24]吴兴兵,朱永久,陈建武,等.小体鲟胚胎发育特征观察[J].淡水渔业,2012,42(6):61-67.
[25]宋炜,宋佳坤,范纯新,等.全人工繁殖西伯利亚鲟的早期胚胎发育[J].水产学报,2010,34(5):777-785.
[26]杜佳垠.闪光鲟生态学特点与增养殖进展[J].渔业经济研究,2007(4):6-10.
[27]陈细华.鲟形目鱼类生物学与资源现状[M].北京:海洋出版社,2007.
[28]任华,蓝泽桥,孙宏懋,等.欧洲鳇全人工繁殖技术研究[J].江西水产科技,2013(1):20-22,32.
[29]龚全,刘亚,杜军,等.达氏鲟全人工繁殖技术研究[J].西南农业学报,2013,26(4):1710-1714.
Embryonic development of cultured Siberian huso sturgeonHuso dauricus
GUO Chang-jiang1,ZHAOWen1,SHIZhen-guang2,3,WEIJie1,LU Hong-shen2,3,LIU Jian-kui2,3
(1.Key Laboratory of Hydrobiology in Liaoning Province,College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China; 2.Yunnan Amur Sturgeon Group Limited Company,Kunming 650228,China;3.Beijing Sturgeon Dragon Seed Industry Group Limited Company, Beijing 101400,China)
Abstract:The embryonic developmentwas observed in cultured population of Siberian huso sturgeonHuso dauricus,which was induced to spawn by hormone injection,atwater temperature of(16.0±0.2)℃to understand the embryonic development procedure of Siberian huso sturgeon.Itwas found that Siberian huso sturgeon had spherical mature eggs in shape,and yellowish-brown or taupe in color and was non-transparent dermal-adhesive,with mean egg diameter of3.19 mm.The fertilized eggs showed special radial cell division in cleavage stage,with average effective cumulative temperature of 2148-2592℃·h and hatched in 136 hours.Animal pole cells occupied two thirds of the whole embryos in volume in mid-gastrula stage,with“c”-shaped heart in heart beating stage. Most of the freshly hatched fry had caudal end extending to the diencephalon.The embryonic development of Siberian huso sturgeon was divided into 8 continuous stages including fertilized egg,cell division,blastula,gastrula, neurula,organogenesis,heartbeating and hatching stage,amounting to 36 substages based on themorphology.The findings indicated that there was slightly higher cumulative temperature in Siberian huso sturgeon than that in other sturgeons during embryonic development.
Key words:Huso dauricus;embryonic development;development stage;morphological characteristics
中图分类号:Q132;S917
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.06.001
文章编号:2095-1388(2016)06-0589-09
收稿日期:2016-03-20
基金项目:辽宁省海洋与渔业厅科研项目(200920);横向联合项目“达氏鳇基础生物学研究”(2012-2014)
作者简介:郭长江(1989—),男,科研助理。E-mail:407055886@qq.com
通信作者:赵文(1963—),男,教授,博士生导师。E-mail:zhaowen@dlou.edu.cn