
图1 ld4基因编码区序列和蛋白质序列
Fig.1 Coding sequence and protein sequence of ld4 gene
摘要:为研究低温胁迫下抗冻基因ld4对细胞应激颗粒(Stress granules)形成的影响,从南极鱼Lycodichthys dearborn的多聚AFPⅢ基因ld12 cDNA中克隆得到AFPⅢ蛋白四聚体ld4,将其转染到HeLa细胞中,并采用反转录PCR(RT-PCR)、Western blot方法检测到目的基因ld4在细胞中成功表达,进而采用细胞免疫荧光方法检测细胞在低温(10℃)胁迫下细胞应激颗粒的形成情况。结果表明,与对照组相比较,在低温胁迫下,表达ld4基因的HeLa细胞中应激颗粒明显减少。研究表明,ld4基因的表达在低温胁迫下能显著降低HeLa细胞中应激颗粒的形成,试验结果可为ld4基因作为鱼类耐寒育种的候选基因提供理论依据。
关键词:低温胁迫;ld4基因;应激颗粒
在地球的演化过程中,南极海洋环境的骤然巨变使生活在其中的鱼类受到外界环境的胁迫,逐渐进化出能够适应这种极地环境的机制。近些年,被研究较多的是一类能够抑制南极鱼体内冰晶形成的抗冻蛋白(Antifreeze protein,AFP)家族[1-2]。AFP家族蛋白是一类功能相似、结构各异的蛋白统称,其中包括抗冻糖蛋白(AFGPs)、Ⅰ型抗冻蛋白(AFPⅠ)、Ⅱ型抗冻蛋白(AFPⅡ)、Ⅲ型抗冻蛋白(AFPⅢ)和Ⅳ型抗冻蛋白(AFPⅣ)[3]。AFGPs结构上含有三肽糖单位,其功能与这些糖基的化学修饰(乙酰化和过氧化等)有关[4]。AFPⅠ到AFPⅣ的结构与AFGPs差异较大,主要由Ala、Cys、Glu和多肽重复单元结构参与调控[5]。研究发现,生存在南极的eel pout(Lycodichthys dearborn)体内AFPⅢ含量比较高,为了寻找新的AFPⅢ基因,本实验室构建了L.dearborni肝脏cDNA文库。通过文库筛选,发现一个2.87 kbp的cDNA克隆ld12[6],并进一步克隆得到了具有抗冻功能的AFPⅢ蛋白四聚体ld4基因。
应激颗粒(Stress granules)是生物体受到热休克、氧化性应激、局部缺血或者病毒感染等外界环境压力时,体内细胞产生的一种保护机制,其主要由40s核糖体亚基、翻译起始因子、mRNA,以及一些RNA结合蛋白(TIA-1、G3BP)和信号分子SRP等组成。细胞应激颗粒的形成包括依赖于eIF-2α和不依赖于eIF-2α两种机制:依赖于eIF-2α的机制主要受双链RNA依赖性激酶(PKR)、GCN2、血红素调控抑制激酶(HRI)和PKR样内质网激酶(PERK)等介导,在病毒感染、饥饿、热激和蛋白质错误折叠等压力下,通过磷酸化eIF-2α51位Ser残基,阻碍了三元前起始复合物eIF2 -GTP-tRNAMet的活化,导致翻译起始终止[7-9],最终在一系列翻译因子的结合下,形成应激颗粒复合体[10];不依赖于eIF-2α磷酸化途径,则直接由翻译因子eIF-4A、eIF-4G失活诱导产生[11],一旦压力撤去,应激颗粒分解释放出翻译元件重新用于蛋白翻译[12]或将mRNA呈递给处理体(Processing body,PB)进行降解[13]。
应激颗粒是生物体遭受不利环境时细胞产生的一种自我保护机制,之前对其研究主要集中在组分、功能和涉及的信号调控通路方面[14-16]。近年来,在抗病毒、抗氧化等方面对细胞应激颗粒功能进行了详细的研究[16]。近期也有研究发现,低温刺激可使细胞形成应激颗粒[17],但有关抗冻基因功能和应激颗粒形成对生物体处于低温环境方面影响的研究尚未见报道。因此,基于实验室前期对抗冻基因方面的研究[18],本试验中进一步研究低温胁迫下抗冻基因ld4对细胞应激颗粒形成的影响,旨在为抗冻蛋白AFPⅢ家族作为外源性蛋白应用于抗寒耐低温时对生物体自身保护机制的影响提供参考,同时为鱼类耐寒育种提供理论依据。
1.1 材料
试验用Taq酶、DNA连接酶、DL2000 DNA Marker、DL10000 DNA Marker、反转录试剂盒等均购自TaKaRa公司;限制性内切酶EcoRⅠ和BamHⅠ购自NEB公司;胶回收和质粒小提试剂盒均购自OMEGA Bio-Tek公司;一抗G3BP1购自Santa cruz公司;倒置荧光显微镜购自Carl Zeiss Jena公司;高温细胞培养箱(Galaxy170S)、低温细胞培养箱(Galaxy170R)均购自Eppendrof公司;培养基DMEM,含有青霉素(10 000 IU)和链霉素(10 000μg/mL)的混合液-双抗、胰蛋白酶购自Hyclone公司;胎牛血清购自Gibco公司;Turbo-Fect购自Thermo公司;其他常规试剂均购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 重组质粒的酶切验证 将Tol2-actin-2AEGFP空载体和Tol2-actin-ld4-2A-EGFP重组质粒分别进行双酶切。酶切体系(共50μL):DNA 1 μg,EcoRⅠ1μL,BamHⅠ1μL,10×cut smartbuffer 5μL,用ddH2O补至50μL,37℃下酶切2 h,对酶切产物用10 g/L琼脂糖凝胶进行电泳,验证其条带大小。
1.2.2 HeLa细胞的培养 将冻存的HeLa细胞从液氮中取出,于37℃水浴中解冻,然后在离心机中以1000 r/min离心7 min,弃冻存液,迅速向冻存管中加入1 mL 37℃完全培养基(89%DMEM+ 10%FBS+1%P.S双抗),并用移液器轻轻吹散细胞,将吹散的细胞连同培养基一起转移到直径为100 mm的细胞培养皿中,并且再向培养皿中加入7 mL完全培养基,然后将培养皿置于37℃、5% CO2的高温培养箱中培养。
1.2.3 质粒转染试验 转染前将4×105cells HeLa细胞接种于培养皿(直径为60 mm)中,培养24~48 h,待细胞汇合度达到70%~80%后,用无血清的DMEM培养基稀释4μg质粒至400μL,混匀后加入7μL TurboFect,室温下静置20 min,分别加入到细胞密度适中的培养皿(直径为60 mm)中,轻轻晃动使转染混合液均匀分布,再置于高温培养箱(37℃)中培养24 h,之后去培养基,用DPBS洗2次,然后加入新鲜的培养基继续培养。
1.2.4 转染HeLa细胞后基因转录水平以及蛋白水平成功表达的鉴定 用DPBS清洗在37℃下培养3 d的细胞,用Trizol法提取RNA,然后严格按照反转录试剂盒说明书进行反转录。利用反转录后的cDNA作为模板,进行PCR扩增。反应体系(共20μL):模板1μL,Forward引物1μL,Reverae引物1μL,dNTP 2μL,10×reaction buffer 2μL,Taq enzyme 0.2μL,ddH2O 12.8μL。反应条件为:95℃下预变性5 min;95℃下变性10 s,57℃下退火5 s,72℃下延伸1 min,共进行34个循环;在72℃下再延伸10 min。最后将PCR产物用10 g/L琼脂糖凝胶进行电泳分析及测序验证。
当细胞数目达到(0.7~1.1)×106cells时,移除培养基,并用PBS清洗细胞2次,然后加入400 μL的细胞裂解液(50 mmol/L Tris-HCl,pH 7.4,150 mmol/L NaCl,1 mmol/L EDTA,1%Triton X-100,1 mmol/L PMSF),冰上裂解15 min,收集裂解液并用预冷的离心机以12 000 r/min离心10 min,吸取上清到一个新的EP管中,使用Nano-Drop 2000C(Thermo Scientific)测定提取的总蛋白浓度,并于-80℃下保存蛋白。取含总蛋白质量相同的野生型、转空载和转ld4基因的HeLa细胞总蛋白提取液,加入蛋白电泳加样缓冲液(TaKa-Ra),在沸水中煮10 min,然后在12%SDS-PAGE胶中进行电泳,转膜后用GFP(santa cruz)和LD4抗体分别检测GFP和LD4的表达。
1.2.5 低温胁迫策略及细胞免疫荧光试验 以转染Tol2-actin-ld4-2A-EGFP重组质粒的细胞作为试验组细胞,以转染Tol2-actin-2A-EGFP空载体的细胞与野生型细胞作为对照组细胞。将试验组细胞及对照组细胞分别在低温培养箱(10℃)中处理10 h,然后将其分别去培养基,用DPBS洗2次,加1 mL 4%的多聚甲醛固定(冰浴)10 min;用PBS洗2次,加-20℃的甲醇透化10 min;用PBS洗3次,用2%的BSA(PBS配)封闭1 h,一抗孵育2 h;用PBS洗3次,每次5min,二抗避光孵育1 h;用PBS洗3次,每次5min,最后加抗猝灭剂避光封片30 min,在显微镜下观察并拍片。
2.1 ld4基因的克隆
本实验室从南极鱼Lycodichthys dearborn的多聚AFPⅢ基因ld12 cDNA中克隆得到AFPⅢ蛋白四聚体ld4基因,经测序表明,该基因编码区片段全长为888 bp,其基因序列和蛋白质序列见图1。

图1 ld4基因编码区序列和蛋白质序列
Fig.1 Coding sequence and protein sequence of ld4 gene
2.2 ld4真核表达重组质粒的酶切验证与结构分析
从实验室获得的ld4真核表达载体Tol2-actinld4-2A-EGFP结构图见图2。为了验证ld4基因编码区888 bp核苷酸序列是否插入到Tol2-actin-2A-EGFP载体上,分别对Tol2-actin-ld4-2A-EGFP重组质粒和Tol2-actin-2A-EGFP空载体用EcoRⅠ和BamHⅠ限制性内切酶进行双酶切。酶切产物经10 g/L琼脂糖凝胶电泳检测,可见质粒变成线性条带,重组质粒被切开成2条带,一条大小为888 bp,另一条为7287 bp;而空载体只有一条可见带,大小为7287 bp(图3)。结果表明,ld4基因片段成功插入到Tol2-actin-2A-EGFP载体上,形成重组质粒,可进行下一步的转染试验。
2.3 转染HeLa细胞后基因转录水平与蛋白水平
表达的鉴定
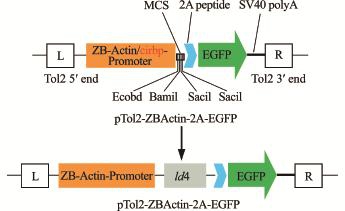
图2 Tol2-actin-ld4-2A-EGFP示意图
Fig.2 Structure of Tol2-actin-ld4-2A-EGFP
将重组质粒与空载质粒转入HeLa细胞中,通过荧光显微镜观察有绿色荧光(图4-A),说明质粒成功转入HeLa细胞中。为了验证重组质粒在HeLa细胞中的转录表达,本试验中分别对试验组和对照组HeLa细胞的RNA进行了反转录PCR。转染了Tol2-actin-ld4-2A-EGFP重组质粒的HeLa细胞作为试验组细胞,转染了Tol2-actin-2A-EGFP空载体的HeLa细胞和野生型的HeLa细胞作为对照组细胞。PCR产物经琼脂糖凝胶电泳检测,试验组的PCR产物大小为888 bp(由于ld4基因有4个相同的结构域,所以会有几条条带出现),而对照组没有条带出现(图4-B)。与此同时,本试验中分别对试验组和对照组细胞收取蛋白,并对其进行蛋白水平的检测,试验组分别检测到GFP和LD4蛋白,而对照组中转空载的细胞检测到GFP蛋白,而野生型细胞既没有检测到GFP蛋白也没有检测到LD4蛋白(图4-C)。结果表明,ld4基因在HeLa细胞中成功地进行了转录与表达,可进行下一步的低温胁迫与细胞应激颗粒检测试验。
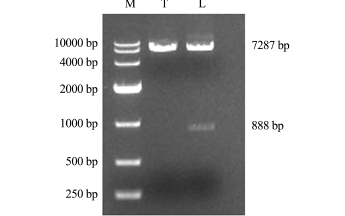
图3 2个质粒双酶切结果
Fig.3 Restriction enzyme digestion of pTol2-actin-2 A-EGFP and pTol2-actin-ld4-2A-EGFP
注:M为DL10000 DNA Marker;T为双酶切后(pTol2-actin-2A-EGFP)质粒;L为双酶切后(pTol2-actin-ld4-2A-EGFP)质粒
Note:M,DL10000 DNAMarker;T,pTol2-actin-2A-EGFP;L,pTol2-actin-ld4-2A-EGFP plasmid cuting by double enzymes
2.4 细胞免疫荧光检测应激颗粒的形成
为了检测低温胁迫下细胞中应激颗粒形成的情况,首先对试验组与对照组细胞进行10℃低温处理10 h,然后用G3BP1(应激颗粒的标志物)对处理的细胞进行细胞免疫荧光试验。结果显示,在37℃正常培养条件下,野生型对照组的HeLa细胞没有应激颗粒形成,与37℃正常培养的细胞相比,10℃低温处理10 h的野生型和空载对照组HeLa细胞有明显的应激颗粒形成。但十分有趣的是,与10℃低温处理10 h的野生型和空载对照组HeLa细胞相比,试验组HeLa细胞中的应激颗粒明显降低(图5)。结果表明,在低温胁迫下,ld4基因的表达能显著降低HeLa细胞中应激颗粒的形成。
南极海域是世界上最冷的海域,由于南极环流的隔离,水温终年为-1.9℃,这与北极海域的季节变化形成对比[19]。冰冻的南极海洋环境使能够面临挑战的鱼类进化出了适应寒冷的机制。北极海域的Lycodes polaris、南极海域的Pachycara brachycephalum和Lychodyichthys dearborni鱼类都能合成Ⅲ型抗冻蛋白(AFPⅢ)[20-23]。研究证实,AFPⅢ的抗冻活性与分子量有一种正相关关系。Baardsnes等[24]发现,在L.dearborni体内自然存在的相对分子质量为14 000的AFPⅢ抗冻活性几乎是相对分子质量为7000蛋白的两倍;ld4分子是南极鱼Lycodichthys dearborni的多聚AFPⅢ基因ld12 cDNA中克隆得到的AFPⅢ蛋白四聚体。研究表明,将ld4基因转入到烟草叶片中,可以增强植物的抗寒功能[25]。目前,对AFP的功能研究主要集中在结构构象改变抑制冰晶生长方面,但对其在生物体内具体参与的信号通路及其生物学功能相关的研究尚不清楚。故笔者基于生物学功能方面的相似性,通过细胞应激颗粒这种自身的保护机制作为切入点,探讨类似于ld4这种特异性功能基因与细胞自我保护机制——应激颗粒形成之间的关系。
应激颗粒是生物体遭受不利环境时细胞产生的一种保护机制,其研究主要集中在组分、抗病毒、抗氧化等功能调控方面。近期有研究发现,低温刺激下可使细胞形成应激颗粒[17],但是涉及抗冻基因功能和细胞应激颗粒形成对生物体处于低温环境方面的研究一直还是空白。本研究结果表明,在低温胁迫下,表达ld4基因的HeLa细胞的应激颗粒明显减少,这说明ld4基因的表达在低温胁迫下能显著降低HeLa细胞中应激颗粒的形成。结果显示,ld4基因的导入,提高了细胞Stress Granules形成的阈值。换言之,ld4基因的导入有可能提高了细胞的耐低温性能,从而使细胞在低温下不易形成应激颗粒,这对于耐寒鱼类筛选育种具有非常重要的应用价值。此外,ld4是通过什么途径影响应激颗粒的形成,参与Stress Granules哪一方面的功能,目前尚不清楚,可能与应激颗粒的磷酸化形成途径及细胞抗凋亡相关,这方面的研究将是后续需要解决的问题。
综上所述,本研究中首次通过在HeLa细胞中表达ld4基因,进一步通过免疫荧光发现,ld4的导入可以降低低温胁迫下细胞应激颗粒的形成,说明ld4对细胞的保护功能与应激颗粒相关。以上研究结果为ld4基因成为提高生物体耐寒能力的功能基因提供了一定的理论依据。
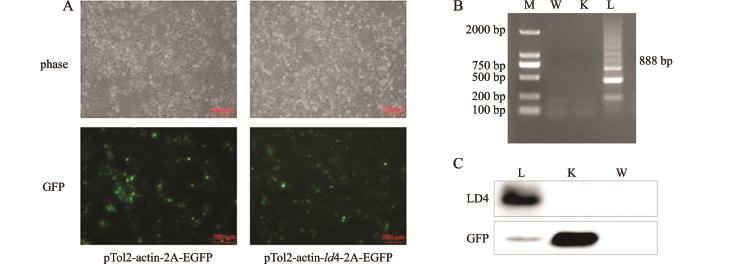
图4 LD4蛋白的表达与检测
Fig.4 Expression and detection of LD4 in HeLa cell line
注:A为真核表达载体在HeLa细胞系中的表达,其中phase为正常光视野,GFP为绿色荧光视野,放大倍数为100倍;B为HeLa细胞中过表达ld4基因转录结果,M为DL2000 DNA Marker,W为野生型对照组样品,K为空载对照组样品,L为试验组样品;C为HeLa细胞系中表达GFP和LD4蛋白的Western blot检测,泳道L为LD4的表达,泳道K为空载对照组(pTol2-actin-2A-EGFP),泳道W为阴性野生型对照(HeLa-WT)
Note:A,the expression ofeukaryotic expression vector in HeLa cell,the phase in the normalvision,and GFP,thegreen fluorescentvision withmagnification of100×;B,the expression of ld4 gene in HeLa cell line:M,DL2000 DNA Marker;W,control group ofwild type;K,control group of empty vector;L,experimental group;C,Western blot detection of GFP and LD4 protein:lane L,expression of LD4;lane K and W representing control group of empty vector(pTol2-actin-2A-EGFP)and control group ofwild type(HeLa-WT),respectively
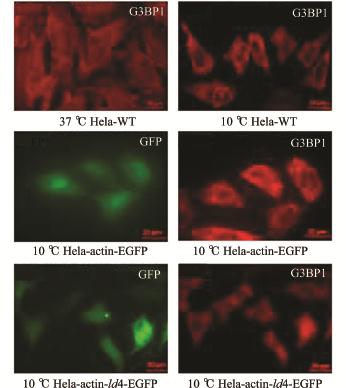
图5 ld4基因的表达能显著降低HeLa细胞中应激颗粒的形成
Fig.5 Expression of ld4 gene leads to reduce the formation of stress granules
参考文献:
[1] DeVries A L.Role of glycopeptide and peptide antifreezes in inhibition of ice crystal growth and recrystallization[D].Stanford:Stanford University,1968.
[2] DeVries A L,Lin Yuan.Structure of a peptide antifreeze andmechanism of adsorption to ice[J].Biochimica et Biophysica Acta(BBA)-Protein Structure,1977,495(2):388-392.
[3] 钟其旺,樊廷俊.鱼类抗冻蛋白的研究进展[J].生物化学与生物物理学报,2002,34(2):124-130.
[4] 田云,卢向阳,张海文.抗冻蛋白研究进展[J].中国生物工程杂志,2002,22(6):48-53.
[5] Zhang Junfang,Deng Cheng,Wang Jianshe,etal.Identification of a two-domain antifreeze protein gene in Antarctic eelpout Lycodichthys dearborni[J].Polar Biology,2009,32(1):35-40.
[6] 於静,Cheng C H,DeVries A L,等.南极eel pout(Lycodichthys dearborni)多聚体Ⅲ型抗冻蛋白基因的克隆及进化分析[J].遗传学报,2005,32(8):789-794.
[7] Montero H,Trujillo-Alonso V.Stress granules in the viral replication cycle[J].Viruses,2011,3(11):2328-2338.
[8] Emara M M,Brinton M A.Interaction of TIA-1/TIAR with West Nile and dengue virus products in infected cells interferes with stress granule formation and processing body assembly[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(21):9041-9046.
[9] Montero H,Rojas M,Arias C F,et al.Rotavirus infection induces the phosphorylation of eIF2αbut prevents the formation of stress granules[J].Journal of Virology,2008,82(3):1496-1504.
[10] LindquistM E,Lifland AW,Utley T J,etal.Respiratory syncytial virus induces host RNA stress granules to facilitate viral replication[J].Journal of Virology,2010,84(23):12274-12284.
[11] Anderson P,Kedersha N.Stress granules:the Tao of RNA triage[J].Trends Biochemical Sciences,2008,33(3):141-150.
[12] Qin Qingsong,Hastings C,Miller C L.Mammalian orthoreovirus particles induce and are recruited into stress granules at early times postinfection[J].Journal of Virology,2009,83(21):11090-11101.
[13] Schütz S,Sarnow P.How viruses avoid stress[J].Cell Host&Microbe,2007,2(5):284-285.
[14] Solomon S,Xu Yaoxian,Wang Bin,et al.Distinct structural features of caprin-1 mediate its interaction with G3BP-1 and its induction of phosphorylation of eukaryotic translation initiation factor 2α,entry to cytoplasmic stress granules,and selective interaction with a subsetofmRNAs[J].Molecular and Cellular Biology,2007,27(6):2324-2342.
[15] TakahashiM,HiguchiM,MatsukiH,etal.Stress granules inhibit apoptosis by reducing reactive oxygen species production[J].Molecular and Cellular Biology,2013,33(4):815-829.
[16] Zhang Peifen,Li Yuye,Xia Jun,et al.IPS-1 plays an essential role in dsRNA-induced stress granule formation by interacting with PKR and promoting its activation[J].Journal of Cell Science,2014,127(11):2471-2482.
[17] Hofmann S,Cherkasova V,Bankhead P,et al.Translation suppression promotes stress granule formation and cell survival in response to cold shock[J].Molecular Biology of the Cell,2012,23(19):3786-3800.
[18] 马战领,胡瑞芹,黄巧,等.齐口裂腹鱼Zona pellucida 3的克隆表达及其蛋白活性研究[J].大连海洋大学学报,2015,30(6):592-597.
[19] Shackleton N J,Opdyke N D.Oxygen isotope and palaeomagnetic evidence for early northern hemisphere glaciation[J].Nature,1977,270(5634):216-219.
[20] Sönnichsen F D,DeLuca C I,Davies P L,et al.Refined solution structure of typeⅢantifreeze protein:hydrophobic groupsmay be involved in the energetics of the protein-ice interaction[J]. Structure,1996,4(11):1325-1337.
[21] Cheng C H,DeVries A L.Structures of antifreeze peptides from the Antarctic eel pout,Austrolycicthys brachycephalus[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1989,997(1-2):55-64.
[22] Wang Xin,DeVries A L,Chen C H.Genomic basis for antifreeze peptide heterogeneity and abundance in an Antarctic eel pout:gene structures and organization[J].Molecular Marine Biology and Biotechnology,1995,4(2):135-147.
[23] Wang Xin,DeVries A L,Chen C H.Antifreeze peptide heterogeneity in an Antarctic eel pout includes an unusually large major variant comprised of two 7 kDa typeⅢAFPs linked in tandem[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1995,1247(2):163-172.
[24] Baardsnes J,Kuiper M J,Davies P L.Antifreeze protein dimer:when two ice-binding facesare better than one[J].Journal of Biological Chemistry,2003,278(40):38942-38947.
[25] Yang Na,Peng Changlian,Cheng Deng,et al.The over-expression of calmodulin from Antarctic notothenioid fish increases cold tolerance in tobacco[J].Gene,2013,521(1):32-37.
Effects of antifreeze gene ld4 on stress granule formation in cells exposed to cold stress
Abstract:An AFPⅢtetramer gene ld4 from Antarctic eelpout Lycodichthys dearborni was transfected into HeLa cell(human cervical cancer cell)to investigate the relationship between antifreeze gene ld4 and cell stress granule formation in response to cold stress.Reverse Transcription PCR(RT-PCR)and Western blotwere applied to verify the ld4 gene expression in mRNA and protein levels in ld4 transfected HeLa cell.Further,cellular stress granules formation was detected under cold stress(10℃)and compared with that in the control cell by immunofluorescence.There was significant decrease in the stress granules formation in ld4 transfected HeLa cell under the cold stress than in the control,indicating that ld4 may enhance cellular cold resistance by reducing the formation of cellular stress granules.The findings provide amechanism for ld4 gene as a candidate gene in breeding of cold resistant fishes.
Key words:cold stress;ld4 gene;stress granule
中图分类号:Q291
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.05.009
文章编号:2095-1388(2016)05-0522-06
收稿日期:2016-01-07
基金项目:国家自然科学基金面上项目(31572611);上海高校水产高峰学科建设项目