
图1 海七鳃鳗pma-m iR-200c-3p序列与斑马鱼、人类、大鼠和小鼠m iR-200c-3p序列的保守性分析
Fig.1 Sequence conservation analysis ofm iR-200c-3p among sea lam prey,zebrafish,human,rat and m ouse
摘要:为研究海七鳃鳗Petromyzon marinus pma-miR-200c-3p在心脏发育过程中的生物学功能,采用显微注射技术,将pma-miR-200c-3p模拟体注射到斑马鱼Danio rerio胚胎,过表达pma-miR-200c-3p后,使用qRT-PCR及Western blot法检测了一些与心脏发育相关的标志性基因的表达水平,以及BMP/Smad通路重要基因蛋白水平的变化,并利用生物信息学预测、GFP荧光表达分析了pma-miR-200c-3p的生物学作用。结果表明:过表达pma-miR-200c-3p的斑马鱼胚胎中,与心脏发育相关的标志性bmp4、bmp5、smad1、gata5、tbx2b和notch1a基因的表达水平极显著上调(P<0.01),同时BMP/Smad通路中BMP4、Smad1、GATA5蛋白表达水平也明显升高;细胞试验表明,cdx1b基因可能是pma-miR-200c-3p的一个靶基因。研究表明,pma-miR-200c-3p可能通过抑制cdx1b基因的表达,参与BMP/Smad通路以促进心脏发育。
关键词:海七鳃鳗;miR-200c-3p;斑马鱼;心脏发育;cdx1b
心脏作为胚胎发育过程中最早形成的器官之一,为其他器官的发育和生长提供氧气和营养,并参与机体的生命活动[1]。心脏的形成是一个复杂的动态过程,首先,心脏由形状、大小一致的心肌细胞组装成线性管状结构,接着线性管状结构发生环化,心肌细胞增大、延伸、细胞迁移[2],心室、心房膨大,最终形成成熟的器官[3]。心脏的发育受到多种特异转录因子和信号通路的精确调控,微小的失调都可能造成先天性心脏缺陷,甚至导致胚胎死亡[3]。心管的形成需要GATA家族(GATA4、GATA5和GATA6)特异性转录因子的参与[4],如BMP4参与了心脏环化和不对称发育[5]。同时,心脏的发育也需要BMP/Smad[6]、Wnt[7]、Notch[8]等通路的调控;这些通路上的基因与特异性转录因子结合,形成复杂的基因调控网络并相互作用。近期研究表明,越来越多的基因会参与心脏的发育。Lengerke等[9]发现,在小鼠分化的胚胎干细胞(ESC)中,cdx1和cdx4基因的过表达会严重抑制心脏发育;Chu等[10]发现,低剂量的cdx1能够诱导心外膜细胞的转移和分化。此外,近年来microRNA对心脏发育的调节也受到广泛关注。
microRNA是一类21~25nt相对保守的非编码RNA[11],在转录后水平上调控基因的表达。microRNA参与了不同的生命活动,调控着众多基因的表达。至今已发现许多microRNA,其对应的靶基因及生物学功能已被广泛研究。在心脏中,一些microRNA通过调控离子通道[12]、心肌肥大[13-16],参与心肌纤维化[17]等来调控心脏的发育。miR-200c属于miR-200家族的成员之一,研究发现,miR-200c-3p在卵巢癌[18]、宫颈癌[19]、肺癌[20]等癌细胞中高表达;此外,miR-200c通过靶向抑制CDH1、ZEB1的表达,从而抑制上皮细胞向间充质细胞转化(EMT)[21];而miR-200c在心脏方面的作用研究尚未见报道。
七鳃鳗Lampetra japonica隶属于圆口纲Cyclostomata、七鳃鳗目Petromyzoniformes、七鳃鳗科Petromy-zonida[22],是目前已知最古老的脊椎动物中唯一的幸存者,是脊椎动物发育生物学研究的重要模式生物[23]。海七鳃鳗Petromyzon marinus是被用于研究最多的一种七鳃鳗。本研究前期工作中,通过高通量小分子RNA测序发现,海七鳃鳗pmamiR-200c-3p在胚胎心脏中表达量上调,推测其可能参与了心脏的发育。为研究海七鳃鳗pmamiR-200c-3p在心脏发育中的功能,本研究中比较了miR-200c-3p在不同物种中的种子序列,发现其在物种进化中非常保守,因此,以斑马鱼为研究对象,注射pma-miR-200c-3p模拟体(mimics)使之过表达,检测其与心脏发育相关的标志性基因及BMP/Smad通路中重要基因蛋白的表达,并通过细胞试验,验证了斑马鱼的cdx1b可能是pma-miR-200c-3p的一个靶基因,研究结果初步揭示了pma-miR-200c-3p对斑马鱼心脏发育的影响。
1.1 材料
试验用主要仪器和试剂有Roche LightCycler480Ⅱ型实时荧光定量PCR仪(Roche480);pmamiR-200c-3p mimics和标准NC(Negative control,NC)(上海吉玛基因);PMD-18-T载体、PCR rTaq酶、T4连接酶(TaKaRa);胶回收试剂盒(OMEGA);HindⅢ和SacⅡ限制性内切酶(NEB);质粒抽提试剂盒(生工生物工程上海股份有限公司,以下简称生工);去内毒素质粒抽提试剂盒(GeneMark);组织蛋白裂解液(生工);真核表达载体EGFP-C2(本实验室自有);Prime-ScriptTM RT reagent Kit(TaKaRa);GFP一抗(兔抗,GenTex)、BMP4一抗(兔抗,GenTex)、Smad1/5/9一抗(兔抗,Abcam)、GATA5一抗(兔抗,LSBio)、HRP标记的二抗(羊抗兔,Cell Signaling)、Actin一抗(兔抗,生工);DMEM-高糖培养基(Hyclone)、胎牛血清(Gibco)、转染试剂(QIAGEN)。
1.2 方法
1.2.1 pma-miR-200c-3p保守性分析 从miRBase网站上(http://www.mirbase.org/)找到斑马鱼、大鼠、人类和小鼠的miR-200c-3p序列,与pma-miR-200c-3p的序列进行比对分析。
1.2.2 microRNA mimics显微注射 pma-miR-200c-3p mimics合成序列为UAACACUGUCUGGUAAUGAUGUU,标准NC(作为阴性对照)序列为UUCUUCGAACGUGUCACGUTT。将pma-miR-200c-3p以及NC的浓度配制成10μmol/L,分别注射到Ⅰ细胞期斑马鱼的动物极中,每个胚胎注射1 nL左右,对照组和试验组分别注射200枚胚胎。注射后的斑马鱼胚胎置于纯净水中培养72 h,统计斑马鱼胚胎的死亡率以及心脏增大的胚胎数。
1.2.3 定量qRT-PCR 将浓度为10μmol/L的pma-miR-200c-3p和NC分别注射到Ⅰ细胞期的斑马鱼胚胎中,每个胚胎注射1 nL,受精后72 h后收集胚胎(试验组和对照组WT、NC分别取60枚胚胎),用Trizol提取RNA,反转录成cDNA后,进行定量qRT-PCR,反应结束后进行溶解曲线分析以及计算不同样品的2-△△Ct值,用SPSS 13.0软件进行One-Way ANOVA分析,比较注射pmamiR-200c-3p和对照组WT、NC斑马鱼胚胎中与心脏发育相关的标志性基因bmp4、bmp5、smad1、gata5、tbx2b和notch1a的表达水平,同时检测cdx1b的表达水平。以β-actin作为内参基因。
1.2.4 Western blot检测 将浓度为10μmol/L的pma-miR-200c-3p和NC分别注射到Ⅰ细胞期的斑马鱼胚胎中,每个胚胎注射1 nL,受精后72 h收集胚胎,试验组和对照组(WT、NC)分别取40枚胚胎,用1×PBS洗3次,加入组织蛋白裂解液A和B液(100∶1),充分裂解后,加入巯基乙醇和Loading buffer,沸水中煮10 min,使之变性。取150μg蛋白进行10%SDS-PAGE蛋白胶电泳,用孔径为0.45μm的PVDF膜(Millipore)在250 mA下转膜1 h。封闭后,分别用一抗BMP4、Smad1/5/9、GATA5(1∶1000)和Actin(1∶2000)孵育过夜,用PBST洗涤3次,每次5 min,再用二抗孵育(1∶2000),室温下静置1 h。用PBST洗涤,加入显影液,使用化学发光成像仪成像,并用Western blot法检测这些蛋白的表达水平。
1.2.5 miR-200c-3p靶基因的预测 通过microRNA的靶基因预测软件TargetScan(http:// www.targetscan.org/)、Microcosm Targets(http:// www.ebi.ac.uk/enright-srv/microcosm/cgi-bin/targets/v5/search.pl)等来预测pma-miR-200c-3p的靶基因,其中斑马鱼的cdx1b是其靶基因之一。
1.2.6 靶基因cdx1b的验证 从受精后72 h斑马鱼胚胎的cDNA中扩增出斑马鱼cdx1b的一段3′-UTR序列。将扩增的片段克隆到pMD18-T载体上,用HindⅢ和SacⅡ酶双酶切后将目的片段连接到pEGFP-C2真核表达载体中,用去内毒素质粒抽提试剂盒提取阳性质粒。
用Attractene转染试剂将EGFP-C2和NC、pma-miR-200c-3p分别共转染293T细胞,NC和miR-200c-3p转染终浓度均为10μmol/L。293T细胞转染后24 h,用PBS洗3次,加入组织蛋白裂解液充分裂解后,利用Western blot法检测GFP(1∶5000)和Actin(1∶2000)蛋白的表达水平。
2.1 m iR-200c-3p在不同物种中的保守性分析
在miRBase数据库中发现,斑马鱼、人类、大鼠和小鼠这4个物种的种子序列一致,而七鳃鳗pma-miR-200c-3p的种子序列与以上物种相比,只有第4位一个碱基的差异(图1)。但是碱基C和U都是嘧啶,与碱基G都能够互补配对。并且,对于成熟的miR-200c-3p序列来说,这5个物种的序列差异很小。因此,就进化而言,miR-200c-3p在七鳃鳗以及这4个物种中是保守的。这为以斑马鱼为生物模型来研究pma-miR-200c-3p对心脏发育的影响提供了有效的理论依据。

图1 海七鳃鳗pma-m iR-200c-3p序列与斑马鱼、人类、大鼠和小鼠m iR-200c-3p序列的保守性分析
Fig.1 Sequence conservation analysis ofm iR-200c-3p among sea lam prey,zebrafish,human,rat and m ouse
2.2 斑马鱼胚胎心脏增大及存活率统计
显微注射后,将胚胎培养到受精后72 h,此时的胚胎正好处于脱膜阶段,且色斑较少,便于观察心脏的发育情况,故选择72 h的胚胎进行观察并统计。根据死亡率以及心脏畸形表型的统计(图2),发现注射pma-miR-200c-3p的胚胎死亡率较高,且心脏增大这种表型的胚胎占20%左右。因此,就斑马鱼心脏表型而言,pma-miR-200c-3p可能影响斑马鱼心脏的发育。
2.3 pma-m iR-200c-3p对心脏发育过程中一些
标志性基因的影响
在心脏发育过程中,需要许多重要的转录因子和信号通路参与其调控过程。qRT-PCR结果表明,与对照组WT和NC胚胎相比,过表达pma-miR-200c-3p的斑马鱼胚胎中bmp4/5、smad1、tbx2b和notch1a基因的表达水平发生了极其显著上升(P<0.001),gata5基因表达量也发生了极显著提高(P<0.01)(图3)。可见,过表达pma-miR-200c-3p能够显著提高心脏中一些标志性基因的表达水平,这表明pma-miR-200c-3p能够促进心脏的发育。
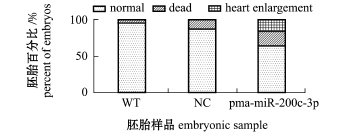
图2 斑马鱼心脏增大及存活率统计
Fig.2 Percent of heart enlargement and survival rate in zebrafish
注:WT为野生型斑马鱼胚胎;NC为注射阴性对照寡核苷酸的斑马鱼胚胎;pma-miR-200c-3p为注射了pmamiR-200c-3p mimics的斑马鱼胚胎;normal为心脏正常的胚胎;dead为死亡的胚胎;heart enlargement为心脏增大的斑马鱼胚胎,下同
Note:WT,wild type of zebrafish embryos;NC,the embryos injected by oligonucleotides in negative control;pma-miR-200c-3p,the embryos injected by pmamiR-200c-3pmimics;normal,embryoswith normal heart;dead,embryos died;heart enlargement,cardiac enlargement of embryos,et sequentia
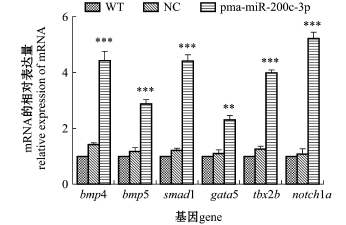
图3 与心脏发育相关的标志性基因的表达量变化
Fig.3 Changes in expression of severalmarker genes related to heart developm ent
注:**表示与WT和NC对照组有极显著性差异(P<0.01);***表示与WT和NC对照组有极其显著性差异(P<0.001),下同
Note:**means significant difference compared with the WT and NC(P<0.01);***means very significant difference compared with theWT and NC(P<0.001),et sequentia
2.4 pma-m iR-200c-3p对BMP/Smad1通路的影响
从qRT-PCR结果中发现,过表达pma-miR-200c-3p后,BMP4、Smad1和GATA5蛋白的表达量上升,而这3个转录因子是BMP/Smad信号通路中的重要组成,正常的心脏发育过程受到BMP/ Smad通路的调控。为了验证这3种转录因子在蛋白水平上是否发生变化,用Western blot法检测受精后72 h斑马鱼胚胎中BMP4、Smad1和GATA5蛋白的表达水平。与对照组WT和NC胚胎相比,过表达pma-miR-200c-3p的斑马鱼胚胎中,BMP4蛋白表达水平升高;Smad1和GATA5蛋白的表达量也都有一定的上升(图4)。结果表明,pmamiR-200c-3p能够通过促进BMP/Smad1通路中一些基因的表达,进而促进心脏的发育。
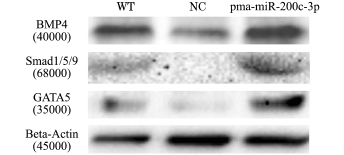
图4 用W estern blot法分析pma-m iR-200c-3p斑马鱼胚胎的BM P/Smad通路
Fig.4 The pma-m iR-200c-3p increases the expression of BM P/Smad pathway in zebrafish embryos detected by W estern blot
2.5 cdx1b可能是pma-m iR-200c-3p的一个靶
基因
本研究中通过TargetScan和Microcosm Targets软件分析发现,cdx1b 3′-UTR的一段序列与pmamiR-200c-3p的种子序列除了第4个位点不能互补外,其他位点完全互补(图5-A)。由此推测,cdx1b可能是pma-miR-200c-3p的一个靶基因。
在体外,将cdx1b 3′-UTR连到pEGFP-C2载体上(图5-B),转染HEK-293T细胞后,发现与NC共转的细胞,荧光强度和只转染EGFP 3′-UTR的WT差异不大,而共转了pma-miR-200c-3p的细胞和NC、WT相比,其荧光强度明显减少(图5-C)。Western blot检测结果显示,EGFP cdx1b 3′-UTR和NC共转的细胞,GFP的表达量与只转染EGFP 3′-UTR细胞的一致,而共转pma-miR-200c-3p的细胞,GFP表达量减少(图5-D)。这说明pma-miR-200c-3p可能与cdx1b 3′-UTR结合,抑制了EGFP的表达。这也提示,cdx1b可能是pma-miR-200c-3p的一个靶基因。同时,qRTPCR结果显示,与WT和NC相比,过表达pmamiR-200c-3p的斑马鱼胚胎中cdx1b表达量极其显著下降(P<0.001)(图5-E),即pma-miR-200c-3p的过表达抑制了斑马鱼cdx1b基因的表达。
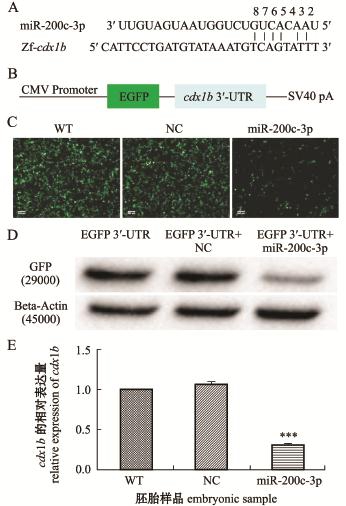
图5 斑马鱼cdx1b可能是pma-m iR-200c-3p的一个靶基因
Fig.5 Zebrafish cdx1b may be a target gene of pmam iR-200c-3p
注:A为pma-miR-200c-3p和cdx1b的结合位点;B为pEGFP-C2-cdx1b 3′-UTR载体的构建;C为转染细胞的荧光比较(标尺500μm);D为用Western blot法检测出的293T细胞中GFP的表达量;E为用qRT-PCR法检测出的斑马鱼胚胎中cdx1b的表达水平
Note:A,the binding site between pma-miR-200c-3p and cdx1b;B,plasmid construction of pEGFP-C2-cdx1b3′-UTR;C,the GFP fluorescence comparison of transfecting 293T cell,bar=500μm;D,Western blot analysiswas performed to quantify the expression of EGFP;E,the relative expression of cdx1b in zebrafish was detected by qRT-PCR
Auman等[2]研究表明,心脏的发育伴随着心肌细胞大小的改变以及形状的变化。本研究中通过在斑马鱼Ⅰ细胞期动物极注射pma-miR-200c-3p mimics,使之过表达,发现斑马鱼的心脏尤其是心房增大,推测pma-miR-200c-3p可能在心脏发育过程中发挥着重要的调控作用。
心脏的发育是一个复杂的过程,受到不同的转录调控因子、心脏特异的转录因子和许多信号通路的调控[5]。已有研究表明,Notch通路可通过参与上皮-间叶细胞转化(EMT)来促进心瓣的形成。notch1a和tbx2b、bmp4分别参与了心内膜的形成以及心肌细胞的分裂分化、心肌细胞的迁移,心脏的发育也离不开bmp5、smad1、gata5等转录因子的参与。因此,本研究中检测了这些心脏相关标志性基因的表达。结果发现,在过表达pma-miR-200c-3p的斑马鱼中,这些基因的表达量都显著上升(图3),说明pma-miR-200c-3p可能参与心脏的发育过程。
Van Wijk等[24]研究表明,BMP4/5、Smad1和GATA5属于BMP/Smad信号通路。在心脏发育过程中,BMP家族及其下游SMAD家族参与心脏祖细胞的分化、增殖等过程。BMP家族通过Ⅰ型和Ⅱ型受体激酶使得Smad1/5/8磷酸化[25],磷酸化的Smad1/5/8和Smad4进入细胞核,促进靶基因Nkx2.5、GATA家族这些靶基因的激活,从而促进心肌祖细胞的分化[26-27]。Lee等[28]研究表明,心脏祖细胞中GATA4/5/6的表达需要BMP-Smad1/4的参与,并且在鸡轴旁中胚层中,发现BMP能够诱导GATA4/5/6的表达。本研究中采用Western blot技术检测了斑马鱼胚胎中BMP4、Smad1和GATA5的表达水平,结果发现,与对照组WT和NC斑马鱼相比,注射了miR-200c-3p斑马鱼的BMP4、Smad1和GATA5表达量明显增加(图4),GATA5是心脏形成以及心脏祖细胞分化的重要转录因子[29]。说明pma-miR-200c-3p可能通过调控BMP/Smad通路来促进心脏的分裂分化。
cdx家族是胚胎形成过程中重要的转录调控因子,参与心脏、肾脏、肠的形成以及造血细胞的分化等[30]。Lengerke等[9]研究表明,在小鼠胚胎干细胞中过表达cdx1会抑制心脏的发育,而在cdx1基因突变的斑马鱼胚胎中,前外侧板中胚层tbx5a的表达量升高,而前外侧板中胚层会发育成心脏祖细胞。本研究中,通过TargetScan、Microcosm Targets等软件预测,发现cdx1b可能是pma-miR-200c-3p的一个靶基因(图5-A)。为验证cdx1b是否为pma-miR-200c-3p的靶基因,本研究中将cdx1b的3′-UTR克隆到pEGFP-C2质粒上,转染293T细胞,结果发现,过表达miR-200c-3p后,293T细胞荧光减少,并且在蛋白水平上检测发现,GFP表达量降低(图5-D)。为进一步验证pmamiR-200c-3p是否能够抑制cdx1b的表达,用qRT-PCR技术检测了斑马鱼中cdx1b在mRNA水平的表达,发现其表达量降低(图5-E)。这表明,pma-miR-200c-3p可能通过抑制cdx1b来促进心脏的发育。
由此推测,海七鳃鳗胚胎中高表达的pmamiR-200c-3p可能通过抑制cdx1b的表达,以及上调BMP通路中某些重要基因的表达来调控心脏的发育。需要指出的是,本试验中对pma-miR-200c-3p的功能研究都是在斑马鱼细胞水平上进行验证的,这可能与pma-miR-200c-3p在海七鳃鳗体内对心脏发生的影响有所差异。后续工作中需尽可能找到海七鳃鳗pma-miR-200c-3p自身的靶基因来研究其调控机制,并且在海七鳃鳗体内验证相关基因的表达功能,从而进一步揭示pma-miR-200c-3p对心脏发育调控的分子机制。
参考文献:
[1] 王家骥,贾竹青,周春燕.microRNA在心脏发育和心脏疾病中的作用[J].中国科学:生命科学,2012,42(12):957-966.
[2] Auman H J,Coleman H,Riley H E,etal.Functionalmodulation of cardiac form through regionally confined cell shape changes[J]. PLoSBiology,2007,5(3):e53.
[3] Männer J.The anatomy of cardiac looping:a step towards the understanding of themorphogenesis of several forms of congenital cardiac malformations[J].Clinical Anatomy,2009,22(1):21-35.
[4] Bruneau B G.Transcriptional regulation of vertebrate cardiac morphogenesis[J].Circulation Research,2002,90(5):509-519.
[5] 龚丁旭,张浩,胡盛寿.心脏发育过程中常见的相关基因与先天性心脏病[J].基础医学与临床,2011,31(2):207-209.
[6] Potts JD,Vincent E B,Runyan R B,et al.Sense and antisense TGFβ3 mRNA levels correlate with cardiac valve induction[J]. Developmental Dynamics,1992,193(4):340-345.
[7] Hurlstone A F L,Haramis A PG,Wienholds E,etal.TheWnt/βcatenin pathway regulates cardiac valve formation[J].Nature,2003,425:633-637.
[8] Timmerman L A,Grego-Bessa J,Raya A,et al.Notch promotes epithelial-mesenchymal transition during cardiac development and oncogenic transformation[J].Genes&Development,2004,18(1):99-115.
[9] Lengerke C,Wingert R,BeeretzM,et al.Interactions between Cdx genes and retinoic acid modulate early cardiogenesis[J].Developmental Biology,2011,354(1):134-142.
[10] Chu Min,Wang Libo,Wang Huan,etal.A novel role of CDX1 in embryonic epicardial development[J].PLoS One,2014,9(7):e103271.
[11] Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[12] Harada M,Luo Xiaobin,Qi Xiaoyan,et al.Transient receptor potential canonical-3 channel-dependent fibroblast regulation inatrial fibrillation[J].Circulation,2012,126(17):2051-2064.
[13] Ikeda S,He Aibin,Kong SW,et al.MicroRNA-1 negatively regulates expression of the hypertrophy-associated calmodulin and Mef2a genes[J].Molecular and Cellular Biology,2009,29(8):2193-2204.
[14] Dong Deli,Chen Chang,Huo Rong,et al.Reciprocal repression between microRNA-133 and calcineurin regulates cardiac hypertrophy:a novel mechanism for progressive cardiac hypertrophy[J].Hypertension,2010,55(4):946-952.
[15] Callis T E,Pandya K,Seok H Y,et al.MicroRNA-208a is a regulator of cardiac hypertrophy and conduction in mice[J].Journal of Clinical Investigation,2009,119(9):2772-2786.
[16] Li Cui,Li Xuelian,Gao Xu,et al.MicroRNA-328 as a regulator of cardiac hypertrophy[J].International Journal of Cardiology,2014,173(2):268-276.
[17] Thum T,Gross G,Fiedler J,et al.MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[J].Nature,2008,456:980-984.
[18] Iorio M V,Visone R,Di Leva G,et al.MicroRNA signatures in human ovarian cancer[J].Cancer Research,2007,67(18):8699-8707.
[19] Lee JW,Choi C H,Choi JJ,et al.Altered MicroRNA expression in cervical carcinomas[J].Clinical Cancer Research,2008,14(9):2535-2542.
[20] Liu Xiaoguang,Zhu Wangyu,Huang Yanyan,et al.High expression of serum miR-21 and tumormiR-200c associated with poor prognosis in patients with lung cancer[J].Medical Oncology,2012,29(2):618-626.
[21] Bracken C P,Gregory P A,Kolesnikoff N,et al.A double-negative feedback loop between ZEB1-SIP1 and themicroRNA-200 family regulates epithelial-mesenchymal transition[J].Cancer Research,2008,68(19):7846-7854.
[22] 孟庆闻.鱼类学[M].上海:上海科学技术出版社,1989:201-297.
[23] 林斌彬,张子平,王艺磊,等.七鳃鳗遗传多样性与演化研究进展[J].动物学杂志,2009,44(1):159-166.
[24] Van Wijk B,Moorman A FM,van den Hoff M JB.Role of bone morphogenetic proteins in cardiac differentiation[J].Cardiovascular Research,2007,74(2):244-255.
[25] MassaguéJ,Seoane J,Wotton D.Smad transcription factors[J]. Genes&Development,2005,19(23):2783-2810.
[26] Brown CO III,Chi Xuan,Garcia-Gras E,et al.The cardiac determination factor,Nkx2-5,is activated by mutual cofactors GATA-4 and Smad1/4 via a novel upstream enhancer[J].The Journal of Biological Chemistry,2004,279(11):10659-10669.
[27] Mishina Y.Function of bonemorphogenetic protein signaling duringmouse development[J].Frontiers in Bioscience,2003,8(1-3):d855-d869.
[28] Lee K H,Evans S,Ruan T Y,et al.SMAD-mediated modulation of YY1 activity regulates the BMP response and cardiac-specific expression of a GATA4/5/6-dependent chick Nkx2.5 enhancer[J].Development,2004,131(19):4709-4723.
[29] Kwon C,Arnold J,Hsiao E C,et al.CanonicalWnt signaling is a positive regulator ofmammalian cardiac progenitors[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(26):10894-10899.
[30] 王欢.Cdxl在心脏发育过程中转录调控研究[D].上海:华东师范大学,2014.
Functional effects of pma-m iR-200c-3p of sea lam prey on heart development of zebrafish
Abstract:The pma-miR-200c-3p mimics from sea lamprey Petromyzon marinus were injected into zebrafish Danio rerio embryos bymicroinjection,and qRT-PCR and Western blotwere used to analyze themarker gene expression of the development of heart,and the expression levels of several genes in BMP/Smad pathway to study the biological function of pma-miR-200c-3p of the sea lamprey.Besides,target gene bio-informatics and GFP fluorescence expression analysiswere used to study the function of pma-miR-200c-3p.The results showed that the gene expression levels of some cardiac developmentmarkers including bmp4,bmp5,smad1,gata5,tbx2b and notch1a were significantly increased in the pma-miR-200c-3p-injected embryos(P<0.01).The protein expression levels of the BMP4,Smad1 and GATA5 were significantly increased bya BMP/Smad pathway,and it appears that cdx1b is a targetgene of pma-miR-200c-3p.Therefore,the findings indicate that pma-miR-200c-3pmight repress the gene expression of cdx1b,and be involved in the BMP/Smadpathway to promote the cardiac development process. Key words:Petromyzon marinus;miR-200c-3p;zebrafish;cardiac development;cdx1b
中图分类号:Q951
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.05.007
文章编号:2095-1388(2016)05-0510-06
收稿日期:2015-12-17
基金项目:国家自然科学基金面上项目(31572598);上海市教育发展基金会和上海市教育委员会曙光计划项目(13SG51);教育部科学技术研究项目(213013A);上海市教委水产学高峰学科项目