盐度胁迫对不同发育时期菲律宾蛤仔生长和存活的影响
范超,温子川,霍忠明,杨凤,闫喜武
(大连海洋大学水产与生命学院,辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023)
摘要:为研究盐度对不同发育时期菲律宾蛤仔Ruditapes philippinarum(以下称蛤仔)生长和存活的影响,在水温24℃条件下,对不同盐度(5、8、11、14、32、38、41、44、47,盐度32为对照组)胁迫下蛤仔幼虫、稚贝和幼贝(壳长10 mm)的生长和存活情况进行了研究。结果表明:盐度胁迫对蛤仔的生长和存活具有显著影响(P<0.05),盐度胁迫72 h时,盐度38组蛤仔幼虫、稚贝、幼贝的存活率均最高,分别为97.87%±3.69%、100%、100%,且与其他盐度组有显著性差异(P<0.05),而盐度5组蛤仔幼虫、稚贝、幼贝以及盐度8组的幼贝全部死亡;盐度38组蛤仔幼虫及稚贝的生长速度最快,壳长平均日生长分别为(4.83±0.03)μm和(6.81±0.11)μm,仅次于对照组(盐度32),并显著高于其他盐度组(P<0.05);蛤仔幼虫、稚贝和幼贝对盐度的耐受范围随着蛤仔受盐度胁迫时间的延长逐渐减小;盐度胁迫21 d时,盐度38组幼虫存活率为50.27%±3.76%,显著低于对照组(P<0.05),其他各盐度组幼虫全部死亡;盐度胁迫30 d时,盐度38组稚贝存活率为68.75%±5.25%,与对照组无显著性差异(P>0.05),其他盐度组稚贝全部死亡;盐度胁迫30 d时,盐度14组幼贝存活率为94.36%±2.03%,与对照组接近(P>0.05),而盐度38组存活率为60.00%±14.53%,较对照组显著下降(P<0.05),其他盐度组幼贝全部死亡。本试验结果可为蛤仔的生态养殖及抗逆品系的选育提供理论依据。
关键词:菲律宾蛤仔;盐度;生长;存活
盐度是影响贝类生长存活的重要环境因子之一。海水盐度变化超过贝类的耐盐范围,会使贝类自身渗透压调节紊乱,导致围心腔血压突增,进而表现出内脏团颤动、面盘与鳃纤毛摆动速度下降、心跳减慢、足伸缩缓慢和对外界刺激反应迟钝等现象[1]。盐度对贝类摄食率有较为显著的影响,低盐能降低贝类的滤水率,导致贝类摄食能力下降[2]。高盐或低盐对贝类产卵质量、孵化率、受精率和变态率均会造成影响[3]。目前,国内外关于贝类盐度胁迫的研究已有大量报道。Malagoli等[4]研究发现,极盐会阻碍紫贻贝Mytilus edulis免疫系统调节。何义朝等[5]研究发现,不同发育阶段的海湾扇贝Argopecten irradias盐度适宜范围不同。沈伟良等[6]研究了不同盐度对毛蚶Scapharca subcrenata受精、孵化和幼虫生长的影响,结果表明,适宜幼虫生长的盐度范围广于其受精卵孵化期的盐度范围。尤仲杰等[7]对墨西哥湾扇贝Argopecten irradians concentricus幼虫和稚贝的研究发现,幼虫与稚贝的盐度耐受范围相同。张涛等[8]研究了盐度对硬壳蛤Mercenaria mercenaria稚贝生长和存活的影响,结果表明,硬壳蛤稚贝的最适盐度范围为24~36。章启忠等[9]对华贵栉孔扇贝Chlamys nobilis盐度适应范围的研究表明,当盐度变化超出最适范围时,低盐度变化的影响比高盐度明显。关于盐度对菲律宾蛤仔Ruditapes philippinarum(以下称蛤仔)的影响研究也有报道:丁鉴锋等[10]对不同壳色蛤仔的耐低盐能力进行了比较,结果表明,斑马蛤的盐度耐受性最强;林笔水等[11]对蛤仔稚贝盐度适应性的研究表明,蛤仔稚贝的最适盐度为20.5;王军等[12]对蛤仔浮游幼虫的盐度适应性研究表明,蛤仔幼虫生长和存活最适盐度均为29;吴桂汉等[13]研究发现,蛤仔在盐度为25时摄食率最高。
蛤仔为广温、广盐性滩涂贝类,其幼虫适宜生长的盐度范围为23~35[12],稚贝为14.5~33.5[11],幼贝为9.36~34.16[14]。夏季暴雨会引起滩涂盐度急剧下降,另外,在高温干旱季节,池塘海水由于自然蒸发等原因,盐度又会持续升高。盐度变化超过蛤仔的耐受范围会导致蛤仔大规模死亡,引起臭滩、烂滩等现象,对生态环境造成不良影响。本试验中研究了盐度胁迫对不同发育阶段蛤仔的影响,以期为降低养殖风险及抗逆品种的培育提供参考。
1 材料与方法
1.1 材料
试验于2015年6月在獐子岛集团原良种场进行。獐子岛海域海水盐度为32,水温为24℃。亲贝于2015年5月初采自大连獐子岛海区,先将性腺成熟的亲贝采集后带回室内,清洗干净后放在预先加入新鲜海水的60 L白色塑料桶中(以下简称大白桶)暂养,排出泥沙待产。用海水晶、沙滤海水和淡水配制试验用不同盐度的海水,使用WYY-Ⅱ手持盐度折光仪进行盐度校对。
1.2 方法
3个发育时期蛤仔用相同的盐度进行胁迫,设置盐度分别为5、8、11、14、32(对照组)、38、41、44、47,每个盐度组设置3个平行。
1.2.1 蛤仔幼虫盐度胁迫试验 挑选健康、壳型规整的蛤仔进行室内促熟,经阴干刺激后在大白桶中产卵、排精,受精24 h后进行选育。受精卵孵化为D形幼虫后,用自制的300目筛绢网收集等量D形幼虫,将其直接转入各盐度的试验用水中,在显微镜下用目微尺(100×)随机测量30个幼虫的壳长。继续培养,每天根据摄食量的情况适量投饵3次,饵料为叉鞭金藻Dicrateria sp.,每天全量换水一次。为防止投饵或其他原因造成的盐度变化,不定期对盐度进行调整,使盐度保持稳定。分析24、48、72 h时各盐度组幼虫的存活情况;每3 d记录幼虫生长、存活情况。幼虫试验共进行21 d。1.2.2 蛤仔稚贝盐度胁迫试验 待未经盐度胁迫的幼虫完全变态后,用筛绢收集等量且规格一致的稚贝(平均壳长为450μm),直接转入各盐度的试验海水中,在显微镜下用目微尺(25×)随机测量30个稚贝的壳长。继续培养,每天根据摄食量的情况适量投饵3次,饵料为叉鞭金藻和小球藻Chlorella sp.,每天全量换水一次。不定期调整盐度,使盐度保持稳定。连续监测72 h稚贝的存活情况,分析24、48、72 h时各盐度组中稚贝的存活情况;每5 d记录稚贝的生长、存活情况。稚贝试验周期为30 d。
1.2.3 蛤仔幼贝盐度胁迫试验 试验用蛤仔幼贝为2014年8月繁育在海区吊养的一龄幼贝。筛选等量且规格一致的幼贝(壳长10 mm),直接转入各盐度的试验海水中。试验所用海水是用海水稀释的饵料与海水晶、淡水配制而成。每天适量投饵3次,饵料为叉鞭金藻,每天全量换水一次。试验过程中随时对盐度进行检测和调整。随时挑出死亡蛤仔,避免对其他蛤仔产生影响,蛤仔死亡的评判标准为壳完全张开并对外界刺激没有反应。每5 d记录幼贝的存活情况,幼贝试验共进行30 d。
1.3 数据处理
使用Excel和SPSS 19.0软件对试验数据进行分析处理,使用单因素方差分析法对不同盐度胁迫组测得的数据进行分析比较,显著性水平设为0.05。
2 结果与分析
2.1 不同发育时期蛤仔24、48、72 h的存活情况2.1.1 幼虫 从表1可见:24 h时,盐度5组蛤仔幼虫存活率为78.05%,显著低于其他各组(P<0.05);48 h时,对照组(盐度32)和盐度38、41组幼虫存活率均为100%,盐度5组幼虫存活率最低,仅为41.05%,盐度8组幼虫存活率为73.01%,显著低于盐度11~47组(P<0.05);72 h时,蛤仔幼虫存活率随胁迫盐度的降低或升高而降低,盐度5组幼虫的存活率为0,盐度8组的存活率为52.16%,显著低于11~47组(P<0.05),盐度38组幼虫的存活率为97.87%,与对照组接近(P>0.05),但显著高于其他各组(P<0.05)。2.1.2 稚贝 从表2可见:24 h时,盐度5组稚贝的存活率为65.94%,而其他盐度组的存活率均为100%;48 h时,蛤仔稚贝存活率随胁迫盐度的降低或升高呈降低趋势,盐度14、32、38组的存活率均为100%,其次为盐度41组,存活率为96.75%,盐度5组存活率最低(50.20%),显著低于盐度8~47组(P<0.05);72 h时,盐度5组中稚贝全部死亡,盐度8组存活率仅为30.50%,显著低于盐度11~47组(P<0.05),盐度32和38组的存活率最高,均为100%。
2.1.3 幼贝 从表3可见:24 h时,除盐度5组(存活率为97.81%)外,其他各组中幼贝均没有死亡;48 h时,各盐度组幼贝的存活率为71.54%~100%,盐度5组存活率最低;72 h时,盐度5和8组幼贝存活率为0,盐度11组为45.02%,显著低于盐度14~47组(P<0.05),盐度32、38、41组的存活率仍为100%。
表1 不同盐度下蛤仔幼虫24、48、72 h的存活率
Tab.1 Survival rates of larvae M anila clam Ruditapes philippinarum at different salinities in 24,48 and 72 h%
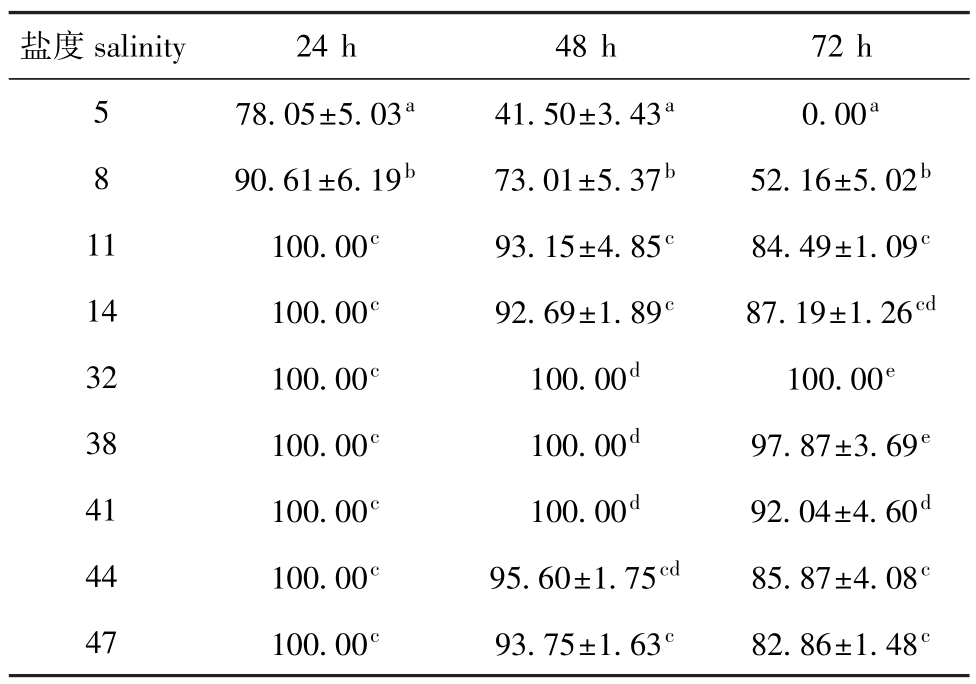
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:Themeanswith different letterswithin the same column are significant differences at the 0.05 probability level,and the means with the same letterswithin the same column are not significant differences,et sequentia
盐度salinity 24 h 48 h 72 h 5 78.05±5.03a41.50±3.43a0.00a8 90.61±6.19b73.01±5.37b52.16±5.02b11 100.00c93.15±4.85c84.49±1.09c14 100.00c92.69±1.89c87.19±1.26cd32 100.00c100.00d100.00e38 100.00c100.00d97.87±3.69e41 100.00c100.00d92.04±4.60d44 100.00c95.60±1.75cd85.87±4.08c47 100.00c93.75±1.63c82.86±1.48c
表2 不同盐度下蛤仔稚贝24、48、72 h的存活率
Tab.2 Survival rates of juvenile M anila clam Ruditapes philippinarum at different salinities in 24,48 and 72 h%
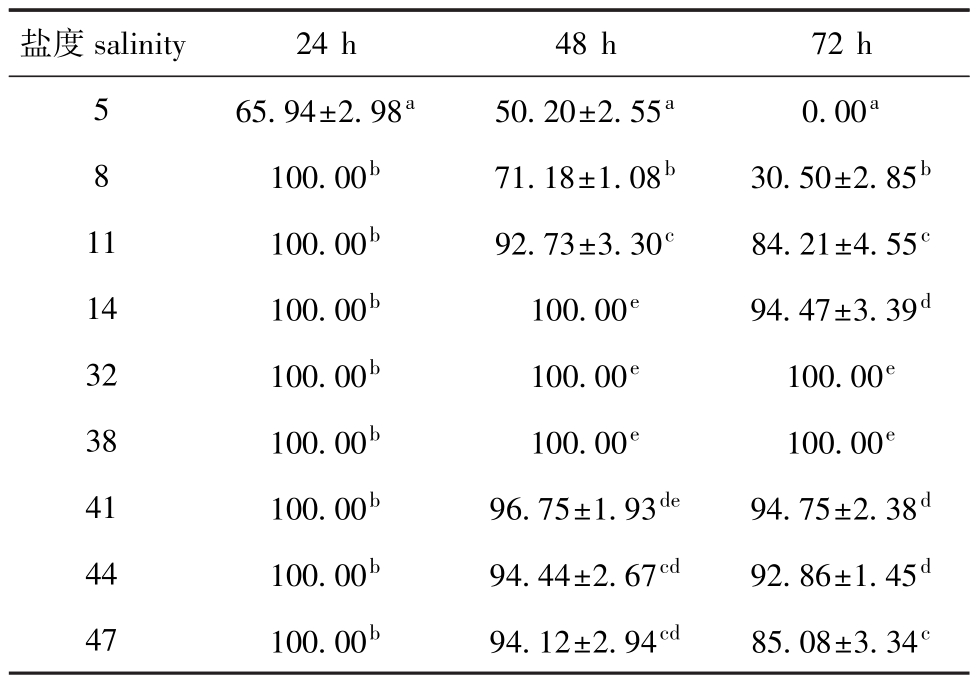
盐度salinity 24 h 48 h 72 h 5 65.94±2.98a50.20±2.55a0.00a100.00b71.18±1.08b30.50±2.85b11 100.00b92.73±3.30c84.21±4.55c14 100.00b100.00e94.47±3.39d32 100.00b100.00e100.00e38 100.00b100.00e100.00e41 100.00b96.75±1.93de94.75±2.38d44 100.00b94.44±2.67cd92.86±1.45d47 100.00b94.12±2.94cd85.08±3.34 8 c
2.2 不同发育时期蛤仔3~30 d时的存活情况
2.2.1 3~21 d幼虫的存活率 从表4可见:盐度胁迫6 d时,盐度5和8组幼虫全部死亡,盐度47组存活率最低,为59.65%,除对照组外,存活率最高组为盐度38和41组,分别为85.71%和85.35%,二者显著高于盐度11、14、47组(P<0.05);盐度胁迫9 d时,盐度47组幼虫全部死亡,盐度11和14组幼虫存活率最低,分别为68.85%和70.36%,显著低于盐度32~44组(P<0.05);盐度胁迫15 d时,蛤仔幼虫出现大量死亡,盐度8以下胁迫组,盐度41以上胁迫组幼虫全部死亡,对照组存活率最高(74.51%),显著高于其他盐度组(P<0.05);盐度胁迫21 d时,仅剩盐度38组和对照组,幼虫存活率分别为50.27%和65.67%。
表3 不同盐度下蛤仔幼贝24、48、72 h的存活率
Tab.3 Survival rates of youth M anila clam Ruditapes philippinarum at different salinities in 24,48 and 72 h %
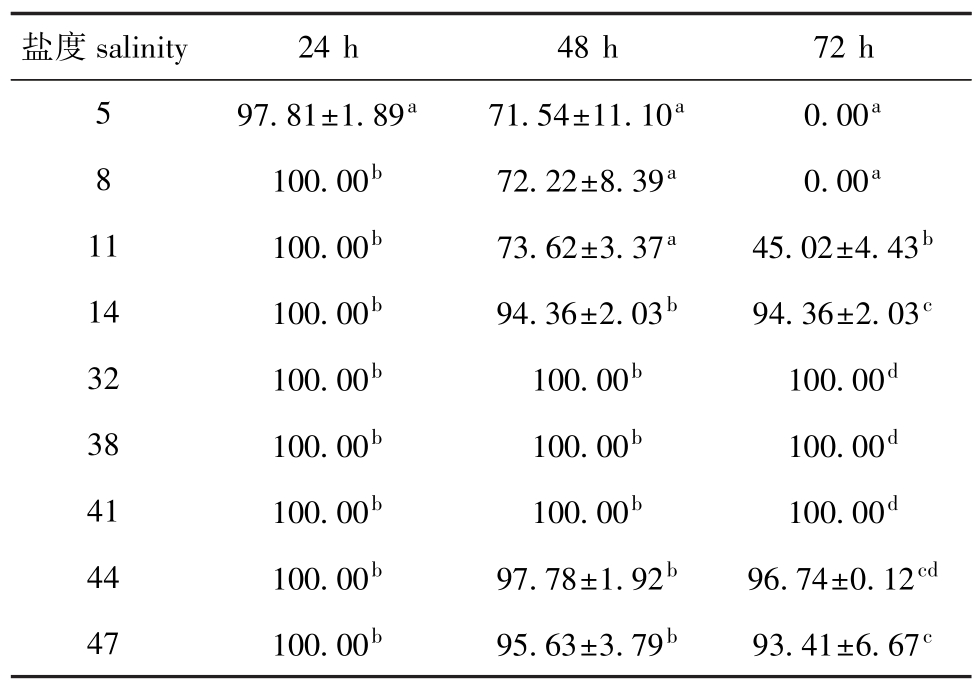
盐度salinity 24 h 48 h 72 h 5 97.81±1.89a71.54±11.10a0.00a100.00b72.22±8.39a0.00a11 100.00b73.62±3.37a45.02±4.43b14 100.00b94.36±2.03b94.36±2.03c32 100.00b100.00b100.00d38 100.00b100.00b100.00d41 100.00b100.00b100.00d44 100.00b97.78±1.92b96.74±0.12cd47 100.00b95.63±3.79b93.41±6.67 8 c
2.2.2 5~30 d稚贝的存活率 从表5可见:盐度胁迫5 d时,除对照组存活率为100%外,其他盐度组均有死亡,其中盐度5、8组稚贝全部死亡;盐度胁迫10 d时,盐度11组稚贝全部死亡,盐度胁迫出现不同程度的死亡,盐度47组的存活率最低(50.15%),显著低于盐度14~44组(P<0.05);盐度胁迫20 d时,盐度41和47组全部死亡,对照组稚贝的存活率最高(91.35%),其次为盐度38组(80.39%),盐度41组存活率最低(53.26%),显著低于盐度14~38组(P<0.05);盐度胁迫30 d时,仅剩对照组和盐度38组,稚贝存活率分别为78.96%和68.75%。
2.2.3 5~30 d幼贝的存活率 从表6可见:盐度胁迫5 d时,盐度5、8、11组幼贝全部死亡;盐度胁迫10 d时,盐度47组幼贝全部死亡;盐度胁迫30 d时,除对照组(97.78%)外,仅有盐度14、38组幼贝存活,存活率分别为94.36%和60.00%。
表4 蛤仔幼虫在不同盐度中的存活率
Tab.4 Survival rates of larvae M anila clam Ruditapes philippinarum at different salinities%

盐度salinity 3 d 6 d 9 d 15 d 21 d 5—————52.16±5.02a——11 84.49±1.09bc76.48±1.47b68.85±1.23a58.54±0.18a—14 87.19±1.26b75.52±1.92b70.36±6.09a61.15±6.40ab—32 100.00d94.43±3.64d88.15±1.98c74.51±0.43c65.67±2.46a38 100.00d85.71±1.41c77.55±0.64b66.73±2.36b50.27±3.76b41 92.04±4.60c85.35±1.51c76.27±3.00b——44 85.87±4.08b82.54±4.15bc76.37±1.94b——47 82.86±1.48b59.65±9.94a8———
表5 蛤仔稚贝在不同盐度中的存活率
Tab.5 Survival rates of juvenile M anila clam Ruditapes philippinarum at different salinities%
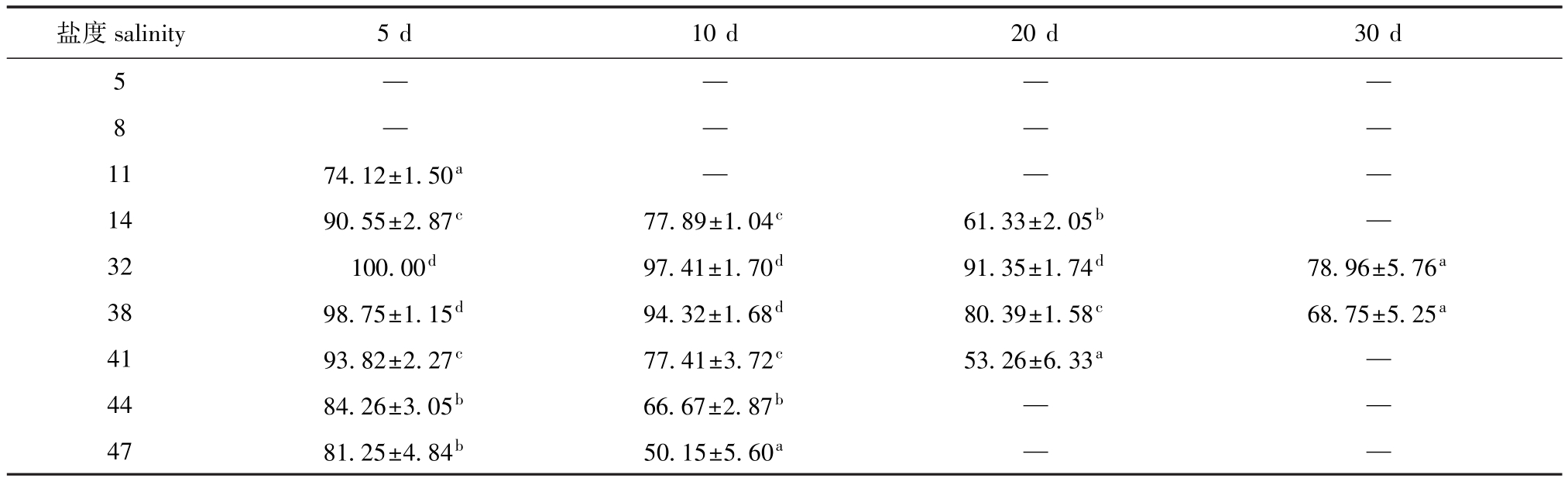
盐度salinity 5 d 10 d 20 d 30 d 5————8————11 74.12±1.50a——14 90.55±2.87c77.89±1.04c61.33±2.05b—32 100.00d97.41±1.70d91.35±1.74d78.96±5.76a38 98.75±1.15d94.32±1.68d80.39±1.58c68.75±5.25a41 93.82±2.27c77.41±3.72c53.26±6.33a—44 84.26±3.05b66.67±2.87b——47 81.25±4.84b50.15±5.60a——
表6 蛤仔幼贝在不同盐度中的存活率
Tab.6 Survival rates of youth M anila clam Ruditapes philippinarum at different salinities%

盐度salinity 5 d 10 d 20 d 30 d 5————8————11——14 94.36±2.03b94.36±2.03ab94.36±2.03b94.36±2.03b32 100.00c100.00b100.00b97.78±1.92b38 100.00c100.00b100.00b60.00±14.53a41 100.00c97.62±4.12ab83.33±14.53ab—44 96.74±0.12bc80.14±20.41a65.76±22.54a—47 83.55±5.60a———
2.3 不同盐度中蛤仔幼虫和稚贝的生长情况
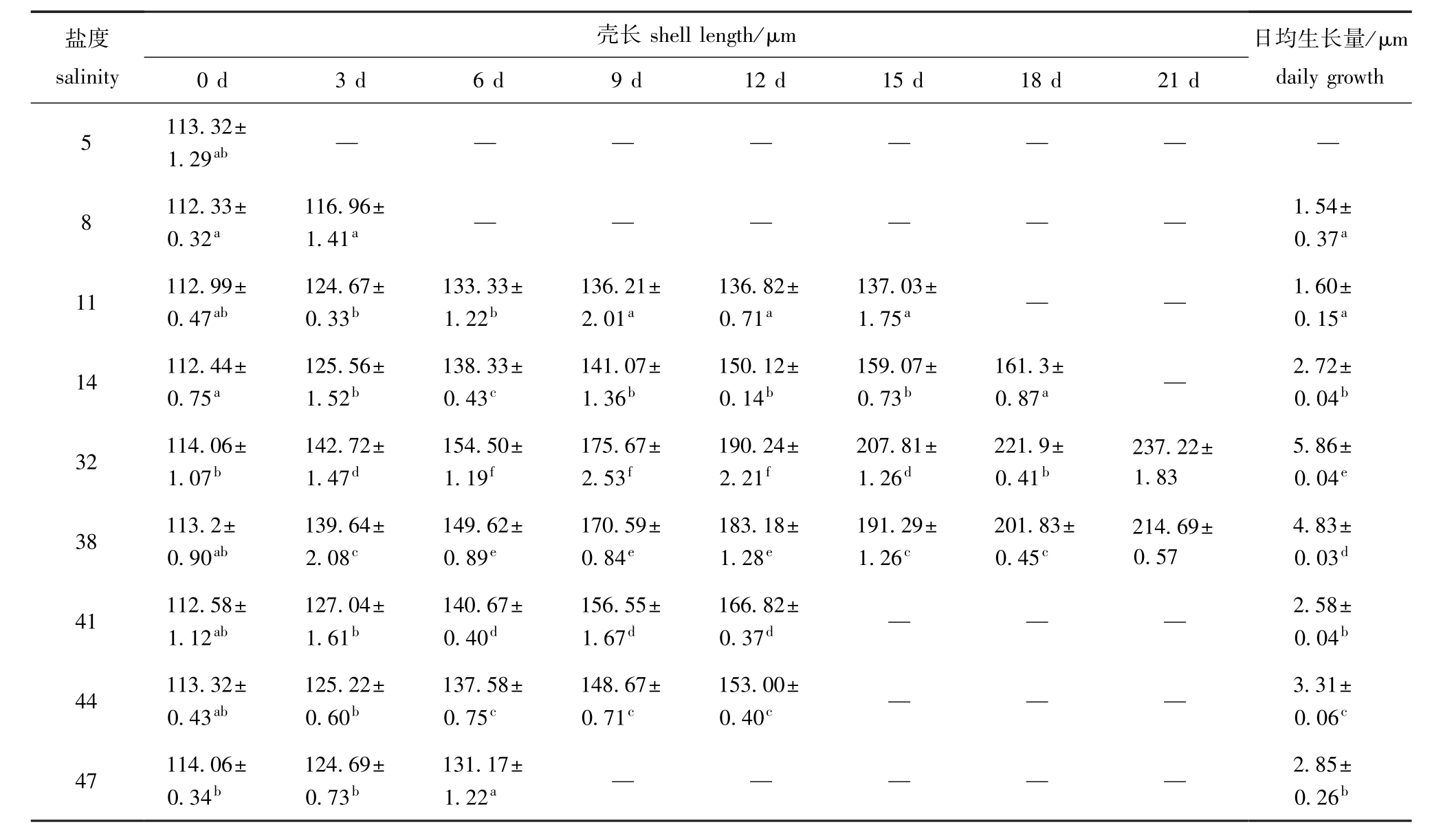
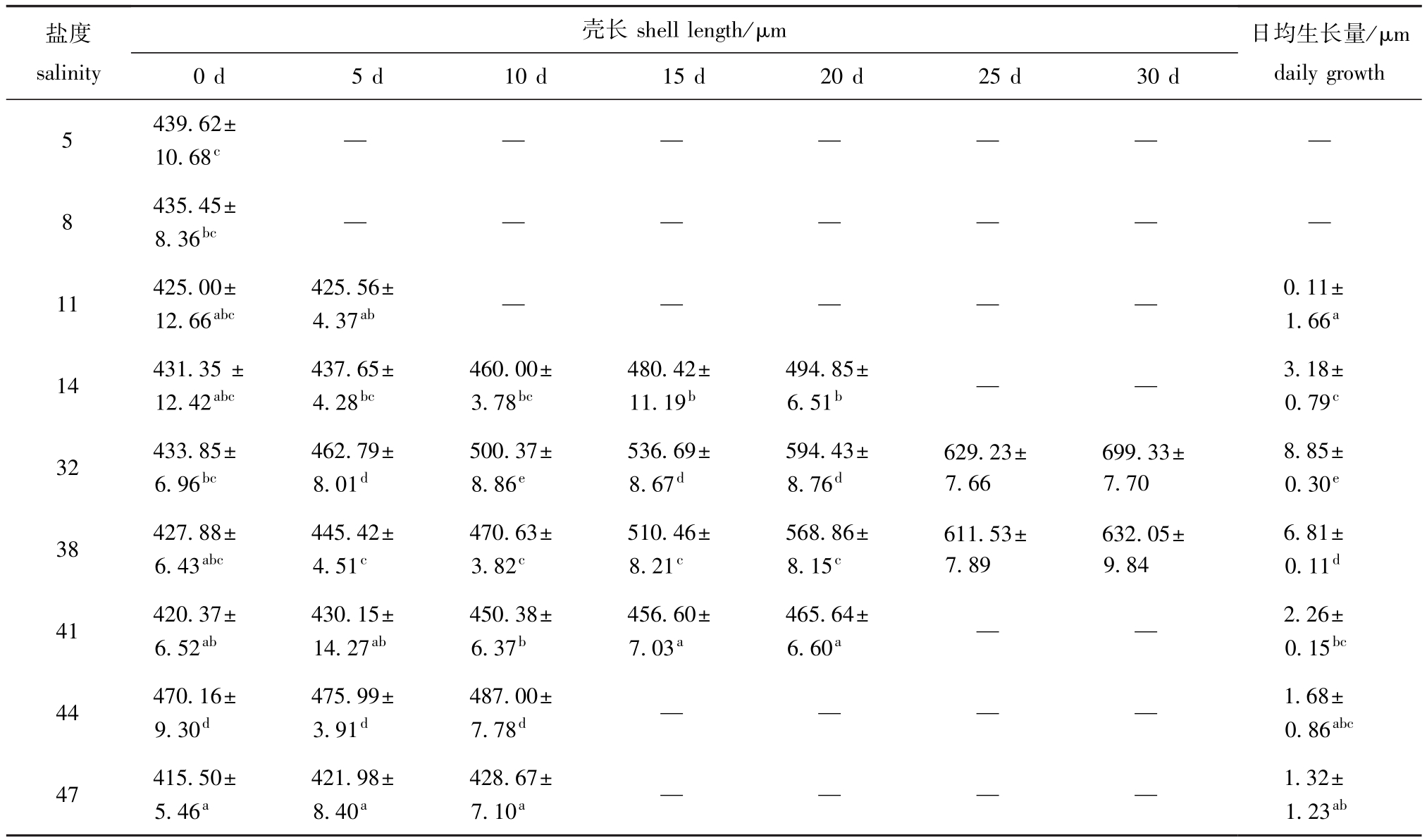
从表7和表8可见:幼虫和稚贝在盐度5组中均未观察到生长;幼虫和稚贝日平均生长最快均出现在对照组中,且与各盐度胁迫组有显著性差异(P<0.05);幼虫和稚贝的日平均生长量随盐度的升高或降低而减小(盐度44组幼虫除外)。
2.3.1 幼虫生长 从表7可见:对照组幼虫生长速度最快,壳长日平均生长量为(5.86±0.04)μm;盐度38组生长速度慢于对照组,但显著快于其他盐度组(P<0.05);4个低盐胁迫组中,幼虫的日生长量随盐度的降低而降低,盐度5、8组幼虫生长速度缓慢,两者无显著性差异(P>0.05),均显著低于其他各组(P<0.05)。
2.3.2 稚贝生长 从表8可见:在低盐胁迫中,稚贝的日均生长量随胁迫盐度的降低而降低,而在高盐胁迫组中,稚贝的日均生长量随胁迫盐度的升高而降低;对照组稚贝生长速度最快,壳长日平均生长量为(8.85±0.30)μm;盐度38组生长速度慢于对照组,但显著快于其他盐度组(P<0.05);盐度11组稚贝生长速度缓慢,显著低于盐度14~44组(P<0.05)。
表7 不同盐度中蛤仔幼虫的壳长及日均生长量
Tab.7 Shell length and daily grow th of larvae Manila clam Ruditapes philippinarum at different salinities
盐度salinity壳长shell length/μm日均生长量/μm 0 d 3 d 6 d 9 d 12 d 15 d 18 d 21 d daily growth 5 113.32± 1.29ab— — — — — — ——1.41a— — — — — —1.54± 0.37a11 112.99± 0.47ab8 112.33± 0.32a116.96± 1.75a— —1.60± 0.15a14 112.44± 0.75a124.67± 0.33b133.33± 1.22b136.21± 2.01a136.82± 0.71a137.03± 0.87a—2.72± 0.04b32 114.06± 1.07b125.56± 1.52b138.33± 0.43c141.07± 1.36b150.12± 0.14b159.07± 0.73b161.3± 5.86± 0.04e38 113.2± 0.90ab142.72± 1.47d154.50± 1.19f175.67± 2.53f190.24± 2.21f207.81± 1.26d221.9± 0.41b237.22± 1.83 4.83± 0.03d41 112.58± 1.12ab139.64± 2.08c149.62± 0.89e170.59± 0.84e183.18± 1.28e191.29± 1.26c201.83± 0.45c214.69± 0.57 0.37d— — —2.58± 0.04b44 113.32± 0.43ab127.04± 1.61b140.67± 0.40d156.55± 1.67d166.82± 0.40c— — —3.31± 0.06c47 114.06± 0.34b125.22± 0.60b137.58± 0.75c148.67± 0.71c153.00± 124.69± 0.73b131.17± 1.22a— — — — —2.85± 0.26b
表8 不同盐度中蛤仔稚贝的壳长及日均生长量
Tab.8 Shell length and daily grow th of juvenile M anila clam Ruditapes philippinarum at different salinities
盐度salinity壳长shell length/μm日均生长量/μm 0 d 5 d 10 d 15 d 20 d 25 d 30 d daily growth 5 439.62± 10.68c— — — — — ——8 435.45± 8.36bc— — — — — — —11 425.00± 12.66abc4.37ab— — — — —0.11± 1.66a14 431.35± 12.42abc425.56± 6.51b— —3.18± 0.79c32 433.85± 6.96bc437.65± 4.28bc460.00± 3.78bc480.42± 11.19b494.85± 8.85± 0.30e38 427.88± 6.43abc462.79± 8.01d500.37± 8.86e536.69± 8.67d594.43± 8.76d629.23± 7.66 699.33± 7.70 6.81± 0.11d41 420.37± 6.52ab445.42± 4.51c470.63± 3.82c510.46± 8.21c568.86± 8.15c611.53± 7.89 632.05± 9.84 6.60a— —2.26± 0.15bc44 470.16± 9.30d430.15± 14.27ab450.38± 6.37b456.60± 7.03a465.64± 7.78d— — — —1.68± 0.86abc47 415.50± 5.46a475.99± 3.91d487.00± 421.98± 8.40a428.67± 7.10a— — — —1.32± 1.23ab
3 讨论
3.1 蛤仔盐度耐受性分析
盐度是生态环境关键因素之一,会影响海洋生物的免疫反应[15]、生理反应[16-17]、胚胎发育[18-20],以及幼虫与稚贝的生长和存活[21-25]。水产动物能根据周围海水的盐度变化调节其自身的渗透压,以利于摄食和生长[8]。但如果这种变化超出贝类的耐受范围,则会严重影响其生长和存活,甚至导致其大量死亡。
蛤仔虽然是广盐性贝类,但不同海区产量并不相同,原因是所处海区的理化环境因子不同,其中盐度是重要因素之一[11]。在自然海区中,由于海水盐度的骤然变化导致的蛤仔死亡时有发生[26]。目前,研究水产动物对温度、盐度耐受性的方法主要有两种:(1)将试验动物从适宜条件突然转入试验条件,并记录直到死亡所经历的时间;(2)以一个上升率标准增加温度或盐度,直至出现死亡[27]。通常情况下,第一种方法常用于贝类对温度、盐度变化的耐受性[28-30],而国内学者常用第二种方法研究鱼类对温度的耐受性[31-35],两种方法均有其实际意义。本研究中,采用第一种方法,即以盐度突变的方式来对蛤仔进行胁迫,所设置的盐度胁迫在适宜范围之外。试验结果表明,高盐或低盐胁迫对蛤仔的生长和存活均有显著的影响。在显微镜下观察幼虫面盘纤毛摆动减慢,聚集在桶底,面盘畸形或无法收缩,几乎不摄食;稚贝腮纤毛摆动减慢,足部伸缩速度下降,摄食减少或几乎不摄食。幼虫在盐度5组中几乎不生长,在盐度8和11组中日生长量仅为(1.54±0.37)μm和(1.60± 0.15)μm;稚贝在盐度5和盐度8两个处理组中几乎不生长,而盐度11组日均生长量仅为(0.11±1.66)μm,稚贝在盐度38组中的生长表现为先慢后快,这可能是由于盐度突变导致了蛤仔的不适应,后期其适应盐度后生长逐渐加快。林笔水等[11]通过盐度胁迫蛤仔生长的研究表明:在3.5、7.5和14.0盐度胁迫组中,蛤仔幼虫和稚贝几乎没有生长,此结论与本研究结果相符合。本研究中,高盐胁迫蛤仔幼虫和稚贝的生长较低盐明显,在林笔水等[11]的研究中也得到了类似的结论。
本试验结果表明,盐度胁迫72 h时,幼虫在对照组中存活率为100%,稚贝在对照组和盐度38组中的存活率为100%,而幼贝在对照组、盐度38和41组中的存活率为100%,说明随着蛤仔的生长,蛤仔的抗高盐能力逐渐增强;幼虫和稚贝均在盐度38组中的存活时间最长,而幼贝在盐度38组中的存活时间短于盐度14组,说明随着蛤仔的生长发育,蛤仔对盐度的耐受性有向低盐方向发展的趋势。本试验的盐度变化方式为突变,试验刚开始的几天蛤仔在低盐中几乎没有摄食,仅靠自身贮存的能量来维持新陈代谢,而在高盐中的摄食量较低盐中要好些,这也说明了虽然在适宜的盐度中,蛤仔更适合在低盐中生存,但在不适宜的盐度中,蛤仔在高盐中的耐受性要比低盐中强。王军等[12]的研究表明,高于或低于适宜盐度范围会使蛤仔生长停滞或大量死亡,曹伏君等[36]对文蛤的盐度耐受性研究中也有相同的结论。
3.2 盐度驯化潜能及应用前景
目前,关于盐度对海洋双壳类动物影响的机制尚未完全探明。一些研究报道表明,海洋双壳类动物渗透压调节中,其对盐度的调节起主要作用[37-43]。章启忠等[9]对华贵栉孔扇贝稚贝的研究发现,盐度变化一旦超出了自身渗透压调节能力,则会导致其大量死亡。尤仲杰等[7]研究发现,墨西哥湾扇贝幼虫和稚贝在不适的盐度下,心跳减慢,代谢缓慢或停止,易死亡。Li等[44]在对南美白对虾Litopenaeus vannamei的研究中发现,新陈代谢的能量是恒定的,用于维持渗透压调节多,则用于维持免疫系统及机体生长的能量就减少。Malagoli等[4]对紫贻贝的研究发现,不同应激因子(高温、极盐等)均可以阻碍其免疫调节系统。税春等[45]对梭鱼Liza haematocheila幼鱼的研究发现,不同盐度中梭鱼幼鱼的摄食率、血清渗透压不同。郭文学[46]研究发现,高盐环境中,生物体内的渗透压开始升高,当达到一定阈值后,即超过了自身调节能力,则会出现死亡。贝类对盐度的耐受力与遗传因素及个体的生理状态有关。在现有的研究中,大部分受试动物对环境因子渐变的能力均强于突变[47-50]。郭文学[46]对中国蛤蜊Mactra chinensis的研究发现,幼虫适应盐度渐变的能力较突变强。施刚等[49]对褐点石斑鱼Epinephelus fuscoguttatus的研究表明,盐度渐变后鱼苗的盐度耐受范围较突变变广。王冲等[50]对三疣梭子蟹Portunus trituberculatus的研究发现,幼蟹适应盐度渐变的能力强于适应突变;但突变的意义在于能在盐度突变中存活下来的蛤仔是对环境突然变化具有高抗逆性的部分,具有进一步筛选的必要。Hosoi等[51]报道了甘氨酸、脯氨酸等氨基酸对细胞内渗透压起主要作用。另外,Palacios等[47]在对虾后期幼体的盐度胁迫研究中发现,通过盐度胁迫测试,可以提高其对盐度的耐受范围。Rupp等[48]对扇贝的研究表明,通过温度和盐度胁迫驯化可能突破其品种的耐受极限。
本研究意义在于,能在盐度突变中存活下来的蛤仔是具有盐度耐受性群体,可以作为耐盐蛤仔基础选育群体,但对其后代进行驯化及耐盐性的遗传机理,也需要进一步进行验证。同时,各时期蛤仔在不同盐度中的存活时间可以作为后期蛤仔抗逆选育的标准,并为后期蛤仔抗逆品系筛选打下基础。经过系统的盐度驯化和定向选育可以得到耐盐品系,为盐碱地、河口区滩涂的综合利用提供了新的方向。
参考文献:
[1] 尤仲杰,陆彤霞,马斌,等.盐度对墨西哥湾扇贝幼虫和稚贝生长与存活的影响[J].动物学杂志,2003,38(3):58-60.
[2] 刘青,张越,付鑫,等.菲律宾蛤仔的研究进展[J].河北渔业,2011(1):56-59.
[3] 常亚青.贝类增养殖学[M].北京:中国农业出版社,2007:69.
[4] MalagoliD,Casarini L,Sacchi S,etal.Stressand immune response in themussel Mytilusgalloprovincialis[J].Fish&Shellfish Immunology,2007,23(1):171-177.
[5] 何义朝,张福绥.盐度对海湾扇贝不同发育阶段的影响[J].海洋与湖沼,1990,21(3):197-204.
[6] 沈伟良,尤仲杰,施祥元.温度与盐度对毛蚶受精卵孵化及幼虫生长的影响[J].海洋科学,2009,33(10):5-8.
[7] 尤仲杰,陆彤霞,马斌,等.几种环境因子对墨西哥湾扇贝幼虫和稚贝生长与存活的影响[J].热带海洋学报,2003,22(3):22-29.
[8] 张涛,杨红生,刘保忠,等.环境因子对硬壳蛤Mercenariamercenaria稚贝成活率和生长率的影响[J].海洋与湖沼,2003,34(2):142-149.
[9] 章启忠,刘志刚,王辉.华贵栉孔扇贝稚贝盐度适应性的研究[J].广东海洋大学学报,2008,28(1):40-43.
[10] 丁鉴锋,王锐,闫喜武,等.菲律宾蛤仔3种壳色群体低盐耐受能力的比较研究[J].大连海洋大学学报,2013,28(3):264-268.
[11] 林笔水,吴天明,黄炳章.温度和盐度对菲律宾蛤仔稚贝生长及发育的影响[J].水产学报,1983,7(1):15-23.
[12] 王军,王志松,董颖,等.盐度对菲律宾蛤仔浮游幼体存活和生长的影响[J].水产科学,2003,22(2):12-14.
[13] 吴桂汉,陈品健,江瑞胜,等.盐度和昼夜节律对菲律宾蛤仔摄食率的影响[J].台湾海峡,2002,21(1):72-77.
[14] 邱清华.杂色蛤子的形态习性和养殖法[J].动物学杂志,1959,3(11):511-517.
[15] Gagnaire B,Frouin H,Moreau K,et al.Effects of temperature and salinity on haemocyte activities of the Pacific oyster,Crassostrea gigas(Thunberg)[J].Fish&Shellfish Immunology,2006,20(4):536-547.
[16] Hildreth JE,Stickle W B.The effects of temperature and salinity on the osmotic composition of the southern oyster drill,Thais haemastoma[J].Biological Bulletin,1980,159(1):148-161.
[17] Madrones-Ladja J A.Salinity effect on the embryonic development,larval growth and survival atmetamorphosis of Placuna placenta Linnaeus(1758)[J].Aquaculture,2002,214(1-4):411-418.
[18] Dos Santos A E,Nascimento IA.Influence of gamete density,salinity and temperature on the normal embryonic development of themangrove oyster Crassostrea rhizophorae Guilding,1828[J]. Aquaculture,1985,47(4):335-352.
[19] Tan SH,Wong TM.Effect of salinity on hatching,larval growth,survival and settling in the tropical oyster Crassostrea belcheri(Sowerby)[J].Aquaculture,1996,145(1-4):129-139.
[20] Huo Zhongming,Wang Zhaoping,Liang Jian,et al.Effects of salinity on embryonic development,survival,and growth of Crassostrea hongkongensis[J].Journal of Ocean University of China(Oceanic and Coastal Sea Research),2014,13(4):666-670.
[21] 刘海涛,董占武,徐志明.盐度对大连湾牡蛎胚胎发育及幼虫生长的影响[J].水产学报,1992,16(1):32-39.
[22] Nell JA,Holliday JE.Effects of salinity on the growth and survival of Sydney rock oyster(Saccostrea commercialis)and Pacific oyster(Crassostrea gigas)larvae and spat[J].Aquaculture,1988,68(1):39-44.
[23] Soria G,Merino G,Uribe E,et al.Effect of increasing salinity on weight-specific filtration rate of juvenile scallop Argopecten purpuratus reared at two temperatures:is any effect related to ammonia buildup?[J].Journal of Shellfish Research,2011,30(2):279-286.
[24] Taylor JJ,Southgate PC,Rose R A.Effects of salinity on growth and survival of silver-lip pearl oyster,Pinctada maxima,spat[J].Journal of Shellfish Research,2004,23(2):375-377.
[25] Xu F,Guo XM,Li L,etal.Effectsof salinity on larvae of the oysters Crassostrea ariakensis,C.sikamea and the hybrid cross[J]. Marine Biology Research,2012,7(8):796-803.
[26] 山东省水产学校.贝类养殖学[M].北京:农业出版社,1980:328-329.
[27] 严福升.牙鲆(Paralichthys olivaceus)生长相关性状遗传力估计和耐热性状初步研究[D].青岛:中国海洋大学,2009.
[28] 陈爱华,姚国兴,张志伟,等.温度、盐度和底质对大竹蛏稚贝生长及存活的影响[J].热带海洋学报,2010,29(5):94-97.
[29] 陈志,高如承,胡青,等.温度、盐度和密度交互作用对波纹巴非蛤幼贝生长的影响[J].海洋科学,2013,37(8):55-60.
[30] 刘志刚,刘建勇,王辉,等.墨西哥湾扇贝稚贝盐度适应性的研究[J].湛江海洋大学学报,2006,26(6):12-16.
[31] 池信才,王军,宋思扬,等.耐温牙鲆分子标记辅助选育研究[J].厦门大学学报:自然科学版,2007,46(5):493-496.
[32] 刘宝锁,张天时,孔杰,等.大菱鲆生长和耐高温性状的遗传参数估计[J].水产学报,2011,35(11):1601-1606.
[33] 卢钟磊,池信才,王义权,等.褐牙鲆耐热性状相关的微卫星分子标记筛选[J].厦门大学学报:自然科学版,2007,46(3):396-402.
[34] 马爱军,黄智慧,王新安,等.大菱鲆(Scophthalmusmaximus)耐高温品系选育及耐温性能评估[J].海洋与湖沼,2012,43(4):797-804.
[35] 许可.大菱鲆与生长、耐高温性状相关的微卫星标记筛选及微卫星标记的开发研究[D].上海:上海海洋大学,2009.
[36] 曹伏君,刘志刚,罗正杰.文蛤稚贝盐度适应性的研究[J].海洋通报,2010,29(2):156-160.
[37] Lange R.Isosmotic intracellular regulation and euryhalinity inmarine bivalves[J].Journal of Experimental Marine Biology and E-cology,1970,5(2):170-179.
[38] Strand O,Solberg P T,Andersen K K,et al.Salinity tolerance of juvenile scallops(Pecten maximus L.)at low temperature[J]. Aquaculture,1993,115(1-2):169-179.
[39] Singnoret-Brailovsky G,Maeda-Martinez A N,Reynoso-Granados T,et al.Salinity tolerance of the catarina scallop Argopecten ventricosus-circularis(Sowerby II,1842)[J].Journal of Shellfish Research,1996,15(3):623-626.
[40] Damrongphol P,Jaroensastraraks P,Poolsanguan B.Effect of variousmedium compositions on survivaland hatching rates ofembryos of the giant freshwater prawn Macrobrachium rosenbergii cultured in vitro[J].Fisheries Science,2001,67(1):64-70.
[41] Laing I.Effect of salinity on growth and survival of king scallop spat(Pecten maximus)[J].Aquaculture,2002,205(1-2):171-181.
[42] Wang Y J,Hu M H,Wong W H,et al.The combined effects of oxygen availability and salinity on physiological responses and scope for growth in the green-lipped mussel Perna viridis[J]. Marine Pollution Bulletin,2011,63(5-12):255-261.
[43] Wang Y J,Hu M H,Wong W H,et al.Combined effects of dissolved oxygen and salinity on growth and body composition of juvenile green-lipped mussel Perna viridis[J].Journal of Shellfish Research,2011,30(3):851-857.
[44] Li E C,Chen LQ,Zeng C,etal.Growth,body composition,respiration and ambient ammonia nitrogen tolerance of the juvenile white shrimp,Litopenaeus vannamei,at different salinities[J]. Aquaculture,2007,265(1-4):385-390.
[45] 税春,张海明,施永海,等.盐度对梭鱼幼鱼生长、渗透生理和体成分组成的影响[J].大连海洋大学学报,2015,30(6):634-640.
[46] 郭文学.四角蛤蜊和中国蛤蜊繁殖生物学、养殖生态学与品种选育研究[D].大连:大连海洋大学,2012.
[47] Palacios E,Racotta IS.Salinity stress test and its relation to future performance and different physiological responses in shrimp postlarvae[J].Aquaculture,2007,268(1-4):123-135.
[48] Rupp G S,Parsons G J.Effects of salinity and temperature on the survival and byssal attachmentof the lion's paw scallop Nodipecten nodosus at its southern distribution limit[J].Journal of Experimental Marine Biology and Ecology,2004,309(2):173-198.
[49] 施钢,张健东,潘传豪,等.盐度渐变和骤变对褐点石斑鱼存活和摄饵的影响[J].广东海洋大学学报,2011,31(1):45-51.
[50] 王冲,姜令绪,王仁杰,等.盐度骤变和渐变对三疣梭子蟹幼蟹发育和摄食的影响[J].水产科学,2010,29(9):510-514.
[51] HosoiM,Kubota S,Toyohara M,etal.Effectof salinity change on free amino acid content in Pacific oyster[J].Fisheries Science,2003,69(2):395-400.
Influence of salinity stress on grow th and survival of M anila clam Ruditapes philippinarum at various developmental stages
FAN Chao,WEN Zi-chuan,HUO Zhong-ming,YANG Feng,YAN Xi-wu
(College of Fisheries and Life Science,Engineering Research Center of Shellfish Culture and Breeding in Liaoning Province,Dalian Ocean University,Dalian 116023,China)
Abstract:The growth and survival of larvae,juvenile,and 1-year old youth(shell length 10 mm)of Manila clam Ruditapes philippinarum were studied ata salinity of5,8,11,14,32(control),38,41,44,and 47 atwater temperature of 20℃.The results showed that there were significant effects of salinity stress on growth and survival of the clam,with themaximal survival rates(97.87%±3.69%,100%,and 100%)in 72 h in the three stages at salinity of 38(P<0.05)and mortality at salinity of 5.The best daily growth was observed in larvae(4.83μm±0.03 μm)and juveniles(6.81μm±0.11μm)at a salinity of38,poorer than that in the control group and significantly better than that in the other groups(P<0.05).Itwas found that the range of salinity tolerancewas decreased as the clam developed,with survival rate of(50.27±3.76)%in 21 day old larvae at a salinity of38,significantly lower than that in the other groups(P<0.05),even mortality in the other groups.In 30 days salinity stress,however,the juveniles had survival rate of(68.75±5.25)%in a salinity of38,without significantly different from that in the control group(P>0.05),evenmortality in the other groups.Therewas survival rate of(94.36±2.03)%ata salinity of 14,without significant difference compared to that in the control group(P>0.05),and survival rate of(60.00±14.53)%at a salinity of 38,significantly lower than that in the control group(P<0.05),in the youth clam exposed to salinity stress for 30 days.The findings provided a theoretical basis for eco-breeding of resistant clam strains.
Key words:Ruditapes philippinarum;salinity;growth;survival
中图分类号:Q954.4
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.05.005
文章编号:2095-1388(2016)05-0497-08
收稿日期:2016-01-14
基金项目:国家现代农业产业技术体系建设专项(CARS-48);国家“863”计划项目(2012AA10AA400)
作者简介:范超(1989—),男,硕士研究生。E-mail:616621402@qq.com
通信作者:霍忠明(1983—),男,博士,讲师。E-mail:houzm@dlou.edu.cn







