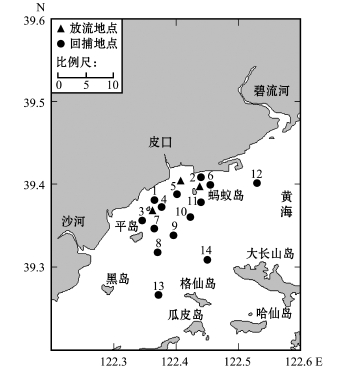
图1 2015年皮口海域中国对虾放流地点与回捕调查站位
Fig.1 Releasing area and recapture survey stations of Chinese shrim p Fenneropenaeus chinensis in Pikou Bay in 2015
摘要:为了解增殖放流后,黄海北部海域中国对虾Fenneropenaeus chinensis的生长状况,于2015年6—10月在黄海北部辽宁省皮口海域进行了6个航次的回捕调查,共采集样品1434尾,并对其生长指标进行测量分析。结果表明:皮口海域中国对虾体长和体质量呈幂函数关系,雌虾W=8×10-6L3.0729,雄虾W=9×10-6L3.0573;采用Von Bertallanffy生长方程对皮口海域中国对虾体长、体质量进行拟合,雌虾Lt=230.09[1-e-0.0098(t-29.54)]、Wt=144.87[1-e-0.0098(t-29.54)]3.0729,雄虾Lt=175.05[1-e-0.0151(t-34.73)]、Wt=65.98[1-e-0.0151(t-34.73)]3.0573;皮口海域中国对虾在生长过程中表现出雌、雄差异,前期雄虾体长生长速度快于雌虾,约74 d后,雌虾体长生长速度明显快于雄虾,雄虾体质量生长拐点出现在109 d前后,而雌虾则出现在144 d前后;与历史文献相比较,皮口海域中国对虾的生长系数k值较小,显示出生长速度可能较其他海区有减缓的趋势,但渐近体长和渐近体质量有增大趋势;皮口海域中国对虾摄食等级存在月份差异。本研究结果可为探讨大规模增殖放流后黄海北部现有中国对虾种群的自然状况及制定相关管理策略提供科学依据。
关键词:中国对虾;黄海北部;增殖放流;生长特性
重建和保护近海资源是中国海洋战略的重要组成部分。近年来,随着过度捕捞、环境污染和海洋工程的扩大,中国近海资源日益萎缩,渔获物呈低龄化、小型化和低值化趋势[1],渔业资源结构发生了显著变化[2]。目前,世界各国开展了一系列修复近海资源的措施,主要包括:(1)增殖放流;(2)人工鱼礁;(3)伏季休渔;(4)配额管理与捕捞许可制度;(5)渔船渔具管控;(6)产卵场和栖息地保护等[3-8]。其中,增殖放流作为渔业资源修复的最直接手段,在资源养护及生态修复方面发挥了重要作用[9]。
中国对虾Fenneropenaeus chinensis俗称对虾、大虾等,隶属于十足目Decapoda、对虾总科Penaeoidae、对虾科Penaeidae、明对虾属Fenneropenaeus[10],为广温、广盐性的一年生种类,主要分布于中国黄、渤海海区。中国对虾作为重要的经济种类,具有个体大、生长快、肉味鲜美等特点,经济价值较高。1979年,其产量曾达到历史最高水平,为4.27万t[11]。但近10余年来,随着自然资源严重萎缩,很多传统渔场已经到了无虾可捕的地步。为保护这一重要渔业资源,辽宁省自1984年开始实施大规模增殖放流工作,2012—2015年共放流仔虾超过137.5亿尾。黄海北部面积约8万km2,是传统的对虾捕捞海域[11-12],也是辽宁省的主要增殖区,其放流地点包括东港、庄河、皮口和旅顺。
研究表明,增殖放流在恢复近海资源、提高渔业生产力的同时,所带来的一些新问题也不容忽视[13-15]。主要渔业品种的大规模、连续性放流,会对当地生态系统产生深远影响[16-17]。例如,对山东半岛南部对虾增殖放流调查发现,放流群体已占当地可捕种群的绝大多数[11]。在生长方面,天然虾生长保持基本稳定,而放流虾受人工育苗、年间放流时间等因素影响,生长处于变化中[18]。近年来,有关中国对虾生长和生活习性的研究多集中在山东及浙江等海域。张波等[19]报道了莱州湾对虾的生长、分布和摄食规律。李忠义等[20]阐述了鳌山湾放流区的资源组成与丰度、放流群体的生长特性和资源密度变化。楼宝[21]研究了象山港放流群体与野生群体间的生长差异、放流与不放流年份回捕量的变化规律等。以上研究均对指导当地资源修复起到了积极作用。但截至目前,黄海北部海域历经长期人工放流后,中国对虾群体新的生长规律尚未见报道[18]。
为阐明近年来黄海北部海域中国对虾种群的新变化,如种群补充机制及放流影响,海域环境变化对其生长和生活习性的改变等,本研究中首次以黄海北部主要增殖放流地点——辽宁省皮口海域分布的中国对虾为研究对象,对其生长特性进行了系统研究,旨在为完善黄海北部海域增殖放流策略提供理论基础。
1.1 调查船及调查站位
2015年5月20—31日,渔业管理部门在黄海北部海域共放流中国对虾人工苗超过12.5亿尾。在增殖放流后10 d左右,研究人员租用渔船于放流海域附近(普兰店皮口蚂蚁岛)进行资源调查。调查船为36.8 kW的单拖渔船(SB1)和29.4 kW的单拖渔船(SB2),对虾放流地点(3个)与回捕调查站位(14个)如图1所示。
1.2 方法
1.2.1 样品的采集 调查船以3 kn为平均航速进行资源调查。每次船行8~12 h,调查时间依次为2015年6月10日(SB1)、7月25日(SB1)、8月21日(SB2)、9月1日(SB2)、9月25日(SB2)和10月22日(SB2),共进行6个航次,各个航次均回捕到中国对虾,总计样品1434尾。其中,样品信息、调查时间和网具信息如表1所示。在调查过程中,考虑到中国对虾的生长状况,以捕捞对象不能由网眼逃逸为标准,故选择虾推网和单船底层拖网作为调查工具。
1.2.2 样品的处理与分析 将采集到的完整样品带回实验室,鉴别性别,测量体长(眼柄基部至尾节末端的距离)(L,精确到1.0 mm),称量体质量(W,精确到0.1 g)。测量时使用纸巾将虾体水分擦干,以减少误差。同时,解剖样品,进行摄食强度分析。摄食强度分为6个等级:0级(空胃),1级(食物占消化道的比例为10%,并以此类推),2级(30%),3级(50%),4级(70%),5级(90%以上)[22]。

图1 2015年皮口海域中国对虾放流地点与回捕调查站位
Fig.1 Releasing area and recapture survey stations of Chinese shrim p Fenneropenaeus chinensis in Pikou Bay in 2015
1.2.3 种群特征及生长模型分析 因航次1采集的样品较小,性别鉴定可能存在误差,故仅记录航次2~航次6采集到的样品性别。使用SPSS 22.0软件,以1∶1为期望值,采用卡方检验(Chisquare test)检验所有航次样品的性别比例。同时记录各航次所有中国对虾体长、体质量参数,统计值以平均值±标准误(mean±S.E.)表示,并采用独立样本T检验分别比较不同航次的雌、雄对虾体长和体质量差异,显著性水平设为0.05。
根据Taylor公式分别拟合雌、雄对虾体长与体质量模型,Taylor公式为
其中:L为体长(mm);W为体质量(g);参数a、b分别为条件因子和异速生长因子。
以2015年黄海北部海域放流承担单位的产卵盛期(5月1日)作为0日龄,使用Von Bertallanffy生长方程对各航次中国对虾的平均体长(La)、平均体质量(Wa)与日龄(t)的关系进行拟合。考虑到采样时间非等间隔,故使用拉格朗日抛物线插值(Lagrange interpolation)内插法[23]对各航次样品的平均体长进行插值处理,以10 d间隔为计。若得到的等间隔体长插值数据Lt+1与Lt呈线性相关,则使用Walford作用法作图[24],若不呈线性关系,则对中国对虾生长规律分阶段描述,呈线性相关月份采用Bertalanffy方程描述其生长规律,其他情况采用Logistic方程拟合出生长规律[25]。计算平均渐近体长L∞,代入Taylor公式,推导得到平均渐近体质量W∞。Von Bertallanffy生长方程为
其中:k为生长系数;t0为假设的理论生长起点日龄。
对体长、体质量生长方程分别求导,建立体长、体质量生长速度方程,并对体质量生长方程二次求导,构建中国对虾体质量生长加速度方程。令d Wt2/d t2=0,可得对虾拐点年龄式:tr=ln b/k+t0,代入参数,获得体质量生长拐点。
2.1 中国对虾的体长、体质量及性别比例
各航次对虾性别比例维持在0.51~1.36,卡方检验表明:航次3采集的样品中,雌雄比例与雌雄性比1∶1之间存在显著性差异(P<0.05),航次6存在极显著性差异(P<0.01),其余航次均无显著性差异(P>0.05)。采用独立样本T检验对各航次雌、雄之间的体长及体质量进行比较,结果表明,航次2采集的雌虾、雄虾间体长、体质量均无显著性差异(P>0.05),其余航次采集的雌虾和雄虾间体长、体质量均有极显著性差异(P<0.01)(表1)。
表1 皮口海域6个航次中国对虾的样品信息(平均值±标准误)
Tab.1 Details of the samples of Chinese shrimp Fenneropenaeus chinensis in Pikou Bay druing 6 navigation survey(means±S.E.)
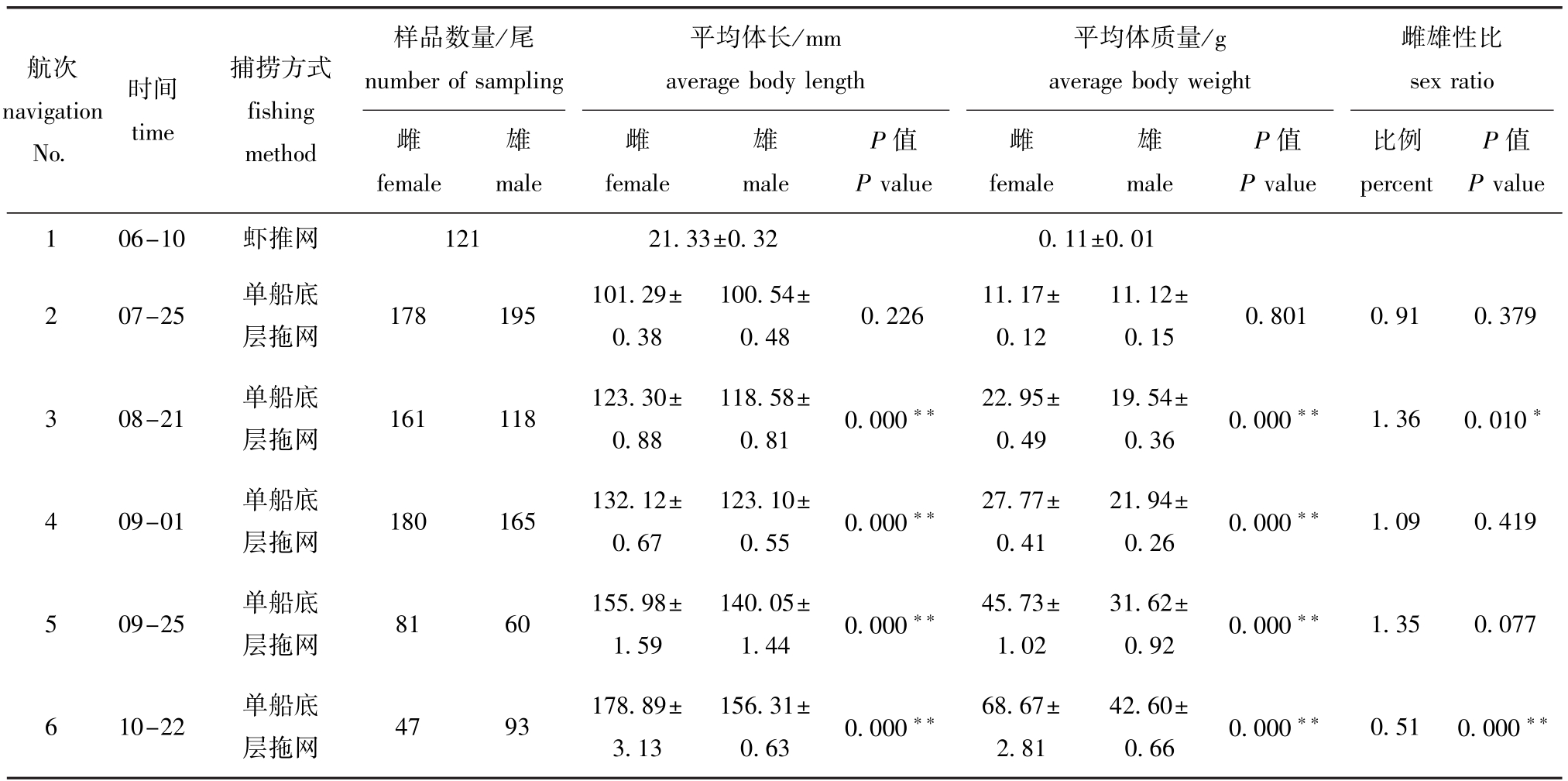
注:虾推网网口周长为7.8 m,网目尺寸为10 mm;单船底层拖网网口周长为47 m,网目尺寸为20 mm;*表示存在显著性差异(P<0.05),**表示存在极显著性差异(P<0.01)
Note:In a push net,the netmouth circumference is7.8m and themesh size is10mm;in trawl net,the netmouth circumference is47m and themesh size is 20 mm;*means significant difference compared with the control(P<0.05),**means very significant difference compared with the control(P<0.01)
航次navigation No.时间time捕捞方式fishing method 雄雄雄value 1 06-10虾推网样品数量/尾number of sampling雌female male平均体长/mm average body length雌female male P值P value平均体质量/g average body weight雌female male P值P value雌雄性比sex ratio比例percent P值P 121 21.33±0.32 0.11±0.01 2 07-25单船底层拖网178 195 101.29± 0.38 100.54± 0.48 0.226 11.17± 0.12 11.12± 0.15 0.801 0.91 0.379 3 08-21单船底层拖网161 118 123.30± 0.88 4 09-01单船底层拖网180 165 132.12± 0.67 5 09-25单船底层拖网81 60 155.98± 1.59 118.58± 0.81 0.000**22.95± 0.49 123.10± 0.55 0.000**27.77± 0.41 140.05± 1.44 0.000**45.73± 1.02 19.54± 0.36 0.000**1.36 0.010*21.94± 0.26 0.000**1.09 0.419 31.62± 0.92 0.000**1.35 0.077 6 10-22单船底层拖网47 93 178.89± 3.13 156.31± 0.63 0.000**68.67± 2.81 42.60± 0.66 0.000**0.51 0.000**
从中国对虾生长情况看(图2、图3):6月份(航次1)捕获的中国对虾平均体长为21.33 mm,平均体质量为0.11 g;7月份(航次2)捕获的中国对虾,99.47%的个体体长集中在80~120 mm;71.05%的个体体质量集中在10~20 g;8月份(航次3)捕获的中国对虾,91.75%的个体体长集中在100~140 mm,91.04%的个体体质量集中在10~30 g;9月份(航次4和航次5)捕获的中国对虾,体长为106~183 mm,平均体长为134.01 mm,体质量为14.95~49.23 g,平均体质量为29.26 g;10月份(航次6)捕获的中国对虾,95.00%的个体体长集中在140~200 mm,96.42%的个体体质量集中在30~90 g。

图2 皮口海域中国对虾体长分布
Fig.2 Body length frequency of Chinese shrim p Fenneropenaeus chinensis in Pikou Bay
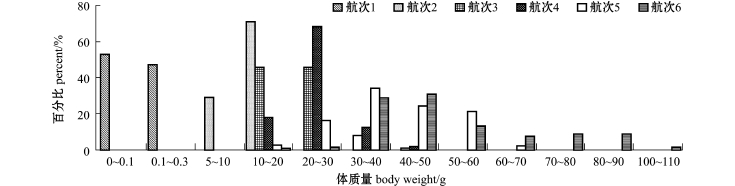
图3 皮口海域中国对虾体质量分布
Fig.3 Body weight frequency of Chinese shrim p Fenneropenaeus chinensis in Pikou Bay
2.2 中国对虾体长与体质量的关系
雌、雄对虾体长与体质量的关系模型分别为
雌性W=8×10-6L3.0729,R2=0.9949,
雄性W=9×10-6L3.0573,R2=0.9958。
由图4可知,雌、雄对虾的体长与体质量曲线近似重合。
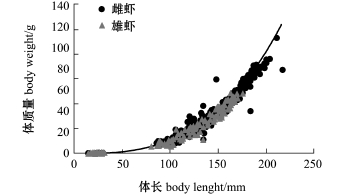
图4 皮口海域中国对虾体长与体质量的关系曲线
Fig.4 Relationship between body length and body weight of Chinese shrimp Fenneropenaeus chinensis in Pikou Bay
2.3 中国对虾的生长方程
依照拉格朗日抛物线插值法进行数据处理,结果如表2所示。
表2 插值结果
Tab.2 Results of interpolation
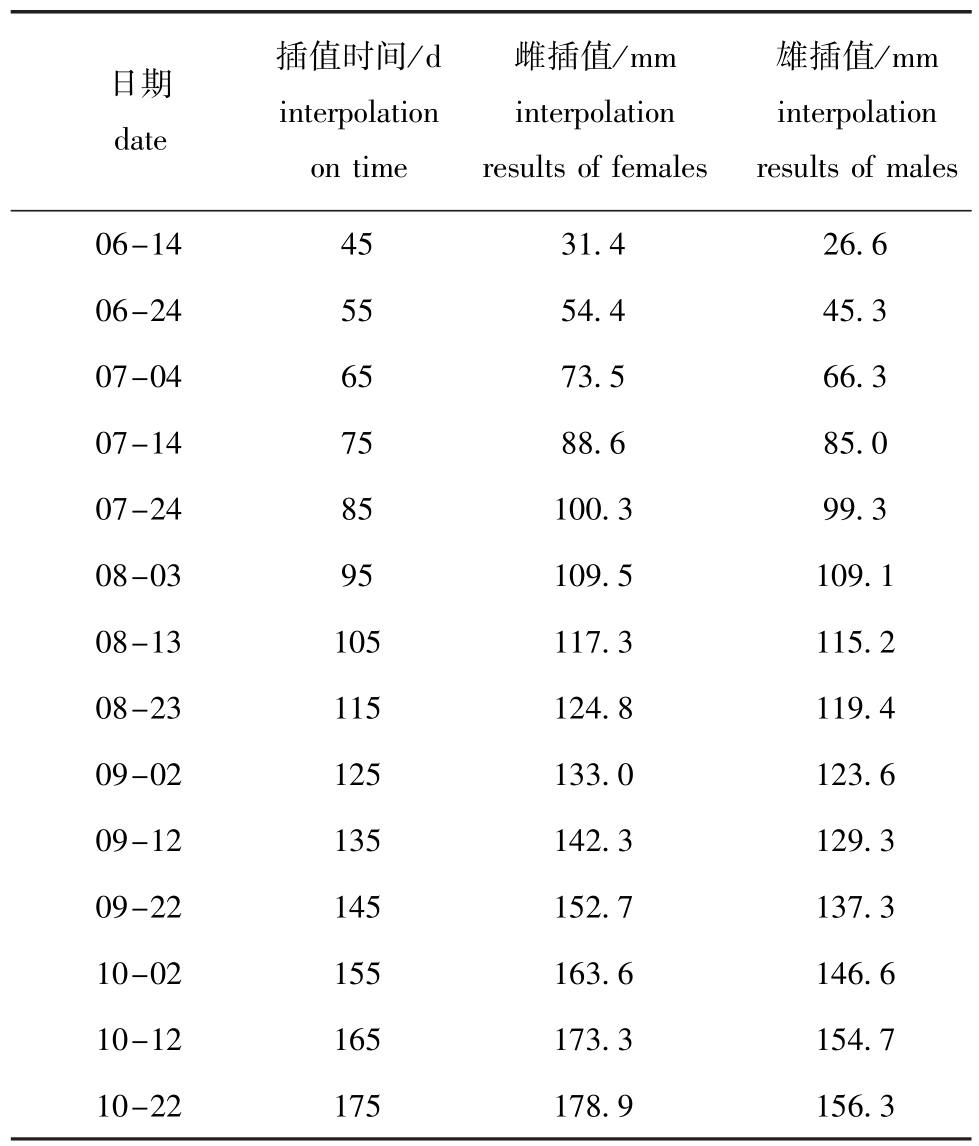
日期date插值时间/d interpolation on time雌插值/mm interpolation results of females雄插值/mm interpolation results ofmales 06-14 45 31.4 26.6 06-24 55 54.4 45.3 07-04 65 73.5 66.3 07-14 75 88.6 85.0 07-24 85 100.3 99.3 08-03 95 109.5 109.1 08-13 105 117.3 115.2 08-23 115 124.8 119.4 09-02 125 133.0 123.6 09-12 135 142.3 129.3 09-22 145 152.7 137.3 10-02 155 163.6 146.6 10-12 165 173.3 154.7 10-22 175 178.9 156.3
根据插值结果进行线性回归,推导出Von Bertallanffy生长方程为
雌性:
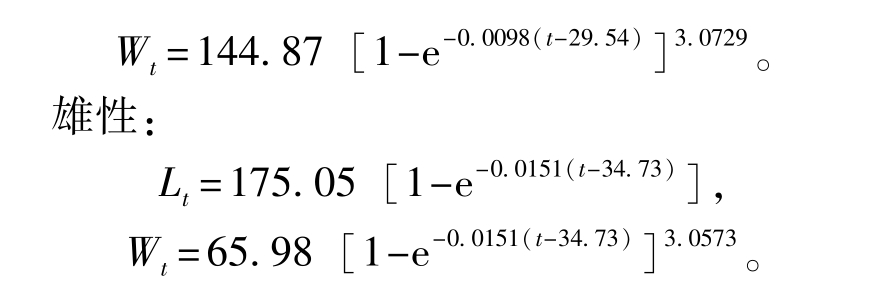
绘制不同日龄对虾体长(Lt)、体质量(Wt)生长曲线,结果显示,体长生长曲线是一条逐渐趋近渐近值的曲线(图5),而体质量生长曲线是一条存在拐点的不对称的“S”型曲线(图6)。
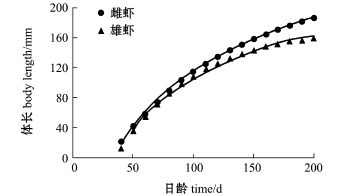
图5 皮口海域中国对虾体长生长曲线
Fig.5 Body length grow th curve of Chinese shrimp Fenneropenaeus chinensis in Pikou Bay
将体长、体质量的实测值与Von Bertallanffy生长方程的计算值进行比较(表3),结果表明,总体上实测值与计算值差异不大,说明拟合的生长方程与中国对虾实际生长特征较符合。
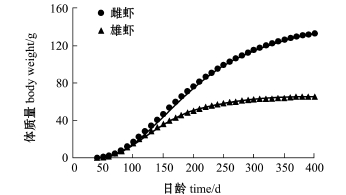
图6 皮口海域中国对虾体质量生长曲线
Fig.6 Body weight grow th curve of Chinese shrimp Fenneropenaeus chinensis in Pikou Bay
表3 皮口海域中国对虾体长和体质量推算值与实测值的比较
Tab.3 Com parison of estimated and measured values of body length and body weight of Chinese shrimp Fenneropenaeus chinensis in Pikou Bay
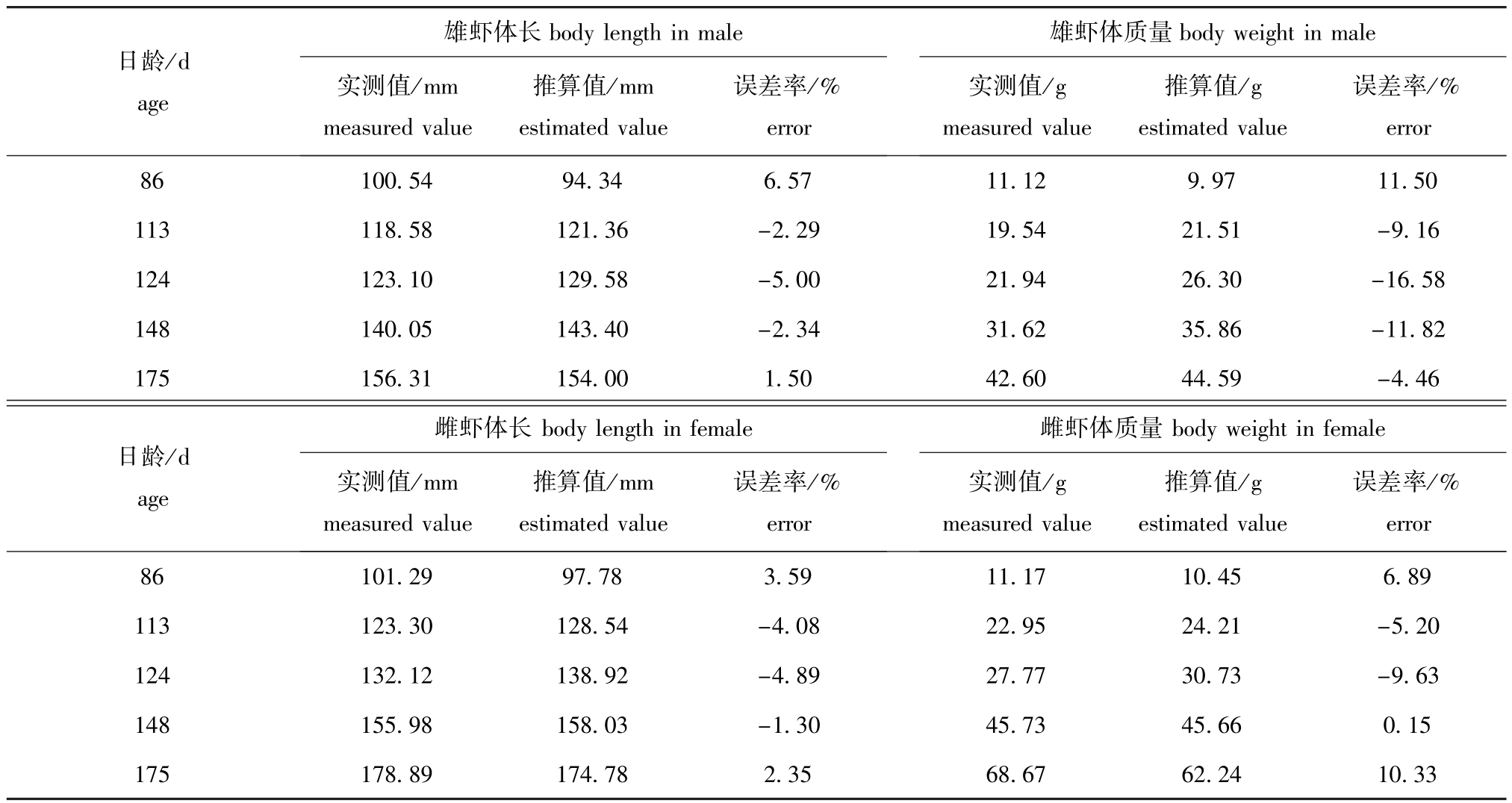
雄虾体长日龄/d age body length in male实测值/mm measured value推算值/mm estimated value误差率/%误差率/%雄虾体质量error body weight in male实测值/g measured value推算值/g estimated value error 86 100.54 94.34 6.57 11.12 9.97 11.50 113 118.58 121.36-2.29 19.54 21.51-9.16 124 123.10 129.58-5.00 21.94 26.30-16.58 148 140.05 143.40-2.34 31.62 35.86-11.82 175 156.31 154.00 1.50 42.60 44.59-4.46日龄/d age雌虾体长body length in female实测值/mm measured value推算值/mm estimated value误差率/%误差率/% error雌虾体质量body weight in female实测值/g measured value推算值/g estimated value error 86 101.29 97.78 3.59 11.17 10.45 6.89 113 123.30 128.54-4.08 22.95 24.21-5.20 124 132.12 138.92-4.89 27.77 30.73-9.63 148 155.98 158.03-1.30 45.73 45.66 0.15 175 178.89 174.78 2.35 68.67 62.24 10.33
2.4 中国对虾的生长速度与加速度
雌性对虾体长、体质量生长速度方程分别为
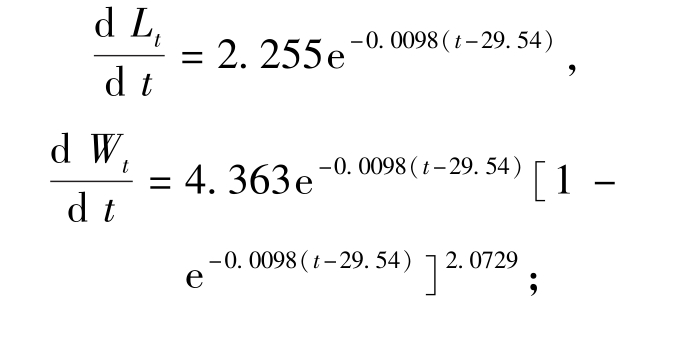
雄性对虾体长、体质量生长速度方程分别为

中国对虾体长生长速度曲线(图7)表明:中国对虾体长生长速度随日龄的增加而逐渐减缓,雌、雄存在生长差异;日龄小于74 d时(7月13日之前),雄虾体长的生长速度快于雌虾,之后则相反;整个生长周期中,雄虾的生长系数k值比雌虾大,故以更快的生长速度接近渐近体长。

图7 皮口海域中国对虾体长生长速度曲线
Fig.7 Grow th curve of body length in Chinese shrimp Fenneropenaeus chinensis in Pikou Bay
中国对虾体质量生长速度曲线(图8)表明:体质量生长速度呈先增大后减小的趋势,初期差别不大,后期雌性明显快于雄性。推算的雄虾生长拐点(tr)为108.74 d(8月17日),雌虾生长拐点为144.13 d(9月21日)。体质量在生长拐点前的生长速度均处于递增阶段,在拐点后减弱(图9)。

图8 皮口海域中国对虾体质量生长速度曲线
Fig.8 Grow th curve of body weight in Chinese shrimp Fenneropenaeus chinensis in Pikou Bay
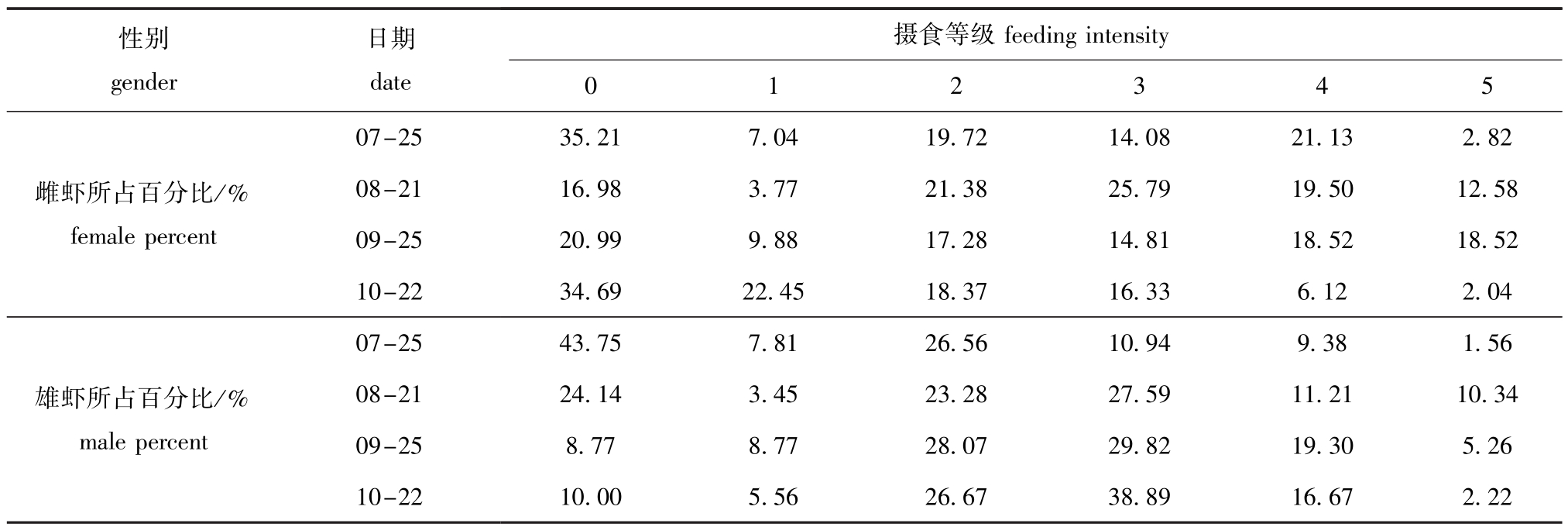
2.5 中国对虾的摄食
中国对虾摄食强度等级存在月份差异(图10)。7月份空胃率(0级)最高,为39.26%,9月份的空胃率最低,为15.94%。随时间的变化,空胃率呈先下降后升高的趋势;1级所占比例一直维持在较低水平,最高值出现在9月,仅为9.42%;2级所占比例月间变化不大,约为22%;3级所占比例在8月和10月出现峰值,分别为26.55%和31.91%;4级与5级所占比例均呈先升高后下降趋势,最高值均出现在9月,分别为18.84%和13.05%。总的来说,夏季航次(7月、8月)出现空胃率和5级摄食强度的比例要大于秋季(9月、10月),出现3级摄食强度的比例与秋季类似;而出现2级和4级摄食强度的比例要小于秋季。此外,虽然摄食强度在雌、雄对虾间出现比例分化,但也具备一定规律(表4)。例如,雌虾和雄虾摄食等级均以空胃(0级)和3级的出现比例最高,而1级和5级所占比例最低。
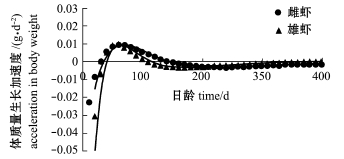
图9 皮口海域中国对虾体质量生长加速度曲线
Fig.9 G row th acceleration curve of body weight in Chinese shrim p Fenneropenaeus chinensis in Pikou Bay
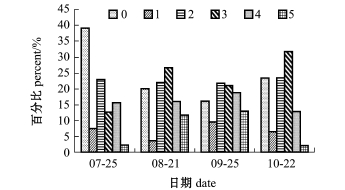
图10 皮口海域中国对虾摄食等级变化
Fig.10 Changes in feeding intensity of Chinese shrimp Fenneropenaeus chinensis in Pikou Bay
3.1 皮口海域中国对虾的生长特性
甲壳动物生长不同于鱼类,个体的蜕皮生长本不适用于Von Bertallanffy生长方程[26],然而,同一种群的平均生长曲线可以看成近似连续的,符合方程评估要求[27-29]。截至目前,国内外学者通过生长模型评估了不同种类甲壳动物的生长特性[25,30-31]。中国学者对天津外海、鳌山湾、闽东海区、象山港等海区中国对虾的生长规律进行了详细的研究,为资源保护和放流策略的制定提供了科学的参考。
邓景耀[32]拟合了渤海中国对虾的体长与体质量关系,雌虾W=11×10-6L3.0044,雄虾W=11.3×10-6L2.9987。本研究中也基于Taylor公式,拟合了中国对虾体长与体质量的关系,雌虾W=8×10-6L3.0729,雄虾W=9×10-6L3.0573。研究发现,皮口海域的雌、雄对虾,其生长指数与等速生长指数(b=3)无显著性差异(P>0.05),表明采样群体的体长与体质量呈匀速生长状态。
本研究中拟合的生长方程参数为:雄性L∞= 175.05 mm,W∞=65.98 g,k=0.0151,t0= 34.73;雌性L∞=230.09 mm,W∞=144.87 g,k= 0.0098,t0=29.54。据报道,渤海湾[32]中国对虾生长方程的参数为:雄性L∞=163.5 mm,W∞= 49.1 g,k=0.0168,t0=9;雌性L∞=201.3 mm,W∞=91.8 g,k=0.018,t0=25。此外,黄海南部鳌山湾[20]中国对虾生长方程的参数为:雄性L∞= 172.64 mm,W∞=38.81 g,k=0.026,t0=24.17;雌性L∞=200.83 mm,W∞=104.05 g,k=0.019,t0=23.70。与后两者相比,皮口海域中国对虾t0值较大,表明该海域中国对虾体质量开始增加的时间相对较晚;而生长系数k值较小,表明该海域中国对虾接近其渐近体长的生长速度慢于其他群体,但体长渐近值L∞和体质量渐近值W∞较大,尤其是体质量明显增大。造成上述现象的原因除与海域自然环境有关外,大规模放流导致的种群结构变化不容忽视[33]。总体上,本研究中所获得的渐近体长和体质量参数相对较大,表明皮口海域适宜中国对虾生长,是理想的增殖场所。
表4 皮口海域雌雄中国对虾摄食等级比较
Tab.4 Comparison of feeding intensity between female and male Chinese shrim p Fenneropenaeus chinensis in Pikou Bay
性别gender日期摄食等级feeding intensity date 012345雌虾所占百分比/% female percent 07-25 35.21 7.04 19.72 14.08 21.13 2.82 08-21 16.98 3.77 21.38 25.79 19.50 12.58 09-25 20.99 9.88 17.28 14.81 18.52 18.52 10-22 34.69 22.45 18.37 16.33 6.12 2.04雄虾所占百分比/% male percent 07-25 43.75 7.81 26.56 10.94 9.38 1.56 08-21 24.14 3.45 23.28 27.59 11.21 10.34 09-25 8.77 8.77 28.07 29.82 19.30 5.26 10-22 10.00 5.56 26.67 38.89 16.67 2.22
从皮口海域中国对虾生长曲线可知(图5和图6):6月至9月中旬间体长生长迅速,9月中旬雌、雄对虾体长可达144 mm和133 mm,为渐近体长L∞的60%以上,而9月中旬以后,体长生长逐渐减缓;到10月中旬,雄虾达170日龄,体质量为43 g以后,基本不再增加体质量,此时雌虾体质量增长速度虽有放缓,但体质量依旧增加。本研究发现,中国对虾体长生长早于体质量生长,达到最大体长之后体质量还会继续增加。这与邓景耀[32]的研究结果相一致。
生长速度曲线进一步表明(图7和图8):雌虾体长为0~42日龄(6月11日)时,体长增长速度大于2 mm/d,至113日龄(8月21日)时,体长增长速度保持在1~2 mm/d,之后趋缓,直至渐近体长L∞的生长速度;而雄虾体长为0~53日龄(6月22日)时,体长增长速度大于2 mm/d,至99日龄(8月7日)时,增长速度降至在1~2 mm/d,最后增长趋缓,直至达到渐近体长L∞的生长速度。在体质量方面,雌、雄对虾的生长速度曲线均呈不对称的倒二次曲线型,但拐点不同,其中,雌虾体质量拐点为144日龄前后,即9月21日,雄虾较早,出现在109日龄前后,即8月17日。故雌、雄对虾的生长拐点相差5周左右。此外,本研究中还发现,皮口海域雌、雄对虾最大日体质量增长量分别为0.63、0.44 g。有研究表明,闽东海区[34]中国对虾雌虾生长拐点出现在105日龄前后,雄虾生长拐点出现在98日龄前后,最大日体质量增长量分别为0.61、0.36 g;渤海莱州湾[35]中国对虾雌虾生长拐点出现在90日龄前后,雄虾生长拐点出现在71日龄前后,而最大日体质量增长量分别为0.92、0.66 g。黄海南部鳌山湾[20]中国对虾雌、雄生长拐点分别出现在80日龄和77日龄前后,此时最大日体质量增长量分别为0.88、0.47 g。比较发现,皮口海域中国对虾生长相对较慢,体质量增长周期长,拐点出现时间晚于其他海域。
食性分析发现,各航次皮口海域中国对虾空胃率百分比高达16%~40%,而摄食等级达到5级的百分比仅为2%~13%。摄食等级普遍不高的原因,一方面可能与该海域饵料现状有关,饵料的种类、丰度会对中国对虾摄食产生影响[36];另一方面,海区水温、盐度、水体污染程度和敌害生物等也影响中国对虾的摄食[37-39]。此外,7—9月份虽然是中国对虾生长的黄金期,索饵活动频繁,但是由于在此期间对虾需要经历数次蜕皮,蜕皮时整个胃随之蜕掉,故蜕皮前后胃是空的,平均摄食强度并不大。10月中下旬为对虾交尾盛期,交尾活动也会对其摄食强度产生影响[12],这也可能造成皮口海域中国对虾空胃率始终较高、摄食强度普遍不高的原因。今后尚需进一步研究哪些环境或生理因子对黄海北部海域中国对虾生长起决定作用。
3.2 皮口海域中国对虾的资源保护和利用策略
目前,黄海北部海域中国对虾放流在5月底至6月初完成,禁渔期恰好从6月1日到9月1日,此时雄虾可以达到生长拐点,而雌虾并未达到。考虑到皮口海域中国对虾生长较慢,对虾生长迅速期为6—9月,适当延迟开捕时间至雌虾的生长拐点(9月21日)前后,会使雌虾生长更充分,更易获得最大经济产值。
综上所述,对皮口海域中国对虾的生长特性和摄食等级构成的研究结果,将有助于了解目前黄海北部海域开展大规模增殖放流后,中国对虾种群的新特性,并为制定放流种类的适应性管理策略提供了依据。
参考文献:
[1] 孙鹏飞.莱州湾及黄河口水域渔业资源结构特征与渔业生态系统健康评价的初步分析[D].上海:上海海洋大学,2014.
[2] 傅秀梅.中国近海生物资源保护性开发与可持续利用研究[D].青岛:中国海洋大学,2008.
[3] Blankenship H L,Leber K M.A responsible approach to marine stock enhancement[J].American Fisheries Society Symposium,1995,15:165-175.
[4] Bohnsack JA,Ecklund A M,Szmant A.Artificial reef research:is there more that the attraction-production issue[J].Fisheries,1997,22(4):14-16.
[5] Jiang Yazhou,Cheng Jiahua,Li Shengfa.Temporal changes in the fish community resulting from a summer fishingmoratorium in the northern East China Sea[J].Marine Ecology Progress Series,2009,387:265-273.
[6] Levelton C R.Toward an Atlantic Coast Commercial Fisheries Licensing System:a Report Prepared for the Department of Fisheries and Oceans,Government of Canada[M].Ottawa,Ont.,Canada:Communications Branch,Department of Fisheries and Oceans,1981.
[7] 张建华,梁澄,丁建乐.挪威海洋捕捞及渔船管理概述[J].渔业现代化,2012,39(4):67-72.
[8] Koenig C C,Coleman F C,Grimes C B,et al.Protection of fish spawning habitat for the conservation of warm-temperate reef-fish fisheries of shelf-edge reefs of Florida[J].Bulletin of Marine Science,2000,66(3):593-616.
[9] Masuda R,Tsukamoto K.Stock enhancement in Japan:review and perspective[J].Bulletin of Marine Science,1998,62(2):337-358.
[10] 见时璋,陈世骧,李汝祺,等.中国大百科全书:生物学[M].北京:中国大百科全书出版社,1991:293.
[11] 金显仕.黄渤海渔业资源增殖基础与前景[M].北京:科学出版社,2014.
[12] 邓景耀,叶昌臣,刘永昌.渤黄海的对虾及其资源管理[M].北京:海洋出版社,1990.
[13] 杨爽,宋娜,张秀梅,等.基于线粒体控制区序列的三疣梭子蟹增殖放流亲蟹遗传多样性研究[J].水产学报,2014,38(8):1089-1096.
[14] 李文抗,刘克奉,苗军,等.中国对虾增殖放流技术及存在的问题[J].天津水产,2009(2):13-18.
[15] 黄硕琳.我国渔业资源增殖放流管理的分析研究[J].江西水产科技,2011(3):1-5.
[16] 潘绪伟,杨林林,纪炜炜,等.增殖放流技术研究进展[J].江苏农业科学,2010(4):236-240.
[17] 程家骅,姜亚洲.海洋生物资源增殖放流回顾与展望[J].中国水产科学,2010,17(3):610-617.
[18] 王文波,邵武功,林源,等.黄海北部中国对虾放流虾生长的研究[J].水产科学,1998,17(1):3-5.
[19] 张波,金显仕,吴强,等.莱州湾中国明对虾增殖放流策略研究[J].中国水产科学,2015,22(3):361-370.
[20] 李忠义,金显仕,吴强,等.鳌山湾增殖放流中国明对虾的研究[J].水产学报,2014,38(3):410-416.
[21] 楼宝.象山港人工放流中国对虾的生长特性研究[J].浙江水产学院学报,1998,17(1):51-58.
[22] 徐增洪,周鑫,水燕.克氏原螯虾的食物选择性及其摄食节律[J].大连海洋大学学报,2012,27(2):166-170.
[23] 陈上及,马继瑞.海洋数据处理分析方法及其应用[M].北京:海洋出版社,1991.
[24] 殷名称.鱼类生态学[M].北京:中国农业出版社,1995:57-61.
[25] 刘军,龚世园,何绪刚,等.湖北武湖日本沼虾的生长特性[J].湖泊科学,2003,15(2):177-183.
[26] DallW.对虾生物学[M].陈楠生,译.青岛:青岛海洋大学出版社,1992:229-238.
[27] Jamieson G S,Bourne N.North Pacific Workshop on Stock Assessment and Management of Invertebrates:Nanaimo,British Columbia,May 7-10,1984[M].Ottawa:Department of Fisheries and Oceans,Information and Publications Branch,1986.
[28] Caddy J.Size-frequency analysis for Crustacea:moult increment and frequencymodels for stock assessment[J].Kuwait Bulletin of Marine Science,1987(9):43-61.
[29] Garcia S,Le Reste L.Life Cycles,Dynamics,Exploitation and Management of Coastal Penaeid Shrimp Stocks[M].Rome:Foodand Agriculture Organization of the United Nations,1981.
[30] 李旭杰,任一平,徐宾铎,等.青岛市古镇口湾增殖放流日本对虾的生长特性[J].南方水产,2008,4(4):26-29.
[31] 汪留全,周婉华.池养中华绒螯蟹幼蟹生长特性的初步研究[J].水产学报,1989,13(1):17-23.
[32] 邓景耀.渤海对虾(Penaeus orientalis Kishinouye)的生长[J].海洋水产研究,1981(2):85-93.
[33] 刘萍,李健,何玉英,等.中国明对虾种质资源研究现状与保护策略[J].海洋水产研究,2004,25(5):80-85.
[34] 张澄茂.闽东海区中国对虾放流虾的生长特性[J].水产学报,2001,25(2):116-119.
[35] 徐炳庆.山东近海中国对虾增殖放流的研究[D].上海:上海海洋大学,2011.
[36] 黄国强,董双林,王芳,等.饵料种类和摄食水平对中国对虾蜕皮的影响[J].中国海洋大学学报,2004,34(6):942-948.
[37] 胡钦贤,陆建生.中国对虾生长与环境因子关系的初步探讨[J].海洋学研究,1990,8(2):58-62.
[38] 刘海映,董婧,王文波,等.黄海北部对虾放流水域污染分析[J].海洋环境科学,2000,19(1):60-63.
[39] 董婧,刘海映,王文波,等.黄海北部对虾放流区的浮游动物[J].大连水产学院学报,2000,15(1):65-70.
Grow th characteristics of Chinese shrim p Fenneropenaeus chinensis in Pikou Bay in north Yellow Sea
Abstract:The body length(L),body weight(W)and stomach contentweremeasured in 1434 individuals of Chinese shrimp Fenneropenaeus chinensis collected in the area of Pikou Bay in North Yellow Sea by six vessels during investigation from June 2015 to October 2015 to evaluate the growth characteristics of Chinese shrimp.Results showed that the relationship between body length and body weight of the Chinese shrimp was described by a power function formula:W=8×10-6L3.0729in female and W=9×10-6L3.0573in male.The growth equations of the Chinese shrimp was expressed by Von Bertallanffy growth equation as Lt=230.09[1-e-0.0098(t-29.54)],and Wt=144.87[1-e-0.0098(t-29.54)]3.0729in female;Lt=175.05[1-e-0.0151(t-34.73)]and Wt=65.98[1-e-0.0151(t-34.73)]3.0573in male. There was different growth rate between female and male in Pikou Bay,better in male than that in female at early life.The female shrimp had better growth than themale ones did about74 days after stocking,with infection points in body weight in male about109 days and 144 days in female.The growth index k seemed to be smaller in Pikou Bay compared with
references:recorded in other sea areas,indicating that the growth of Chinese shrimp in Pikou Bay was poorer than in other sea areas,even though L∞and W∞were larger than in other sea areas.There were different degrees of stomach contents in variousmonths,and growth characteristics of Chinese shrimp population after large scale stock enhancement in North Yellow Sea were discussed.The findingswould be beneficial for establishment of stock enhancement stratege in the future.
Key words:Fenneropenaeus chinensis;North Yellow Sea;stock enhancement;growth characteristics
中图分类号:S917;Q953
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.05.004
文章编号:2095-1388(2016)05-0488-09
收稿日期:2016-01-16
基金项目:辽宁省科学技术计划项目(2014203016);辽宁省教育厅科学研究项目(L201614);教育部留学回国人员科研启动基金资助项目(2015-311);农业部北方海水增养殖重点实验室开放课题(2014-MSENC-KF-14);大连海洋大学博士启动基金资助项目(2014017349)