蛋白质交联与食品蛋白配料功能性的研究进展
姜梦云,刘俊荣,田元勇
(大连海洋大学食品科学与工程学院,辽宁大连116023)
摘要:为研究蛋白质交联技术对蛋白质的功能性作用,对国内外食品体系中蛋白质交联的研究状况进行了系统回顾。首先,围绕食品蛋白配料最重要的两种功能性(乳化性、凝胶性),分析了“蛋白-蛋白”与“蛋白-糖”两种交联类型各自对乳化功能及凝胶功能的促进作用;其次,进一步探讨了不同蛋白质交联对热稳定性、亲水性、成膜性、发泡性和其他食品配料的常见加工性能的影响。研究表明:多数与蛋白质有关的交联对食品蛋白配料功能均产生积极作用,且针对“蛋白-蛋白”交联的研究多于“蛋白-糖”交联;国内外有关蛋白质交联的研究涵盖了动物、植物、乳和蛋等主要食品蛋白源,且多数集中在对单一蛋白源的研究,而对混合蛋白源的研究相对匮乏;今后应针对蛋白质交联机理,特别是加工过程中蛋白自然氧化进行深入探索,将蛋白源应用范围进一步扩展到低值蛋白、加工副产物及混合蛋白源。
关键词:蛋白质交联;食品蛋白配料;功能性
作为生命构成基础的蛋白质是食物的重要组分之一。目前,由于蛋白源利用的局限性,使其无法满足现代食品开发与加工需求,其中最具代表性的是鱼蛋白。凝胶性一直是鱼糜制品最重要的属性,由于鱼蛋白易遭受蛋白变性,导致其凝胶效果较差,但通过改性处理可以有效地解决这个问题[1]。蛋白质交联是常见的蛋白质化学改性方法之一,它是指在自然或变性状态下对蛋白质功能产生重大影响的一类化学反应。其中包括蛋白-蛋白质交联,即通过一定的化学试剂或催化剂,在蛋白质内部多肽链间(分子内交联)或蛋白质间(分子间交联)形成共价键,从而起到改善蛋白质功能性的目的[2]。Gerrard[3]将此种交联分成美拉德反应交联、二硫键交联、转谷氨酰胺酶交联、酪氨酸残基交联和脱氢蛋白质交联。此外,蛋白质和糖也会发生交联,形成蛋白质-糖复合物,Schmitt等[4]把这种交互作用归因于静电、氢键、范德华力、疏水作用。美拉德反应则是最高效的制备蛋白质-糖复合物的手段。上述交联形式均通过改变蛋白质结构使其具备某种功能特性。
在食品体系内,应用蛋白质交联技术对蛋白质功能性进行修饰的研究较多,包括乳化性、凝胶性、溶解性、持水力、热稳定性、成膜性、起泡性、pH稳定性和抗过敏等功能性[5-13]。涉及的蛋白源类型有动物蛋白、植物蛋白、乳蛋白和卵蛋白[14-17]。本研究中,对国内外食品体系中影响蛋白功能性的蛋白质交联的研究进行了系统的回顾,着重围绕食品蛋白配料的乳化性和凝胶性进行分析讨论,并对今后的研究方向进行了展望。
1 改善乳化性的蛋白质交联
1.1 “蛋白-蛋白”交联对乳化性的影响
食品体系中蛋白质的乳化性基于其抗聚集的表面活性[18-19],而蛋白质结构的改变势必会对乳化性产生影响。“蛋白-蛋白”交联方法可分为酶促法和非酶促法。特异性及反应条件温和的优势使得酶促法最为常用;非酶促法则采用戊二醛或过氧化氢等化学交联剂,但存在一定的食品安全问题。
转谷氨酰胺酶交联的高效性及安全性使其被广泛应用于食品工业中。它可以催化蛋白质或肽键中谷氨酰胺残基的γ-甲酰胺基与其他蛋白质中赖氨酸的ε-氨基或赖氨酸残基等伯胺之间的酰胺基转移反应。根据其酰基受体的不同,可将其分为3类:(1)赖氨酰残基;(2)赖氨酸的ε-氨基;(3)水(脱酰胺)[20]。Færgemand等[21]使用转谷氨酰胺酶交联,分别由酪蛋白酸钠、αs1-酪蛋白、β-酪蛋白、β-乳球蛋白制备乳蛋白膜,因发现膜表面黏弹性的增加与蛋白膜中液滴和气泡稳定性的提高相关,故认定转谷氨酰胺酶交联是一种潜在的控制乳液稳定性的手段。酪氨酸酶也是一种常用交联剂,它可以催化单酚的邻位羟基化及随后的二酚氧化成醌[22]。Isaschar-Ovda等[23]用酪氨酸酶作为交联剂,对大豆油包水乳液进行了研究,使分层速率大大降低,黏度增加,乳液稳定性提高。此外,过氧化物酶也有促交联作用,Li等[24]研究辣根过氧化物酶对酪蛋白的交联作用时发现,乳化活性指数和乳化稳定指数显著提高。而在化学交联研究中,Park等[25]将戊二醛用于促大豆分离蛋白的交联。
“蛋白-蛋白”交联对乳化性影响的研究报道多见于乳蛋白体系,如Færgemand等[21,26]长期从事酪蛋白酸钠、β-乳球蛋白等乳蛋白质交联的研究。在植物蛋白方面,Marcoa等[27]用转谷氨酰胺酶分别交联豌豆、大豆与米粉面团的混合物。而有关动物源的乳化性,最常见的是蛋白质氧化对肉品质的影响研究。蛋白质氧化是指受到反应物直接诱导或者受到氧化应激产物间接诱导的蛋白质共价改性,是一种会降低肉的营养价值、损害肉品质的蛋白质交联现象[28]。Sun等[29]用猪肉作为研究对象,探讨了蛋白质氧化对肌原纤维蛋白乳化特性的影响。此类研究有助于阐明蛋白质的氧化机理,从而解决实际生产问题以保证蛋白质品质。此外,Hu等[30]将蓝园鲹Decapterusmaruadsi和脱脂花生粕混合作为异源蛋白配料,研究了转谷氨酰胺酶对其乳化特性的影响。目前,对此类混合源蛋白的研究很匮乏,这种方法在增加植物蛋白配料营养价值的同时,还可提高低值水产蛋白利用率。
1.2 “蛋白-糖”交联对乳化性的影响
“蛋白-糖”交联有单糖或低聚糖作用和多糖作用两大类型。葡萄糖是最常见的通过美拉德反应与蛋白质发生交联的单糖。Saeki[7]用葡萄糖对鲤Cyprinus carpio肌原纤维功能性进行研究发现,在美拉德反应早期葡萄糖对乳化活性和乳化稳定性均有所提高。You等[9]在研究鲢Hypophthalmichthys molitrix水溶性蛋白与不同糖类形成聚合物的乳化性中发现,处理样品的糖分子量越低,其乳化特性越差,如木糖分子量最低,其最易发生美拉德反应,生成较多不溶类黑素,使溶液溶解度降低,并进一步导致乳化性下降。Kato等[31]在研究卵清蛋白美拉德反应时发现,经葡萄糖反应后,样品的乳化性比空白样品更高,但效果弱于葡萄糖6-磷酸,这是因为葡萄糖6-磷酸除了具有羰基外,还具有磷酰基团,有助于卵清蛋白与其作用。
根据Dickinson[32]的理论,乳液液滴通过蛋白-多糖作用形成稳定的方法有两种:一是先制备蛋白乳液,后添加碳水化合物,在液滴表面形成双层膜以保持稳定;二是先制备蛋白-碳水化合物复合物,并以此作为表面活性剂加入到液滴中进行均质,使之形成稳定乳液。然而,由于第一种方法在碳水化合物添加量低时,液滴碰撞速度会快于碳水化合物与液滴表面蛋白质膜形成速度,导致液滴发生絮凝,因此,第二种方法被广泛使用,且首选葡聚糖作为交联剂。
“蛋白-糖”相互作用对蛋白改性的研究较多,其中乳品蛋白占主导:Lillard等[8]用葡聚糖35、葡聚糖100交联乳清蛋白,发现交联改性后产物的乳化稳定性要远远优于原料和酸改性产物;Tokaev等[33]用硫酸葡聚糖交联酪蛋白,也得出了乳化能力和乳化稳定性显著提高的结论;Dickinson等[34]用葡聚糖T-500、硫酸葡聚糖、藻酸丙二醇酯交联β-乳球蛋白。动物源蛋白中,You等[9]研究了5种糖(葡萄糖、木糖、半乳糖、低聚异麦芽糖、葡聚糖10)对鲢水溶性蛋白的乳化特性影响。Saeki[7]、Fujiwara等[35]分别用葡萄糖和葡聚糖对鲤肌原纤维进行了研究。Kato等[31]用葡萄糖和葡萄糖6-磷酸交联卵清蛋白,但这属于卵蛋白研究。植物源蛋白中,Diftis等[36]用羟甲基纤维素交联大豆分离蛋白。Burova等[37]用多种多糖(葡聚糖T-500、硫酸葡聚糖、甲基纤维素、羧甲基纤维素、果胶、阿拉伯胶、卡拉胶)对蚕豆11S豆球蛋白进行了研究。从这些研究中不难看出,选择的糖类大多为葡萄糖和不同分子量的葡聚糖。对于植物蛋白,还可以用各种食品胶来提高其乳化性。此外,同样具有羰基的多糖衍生物也可以作为交联剂。
2 增强凝胶性的蛋白质交联
2.1 “蛋白-蛋白”交联对凝胶的促进
蛋白质胶凝作用属于蛋白质结构性质,蛋白质发生有序聚集后,形成可以容纳水等物质的三维网状结构。此结构是由蛋白-蛋白间(氢键、疏水作用)、蛋白-水间的相互作用,以及邻近肽链间的吸引力和排斥力(静电相互作用)这3种作用达到平衡所致[18,38]。
同样,酶法也是“蛋白-蛋白”交联增强凝胶的主要方法,其中,转谷氨酰胺酶[39]及酪氨酸酶[23]应用最为广泛。近年来,有关漆酶的报道不断涌现。漆酶与蛋白质进行交联时,首先会催化蛋白质形成半醌自由基,然后自由基会进一步通过歧化和互变异构化等反应而生成醌,随后同酚类、胺类、氨基酸或者其他蛋白质等发生反应[40-42]。Cura等[42]用漆酶作为交联剂,可以使酪蛋白酸钠的凝胶强度增大。
目前,促凝胶交联研究集中在动物源蛋白方面,主要针对肉糜制品。Ahhmed等[43]用转谷氨酰胺酶使鸡肉肠、牛肉肠凝胶强度显著提高。Chanarat等[6]研究了金线鱼Nemipterus furcosus、印度鲭鱼Rastrelliger kanagurta、沙丁鱼Sardinella gibbosa的鱼糜凝胶性,发现交联后凝胶强度均显著增加,且金线鱼效果最强,这是因为其属于低脂鱼,而脂肪过多会阻碍凝胶基质的蛋白聚集。有关研究中所用的转谷氨酰胺酶大都属于外源性酶[20],而很多鱼本身含有的内源性转谷氨酰胺酶也是良好的交联剂,Yongsawatdigul等[14]利用罗非鱼内源性转谷氨酰胺酶来交联长蛇鲻Saurida spp.鱼糜后发现,其凝胶断裂强度和变形均有所增加。Giosafatto等[44]用转谷氨酰胺酶交联卵清蛋白,发现转谷氨酰胺酶会通过共价键增强凝胶形成,并使得弹性提高。涉及乳源蛋白的研究中,Lauber等[39]用转谷氨酰胺酶交联酸奶后断裂点力增加;Cura等[42]用漆酶作为交联剂,交联酪蛋白酸钠后使凝胶断裂点力增加。对于植物源蛋白而言,Sun等[45]用转谷氨酰胺酶诱导鸡胸肉肌原纤维/豌豆蛋白,发现其凝胶峰值力显著增加。Ramírez-Suárez等[46]则以鸡胸肉肌原纤维/大豆混合物为蛋白源,发现其储能模量显著提高。这类将植物蛋白与动物蛋白混合制备而成的蛋白配料,是一种用来制备少肉食品的手段。
2.2 “蛋白-糖”交联对凝胶的促进
关于用“蛋白-糖”交联来改善食品凝胶性的研究相对较少。Burova等[37]用果胶和硫酸葡聚糖分别交联蚕豆11S豆球蛋白,结果表明,凝胶阈值从13%分别下降到10.3%和10.5%,而凝胶阈值越小,表明凝胶效果越高。Handa等[47]用葡萄糖与干燥蛋清进行美拉德反应后,发现其凝胶断裂强度和断裂应力均明显增大。Hiller等[48]研究表明,在酪蛋白酸钠中添加乳糖后,凝胶强度得以提高。
3 食品加工性能与蛋白质交联
除乳化性和凝胶性外,蛋白质交联还可以对食品蛋白配料的加工性能进行改性。本研究中涉及到的加工性能有热稳定性、溶解性、持水力、成膜性、起泡性、消化性、pH稳定性和抗过敏性(表1)。
3.1 蛋白质交联与热稳定性
You等[9]研究发现,5种糖对鲤肌肉蛋白的热稳定性均有积极作用,其中,葡聚糖10的效果最为显著。Babiker等[13]用半乳甘露聚糖、转谷氨酰胺酶和胰凝乳蛋白酶处理大豆蛋白,其中,半乳甘露聚糖处理的样品溶解性几乎不受温度影响,且保持在90%以上,而另外两种酶处理后,样品的溶解度随温度增加均有所下降,Kato等[31]将葡萄糖和葡萄糖6-磷酸与卵清蛋白交联,其溶解度也不会因加热显著下降。
3.2 蛋白质交联与亲水性
Saeki[7]对鲤肌原纤维进行糖基化改性,用葡萄糖处理后,样品溶解度始终高于空白样品。You等[9]对鲢的美拉德研究表明,加热后蛋白溶解度会立即下降,但经糖交联后样品的溶解度会恢复。Chanarat等[6]发现,经转谷氨酰胺酶处理后的金线鱼、印度鲭鱼和沙丁鱼的压榨水均减少,即持水力增加。Lillard等[8]发现,用葡聚糖35、葡聚糖10处理乳清蛋白后,虽然持水力不如原始乳清蛋白,但显著高于仅经过加热处理后的样品。
3.3 蛋白质交联与成膜性
Martucci等[49]用低浓度戊二醛制备的鱼明胶膜的抗张强度、氧气阻隔均有所提高。Lim等[17]用转谷氨酰胺酶制备卵清蛋白膜后发现,抗张强度和平衡水分的能力均有增加。
3.4 蛋白质交联与起泡性
Sarker等[11]用阿拉伯葡聚糖交联牛血清白蛋白发现,阿拉伯葡聚糖通过增加蛋白泡沫黏度及改变泡沫膜排水特性来提高起泡性。Yildirim等[50]用转谷氨酰胺酶交联大豆11S球蛋白和乳清蛋白混合物发现,虽然交联后起泡能力没有改变,但泡沫稳定性却显著提高。
3.5 蛋白质交联与其他加工性能
除上述常见的加工性能研究外,还有少量有关pH稳定性、抗过敏性、消化性和面团特性的研究(表1)。Salminen等[12]利用酯化果胶对乳清蛋白-果胶体系的稳定性进行了研究,结果发现,71%酯化度果胶体系的稳定性明显低于50%酯化度果胶体系,原因是高度酯化导致果胶颗粒中疏水甲酯基团含量增加,使得羧基含量减少,不利于氢键形成。Babiker等[13]用半乳甘露聚糖、转谷氨酰胺酶、胰凝乳蛋白酶处理大豆蛋白时发现,添加半乳甘露聚糖是最佳的去除大豆致敏性的手段。Giosafatto等[44]用转谷氨酰胺酶处理卵清蛋白后,在体外进行胃蛋白酶、胰蛋白酶、糜蛋白酶消化试验,结果表明,改性后的卵清蛋白有抵抗蛋白酶水解的性能,从而增加饱腹感。Rasiah等[53]用葡萄糖氧化酶处理小麦面粉后,制备出的羊角面碎屑性有所增加,虽然面包体积没有明显改变,但面包外形却更加蓬松、潮湿,并有气孔。
综上所述,除凝胶性和乳化性外,蛋白质交联多应用于成膜性和亲水性,热稳定性和起泡性次之,对pH稳定性、抗过敏性、消化性和面团特性涉及较少。四类蛋白源均可以利用蛋白质交联来改善加工性能。在研究溶解性时常常关联到乳化性,且溶解性与乳化性呈正相关。凝胶性也常与持水性一并被研究。此外,热稳定性的测定也可以通过特定温度下蛋白溶解性来体现。
表1 蛋白质交联对不同蛋白源及功能性影响的研究情况汇总
Tab.1 Functionality performances of varied protein sources induced by protein crosslinks
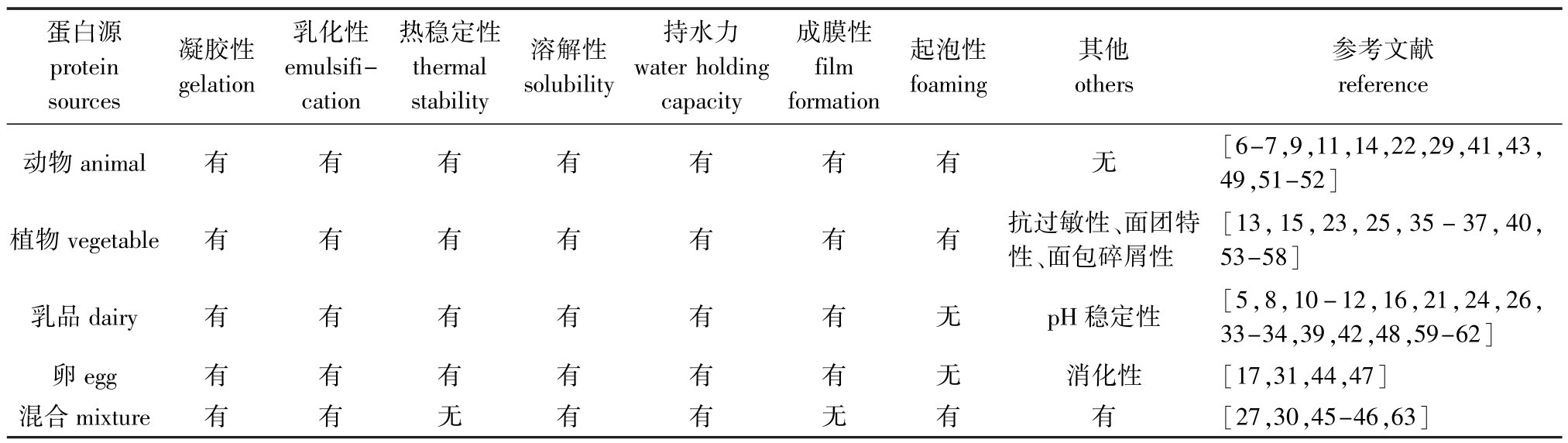
参考文献reference动物animal有有有有有有有无[6-7,9,11,14,22,29,41,43,49,51-52]蛋白源protein sources凝胶性gelation乳化性emulsification热稳定性thermal stability溶解性solubility持水力water holding capacity成膜性film formation起泡性foaming其他others植物vegetable有有有有有有有抗过敏性、面团特性、面包碎屑性[13,15,23,25,35-37,40,53-58]乳品dairy有有有有有有无pH稳定性[5,8,10-12,16,21,24,26,33-34,39,42,48,59-62]卵egg有有有有有有无消化性[17,31,44,47]混合mixture有有无有有无有有[27,30,45-46,63]
4 总结与展望
近30年来,在食品体系内应用蛋白质交联改善食品蛋白配料功能性的研究统计中(表2)可见,应用蛋白质交联的研究中,“蛋白-蛋白”交联的应用研究多于“蛋白-糖”交联,且转谷氨酰胺酶的应用最为广泛。从蛋白源角度分析,对乳源蛋白的研究所占比重最大,其次是植物源蛋白和动物源蛋白,而针对卵源蛋白的研究较少,对于混合源蛋白的研究则相对匮乏。在动物源蛋白的应用研究中,水生动物主要集中在以低值鱼或水产品加工副产物为原料,开发鱼糜制品。值得注意的是,很多水生动物自身就携带内源性转谷氨酰胺酶,基于此特性,可使其担负蛋白配料及交联剂的双重功能;对于陆产动物而言,蛋白质交联技术除改善肉糜凝胶性外,还可用于改良生产配方,制备低盐低脂制品。对于乳源蛋白,应用蛋白质交联技术主要是提高其乳化性、热稳定性,从而改善乳品的品质及质地。用蛋白质交联对植物源蛋白的功能性进行改良,可增加消费者的适口性;对于已经丧失功能性的蛋白质,如榨油残渣,通过交联可恢复其功能性,从而成为蛋白配料。对于混合蛋白源,多数研究是将动物蛋白与其他蛋白源混合使用,一是可满足动物蛋白的加工和健康需求,二是可增加其他蛋白源制品的营养价值。
需要指出的是,现有研究大多对蛋白质的功能性产生了积极作用,然而,尚有少量研究结果并不尽人意。Park等[25]将戊二醛用于促大豆分离蛋白交联,乳化稳定性和乳化活性均出现降低现象,这可能是由于交联后,其表面疏水性降低所致。Stuchell等[57]研究辣根过氧化物酶对大豆蛋白膜的作用时发现,膜的溶解度和抗张强度提高,而断裂延伸率下降,且水蒸气渗透率增大,解释原因为辣根过氧化物酶会引起蛋白质残基氧化和蛋白质降解。Jumnongpon等[64]用戊二醛、甲基乙二醛对可可蛋白进行改性研究中,没有得出理想的改性效果,分析原因是可可蛋白中的多酚含量太高。Truong等[65]用转谷氨酰胺酶对乳清蛋白交联后,发现凝胶强度下降,归因于分子内和分子间的交联过于强烈,导致形成的聚集体过大,无法形成凝胶的三维网络结构。此外,发生于食品加工和贮藏中的蛋白质自然氧化对食品品质也会造成损害,如Sun等[29]研究表明,蛋白质氧化可降低猪肉肌原纤维乳化性。
目前,蛋白质交联技术已经应用到实际生产加工中,但对其的研究空间依然很大,主要包含以下几点:①由于交联方法多样,对于某些交联机理的研究还存在不足,应继续深入探讨;②所研究的蛋白质交联机制几乎均基于对目标功能性的预先设计,而对于加工过程中自然形成的交联现象还缺乏清楚的理解与认识,这类交联的优势也应在生产中加以利用;③蛋白质氧化是一种有损蛋白质品质的交联,对其交联机制和解决办法均应深入探索;④蛋白质交联技术大多应用于单一蛋白,对于混合源蛋白的应用研究较少,而充分利用混合源蛋白是提高效益、降低成本、节约蛋白资源的好方法,应下气力研究;⑤对于低值蛋白、加工副产物而言,蛋白交联技术也是提高其经济价值的方法之一,有待大力推广。
表2 国内外不同食品蛋白源的蛋白质交联的研究统计
Tab.2 Protein crosslinks of varied protein sources at domestic and abroad

注:带有*的研究表明交联对食品功能性产生不利影响
Note:*means a negative impact of protein crosslinking on the functionality
原料类型protein source品种/组分species交联机制cross-linkingmechanism“蛋白-蛋白”protein-protein “蛋白-糖”protein-carbohydrate水生动物aquatic金线鱼、印度鲭鱼和沙丁鱼[6],鲤[7,35],罗非鱼及长蛇鲻[14],鲢[9],鱼明胶[49,51-52][6,14,49,51][7,9,35]陆产动物terrestrial [22,29*,41,43][11,52]植物类vegetable牛血清白蛋白[11],鸡肉[22,43],猪肉[29],牛皮胶原[41],猪肉+牛肉[51],牛肉[43]米粉+豌豆、大豆[27],菜豆[15]、蚕豆[37],小麦[40,53-54],花生[55],棉籽[56],大豆[13,23,25,36,57-58],可可[64][13,15,23,25*,40,53-56,64*][13,36-37,57*-58]乳类dairy酪蛋白[5,10,21,24,26,33,42],乳清蛋白[8,12,21,26,34,60-61],牛奶[16,39,48,62][5,8,10,16,21,24,26,39,42,48,61-62,65*][12,33-34,48,60]蛋类egg卵蛋白[17,31,44,47][17,44][31,47]混合蛋白mixture动物源+植物源[30,45-46]、乳品[46,59]、卵[63],植物源+乳品[27,50]、卵[27][27,30,45-46,50,59,63][63]
参考文献:
[1] 吴忠,刘俊荣,马永生.鱼蛋白的浓缩分离及其凝胶性的研究进展[J].大连海洋大学学报,2014,29(5):536-542.
[2] 李君文,赵新淮.食品中的蛋白质交联技术[J].食品工业科技,2011(1):380-384.
[3] Gerrard JA.Protein-protein crosslinking in food:methods,consequences,applications[J].Trends in Food Science&Technology,2002,13(12):391-399.
[4] Schmitt C,Sanchez C,Desobry-Banon S.Structure and technofunctional properties of protein-polysaccharide complexes:a review[J].Critical Reviews in Food Science and Nutrition,1998,38(8):689-753.
[5] Liu Mingxia,Damodaran S.Effect of transglutaminase-catalyzed polymerization ofβ-casein on its emulsifying properties[J].Journal of Agricultural and Food Chemistry,1999,47(4):1514-1519.[6] Chanarat S,Benjakul S,H-Kittikun A.Comparative study on protein cross-linking and gel enhancing effect ofmicrobial transglutaminase on surimi from different fish[J].Journal of the Science of Food and Agriculture,2012,92(4):844-852.
[7] Saeki H.Preparation of neoglycoprotein from carp myofibrillar protein by maillard reaction with glucose:biochemical properties and emulsifying properties[J].Journal of Agricultural and Food Chemistry,1997,45(3):680-684.
[8] Lillard JS,Clare D A,Daubert C R.Glycosylation and expanded utility of amodified whey protein ingredient via carbohydrate conjugation at low pH[J].Journal of Dairy Science,2009,92(1):35-48.
[9] You Juan,Luo Yongkang,Shen Huixing.Functional properties of water-soluble proteins from silver carp(Hypophthalmichthysmolitrix)conjugated with five different kinds of sugar[J].Food and Bioprocess Technology,2013,6(12):3596-3603.
[10] Juvonen H,Smolander M,Boer H,et al.Film formation and surface properties of enzymatically crosslinked casein films[J].Journal of Applied Polymer Science,2011,119(4):2205-2213.
[11] Sarker D K,Wilde P J,Clark D C.Enhancement of protein foam stability by formation of wheat arabinoxylan-protein crosslinks[J].Cereal Chemistry,1998,75(4):493-499.
[12] Salminen H,Weiss J.Effect of pectin type on association and pH stability ofwhey protein—pectin complexes[J].Food Biophysics,2014,9(1):29-38.
[13] Babiker E F E,Hiroyuki A,Matsudomi N,etal.Effectof polysaccharide conjugation or transglutaminase treatment on the allergenicity and functional propertiesof soy protein[J].Journal of Agricultural and Food Chemistry,1998,46(3):866-871.
[14] Yongsawatdigul J,Piyadhammaviboon P.Gel-enhancing effect and protein cross-linking ability of tilapia sarcoplasmic proteins[J].Journal of the Science of Food and Agriculture,2007,87(15):2810-2816.
[15] Mariniello L,Giosafatto C V L,Di Pierro P,et al.Synthesis and resistance to in vitro proteolysis of transglutaminase cross-linked phaseolin,themajor storage protein from Phaseolus vulgaris[J]. Journal of Agricultural and Food Chemistry,2007,55(12):4717-4721.
[16] Cura D E,Lille M,Partanen R,et al.Effect of Trichoderma reesei tyrosinase on rheology and microstructure of acidified milk gels[J].International Dairy Journal,2010,20(12):830-837.
[17] Lim L T,Mine Y,Tung M A.Transglutaminase cross-linked egg white protein films:tensile properties and oxygen permeability[J].Journal of Agricultural and Food Chemistry,1998,46(10),4022-4029.
[18] Damodaran S,Parkin K L,Fennema O R.Fennema's Food Chemistry[M].Boca Raton:CRC Press,2007:825-826.
[19] Hasenhuettl G L,Hartel RW.Food Emulsifiers and Their Applications[M].New York:Springer-Verlag,2008:7-8.
[20] Kuraishi C,Yamazaki K,Susa Y.Transglutaminase:its utilization in the food industry[J].Food Reviews International,2001,17(2):221-246.
[21] Færgemand M,Murray B S,Dickinson E.Cross-linking ofmilk proteinswith transglutaminase at the oil-water interface[J].Journal of Agricultural and Food Chemistry,1997,45(7):2514-2519.
[22] Lantto R,Puolanne E,Kruus K,et al.Tyrosinase-aided protein cross-linking:effects on gel formation of chicken breastmyofibrils and texture and water-holding of chicken breastmeathomogenate gels[J].Journal of Agricultural and Food Chemistry,2007,55(4):1248-1255.
[23] Isaschar-Ovdat S I,Rosenberg M,Lesmes U,et al.Characterization of oil-in-water emulsions stabilized by tyrosinase-crosslinked soy glycinin[J].Food Hydrocolloids,2014,43:493-500.
[24] Li Junwen,Li Tiejing,Zhao Xinhuai.Hydrogen peroxide and ferulic acid-mediated oxidative cross-linking of casein catalyzed by horseradish peroxidase and the impacts on emulsifying property andmicrostructure ofacidified gel[J].African Journalof Biotechnology,2009,8(24):6993-6999.
[25] Park S K,Bae D H,Rhee K C.Soy protein biopolymers crosslinked with glutaraldehyde[J].Journal of the American Oil Chemists'Society,2000,77(8):879-884.
[26] Færgemand M,Otte J,Qvist K B.Emulsifying properties ofmilk proteins cross-linked with microbial transglutaminase[J].International Dairy Journal,1998,8(8):715-723.
[27] Marcoa C,Rosell C M.Effect of different protein isolates and transglutaminase on rice flour properties[J].Journal of Food Engineering,2008,84(1):132-139.
[28] Soladoye O P,Juárez M L,Aalhus J L,et al.Protein oxidation in processed meat:mechanisms and potential implications on human health[J].Comprehensive Reviews in Food Science and Food Safety,2015,14(2):106-122.
[29] Sun Weizheng,Zhou Feibai,Sun Dawen,et al.Effect of oxidation on the emulsifying properties of myofibrillar proteins[J].Food and Bioprocess Technology,2013,6(7):1703-1712.
[30] Hu Xiao,Ren Jiaoyan,Zhao Mouming,et al.Emulsifying properties of the transglutaminase-treated crosslinked product between peanut protein and fish(Decapterusmaruadsi)protein hydrolysates[J].Journal of the Science of Food and Agriculture,2011,91(3):578-585.
[31] Kato Y,Aoki T,Kato N,etal.Modification of ovalbumin with glucose 6-phosphate by amino-carbonyl reaction.Improvement of protein heat stability and emulsifying activity[J].Journal of Agricultural and Food Chemistry,1995,43(2):301-305.
[32] Dickinson E.Interfacial structure and stability of food emulsions as affected by protein-polysaccharide interactions[J].Soft Matter,2008,4(5):932-942.
[33] Tokaev E S,Gurov A N,Rogov IA,et al.Properties of oil/water emulsions stabilized by casein-acid polysaccharidemixtures[J]. Food/Nahrung,1987,31(8):825-834.
[34] Dickinson E,Galazka V B.Emulsion stabilization by ionic and covalent complexes ofβ-lactoglobulin with polysaccharides[J]. Food Hydrocolloids,1991,5(3):281-296.
[35] Fujiwara K,Oosawa T,Saeki H.Improved thermal stability and emulsifying properties of carp myofibrillar proteins by conjugation with dextran[J].Journal of Agricultural and Food Chemistry,1998,46(4):1257-1261.
[36] Diftis N,Kiosseoglou V.Improvement of emulsifying properties of soybean protein isolate by conjugation with carboxymethyl cellulose[J].Food Chemistry,2003,81(1):1-6.
[37] Burova T V,Grinberg N V,Grinberg V Y,et al.Effects of polysaccharides upon the functional properties of 11 S globulin of broad bean[J].Carbohydrate Polymers,1992,18(2):101-108.
[38] 阚建全.食品化学[M].北京:中国农业大学出版社,2008:70.
[39] Lauber S,Henle T,Klostermeyer H.Relationship between the crosslinking of caseins by transglutaminase and the gel strength of yoghurt[J].European Food Research and Technology,2000,210(5):305-309.
[40] 燕茹.基于漆酶改性小麦再生醇溶蛋白纤维的研究[D].无锡:江南大学,2014.
[41] Jus S,Stachel I,SchloeglW,et al.Cross-linking of collagen with laccases and tyrosinases[J].Materials Science and Engineering:C,2011,31(5):1068-1077.
[42] Cura D E,Lantto R,Lille M,et al.Laccase-aided proteinmodification:effects on the structural properties of acidified sodium caseinate gels[J].International Dairy Journal,2009,19(12):737-745.[43] Ahhmed A M,Kawahara S,Ohta K,et al.Differentiation in improvements of gel strength in chicken and beef sausages induced by transglutaminase[J].Meat Science,2007,76(3):455-462.
[44] Giosafatto G V L,Rigby N M,Wellner N,et al.Microbial transglutaminase-mediated modification of ovalbumin[J].Food Hydrocolloids,2012,26(1):261-267.
[45] Sun Xiangdong,Arntfield SD.Gelation properties ofmyofibrillar/ pea protein mixtures induced by transglutaminase crosslinking[J].Food Hydrocolloids,2012,27(2):394-400.
[46] Ramírez-Suárez JC,Xiong Y L.Rheological properties ofmixed muscle/nonmuscle protein emulsions treated with transglutaminase at two ionic strengths[J].International Journal of Food Science&Technology,2003,38(7):777-785.
[47] Handa A,Kuroda N.Functional improvements in dried egg white through the Maillard reaction[J].Journal of Agricultural and Food Chemistry,1999,47(5):1845-1850.
[48] Hiller B,Lorenzen PC.Properties of set-style skim milk yoghurt as affected by an enzymatic orMaillard reaction inducedmilk pro-tein oligomerisation[J].LWT-Food Science and Technology,2011,44(4):811-819.
[49] Martucci JF,Accareddu A EM,Ruseckaite R A.Preparation and characterization of plasticized gelatin films cross-linked with low concentrations of glutaraldehyde[J].Journal of Materials Science,2012,47(7):3282-3292.
[50] Yildirim M,Hettiarachchy N S,Kalapathy U.Properties of biopolymers from cross-linkingwhey protein isolate and soybean 11S globulin[J].Journal of Food Science,1996,61(6):1129-1132.[51] Chiou B S,Avena-Bustillos R J,Shey J,et al.Rheological and mechanical properties of cross-linked fish gelatins[J].Polymer,2006,47(18):6379-6386.
[52] Morin L A,Temelli F,McMullen L.Interactions between meat proteins and barley(Hordeum spp.)β-glucan within a reduced-fatbreakfast sausage system[J].Meat Science,2004,68(3):419-430.
[53] Rasiah I A,Sutton K H,Low F L,et al.Crosslinking of wheat dough proteins by glucose oxidase and the resulting effects on bread and croissants[J].Food Chemistry,2005,89(3):325-332.[54] Rombouts I,Lagrain B,Delcour J A,et al.Crosslinks in wheat gluten films with hexagonal close-packed protein structures[J]. Industrial Crops and Products,2013,51:229-235.
[55] Gharst G,Clare D A,Davis JP,et al.The effect of transglutaminase crosslinking on the rheological characteristics of heated peanut flour dispersions[J].Journal of Food Science,2007,72(7):369-375.
[56] MarquiéC.Chemical reactions in cottonseed protein cross-linking by formaldehyde,glutaraldehyde,and glyoxal for the formation of protein films with enhanced mechanical properties[J].Journal of Agricultural and Food Chemistry,2001,49(10):4676-4681.
[57] Stuchell Y M,Krochta JM.Enzymatic treatments and thermal effects on edible soy protein films[J].Journal of Food Science,1994,59(6):1332-1337.
[58] Cabodevila O,Hill S E,Armstrong H J,et al.Gelation enhancement of soy protein isolate using the Maillard reaction and high temperatures[J].Journal of Food Science,1994,59(4):872-875.
[59] Uresti R M,Téllez-Luis S J,Ramírez JA,et al.Use of dairy proteins and microbial transglutaminase to obtain low-salt fish products from filleting waste from silver carp(Hypophthalmichthys molitrix)[J].Food Chemistry,2004,86(2):257-262.
[60] Jiménez-Castaño L,Villamiel M,López-Fandiño R.Glycosylation of individualwhey proteins by Maillard reaction using dextran of differentmolecularmass[J].Food Hydrocolloids,2007,21(3):433-443.
[61] Galietta G,Gioia L D,Guilbert S,et al.Mechanical and thermomechanical properties of films based on whey proteins as affected by plasticizer and crosslinking agents[J].Journal of Dairy Science,1998,81(12):3123-3130.
[62] Huppertz T.Heat stability of transglutaminase-treated milk[J]. International Dairy Journal,2014,38(2):183-186.
[63] Pietrasik Z.Binding and textural properties of beef gels processed with k-carrageenan,egg albumin and microbial transglutaminase[J].Meat Science,2003,63(3):317-324.
[64] Jumnongpon R,Chaiseri S,Hongsprabhas P,et al.Cocoa protein crosslinking using Maillard chemistry[J].Food Chemistry,2012,134(1):375-380.
[65] Truong V D,Clare D A,Catignani G L,et al.Cross-linking and rheological changes of whey proteins treated with microbial transglutaminase[J].Journal of Agricultural and Food Chemistry,2004,52(5):1170-1176.
Research advances in functionality of food protein ingredients by protein crosslinking:a review
JIANG Meng-yun,LIU Jun-rong,TIAN Yuan-yong
(College of Food Science and Engineering,Dalian Ocean University,Dalian 116023,China)
Abstract:Research advances in protein crosslinks and functionalities of food protein are reviewed comprehensively from the point of view of functional food protein ingredients.Firstly,facilitating roles of crosslinks of“protein-protein”and“protein-carbohydrate”in food functionality are described,with special emphasis on properties of emulsifying and gel forming.Secondly,effects of various crosslinks related to proteins on functionality performances are discussed including heat stability,hydrophilicity,film formation and foaming property.It can be concluded that most of protein crosslinks show a positive effect on improvement of functionalities of food protein ingredients,“protein-protein”crosslinks being more widely explored compared to“protein-carbohydrate”interactions.Furthermore,researches at home and abroad on protein crosslinks contain almost all these conventional food protein sources,including animal and vegetable original proteins,and diary and egg protein,focusing on single protein source,seldom on mixed protein.Finally,protein crosslinking mechanism,especially protein natural oxidation process,is suggested to be further investigated,insight into the application of protein sources,in particular low-fat protein,by-products and mixed protein sources.
Key words:protein crosslink;food protein ingredient;functionality
中图分类号:TS201.1
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.05.018
文章编号:2095-1388(2016)05-0576-07
收稿日期:2016-04-07
基金项目:国家自然科学基金资助项目(31271980)
作者简介:姜梦云(1991—),女,硕士研究生。E-mail:jmy302371549@126.com
通信作者:刘俊荣(1963—),女,博士,教授。E-mail:ljunrong@dlou.edu.cn

