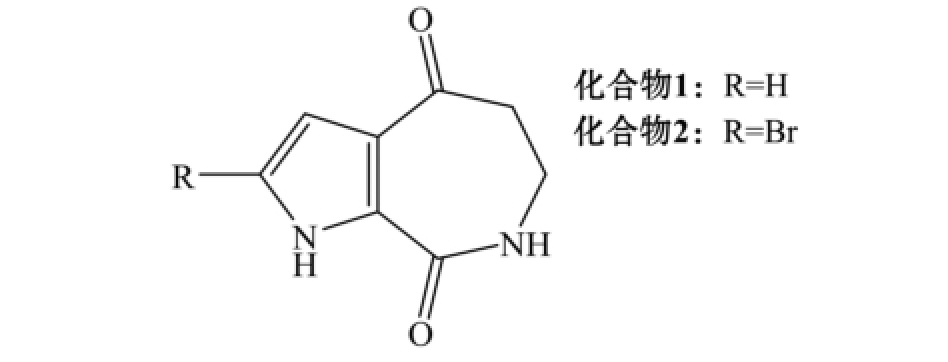
图1 化合物1、2的结构式
Fig.1 Structure of compounds 1 and 2
摘要:为进一步探求澳大利亚厚皮海绵Craniella australiensis在海洋药物研制中的作用,采用硅胶柱层析及Sephadex LH-20凝胶过滤层析等技术,从澳大利亚厚皮海绵乙酸乙酯层浸膏中分离纯化出两种化合物,并通过波谱数据与文献对照的方法对化合物进行了结构鉴定,采用CCK-8法对2个化合物进行体外抗肿瘤细胞活性试验。结果表明:从澳大利亚厚皮海绵分离得到的2个化合物分别为Aldisin和2-Bromoaldisin;体外抗肿瘤细胞活性试验显示,化合物Aldisin和2-Bromoaldisin对人克隆结肠腺癌细胞 (Caco-2)、人结肠癌细胞 (HCT116)、人肝癌细胞 (7721)、人胶质瘤细胞 (U251)和人肾癌细胞 (A498)均具有抑制活性的作用,其中化合物Aldisin处理7721细胞的IC50为 (67.56±3.06)μg/mL,抑制作用显著。研究表明,两种化合物属于天然产物,可作为潜在的抗肿瘤药物进行进一步研究。
关键词:澳大利亚厚皮海绵;化学成分;结构鉴定;体外抗肿瘤
海绵是最原始的多细胞动物,隶属于多孔动物门,迄今已发现约15 000种,从潮间带到几千米深的海域均有分布。海绵种类繁多,可生长于高温(或低温)、高盐、高压、缺氧、少光的环境中,因而具有特殊的代谢途径。又由于海绵与微生物共生,复杂的生长状态使其代谢物和次生代谢物极为丰富[1]。从海绵中已分离出多种化合物,包括生物碱类、甾体类、聚酮类、大环内酯、环肽和过氧化物类等,这些化合物往往具有抗肿瘤、抗病毒、抗菌、抑制酶和抗人类心血管疾病等活性[2-3]。因此,海绵是目前发现新物质最多的海洋动物之一,是海洋天然产物的最大来源[4-6]。如从 Halicortex sp.中可得到一种新的溴吲哚生物碱Dragmacidin F,它具有抗HSV-1和HIV-1的活性[7-8]。另有研究表明,从Dysidea sp.中得到两个倍半萜环戊烯酮Dysidenones A、B及一个倍半萜氨基醌Dysidine,Dysidenones A、B的混合物和Dysidine在浓度为10 μg/mL时就能显著抑制人滑膜磷脂酶PLA2[9]。日本学者从Theonella sp.中分离得到3个含硫含氮的大环内酯Theonezolide A~C,它们都是由两个含有多种官能团 (烷氧基、噻唑环、硫酸酯、酰胺键)的脂肪酸链组成的37元环内酯,这3种化合物均对小鼠L1210淋巴瘤细胞和KB人表皮癌细胞具有显著抑制活性[10-11]。 饶志刚等[12]从南海海绵Rhabdastrella乙酸乙酯层浸膏中分离得到一个具有新型侧链的胆甾醇。
澳大利亚厚皮海绵Craniella australiensis隶属于寻常海绵纲Demospongiae、旋骨海绵目Spirophorida、茄海绵科 Tetillidae、厚皮海绵属 Craniella。虽然李斌[13]从澳大利亚海绵甲醇提取物中分离纯化得到苯丙氨酸、腺嘌呤、多种甾类、邻苯二甲酸二甲酯和罕见的奇数碳脂肪酸甲酯类化合物,但总体来讲对澳大利亚厚皮海绵天然产物的报道较少。本研究中,对澳大利亚厚皮海绵化学成分进行分离纯化,并对得到的化合物进行抗肿瘤活性研究,旨在为澳大利亚厚皮海绵的开发利用提供基础数据。
1.1 材料
澳大利亚厚皮海绵由中国科学院大连化学物理研究所提供。硅胶G与GF254购自青岛海洋化工有限公司;Sephadex LH-20葡聚糖凝胶购于Sigma公司;CCK-8检测试剂盒 (Dojindo,CK04)购于上海锐赛生物技术有限公司;用于核磁的试剂为色谱纯,其他试剂均为分析纯。
人克隆结肠腺癌细胞 (Caco-2)、人结肠癌细胞 (HCT116)、人肝癌细胞 (7721)、人胶质瘤细胞 (U251)、人肾癌细胞 (A498)由中国科学院上海细胞库提供;Caco-2细胞、7721细胞、U251细胞的培养基为DMEM+10%FBS+1%P/S+1% Gln;HCT116细胞的培养基为1640+10%FBS+1% P/S+1%Gln;A498细胞的培养基为MEM+10% FBS+1%P/S+1%Gln。
1.2 方法
1.2.1 澳大利亚厚皮海绵浸膏的制备 根据文献[14]中的方法,并稍作修改。具体过程如下:取2.5 kg新鲜澳大利亚厚皮海绵,剪成1 cm3的小块,加入3倍体积的75%乙醇回流热浸提2 h,滤出提取液,残渣继续加3倍体积的75%乙醇提取,重复3次,合并提取液。提取液在4℃下以6000 r/min离心20 min,取上清液。将上清液减压浓缩、冷冻干燥,得总浸膏123 g。
将总浸膏依次用等体积的石油醚、乙酸乙酯、正丁醇萃取,每种溶剂萃取3次。将萃取液减压浓缩、自然风干,得到石油醚层浸膏 (2 g)、乙酸乙酯层浸膏 (12 g)和正丁醇层浸膏 (22 g)。
1.2.2 澳大利亚厚皮海绵化学成分的分离纯化
通过TLC薄层色谱层析,确定乙酸乙酯层浸膏的洗脱体系为二氯甲烷-甲醇体系。取乙酸乙酯层浸膏5 g,溶解于适量二氯甲烷中,然后将其滴加到5.5 g硅胶 (300~400目)中,搅拌使样品与硅胶充分吸附,静置,将石油醚挥干备用。
称取硅胶 (300~400目)40 g,湿法装柱后用二氯甲烷进行洗脱平衡,将上述挥发完全的拌样硅胶均匀加入到空白硅胶上层,用二氯甲烷-甲醇体系 (100∶0~0∶100)进行梯度洗脱,每个梯度洗脱5个柱体积,分别收集并浓缩除去洗脱液。通过薄层层析进行跟踪分析,合并相似组分,得到E-1、E-2、E-3、E-4、E-5、E-6等6个组分。
组分E-2继续运用柱层析分离,用二氯甲烷-氯仿体系 (100∶0~10∶1)梯度洗脱,得到E2-1、E2-2、E2-3等3个亚组分。亚组分E2-1重结晶得到化合物1(39 mg);亚组分E2-3反复通过Sephadex LH-20凝胶过滤层析分离,甲醇洗脱,得到化合物2(3 mg)。
1.2.3 化合物结构鉴定 采用核磁共振光谱(NMR)对化合物进行鉴定。NMR通过 Bruker Avance DRX 600核磁共振仪 (600/150 MHz)获得,以四甲基硅烷 (TMS)作内标。
1.2.4 化合物体外抗肿瘤活性测定 采用CCK-8法对Caco-2、HCT116、7721、U251、A498肿瘤细胞进行化合物体外抗肿瘤试验。
以DMSO溶解化合物1,以丙酮溶解化合物2,分别配制成10 mg/mL母液,备用。
将肿瘤细胞悬液接种于96孔培养板中 (7721、A498细胞:8×103cells/孔,HCT116细胞:1×104cells/孔,Caco-2、U251细胞:5×103cells/孔),在5%CO2、37℃条件下培养;将样品母液加入培养板孔中,使其最终浓度分别为0、2、20、200、1000 μg/mL。药物处理36 h后,取样观察细胞形态,然后每孔加入10 μL CCK-8,混匀后再培养2 h,测定450 nm处的吸光值。
1.3 数据处理
试验数据以平均值±标准差表示,采用SPSS 17.0软件进行单因素方差分析。
2.1 澳大利亚厚皮海绵中的化合物结构
化合物1:白色粉末,熔点为254~256℃。1H NMR[600 MHz,(CD3)2SO]:δ 2.70~2.72(m,2H),6.56~6.57(t,2H),6.98~6.99(t,2H),8.31(t,1H),12.15 (s,1H)。13C NMR [150 MHz,(CD3)2SO]: δ 36.58,43.52,109.57,122.38,123.60,127.9,162.26,194.40。以上波谱数据与文献 [15]报道的Aldisin一致,由此确定,化合物1为Aldisin,分子式为C8H8N2O2。
化合物2:黄色针状晶体,熔点为232~234℃。1H NMR[600 MHz,(CD3)2CO]:δ 3.55~3.58(m,2H),6.64~6.67(m,2H),7.06~7.07(t,1H),7.60(s,1H),11.78(s,1H)。13C NMR [150 MHz, (CD3)2CO]:δ 37.81,44.28,105.62,112.64,126.00,130.25,162.36,193.62。以上波谱数据与文献 [15]报道的2-Bromoaldisin基本一致,由此确定,化合物2为2-Bromoaldisin,分子式为C8H7N2O2Br。

图1 化合物1、2的结构式
Fig.1 Structure of compounds 1 and 2
2.2 体外抗肿瘤活性测定
利用CCK-8法研究化合物Aldisin和2-Bromoaldisin对 5种肿瘤细胞 (Caco-2、HCT116、7721、U251、A498细胞)的生长抑制作用。由图2可知,化合物 Aldisin对 Caco-2、HCT116、7721、U251、A498细胞的抑制作用均随着化合物浓度的升高而增强,具有剂量依赖性。当化合物浓度降低至2、20 μg/mL时,Aldisin对5种肿瘤细胞的抑制作用比较弱,抑制率≤10%;但当浓度达到200 μg/mL时,抑制作用急剧增强,抑制率高达50%~78%;当浓度增加到1000 μg/mL时,Aldisin对5种肿瘤细胞的抑制率均高达90%以上,其中对A498的抑制率最大,为92.43%。
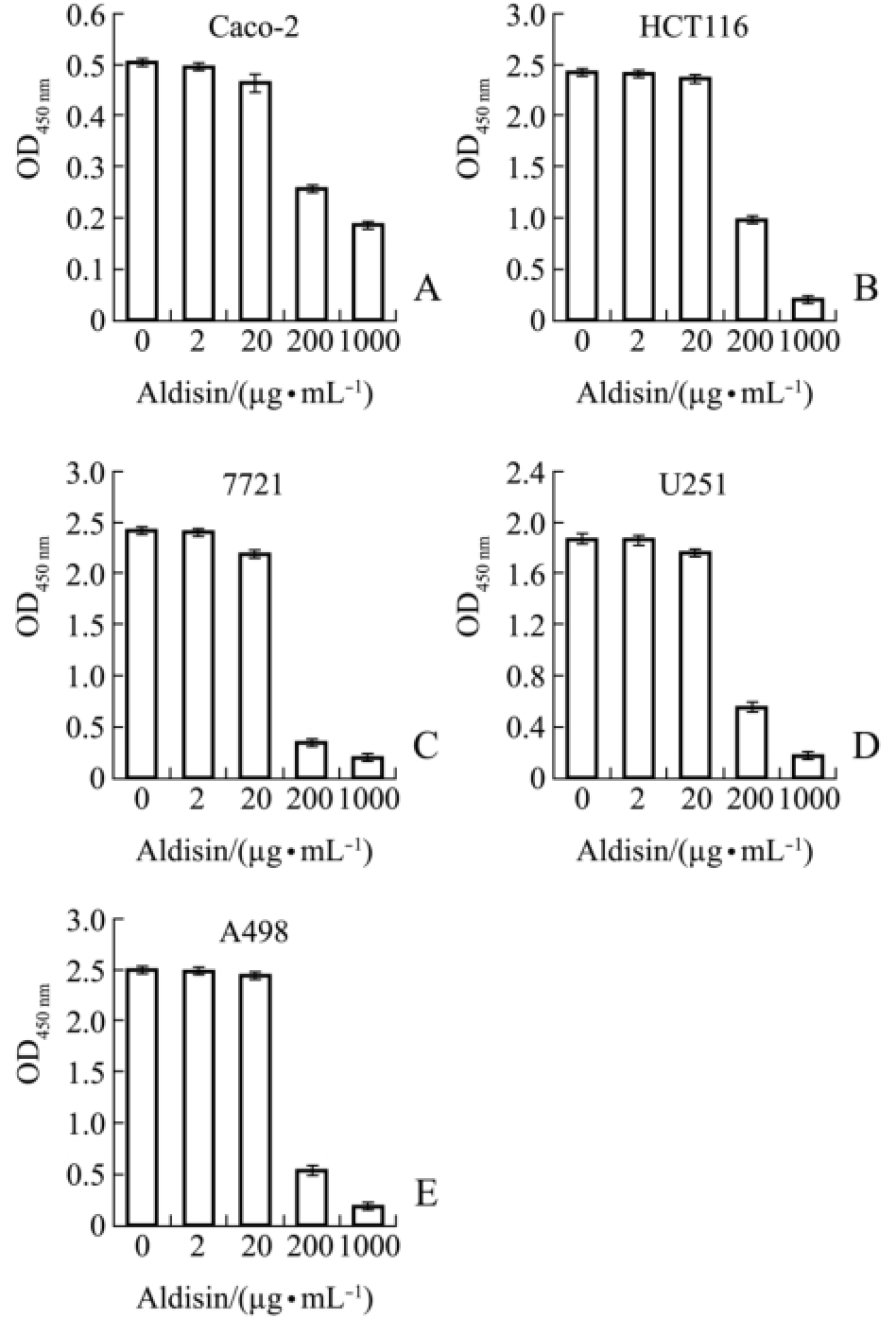
图2 Aldisin对5种肿瘤细胞的抑制作用
Fig.2 Inhibitory activity of Aldisin on five tumor cells
由图3可知,除2 μg/mL化合物2-Bromoaldisin处理的HCT116细胞及2、20 μg/mL该化合物处理的U251细胞外,其余浓度的化合物2-Bromoaldisin对Caco-2、HCT116、7721、U251、A498细胞的抑制作用均随样品浓度的升高而增强,具有剂量依赖性。低浓度的2-Bromoaldisin对5种肿瘤细胞的抑制作用均较弱,抑制率≤15%;但当浓度达到200 μg/mL时,该化合物抑制作用急剧增强,抑制率达42%~69%;当浓度增加到1000 μg/mL时,其对HCT116、7721、A498细胞的抑制率均高达90%,其中对 A498细胞的抑制率最大,为92.15%。
两种化合物对5种肿瘤细胞的IC50值见表1。从表1可见,Aldisin和2-Bromoaldisin在对5种肿瘤细胞作用36 h后,其生长均受到不同程度的抑制,且不同的肿瘤细胞株对化合物的敏感性不同。其中 Aldisin对 7721细胞的 IC50值最小,仅为(67.56±3.06)μg/mL,说明Aldisin对7721细胞的抑制效果最显著;除此之外,化合物Aldisin及2-Bromoaldisin对HCT116、7721、U251、A498细胞的IC50值为96~176 μg/mL,说明两种化合物对相对应的肿瘤细胞均具有明显的抑制效果,而两种化合物对Caco-2细胞的抑制效果均较弱。
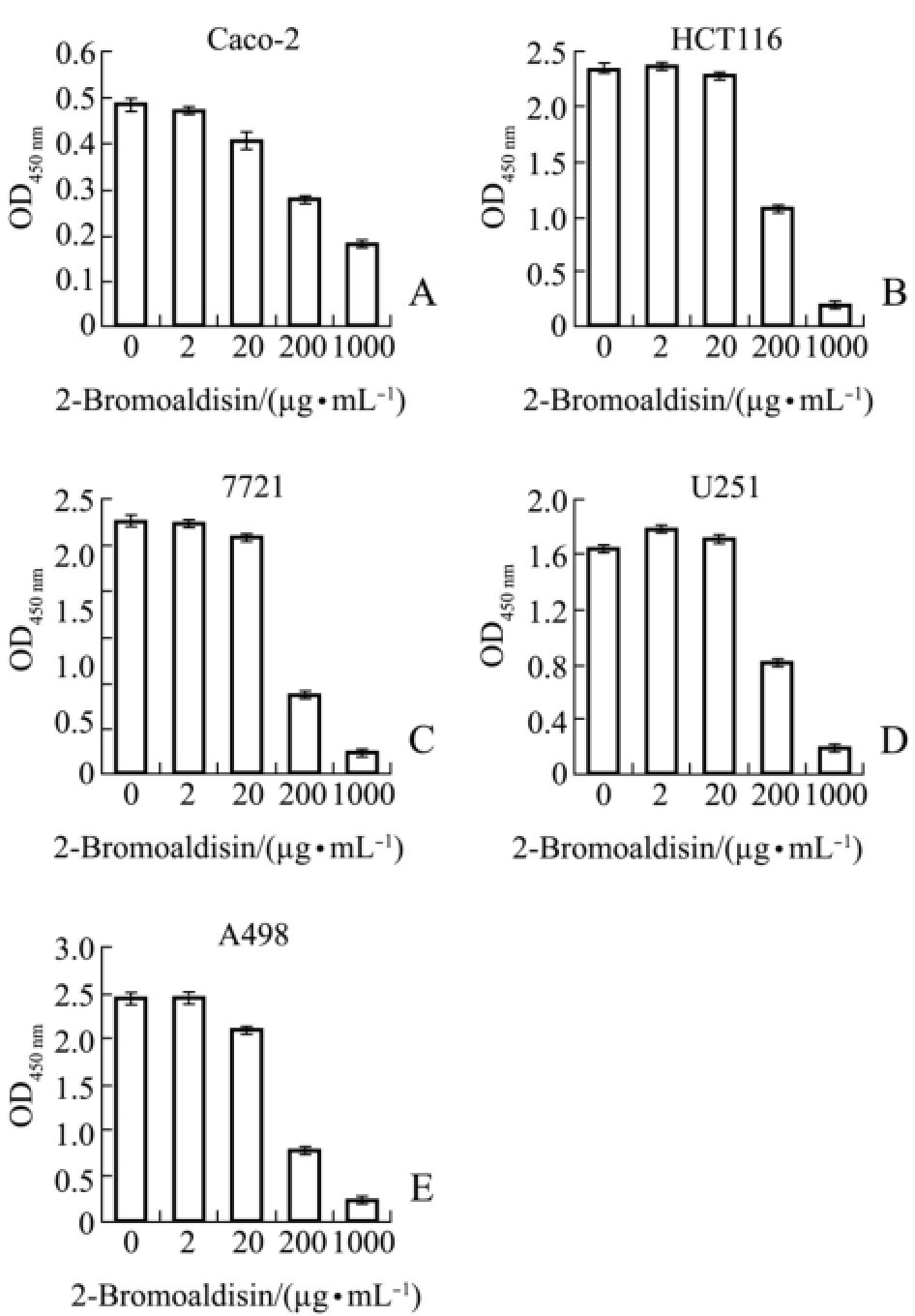
图3 2-Bromoaldisin对5种肿瘤细胞的抑制作用
Fig.3 Inhibitory activity of 2-Bromoaldisin on five tumor cells
表1 Aldisin和2-Bromoaldisin对5种肿瘤细胞的IC50值
Tab.1 The inhibitory IC50values of Aldisin and 2-Bro
moaldisin on five tumor cells μg/mL
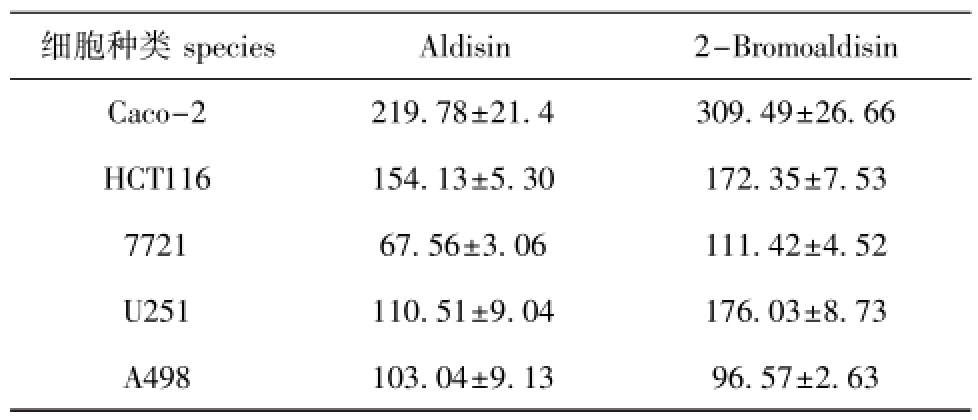
细胞种类species Aldisin 2-Bromoaldisin Caco-2 219.78±21.4 309.49±26.66 HCT116 154.13±5.30 172.35±7.53 7721 67.56±3.06 111.42±4.52 U251 110.51±9.04 176.03±8.73 A498 103.04±9.13 96.57±2.63
图4为化合物Aldisin、2-Bromoaldisin分别在0、200 μg/mL浓度下处理 Caco-2、HCT116、7721、U251和A498细胞36 h后的细胞形态图。通过观察可以发现,浓度为200 μg/mL的化合物处理细胞36 h后,细胞凋亡严重、数量明显减少,并呈破碎状,细胞形态完整性大幅下降。
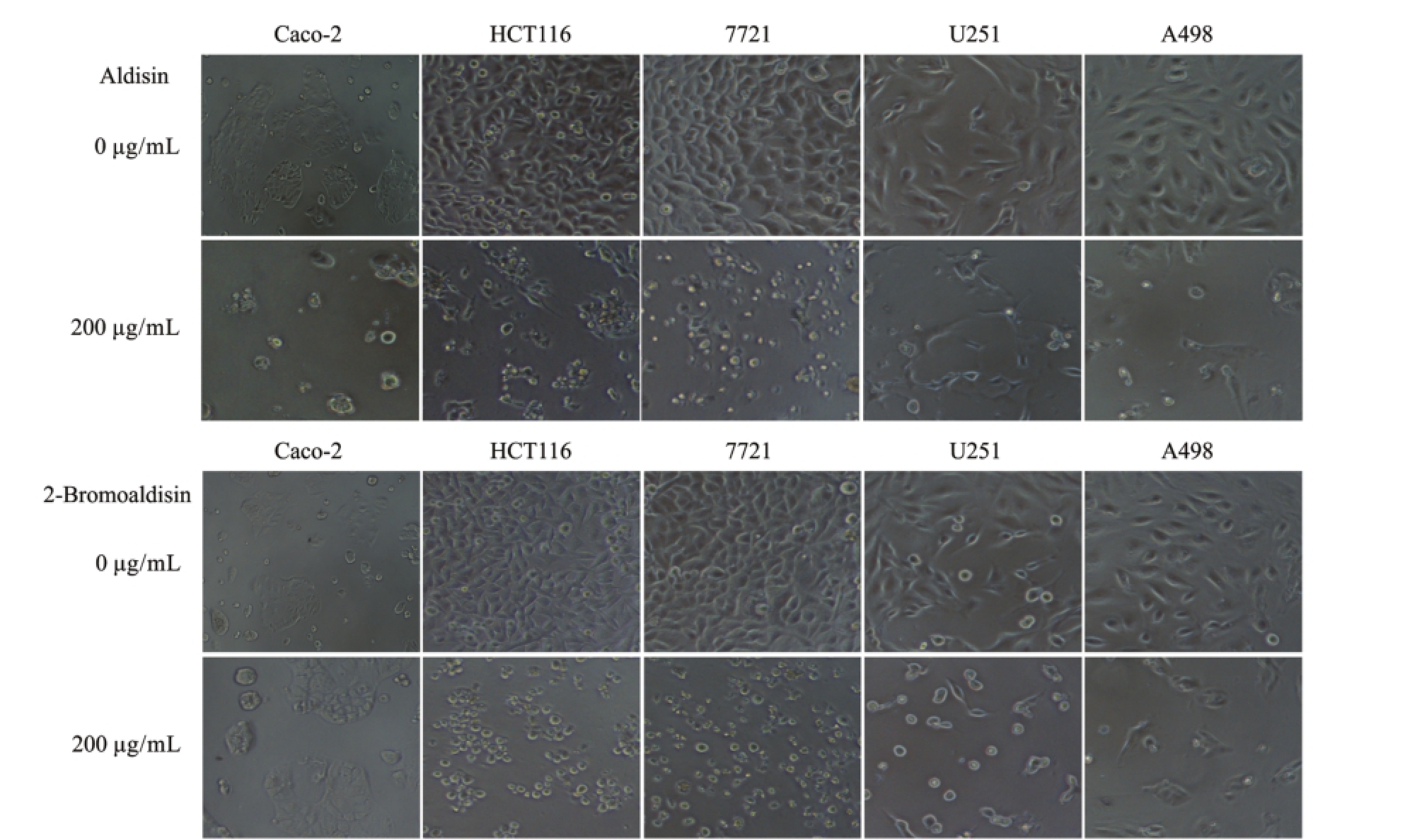
图4 Aldisin、2-Bromoaldisin处理5种肿瘤细胞36 h后的细胞形态 (10×)
Fig.4 The morphology of the five tumor cells treated with Aldisin and 2-Bromoaldisin for 36 h(10×)
根据物质的相似相溶原理可进行生物活性物质的提取,从生物体内分离出的脂溶性物质、水溶性物质和醇溶性物质中都发现过具有抑制肿瘤细胞生长活性的化合物,例如生物碱、甾体化合物和多酚类等小分子类化合物,以及蛋白质、多糖和脂类等大分子类化合物。从澳大利亚厚皮海绵的乙酸乙酯层浸膏分离纯化得到了Aldisin和2-Bromoaldisin两个化合物。Aldisin是吡咯烷型生物碱,2-Bromoaldisin是溴代吡咯烷型生物碱,它们均是首次在该属海绵中被发现。1985年,这两个化合物于关岛海绵中第一次被发现。从海绵Spongiaobligue和从未定名豆荚软珊瑚Lobophytum sp.的乙酸乙酯萃取物中也分离纯化得到过这两个化合物[16-17]。唐孝礼等[18]从海绵Polymistia spongia分离纯化得到Aldisin,并对它的抗脂质过氧化及清除自由基作用进行研究,发现Aldisin具有显著的脂质过氧化作用,并具有有效清除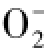 ·、·OH和DPPH·的能力。但这两个化合物的抗肿瘤活性尚未见报道。
·、·OH和DPPH·的能力。但这两个化合物的抗肿瘤活性尚未见报道。
CCK-8法是一种使用方便、检测快速、灵敏度高、重复性好且对细胞毒性小的检测细胞增殖及细胞毒性的方法。本研究中,通过CCK-8法研究了Aldisin和2-Bromoaldisin对Caco-2、HCT116、7721、U251、A498细胞的生长抑制情况,发现这两种化合物对5种肿瘤细胞均具有不同程度的抑制作用,且具有浓度依赖性。体外抗肿瘤IC50值结果显示,除A498细胞外,化合物Aldisin对Caco-2、HCT116、7721、U251细胞的抑制活性均比化合物2-Bromoaldisin强,而两个化合物在结构上的差别仅仅是化合物2-Bromoaldisin是化合物Aldisin在C-8发生溴取代的产物。这个结论与刘洋等[19]得到的在苯环上引入强给电子取代基 (如Br、F等)可增强化合物的抗肿瘤活性正好相反,这可能是取代的位置不同所造成的。苏丽[20]利用Aldisin为底物诱导合成2-Bromoaldisin,并对它们的细胞外PTP1B抑制活性进行了研究,得出100 μmol/L的Aldisin和2-Bromoaldisin的抑制率分别为43.4%和4.7%,Aldisin的2位被Br取代后得到的化合物活性降低了90%,与本研究结果一致。但该类化合物的抗肿瘤机制有待今后进一步研究。
参考文献:
[1] 张金荣.中国南海一种海绵和两种柳珊瑚的化学成分及生物活性研究[D].青岛:中国海洋大学,2012.
[2] 黄孝春,郭跃伟.海绵药物的研究进展:化学和生物活性[J].中国天然药物,2005,3(1):1-9.
[3] 许实波,项辉.海绵中抗菌、抗病毒、抗肿瘤生物活性物质的研究进展[J].中国海洋药物,1994(3):31-38.
[4] Cannell R J P.Natural Products Isolation(Methods in Biotechnology)[M].Humana:Humana Press,1998:365-408.
[5] Urban S,Hickford S J H,Blunt J W,et al.Bioactive marine alkaloids[J].Current Organic Chemistry,2000,4(7):765-807.
[6] 邵志宇.海洋天然产物研究和药用植物虎皮楠化学成分研究[D].上海:中国科学院上海药物研究所,2002.
[7] Cutignano A,Bifulco G,Bruno I,et al.Dragmacidin F:a new antiviral bromoindole alkaloid from the Mediterranean sponge Halicortex sp.[J].Tetrahedron,2000,56(23):3743-3748.
[8] 马伟杰,肖定军,邓松之.海绵生理活性物质研究新进展[J].天然产物研究与开发,2003,15(6):567-571.
[9] Giannini C,Debitus C,Lucas R,et al.New sesquiterpene derivatives from the sponge Dysidea species with a selective inhibitor profile against human phospholipase A2and other leukocyte functions [J].Journal of Natural Products,2001,64(5):612-615.
[10] Kondo K,Ishibashi M,Kobayashi J.Isolation and structures of theonezolides B and C from the Okinawan marine sponge Theonella sp.[J].Tetrahedron,1994,50(28):8355-8362.
[11] 肖定军,邓松之.海绵生理活性物质研究新进展[J].广州化学,1996(1):57-67.
[12] 饶志刚,邓松之,吴厚铭,等.南海海绵Rhabdastrella属中新胆甾醇Rhabdasterol[J].高等学校化学学报,1998,19(3):406-407.
[13] 李斌.澳大利亚厚皮海绵天然产物的研究[D].大连:中国科学院大连化学物理研究所,2004.
[14] 朱春芃,苑朕昱,宋永相,等.光棘球海胆壳中化学成分的分离、鉴定及其抗肿瘤活性[J].大连海洋大学学报,2015,30 (1):85-88.
[15] Schmitz F J,Gunasekera S P,Lakshmi V,et al.Marine natural products:pyrrololactams from several sponges[J].Journal of Natural Products,1985,48(1):47-53.
[16] 徐石海,曾陇梅,苏镜娱.两种吡咯并内酰胺生物碱的分离及结构[J].分析测试学报,1998,17(3):32-34.
[17] 王艳红,闫素君,苏镜娱,等.南海豆荚软珊瑚Lobophytum sp.化学成分研究[J].中山大学学报:自然科学版,2000,39 (5):117-119.
[18] 唐孝礼,许实波,徐石海.海绵Polymistia spongia提取物Aldisin的抗脂质过氧化及清除自由基作用研究[J].中国药理学通报,1998,14(2):148-150.
[19] 刘洋,许建华,黄秀旺,等.3,5-(E)-二亚苄基-N-环丙基哌啶-4-酮类化合物的合成及体外抗肿瘤活性研究[J].中国药物化学杂志,2011,21(4):262-266.
[20] 苏丽.基于海洋天然产物Aldisin的PTP1B抑制剂的设计与合成[D].广州:中山大学,2008.
Isolation,identification and anti-tumor activity of constituents from sponge Craniella australiensis
Abstract:Two compounds were isolated from sponge Craniella australiensis by column chromatography on silica gel and gel filtration chromatography,and identified by spectroscopic analysis and physical-chemistry property to evaluate the application of the sponge in preparation of marine drugs.The inhibition on tumor cells of both extracts from the sponge was evaluated by CCK-8 assay.The results showed that the two compounds were identified as Aldisin and 2-Bromoaldisin which exhibited the potent inhibitory activities against Caco-2,HCT116,7721,U251 and A495 cells in human.The Aldisin showed the strongest cytotoxic activity against 7221 cell with IC50(67.56±3.06)μg/mL.The findings indicate that the extracts as natural products are considered as a potential anti-tumor candidate for further study.
Key words:Craniella australiensis;constituent;structural identification;anti-tumor activity
中图分类号:TS254.1;R284
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.04.013
文章编号:2095-1388(2016)04-0426-05
收稿日期:2015-10-28
基金项目:国家海洋公益性行业科研专项 (201205022-7);大连海洋大学博士启动基金资助项目