海胆营养生理研究进展
左然涛,侯受权,常亚青,丁君,宋坚,赵冲,张伟杰
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
摘要:为深入开发海胆专用人工配合饲料,围绕海胆摄食生理和营养需求研究,综述了海胆主要经济养殖种类,投喂频率、养殖密度、环境因子 (水温、溶氧、光线、氨氮)等因素对海胆摄食量的影响,以及海胆对蛋白质、碳水化合物、脂肪、脂肪酸、胆固醇、维生素和矿物元素的需求量,并在此基础上,探讨了在该领域未来研究的重点,以期为海胆人工配合饲料的开发提供帮助。
关键词:海胆;摄食生理;营养需求
海胆隶属于棘皮动物门Echinodermata、游走亚门Eleutherozea、海胆纲Echinoidea,其现存种类较多,大约有850种,但是被开发利用并达到一定经济规模的种类不到30种[1]。海胆是一种重要的海珍品,其可食用的生殖腺含有大量的蛋白质、氨基酸和不饱和脂肪酸,具有很高的营养价值,在中国、日本、法国等国家颇受欢迎[2-3]。长期以来,养殖海胆的食物来源主要有海带、裙带菜、石莼等大型藻类,随着海胆养殖业的迅猛发展,生物饵料资源供不应求的现象日益突出[4],因此,开发海胆专用人工配合饲料势在必行。目前,国内外对海胆的研究主要集中在海胆人工育苗及增养殖技术上[5-7],有关营养生理方面的研究相对较少[8-10]。本研究中,就海胆摄食生理和营养需求的相关研究加以综述,以期为海胆人工配合饲料的开发研究提供参考。
1 海胆主要养殖种类
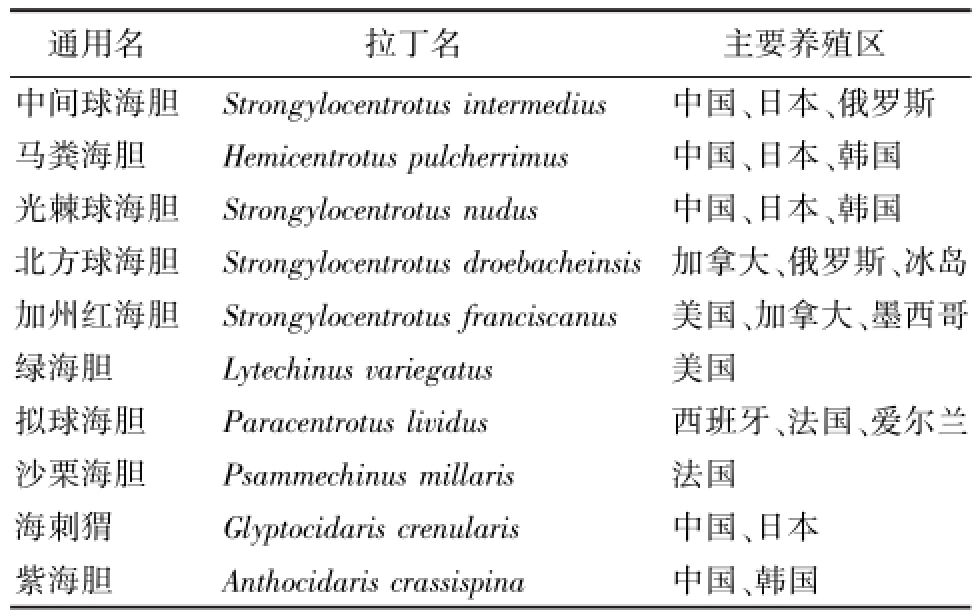
目前,全世界现存海胆种类近千种,但已被较好开发并能形成规模性渔获量的经济种类不超过30种。其中,已开展规模养殖和研究的品种仅有10个左右,具体种类见表1。
2 海胆摄食生理
2.1 海胆消化系统
海胆消化系统由口、口器、食道、胃、肠、肛门等消化器官及附属消化腺体组成。其中,口器由5个大且尖锐的大齿骨、若干块小齿骨以及与之相连的肌肉束组成。口器强健有力,可以切断坚硬的食物。海胆的消化道较长,约为壳径的3倍左右,其通过结缔组织膜沿壳内壁盘曲缠绕,这与其植食特性相关[2]。在海胆的消化酶中,淀粉酶在各种类海胆中均有较高活性,而脂肪酶和蛋白酶活性均相对较低。因此,肠道微生物是海胆脂肪酶和蛋白酶的重要来源[11]。
2.2 影响海胆摄食的因素
2.2.1 投喂频率 研究表明,连续投喂能够显著提高中间球海胆Strongylocentrotus intermedius[12]和Loxechinus albus[13]的生长发育。与每3天投喂一次海带相比,连续投喂海带能显著提高海胆的性腺湿质量,这可能是由于连续投喂时海胆摄食量较高所致[12]。Lawrence等[14]探讨了在水温为25℃、盐度为35的水族箱中不同投喂频率 (自由摄食、2 d投喂一次、4 d投喂一次人工配合饲料)对绿海胆Lytechinus variegatus(壳径50 mm)性腺发育的影响。28 d的摄食生长试验结果表明,海胆性腺指数随投喂频率的降低而依次递减,这与目前海胆室内养殖使用的连续投喂模式相一致。但安琪等[15]发现,马粪海胆经过4周饥饿处理后,体质量和性腺指数显著降低,而之后8周的饱食投喂可恢复海胆的生长和性腺发育,表现出较好的补偿生长现象。与海带等大型藻类相比,人工配合饲料在水中稳定性较差,尤其在海上吊笼养殖条件下,每天投喂定会增加人工成本。因此,利用补偿生长机制适当降低投喂频率可有效提高海胆的摄食速度,降低饲料残饵率,提高海胆的生长和发育速率。
表1 主要养殖海胆的种类和分布地区
Tab.1 The principal species and distribution of sea urchin cultured in the world
通用名 拉丁名 主要养殖区中间球海胆 Strongylocentrotus intermedius 中国、日本、俄罗斯马粪海胆 Hemicentrotus pulcherrimus 中国、日本、韩国光棘球海胆 Strongylocentrotus nudus 中国、日本、韩国北方球海胆 Strongylocentrotus droebacheinsis加拿大、俄罗斯、冰岛加州红海胆 Strongylocentrotus franciscanus 美国、加拿大、墨西哥绿海胆 Lytechinus variegatus 美国拟球海胆 Paracentrotus lividus 西班牙、法国、爱尔兰沙栗海胆 Psammechinus millaris 法国海刺猬 Glyptocidaris crenularis 中国、日本紫海胆 Anthocidaris crassispina 中国、韩国
2.2.2 养殖密度 Siikavuopio等[16]研究发现,北方球海胆Strongylocentrotus droebachiensis的生长速率和性腺指数随养殖密度的增加而显著降低。此外,养殖密度过高还会增加海胆彼此之间的残食率,养殖密度为0.25 kg/m2时,海胆受伤率为0,养殖密度为0.5 kg/m2时,受伤率为7%,而养殖密度为1.0 kg/m2时,受伤率高达20%[17]。在试验条件下也经常发现海胆将其他海胆咬碎的情况,这除了与投饵量不足相关外,饲料中营养元素的缺乏或失衡也可能是引起海胆间残食的重要原因。因此,应加强投饵量与海胆残食率之间的相关性研究。此外,在研究海胆营养素需求量时应将残食率作为一个评价指标,以便更好地解决海胆互残问题。
2.2.3 水体理化指标 常亚青等[6]研究发现,水温能够显著影响中间球海胆的日摄食率,且不同壳径的海胆对温度的耐受性不同,在10~25℃范围内,25℃时各组海胆的摄食率最低,壳径为1.0 cm左右的幼海胆在19.0℃时摄食率最高,而壳径为3.6、5.0 cm的海胆在16.0℃左右时生长最快。水温会影响海胆的饲料系数,在最适水温时,海胆饲料转化率最高,水温偏高或偏低均会降低饲料转化率,从而增加饵料系数。北方球海胆 (初始体质量为0.1~30 g)在水温为10℃时饲料系数最低,显著低于水温为6、12和14℃时的相应值[18]。而对于初始体质量为40~100 g的北方球海胆来说,性腺发育最适宜水温是12℃,而摄食率在4~14℃时随着水温的升高而升高[19]。
溶氧含量会影响北方球海胆的摄食量和性腺发育。通过54 d的研究表明,低氧组 (4.0 mg/L和6.0 mg/L)海胆 (初始体质量为51 g)性腺发育和总摄食量显著低于常氧量对照组 (9.5 mg/L)。性腺发育差异主要是由于缺氧组海胆摄食量及食物转化效率较低所致。研究表明,绿海胆无法在缺氧环境下维持性腺的正常发育[16]。
当水体中氨氮含量超过0.016 mg/L时,海胆的存活和性腺发育会受到显著影响,但同时发现,海胆摄食率不受水体氨氮水平影响。因此,氨氮可能通过影响营养物质代谢来影响海胆性腺发育[20]。
3 海胆营养需求
3.1 蛋白质
蛋白质是人工配合饲料必不可少的营养成分,海胆性腺主要成分之一就是蛋白质。氨基酸作为维持生命活动的重要物质,不仅具有重要的生理功能,而且是一种重要的呈味物质[21]。陈炜等[22]比较了配合饲料和海带对中间球海胆生长和性腺发育的影响,结果发现,配合饲料较海带更能促进海胆性腺发育,推测是由于配合饲料蛋白质含量高于海带所致,但该研究并未交代所使用配合饲料的蛋白质含量。Heflin等[23]通过9周摄食生长试验发现,当人工配合饲料氮能比为68.6 mg P/kcal或蛋白质碳水化合物比大于或等于0.63时,绿海胆的增重率最大。Hammer等[24]以直径为36 mm的绿海胆为研究对象,通过 65 d的摄食生长试验发现,20%和31%蛋白质饲料组海胆的存活率和壳径增长速率均高于9%蛋白质饲料组;20%和31%组性腺指数差异不显著,但均高于9%蛋白质组,这可能是由于高蛋白质饲料促进了海胆卵母细胞的生长[25]。因此,从成本角度考虑,20%饲料蛋白质较适合绿海胆的生长和性腺发育[24]。
此外,随着饲料蛋白质水平的升高,沙栗海胆Psammechinus miliaris和拟球海胆Paracentrotus lividus性腺中二十二碳六烯酸 (DHA)和二十碳四烯酸 (ARA)的积累量也随之升高[26]。一般来说,提高饲料脂肪水平可以减少蛋白质用于氧化供能的比例,从而起到节约蛋白质的作用。对于水产动物来说,蛋白质是其氧化供能最为理想的营养物质,适当提高饲料中蛋白质水平可起到节约脂肪的作用。
3.2 脂肪
脂肪是海水动物的重要能量来源,同时也是重要的脂肪酸来源。海胆性腺中脂肪酸含量丰富,对预防人类心脑血管疾病具有很好的功效[27]。脂肪不仅能改善海胆性腺的颜色和品质,还可以提高动物非特异性免疫机能[28-29]。
3.2.1 磷脂 随着饲料中磷脂水平 (1.0% ~8.8%)的升高,绿海胆幼胆 (湿质量为0.091 g,壳径为 5.8 mm)的体增重和性腺指数显著降低[30],因此,幼胆对磷脂的需求量为饲料干物质的1%。一般来说,随着动物的生长,磷脂在体内的合成能力会逐渐提高,磷脂需求量会随之降低。海胆的性腺是主要的食用部分,其在性腺发育过程中大量积累长链多不饱和脂肪酸等脂类物质,因此,成年海胆对磷脂的需求量还需进一步确定。有研究表明,饲料中添加磷脂能够提高海胆壳和性腺中ARA的积累[31],这可能与磷脂来源有关,海洋动物磷脂在sn-2位通常来源于长链多不饱和脂肪酸,如二十碳五烯酸 (EPA)、DHA和ARA。
3.2.2 脂肪酸 海胆性腺中含有大量人体所需的必需脂肪酸,对拟球海胆和黑海胆Arbacia lixula成熟性腺的脂肪酸组成分析发现,EPA含量高达10% ~17%,DHA含量约为2%[32],推测它们在海胆配子产生和繁殖过程中发挥着重要作用[33]。与肠道和性腺相比,海胆壳中ARA的含量较高,推测其在离子转运和渗透压调节过程中发挥着重要作用[34]。
一般来说,海水浮游植物和浮游动物富含长链多不饱和脂肪酸 (LC-PUFA),致使海水动物饵料中并不缺乏LC-PUFA,因而在进化过程中逐渐丧失体内合成LC-PUFA的能力。对北方球海胆的研究表明,海胆能够很好地利用亚油酸 (LA,18:2n-6)和亚麻酸 (LNA,18:3n-3),通过气相色谱已检测到LA和LNA合成LC-PUFA的中间代谢产物,从而推测海胆可能具有EPA合成能力[31,34]。Bell等[35]发现,沙栗海胆能够从亚麻酸合成EPA,但速度非常慢,且继续延长为C22PUFA的能力非常低。Xu等[36]通过摄食生长试验发现,皱纹盘鲍也具有EPA自身合成能力。上述研究结果表明,海水脊椎动物是在进化过程中逐渐丧失LC-PUFA合成能力的,由于饵料富含LC-PUFA,海水动物已无必要继续自身合成。然而,低等无脊椎动物似乎仍然保留了LC-PUFA的体内合成能力。
3.2.3 胆固醇 胆固醇是棘皮动物性类固醇激素(睾酮和雌二醇)合成的前体物质,合成部位主要在性腺组织和幽门盲肠[37],胆固醇能够调控卵黄蛋白的合成。CYP17和CYP19是细胞色素P450家族的重要成员,是性类固醇激素合成的关键酶[38]。绿海胆性腺中睾酮和雌二醇浓度会随季节发生规律性变化,且在性腺成熟之前浓度达到最高[39]。离体试验发现,雌二醇能够显著提高海燕卵泡的生长速率并促进卵黄生成[37]。生产实践中也发现,单独投喂海带等大型藻类时,海胆性腺发育迟缓,而添加贻贝肉等海洋动物性饵料能有效提高性腺发育速度和质量。与海带等植物性饵料相比,海洋动物性饵料均含有较高水平的蛋白质、必需脂肪酸(EPA和DHA)和胆固醇。因此,动物性饵料促进海胆性腺发育可能与较高的胆固醇水平相关,但尚需进一步研究来加以确认。
3.3 类胡萝卜素
新鲜海胆生殖腺中维生素含量丰富,每100 g生殖腺中含有维生素E 3.6 mg、维生素C 3 mg、β-胡萝卜素700 μg、维生素B2440 μg、叶酸360 μg、维生素B 100 μg。目前,有关海胆维生素营养需求的研究主要集中在类胡萝卜素。类胡萝卜素是一类重要的天然色素的总称,普遍存在于动物、高等植物、真菌、藻类和细菌中,主要成分是β-胡萝卜素、γ-胡萝卜素、叶黄素、虾青素、辣椒红素。有研究表明,海胆性腺颜色是食物中β-类胡萝卜素积累的结果[40]。Borisovets等[41]研究表明,中间球海胆和光棘球海胆S.nudus性腺中海胆酮和胡萝卜素含量在配子形成和排放期间含量最高。Shpigel等[42]比较了β-胡萝卜素、叶黄素、虾青素、辣椒红素对拟球海胆性腺颜色和发育进程的影响,结果发现,饲料中添加适量β-胡萝卜素时海胆性腺颜色较好,主要表现为芒果橙色,无棕色性腺存在;而摄食叶黄素、虾青素或辣椒红素的海胆中有20%~28%的个体性腺呈现棕色;β-胡萝卜素与虾青素、叶黄素相比,能够加速海胆性腺由恢复期到生长期的转变。George等[43]发现,叶黄素和β-胡萝卜素均能提高绿海胆的产卵量和幼体的生长速率,且叶黄素组海胆幼体的成活率高于β-胡萝卜素,而对照组 (无色素添加组)产卵量明显降低且海胆幼体无存活。Luo等[44]研究发现,投喂香蕉皮的中间球海胆性腺颜色明显比喂食南瓜与海带的性腺颜色好。也有研究表明,岩藻黄质(来源于褐藻的一种叶黄素)、β-胡萝卜素和β-海胆酮能够提高Pseudocentrotus depressus的免疫防御和繁殖能力[45]。Pearce等[46]研究表明,北方球海胆配合饲料中β-胡萝卜素的添加量为0.2 mg/kg(饲料),维生素C的添加量为0.8 g/kg(饲料)。
综上所述,色素是海胆配合饲料的一种重要添加剂,应用较为广泛的色素是β-胡萝卜素,有关其调控海胆性腺颜色和发育的生理机制尚需深入探讨。此外,有关海胆对其他种类维生素 (维生素A、D、E、K和水溶性维生素)营养需求的研究鲜有报道。未来研究中不仅要补充和完善海胆对维生素的需求量数据库,而且要阐释维生素对海胆生理指标的影响及营养调控机制。
3.4 矿物质
矿物元素是动物机体所必需的微量元素,它不仅是构成机体组织的重要物质,而且是某些功能蛋白和酶的重要组成成分,能够参与机体功能和酶活性的调节。目前,有关海胆矿物元素需求量的研究尚未见报道。对海胆性腺矿物元素组成分析发现,每100 g新鲜海胆性腺中含有锌2 g、磷390 mg、钙340 mg、铁0.9 mg[2]。通常情况下,动物营养组成虽不能准确确定动物的营养需求,但可以估算动物对各营养素需求量的比例。由此可以推测,海胆配合饲料中需较高含量的锌、磷和钙。其中磷和钙是壳 (外骨骼)的重要组成成分,而锌在动物繁殖过程中发挥着重要作用。因此,在海胆幼体配合饲料的开发中,亟需确定海胆饲料中钙、磷最适需求量和钙/磷比,而对于成年海胆来说,锌需求量的确定尤为迫切,这对提高海胆繁殖性能、保证亲胆配合饲料的质量至关重要。
3.5 添加剂
3.5.1 黏合剂 在人工配合饲料制作过程中,为了增加饲料保形率、降低水中溶蚀率,通常添加一定比例的黏合剂。常用的黏合剂有明胶、藻酸钠、瓜尔胶、淀粉,其中明胶的黏合性最好。黏合剂的种类会影响海胆的性腺指数,但影响效果通常具有一定的时效性。摄食生长试验表明,第9周时,明胶组北方球海胆的性腺指数显著高于其他黏合剂组;但第12周时,各黏合剂组性腺指数未见显著性差异。研究还表明,黏合剂种类和浓度并不会影响海胆性腺的品质,如颜色、口味和坚硬程度[46]。
3.5.2 其他 朱斐等[47]通过在配合饲料中添加不同剂量的螺旋藻粉、蚕蛹粉、冬虫夏草粉和肉毒碱等,经过40 d的摄食生长试验探讨不同饲料添加剂对中间球海胆成活率、饲料系数和生长速率的影响。结果表明:配合饲料的促生长效果明显强于海带,而饲料系数则显著低于海带;而肉毒碱虽然促进了海胆外壳的生长,却限制了体质量的增长;5%的蚕蛹粉促生长效果最佳。
4 展望
4.1 配合饲料的科学性和准确性需进一步加强
(1)营养需求参数需进一步完善。相比其他水产养殖品种,对海胆营养需求的研究起步晚、方法简单。目前,在10个经济海胆养殖品种中,尚无一个品种具备完整营养需求量数据库,这极大地限制了海胆饲料配制的科学性和准确性。此外,对这10个品种营养需求的研究主要集中于蛋白质、碳水化合物、脂肪、脂肪酸、β-胡萝卜素,而对维生素 (A、D、E、K、B族维生素)和矿物元素(Ca、P、Zn、Fe、Mn、Se)的研究尚处于空白。
(2)开展不同生长阶段海胆营养生理的研究。不同生长阶段海胆的消化系统功能和个体发育状态存在差异,且养殖者对海胆各生长阶段的期望指标也存在很大不同。一般来说,存活率、生长速率和性腺指数分别是养殖户对稚胆、幼胆和亲胆最为关注的指标。因此,要确定不同生长阶段海胆营养需求量以达到上述指标的要求,从而能够更好地发挥配合饲料的效果。
(3)评价指标多样性。鱼虾类配合饲料曾经历了一个从低级阶段(动物摄食率和生长速率)到高级阶段(功能性饲料)发展的历程。与传统饲料相比,功能性饲料不仅关注动物生长,更关注动物的免疫力和抗病力,以及产品品质和生态安全 (N、P排放)。对海胆配合饲料研究起步较晚,但并不意味着一定要经历类似鱼、虾类饲料研究的低级阶段,这就要求在营养饲料研究中重视评价指标的多样性,如稚胆阶段重视抗应激能力 (低温、高温、低盐、高盐、高氨氮),幼胆阶段重视免疫力和抗病力,成年海胆则更需关注海胆性腺色泽、风味氨基酸、必需脂肪酸、胶原蛋白等品质指标。此外,各生长阶段的海胆配合饲料均应关注氨氮排放。与之相对应,免疫增强剂、诱食剂、氨基酸、植酸酶、纤维素酶等添加剂的使用,能够在一定程度上增强动物免疫、提高产品品质、降低环境污染。
4.2 海胆饲料加工工艺进一步改进
与其他水产动物相比,海胆的摄食速度相对缓慢,溶蚀的饲料和残饵不仅增加养殖成本,而且容易污染养殖水域环境,特别是在浮筏吊笼养殖模式下饲料的保形率和溶蚀率显得尤为重要。由于人工投喂成本的逐年增加,保形率高且溶蚀率低的配合饲料是取代海带等传统生物饵料的第一要求。目前,主要通过添加高水平的黏合剂来降低饲料溶蚀率,增加其保形率。但是,高比例黏合剂的添加势必会造成海胆对饲料消化率的降低。未来研究中应结合配方筛选最适的黏合剂组合,使其兼顾黏合性和可消化性。此外,通过膨化等手段提高海胆的摄食率和摄食速度、提高饲料保形率、降低海胆饲料的溶蚀率,也是未来研究的重点。
4.3 海胆营养调控机理进一步探讨
海胆是一种重要的模式物种,营养生理的研究不仅可以为海胆饲料工业提供数据支撑,有关营养调控物质代谢机理的阐释也可以为陆生动物或人类营养代谢提供参考。特别是海胆容易养殖、分类地位特殊且具有良好的遗传背景,因此,在营养繁殖机理研究方面具有无可比拟的优势。未来研究中应侧重探讨营养物质对海胆性腺发育和繁殖性能调控机理,亲胆营养对F1和F2代海胆摄食、免疫、性腺发育和繁殖性能的影响及表观遗传修饰等。
参考文献:
[1] 张凤瀛,廖玉麟,吴宝玲.中国动物图谱:棘皮动物分册[M].北京:科学出版社,1964:74-101.
[2] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004:199-201.
[3] 刘恒.世界的海胆渔业[J].海洋科学,2001,25(3):38-41.
[4] 孔泳滔,王琦,程振明,等.盐渍裙带菜替代鲜海带投喂虾夷马粪海胆的试验[J].水产养殖,2001(1):7-8.
[5] 高绪生,胡庆明,孙勉英.大连紫海胆人工育苗试验[J].水产科学,1990,9(2):17-21.
[6] 常亚青,王子臣,孙丕海,等.虾夷马粪海胆的海区渡夏、室内中间培育及工厂化养成[J].水产科学,1999,18(2):66-69.
[7] 丁君,常亚青,郝振林,等.北方海区经济海胆性腺脂肪酸组成与β-胡萝卜素含量的比较研究[J].中国农业科技导报,2011,13(3):122-128.
[8] Chang Y Q,Lawrence J M,Cao X B,et al.Food consumption,absorption,assimilation and growth of the sea urchin Strongylocentrotus intermedius fed a prepared feed and the alga Laminaria japonica [J].Journal of the World Aquaculture Society,2005,36(1):68-75. [9] Lawrence J M,Cao X B,Chang Y Q,et al.Temperature effect on feed consumption,absorption and assimilation efficiencies and production of the sea urchin Strongylocentrotus intermedius[J].Journal of Shellfish Research,2009,28(2):389-395.
[10] Lawrence J M,Chang Y Q,Cao X B,et al.Potential for production of Uni by Strongylocentrotus intermedius using dry formulated feeds[J]. Journal of the World Aquaculture Society,2011,42(2):253-260.
[11] Trenzado C E,Hidalgo F,Villanueva D,et al.Study of the enzymatic digestive profile in three species of Mediterranean sea urchins[J].Aquaculture,2012,344-349:174-180.
[12] Zhao C,Zhang W J,Chang Y Q,et al.Effects of continuous and diel intermittent feeding regimes on food consumption,growth and gonad production of the sea urchin Strongylocentrotus intermedius of different size classes[J].Aquaculture International,2013,21 (3):699-708.
[13] Cárcamo P F.Effects of food type and feeding frequency on the performance of early juveniles of the sea urchin Loxechinus albus (Echinodermata:Echinoidea):implications for aquaculture and restocking[J].Aquaculture,2015,436:172-178.
[14] Lawrence J M,Plank L R,Lawrence A L.The effect of feeding frequency on consumption of food,absorption efficiency,and gonad production in the sea urchin Lytechinus variegatus[J].Comparative Biochemistry and Physiology:Part A,2003,134(1):69-75.
[15] 安琪,曾晓起.饥饿和再投喂对马粪海胆补偿生长的影响[J].中国海洋大学学报,2009,39(S1):32-36.
[16] Siikavuopio S I,Dale T,Mortensen A.The effects of stocking density on gonad growth,survival and feed intake of adult green sea urchin(Strongylocentrotus droebachiensis)[J].Aquaculture,2007,262(1):78-85.
[17] Siikavuopio S I,James P J.Long-term effects of stocking density on somatic growth,gonad index and survival of the juvenile sea urchin,Strongylocentrotus droebachiensis[J].Aquaculture International,2011,19(4):741-747.
[18] Siikavuopio S I,James P,Lysne H,et al.Effects of size and temperature on growth and feed conversion of juvenile green sea urchin(Strongylocentrotus droebachiensis)[J].Aquaculture,2012,354-355:27-30.
[19] Siikavuopio S I,Mortensen A,Christiansen J S.Effects of body weight and temperature on feed intake,gonad growth and oxygen consumption in green sea urchin,Strongylocentrotus droebachiensis [J].Aquaculture,2008,281(1-4):77-82.
[20] Siikavuopio S I,Dale T,Foss A,et al.Effects of chronic ammonia exposure on gonad growth and survival in green sea urchin Strongylocentrotus droebachiensis[J].Aquaculture,2004,242(1-4):313-320.
[21] 林香信,颜孙安,钱爱萍,等.花鳗鲡鱼体肌肉的氨基酸分析研究[J].中国农学通报,2012,28(29):131-136.
[22] 陈炜,赵艳,王家骧,等.虾夷马粪海胆及其饵料中无机元素和蛋白质的初步研究[J].大连水产学院学报,2000,15(1):41-44.
[23] Heflin L E,Gibbs V K,Powell M L,et al.Effect of dietary protein and carbohydrate levels on weight gain and gonad production in the sea urchin Lytechinus variegatus[J].Aquaculture,2012,358-359:253-261.
[24] Hammer H,Watts S,Lawrence A,et al.The effect of dietary protein on consumption,survival,growth and production of the sea urchin Lytechinus variegatus[J].Aquaculture,2006,254(1-4):483-495.
[25] Hammer B W,Hammer H S,Watts S A,et al.The effects of dietary protein concentration on feeding and growth of small Lytechinus variegatus(Echinodermata:Echinoidea)[J].Marine Biology,2004,145(6):1143-1157.
[26] Cook E J,Hughes A D,Orr H,et al.Influence of dietary protein on essential fatty acids in the gonadal tissue of the sea urchins Psammechinus miliaris and Paracentrotus lividus(Echinodermata)[J].Aquaculture,2007,273(4):586-594.
[27] 童圣英,陈炜,由学策,等.三种海胆性腺总脂的脂肪酸组成的研究[J].水产学报,1998,22(3):247-252.
[28] McBride S C,Pinnix W D,Lawrence J M,et al.The effect of temperature on production of gonads by the sea urchin Strongylocentrotus franciscanus fed natural and prepared diets[J].Journal of the World Aquaculture Society,1997,28(4):357-365.
[29] Robinson S M C,Castell J D,Kennedy E J.Developing suitable colour in the gonads of cultured green sea urchins(Strongylocentrotus droebachiensis)[J].Aquaculture,2002,206(3-4):289-303. [30] Gibbs V K,Watts S A,Lawrence A L,et al.Dietary phospholipids affect growth and production of juvenile sea urchin Lytechinus variegatus[J].Aquaculture,2009,292(1-2):95-103.
[31] González-Durán E,Castell J D,Robinson S M C,et al.Effects of dietary lipids on the fatty acid composition and lipid metabolism of the green sea urchin Strongylocentrotus droebachiensis[J].Aquaculture,2008,276(1-4):120-129.
[32] Martínez-Pita I,García F J,Pita M L.Males and females gonad fatty acids of the sea urchins Paracentrotus lividus and Arbacia lixula(Echinodermata)[J].Helgoland Marine Research,2010,64 (2):135-142.
[33] Carboni S,Hughes A D,Atack T,et al.Fatty acid profiles during gametogenesis in sea urchin(Paracentrotus lividus):effects of dietary inputs on gonad,egg and embryo profiles[J].Comparative Biochemistry and Physiology:Part A,2013,164(2):376-382.
[34] Castell J D,Kennedy E J,Robinson S M C,et al.Effect of dietary lipids on fatty acid composition and metabolism in juvenile green sea urchins(Strongylocentrotus droebachiensis)[J].Aquaculture,2004,242(1-4):417-435.
[35] Bell M V,Dick J R,Kelly M S.Biosynthesis of eicosapentaenoic acid in the sea urchin Psammechinus miliaris[J].Lipids,2001,36(1):79-82.
[36] Xu W,Mai K S,Ai Q H,et al.Influence of 18:2n-6/20:5n-3 ratio in diets on growth and fatty acid composition of juvenile abalone,Haliotis discus hannai Ino[J].Aquaculture Nutrition,2011,17(3):346-351.
[37] Lafont R,Mathieu M.Steroids in aquatic invertebrates[J].Ecotoxicology,2007,16(1):109-130.
[38] Payne A H,Hales D B.Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones[J].Endocrine Reviews,2004,25(6):947-970.
[39] Wasson K M,Gower B A,Hines G A,et al.Levels of progesterone,testosterone,and estradiol,and androstenedione metabolism in the gonads of Lytechinus variegatus(Echinodermata:Echinoidea)[J].Comparative Biochemistry and Physiology:Part C,2000,126(2):153-165.
[40] Symonds R C,Kelly M S,Suckling C C,et al.Carotenoids in the gonad and gut of the edible sea urchin Psammechinus miliaris [J].Aquaculture,2009,288(1-2):120-125.
[41] Borisovets E E,Zadorozhny P A,Kalinina M V,et al.Changes of major carotenoids in gonads of sea urchins(Strongylocentrotus intermedius and S.nudus)at maturation[J].Comparative Biochemistry and Physiology:Part B,2002,132(4):779-790.
[42] Shpigel M,Schlosser S C,Ben-Amotz A,et al.Effects of dietary carotenoid on the gut and the gonad of the sea urchin Paracentrotus lividus[J].Aquaculture,2006,261(4):1269-1280.
[43] George S B,Lawrence J M,Lawrence A L,et al.Carotenoids in the adult diet enhance egg and juvenile production in the sea urchin Lytechinus variegatus[J].Aquaculture,2001,199(3-4):353-369.
[44] Luo S B,Zhao C,Chang Y Q,et al.Banana peel provides a new insight into improving gonad flavor in the sea urchin Strongylocentrotus intermedius[J].Aquaculture International,2014,22(2):833-841.
[45] Kawakami T,Tsushima M,Katabami Y,et al.Effect of β,β-carotene,β-echinenone,astaxanthin,fucoxanthin,vitamin A and vitamin E on the biological defense of the sea urchin Pseudocentrotus depressus[J].Journal of Experimental Marine Biology and Ecology,1998,226(2):165-174.
[46] Pearce C M,Daggett T L,Robinson S M C.Effect of binder type and concentration on prepared feed stability and gonad yield and quality of the green sea urchin,Strongylocentrotus droebachiensis [J].Aquaculture,2002,205(3-4):301-323.
[47] 朱斐,王吉桥,张剑诚.几种饲料添加剂对虾夷马粪海胆生长指标的影响[J].水产科技情报,2009,36(2):53-55.
ZUO Ran-tao,HOU Shou-quan,CHANG Ya-qing,DING Jun,SONG Jian,ZHAO Chong,ZHANG Wei-jie
(Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
Research advance of nutritional physiology in sea urchins:a review
Abstract:With the rapid development of sea urchin culture and production,it is imperative to study and develop formulated feeds for this economical species.Up to now,there are ten species that has been intensively studied and cultured.The effects of feeding frequency,stocking density,environmental factors(temperature,dissolved oxygen,illumination intensity and ammonia nitrogen)on feed intake of sea urchins are reviewed.Then,nutrient requirement for protein,lipid,fatty acid,cholesterol,vitamin and mineral were described.At last,some key problems which limited the application of formulated feeds and questions which need to be solved in the further studies are discussed.This will be helpful for the development of formulated feeds for sea urchins.
Key words:sea urchin;feeding physiology;nutrient requirement
中图分类号:S91
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.04.019
文章编号:2095-1388(2016)04-0463-06
收稿日期:2015-10-16
基金项目:农业部 “经济棘皮动物遗传育种与健康养殖创新团队”项目;辽宁省农业攻关及成果产业化项目 (2015203003)
作者简介:左然涛 (1985—),男,博士,讲师。E-mail:rtzuo@dlou.edu.cn
通信作者:常亚青 (1967—),男,博士,教授。E-mail:yqchang@dlou.edu.cn
