图1 电场处理装置
Fig.1 A device of electric field processing
摘要:为选育优良的螺旋藻Spirulina platensis藻株,探究静电场的生物学效应,采用静电场对钝顶螺旋藻进行处理,分别在0、3、6、9、12、15、18、21、24、27 kV电压下处理藻株5 min,处理后的藻株依次记为IS、ES-1、…、ES-9,将藻株按照一定条件进行培养后,对其生长速度、藻体上浮性、叶绿素a、丙二醛(MDA)、水溶性蛋白质、藻蓝蛋白质含量和超氧化物歧化酶(SOD)比活性进行测定。结果表明:与对照藻株IS株相比,处理组藻体MDA含量均有所降低;除ES-5藻株外,其他处理藻株的生长速度均明显加快;ES-8藻株上浮性最好,其叶绿素a、水溶性蛋白质、藻蓝蛋白质含量和SOD比活性较IS均有明显增加,增幅分别为37.69%、19.13%、19.26%和7.06%;对ES-8株与IS株叶绿素a的紫外吸收光谱进行比较,发现ES-8株最大吸收峰值与IS株相比有明显变化。研究表明,静电场对钝顶螺旋藻具有生物效应。
关键词:钝顶螺旋藻;静电场;生物效应
螺旋藻Spirulina platensis是一种具有重要开发应用价值的自养原核生物,它具有光合效率高、生长繁殖快、环境适应性强等特点,是少数能大规模培养的微藻之一[1]。螺旋藻含有高蛋白质、高维生素和丰富的生物活性物质,现已开发成为保健食品和药品。在螺旋藻工业化生产中,产量和质量明显受地区和环境因子的制约,各地均致力于筛选适合本地区生长繁殖、高产优质的品系,以提高产量、降低成本[2]。因此,高产优质螺旋藻藻种的筛选成为实际生产中一个重大课题[3]。利用物理诱变及相关技术可有效地解决螺旋藻对低温适应能力较差、藻种退化等问题。目前,关于激光、电磁波、磁场、微纳米颗粒和微重力等物理因子对螺旋藻生物效应的研究较多,但利用电场处理螺旋藻的相关研究较少。本研究中采用静电场对钝顶螺旋藻进行处理,探索其生物学效应,从中选育出优良藻株,为进一步优化培育钝顶螺旋藻提供理论基础。
1.1 材料
试验用藻种为鄂尔多斯高原盐湖钝顶螺旋藻,由鄂尔多斯市新宇力藻业集团有限公司提供。
1.2 方法
1.2.1 培养基和生长条件 试验用培养基为标准培养液 (Zarrouk培养液)和固体培养基 (在液体培养基的基础上加入0.8%的琼脂)。生长条件:日光灯3500 lx光照,温度为26~28℃,光暗周期为12 h∶12 h。
1.2.2 静电场的处理 将藻体用超声破碎成单细胞。破碎条件:250 W,处理时长3 s,间歇时长4 s,处理30次。取破碎后的藻液10 mL于底部半径为8.8 cm的培养皿中进行静电场处理 (图1)。处理条件为:将藻液分别在0、3、6、9、12、15、18、21、24、27 kV电压下处理5 min,经静电场处理后的藻液样品分别记为 IS、ES-1、ES-2、…、ES-9,然后将各样品接入固体培养基中,放入光照培养箱内培养。培养条件:昼12 h、28℃;夜12 h、26℃。两周后均已长出较长藻丝,此时移入标准培养液中培养。通过静置分层分离法进行扩大培养[4],并进行各项指标的测定。
1.2.3 生长速度和最终生物量的测定 定时取样,用紫外可见分光光度计于560 nm处测定吸光度值,重复测定3次,取其平均值,绘制生长曲线。

图1 电场处理装置
Fig.1 A device of electric field processing
从各组分别取100 mL藻液过滤,用纯水清洗数次,于冷冻干燥机中干燥,称量最终生物量。
1.2.4 藻体上浮性测定 将生长状态良好的螺旋藻培养液充分摇匀,静置10 min和24 h后,分别取各培养瓶中下层液测定吸光度 (A560 nm、A'560 nm),重复测定3次,取其平均值[5]。计算公式为
其中:A、A'分别为起始和终末时的吸光度值。
1.2.5 叶绿素a含量的测定及其紫外吸收光谱扫描 取0.02 g藻干粉,加入6 mL提取液 (95%乙醇-95%丙酮),置入棕色瓶于冰箱 (4℃)中静置过夜后,离心过滤,用紫外可见分光光度计在波长360~720 nm处扫描,再计算叶绿素 a含量(mg/mL)[6]:
1.2.6 蛋白质和丙二醛 (MDA)含量的测定 采用考马斯亮蓝G-250法,以牛血清白蛋白质为标准蛋白质。取0.03 g藻干粉,加入5 mL磷酸缓冲液,于冰箱 (4℃)中静置过夜后,超声破碎,离心取上清液,测定其蛋白质含量。
于第20天时从各个处理样品中提取新鲜藻体,制备提取液。取3 mL提取液加入2 mL 0.6%TBA,沸水中煮20 min,迅速冷却、离心,取上清液用紫外可见分光光度计在波长450、532、600 nm处测量其吸光度A,计算MDA(μmol/L)含量[7]:
1.2.7 藻蓝蛋白质和维生素C含量的测定 取螺旋藻粉0.03 g,加入6 mL磷酸缓冲液,超声破碎后离心,去沉淀得上部溶液,向其中加入硫酸铵达到25%饱和度,去沉淀得上清液,上清液中加入硫酸铵达到55%饱和度,离心得沉淀,向沉淀中加入少量磷酸缓冲液溶解得藻蓝蛋白质 (C-PC)粗酶液。用紫外可见分光光度计在波长620、650 nm处测量其吸光度,计算C-PC浓度 (mg/mL):
由于藻体中所含VC具有还原性,对邻苯三酚的自氧化速率有抑制作用,因此,对藻体破碎液中VC含量进行测定时,采用2,6-二氯酚靛酚滴定法测定每毫升破碎液中VC的含量[8]。
1.2.8 SOD活性的测定 采用邻苯三酚自氧化法测定SOD活性[9]。酶活力单位定义为:25℃ 1 mL反应液中,每分钟抑制邻苯三酚自氧化速率达50%时的酶量为一个酶活力单位 (U)。
2.1 静电场对钝顶螺旋藻生长速度的影响
由图2可知,除ES-5藻株外,经过静电场处理的藻株均较对照藻株IS的生长速度明显加快,其中ES-1株的生长速度最快,其次为ES-6、ES-8株,说明静电场对藻体生长速度具有一定影响。
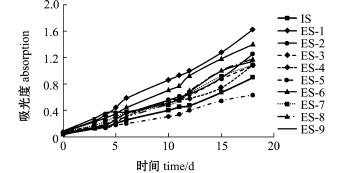
图2 藻体的生长速度曲线
Fig.2 Growth curve of the alga
2.2 静电场对钝顶螺旋藻生物量的影响
由图3可知,经过静电场处理的藻株生长20 d时的生物量,除ES-5株外其余藻株均比IS高,其中ES-1株的生物量最高,其次为ES-8、ES-6。

图3 藻体的生物量
Fig.3 Biomass of the alga
2.3 静电场对藻体上浮性的影响
藻丝浮性对藻丝调节其在水体中的位置非常重要,且在其养殖采收过程中也扮演着重要角色[10]。从表1可知,与对照藻株IS相比,经过静电场处理的藻株 (ES-3除外)上浮性均较好,说明静电场处理可以大大改善藻体上浮性。其中ES-8株的上浮性最好,其上浮率达到76.59%,在采收过程中ES-8株更具有优势。
2.4 藻体的叶绿素a、MDA含量
螺旋藻细胞中的色素积累是衡量螺旋藻藻株品质优劣的重要指标。从表1可见:与对照藻株IS相比,经过静电场处理的藻株,除ES-4株外,其他藻株的叶绿素a含量均明显增加,其中ES-8株的叶绿素a含量最高,其增幅为37.69%,其次为ES-1株,增幅为33.89%。这反映出ES-8藻株是具有较优品质的藻株。
从图4可见,将较好的处理组ES-8与对照藻株IS叶绿素a的紫外吸收光谱相比较,最大吸收峰的位置一致,但ES-8株的最大吸收峰值明显高于IS株,说明静电场起到了一定作用。
植物器官衰老或在逆境下受伤害,往往发生膜脂过氧化作用,MDA是膜脂过氧化的最终分解产物,从膜上产生的位置释放出后与蛋白质、核酸起反应修饰其特征,使纤维素分子间的桥键松弛,抑制蛋白质的合成[11]。由此可见,低浓度MDA时蛋白质的合成并不会受到抑制。从表1可见,经静电场处理的各组藻体MDA含量均低于对照藻株IS,其中ES-2株MDA含量最小,其次为ES-8株。
表1 藻体的上浮性、叶绿素a和丙二醛含量
Tab.1 Floating rate and levels of Chl-a and MDA in the alga

藻株alga strain丙二醛/ (μmol·L-1)MDA IS(对照) 54.34 10.24 —上浮率/% floating rate叶绿素a/ (mg·g-1)Chl-a叶绿素a增幅/% Chl-a increment 0.347 ES-1 71.51 13.17 33.89 0.338 ES-2 61.40 11.43 11.62 0.284 ES-3 47.64 11.81 15.33 0.289 ES-4 71.04 9.71 -5.17 0.329 ES-5 71.11 11.50 12.30 0.289 ES-6 63.23 12.44 21.48 0.340 ES-7 73.99 11.72 14.45 0.324 ES-8 76.59 14.10 37.69 0.287 ES-9 65.93 12.90 25.98 0.342
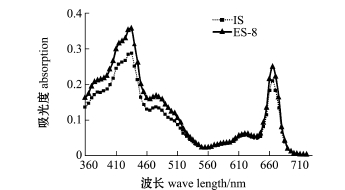
图4 叶绿素a的紫外吸收光谱
Fig.4 Ultraviolet absorption spectra of Chl-a
2.5 藻体的水溶性蛋白质和藻蓝蛋白质含量
从表2可见:与对照藻株IS相比,除ES-4株外其他藻株的水溶性蛋白质含量均有增加,其中ES-8株增幅最大,达到19.13%;而C-PC含量除ES-8、ES-9、ES-1株高于IS株外,其他藻株均低于IS株,其中ES-8株增幅最大,达19.26%。
表2 藻体的水溶性蛋白质和藻蓝蛋白质含量
Tab.2 Water-soluble protein and phycocyanin contents of the alga

藻蓝蛋白质增幅/% C-PC藻株alga strain蛋白质/ (mg·g-1)protein蛋白质增幅/% protein increment increment IS(对照) 275.20 — 120.33藻蓝蛋白质/ (mg·g-1)C-PC —ES-1 312.64 13.60 125.83 4.57 ES-2 285.60 3.78 103.67 -13.85 ES-3 276.00 0.29 108.67 -9.69 ES-4 271.52 -1.34 103.00 -14.40 ES-5 292.96 6.45 120.00 -0.27 ES-6 281.28 2.21 106.83 -11.22 ES-7 292.48 6.28 113.17 -5.95 ES-8 327.84 19.13 143.50 19.26 ES-9 319.84 16.22 140.83 17.04
2.6 藻体的VC含量和SOD比活性
从表3可见:除ES-3株的VC含量超出300 μg/g外,其他藻株均小于300 μg/g,这表明,VC含量对SOD活性检测影响不大;经过静电场处理后的藻株除ES-8、ES-1株的SOD比活性高于IS株外,其他藻株的SOD比活性均低于IS株。
表3 藻体的VC含量和SOD比活性
Tab.3 Content of VC and SOD specific activity of the algae
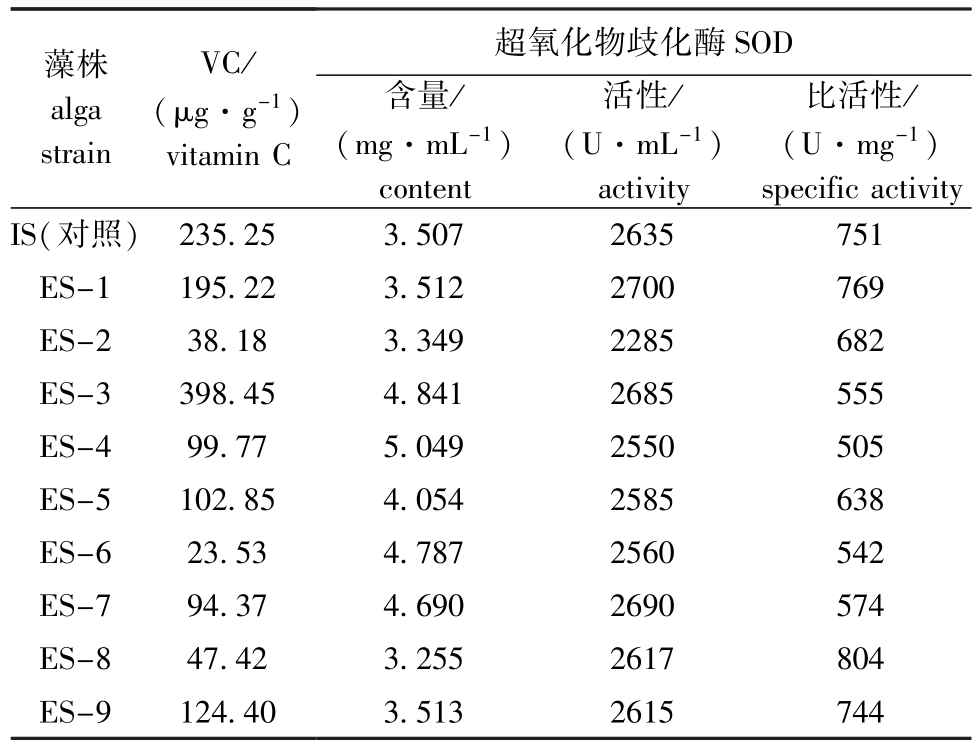
藻株alga strain VC/ (μg·g-1)vitamin C超氧化物歧化酶SOD比活性/ (U·mg-1)specific activity IS(对照)含量/ (mg·mL-1)content活性/ (U·mL-1)activity 235.25 3.507 2635 751 ES-1 195.22 3.512 2700 769 ES-2 38.18 3.349 2285 682 ES-3 398.45 4.841 2685 555 ES-4 99.77 5.049 2550 505 ES-5 102.85 4.054 2585 638 ES-6 23.53 4.787 2560 542 ES-7 94.37 4.690 2690 574 ES-8 47.42 3.255 2617 804 ES-9 124.40 3.513 2615 744
本研究中采用不同电压下的静电场对螺旋藻进行处理,再通过静置分层分离法将处理后的藻液进行扩大培养。结果表明,经静电场处理的藻株(ES-5株除外)的生长速度均比对照藻株IS快,而MDA含量均低于对照藻株。从中筛选出的优质藻株ES-8与IS株比较,其叶绿素a含量的增幅高达37.69%,水溶性蛋白质含量增加19.13%,CPC含量增加19.26%,SOD比活性增加7.06%。藻株ES-8的叶绿素a含量、蛋白质含量、藻蓝蛋白质含量的增幅均明显高于有关报道[2,12],达到了理想的效果。本试验中,经过静电场处理的藻株大多生长速度明显加快,并且测得的叶绿素a含量也相应有较大增幅。提高植物叶片内叶绿素的含量,可促进植物的光合作用,光合作用为植物生长发育提供物质和能量,从而又影响到其他生理指标的变化[13]。静电场处理对螺旋藻的作用效果与对高等植物相似,因此,可认为叶绿素a含量增加就是促进藻体生长的因素之一。同时,通过叶绿素a的紫外吸收光谱可知,经静电场处理后的藻株ES-8最大吸收峰值明显高于对照藻株IS,但峰值位置却没有发生变化,也就是说静电场促进了藻体叶绿素a的合成,但未改变其分子结构。叶绿素a含量变化的原因,可能是静电场处理引起了螺旋藻体内代谢过程的变化所产生的。SOD活力越高,分解氧化产物的能力越强,从而可保护机体免受恶劣环境的伤害,对环境具有较强的适应性[14]。MDA是生物体在逆境条件下发生膜脂质过氧化作用的产物之一。本研究中,ES-8株的蛋白质含量、SOD酶比活性均有明显增加,MDA含量相对较低。综上所述,静电场对钝顶螺旋藻具有生物效应,经静电场24 kV处理5 min可选育出优质的藻株ES-8。
参考文献:
[1]Santillan C.Mass production of Spirulina[J].Experientia(Basel),1982,38(1):40-43.
[2]赵炎生,尹鸿萍,陈向东,等.倍频Nd:YAG脉冲激光诱变钝顶螺旋藻的初步研究[J].光电子·激光,1999,10(6):563-564.
[3]赵萌萌,王卫卫.He-Ne激光对钝顶螺旋藻的诱变效应[J].光子学报,2005,34(3):400-403.
[4]汪志平,贾小明,傅俊杰,等.不同形态钝顶螺旋藻藻丝体分离和纯化的方法[J].浙江农业学报,1998,10(5):275-277.
[5]陈新美,梅兴国.钝顶螺旋藻藻种的紫外诱变初步筛选[J].生物技术,2006,16(2):51-54.
[6]杨敏文.快速测定植物叶片叶绿素含量方法的探讨[J].光谱实验室,2002,19(4):478-481.
[7]黄锐.杂交稻及其亲本抗瘟性与几种酶活性及丙二醛含量的关系[D].雅安:四川农业大学,2007.
[8]李培峰,方允中.用顺磁共振及自旋标记研究活性氧对铜锌超氧化物歧化酶结构的影响[J].生物物理学报,1994,10(3):497-500.
[9]谢卫华,姚菊芳,袁勤生.连苯三酚自氧化法测定超氧化物歧化酶活性的改进[J].医药工业,1988,19(5):217-220.
[10]Kim S G,Choi A,Ahn C Y,et al.Harvesting of Spirulina platensis by cellular flotation and growth stage determination[J].Letters in Applied Microbiology,2005,40(3):190-194.
[11]史成颖.影响钝顶螺旋藻生长的理化因子的研究[D].合肥:安徽农业大学,2003.
[12]王维部,卢运明,侯学瑛.空间诱变钝顶螺旋藻优质高产品系的选育[J].南方水产,2007,3(6):34-39.
[13]巩东辉,王志忠,李国龙,等.稀土Ce3+对盐胁迫下螺旋藻生理特性的影响[J].中国稀土学报,2013,31(1):124-128.
[14]沙飞,常亚青,丁君.两种降温模式的低温胁迫对刺参抗氧化酶活性及丙二醛含量的影响[J].大连海洋大学学报,2015,30(1):25-29.
中图分类号:Q177
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.03.014
文章编号:2095-1388(2016)03-0307-04
收稿日期:2015-08-09
基金项目:国家自然科学基金资助项目 (50267014)
Biological effects of electric field on green alga Spirulina platensis
Abstract:The growth,floating,specific activity of superoxide dismutase(SOD)and levels of malondialdehyde,water-soluble protein and Chl-a were determined in green alga Spirulina platensis named IS,ES-1,…,ES-8 and ES-9 exposed to electric field for 5 mins at 0,3,6,9,12,15,18,21,24 and 27 kV to evaluate the biological effects of electric field on green the alga.The results showed that there was less malondialdehyde content in the treated strains than in the original strain IS.However,the treated strains had better growth than the original strain IS except for ES-5,with the best floating in ES-8,and the contents of chlorophyll,water-soluble protein and phycocyanin increased by 37.69%,19.13%and 19.26%,respectively and the SOD specific activity increased by 7.06%.The ultraviolet absorption spectrum of Chl-a was shown to be significant variation in peak in ES-8 compared with the original strain,showing the biological effects of electrostatic field on green alga Spirulina platensis.
Key words:Spirulina platensis;electric field;biological effect