饲料中精氨酸水平对杂交鲟幼鱼抗氧化能力及血清生化指标的影响
吴俊光1、2,王连生1,王常安1,李晋南1,赵志刚1,罗亮1,都雪1,徐奇友1
(1.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306)
摘要:为研究饲料中不同水平精氨酸对杂交鲟 (Acipenser schrenckii♀×A.baeri♂)幼鱼抗氧化能力及血清生化指标的影响,以0.3%为梯度,配制精氨酸水平为1.74%~3.54% (干物质含量)的7种等氮、等能饲料,测得其中实际精氨酸水平分别为1.76%、2.05%、2.36%、2.64%、2.93%、3.24%和3.53%,选取初始体质量为 (3.63±0.08)g的健康杂交鲟幼鱼630尾,随机分为7组,每组设3个重复,饲养试验共进行8周。结果表明:与1.76%精氨酸水平 (对照)相比,2.64%、2.93%精氨酸水平显著提高了杂交鲟幼鱼肠道中超氧化物歧化酶 (SOD)活力和还原型谷胱甘肽 (GSH)含量 (P<0.05),并显著降低了中肠中丙二醛 (MDA)含量 (P<0.05),饲料中精氨酸水平对前肠和后肠MDA含量的影响不显著 (P>0.05);饲料中精氨酸水平对血清和肝脏中SOD活力和MDA含量的影响不显著 (P>0.05);2.64%精氨酸水平显著提高了血清中总蛋白 (TP)、白蛋白 (ALB)含量 (P<0.05),显著降低了谷草转氨酶 (AST)活性(P<0.05);2.64%、2.93%精氨酸水平显著降低了血清中尿素氮 (BUN)含量 (P<0.05),显著升高了血糖 (GLU)含量 (P<0.05);2.36%、2.64%、2.93%、3.24%精氨酸水平显著降低了血清中甘油三酯(TG)含量 (P<0.05);饲料中精氨酸水平对血清中球蛋白 (GLB)、谷丙转氨酶 (ALT)和总胆固醇(TCHO)含量的影响均不显著 (P>0.05)。研究表明:饲料中适宜的精氨酸水平能显著提高杂交鲟幼鱼的抗氧化能力,并提高机体的代谢水平,促进鱼体蛋白质的合成;分别以中肠MDA和血清BUN为指标,进行二次曲线回归分析表明,杂交鲟幼鱼对饲料中精氨酸的最适需要量分别为2.73%、2.75%。
关键词:精氨酸;杂交鲟;抗氧化能力;血清生化指标
鱼类对蛋白质的需求,实际上是对氨基酸的需求,饲料中蛋白质的含量和质量直接影响鱼类的生长速度[1-2]。在鱼类中,必需氨基酸包括精氨酸、组氨酸、亮氨酸、异亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、苏氨酸、色氨酸和缬氨酸10种[1]。饲料中缺少任何一种必需氨基酸都会影响蛋白质的合成,从而抑制鱼类的生长[3]。与此相反,如果饲料中某种必需氨基酸的含量过高,也会导致鱼体氮排放增加,从而抑制其他氨基酸代谢,对鱼体的生长产生负作用,同时还影响其养殖水质[4]。
精氨酸在鱼体内具有多种营养作用,是维持鱼类生长的必需氨基酸[5]。精氨酸作为蛋白质中重要的组成部分,参与体内多个重要的代谢途径,在生物体的合成和代谢过程中起着重要作用,是肌酸、多胺、一氧化氮 (NO)等活性物质合成的前体物。同时,精氨酸还能参与尿素循环中的氮代谢,刺激生长激素和胰岛素分泌[5-6]。另外,对硬骨鱼类的研究发现,其体内存在完整的尿素循环体系[7],这表明硬骨鱼类自身存在合成精氨酸的潜力[8]。但在鱼体中,尿素循环的活力与哺乳动物相比非常低。
由于精氨酸具有多样化的生理功能,受到了人们的广泛关注。研究表明,鱼类与哺乳动物一样,其体内存在氧化与抗氧化平衡系统[9]。精氨酸及其代谢产物NO在机体的抗氧化和免疫功能方面起着非常重要的作用[10-11]。同时,精氨酸在机体的
鲟鱼是世界上最古老的硬骨鱼类之一,全身是宝,味道鲜美,是一种非常珍贵的水产品,其卵做成的 “鱼籽酱”更是世界名肴,具有很高的营养价值。但有关精氨酸对杂交鲟 (Acipenser schrenckii ♀×A.baeri)幼鱼抗氧化能力和血清生化指标的影响目前尚未见报道。本试验中,以杂交鲟幼鱼为养殖对象,研究了饲料中精氨酸水平对鱼体抗氧化能力及血清生化指标的影响,对精氨酸的生理功能进行了验证,确定了精氨酸的适宜添加量,以期为鲟鱼人工饲料的配制提供理论指导。
1 材料与方法
1.1 材料
试验用杂交鲟购自北京房山鲟鱼繁育中心。
精氨酸购自上海鼓臣生物技术有限公司,纯度≥98%。组氨酸、异亮氨酸、赖氨酸、蛋氨酸、苏氨酸、缬氨酸、胱氨酸、天冬氨酸、甘氨酸、丙氨酸和丝氨酸均购自北京惠康源生物科技有限公司,纯度≥98%。所有氨基酸均为L-型氨基酸。
1.2 方法
1.2.1 试验饲料的制备 根据鲟鱼营养需要和全鱼氨基酸组成配制基础饲料:以进口鱼粉、次粉、豆粕、玉米蛋白粉为主要蛋白源,以鱼油、豆油、大豆磷脂为主要脂肪源,以羧甲基纤维素钠为黏合剂,以2,6-二叔丁基-4-甲基苯酚 (BHT)为抗氧化剂,用非必需氨基酸混合物来替代精氨酸,配制成7种粗蛋白质水平为40%、粗脂肪水平为10%的试验饲料。L-精氨酸的添加量分别为0(对照)、0.3%、0.6%、0.9%、1.2%、1.5% 和1.8%,测得7种饲料中实际精氨酸水平分别为1.76%(对照)、2.05%、2.36%、2.64%、2.93%、3.24%和3.53%。试验饲料的组成和营养成分见表1和表2。
表1 饲料配方 (干物质基础)
Tab.1 Formulation of the trial diets(dry matter basis) %
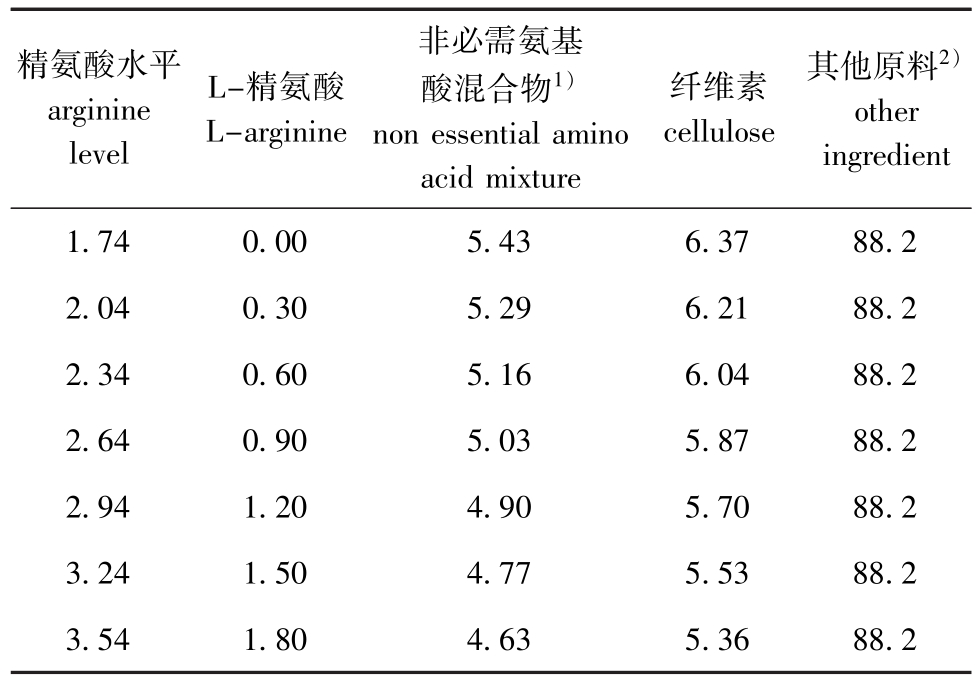
注:1)非必需氨基酸混合物 (g/100 g饲料)包括胱氨酸0.238 1,天冬氨酸 1.948 8,甘氨酸 0.799 3,丙氨酸 1.041 3,丝氨酸1.398 2;2)其他原料包括鱼粉15%,次粉20%,豆粕23%,玉米蛋白粉14%,鱼油3%,豆油2%,大豆磷脂2%,磷酸二氢钙2%,氯化胆碱0.2%,甜菜碱0.1%,BHT 0.02%,羧甲基纤维素钠2%,维生素预混料0.3%,微量元素预混料0.2%,必需氨基酸混合物4.38%;3)维生素预混料为每千克饲料提供维生素A 8000 IU,维生素C 500 mg,维生素D33000 IU,维生素E 60 mg,维生素K35 mg,维生素B115 mg,维生素B230 mg,维生素B615 mg,维生素B120.5 mg,胆碱5000 mg,烟酰胺175 mg,D-生物素2.5 mg,肌醇1000 mg,叶酸5 mg,泛酸50 mg;4)微量元素预混料为每千克饲料提供锌60 mg,铜3 mg,铁25 mg,锰15 mg,碘0.6 mg,镁0.7 mg;5)必需氨基酸混合物 (g/100 g饲料)包括组氨酸0.708 8,异亮氨酸0.219 8,赖氨酸1.245 3,蛋氨酸0.503 7,苏氨酸0.943 1,缬氨酸0.759 8
Note:1)non-essential amino acid mixture(g per 100 g diet):cystine,0.238 1;aspartic acid,1.948 8;glycine,0.799 3;alanine,1.041 3;serine,1.398 2.2)other ingredients:fish meal,15%;wheat middling,20%;soybean meal,23%;corngluten meal,14%;fish oil,3%;soybean oil,2%;soybean phospholipids,2%;monocalcium phosphate,2%;choline chloride,0.2%;betaine,0.1%;BHT,0.02%;sodium carboxymethyl cellulose,2%;vitamin premix,0.3%;mineralpremix,0.2%; essentialamino acids mixture,4.38%.3)the vitamin premix provided the following per kg of diets:vitamin A,8000 IU;vitamin C,500 mg;vitamin D33000 IU;vitamin E,60 mg;vitamin K3,5 mg;vitamin B1,15 mg;vitamin B2,30 mg;vitamin B6,15 mg;vitamin B12,0.5 mg;choline chloride,5000 mg;nicotinic acid,175 mg;D-biotin,2.5 mg;inositol,1000 mg;folic acid,5 mg;pantothenate acid,50 mg.4)the mineral premix provided the following per kg of diet:zinc,60 mg;copper,3 mg;iron,25 mg;manganese,15 mg;iodine,0.6 mg;magnesium,0.7 mg.5)essential amino acid mixture(g per 100 g diet):histidine,0.708 8;isoleucine,0.219 8;lysine,1.245 3;methionine,0.503 7;threonine,0.943 1;valine,0.759 8
精氨酸水平arginine level L-精氨酸L-arginine非必需氨基酸混合物1)non essential amino acid mixture纤维素cellulose其他原料2)other ingredient 1.74 0.00 5.43 6.37 88.2 2.04 0.30 5.29 6.21 88.2 2.34 0.60 5.16 6.04 88.2 2.64 0.90 5.03 5.87 88.2 2.94 1.20 4.90 5.70 88.2 3.24 1.50 4.77 5.53 88.2 3.54 1.80 4.63 5.36 88.2
先将饲料原料粉碎过筛,称重后逐级混合均匀,然后加入适量的水并充分混合,通过小型制粒机挤压成颗粒饲料,风干,于冰箱 (-20℃)中保存备用。
表2 饲料营养成分 (测定值)
Tab.2 Proximate composition of the trial diets(measured value) w/%
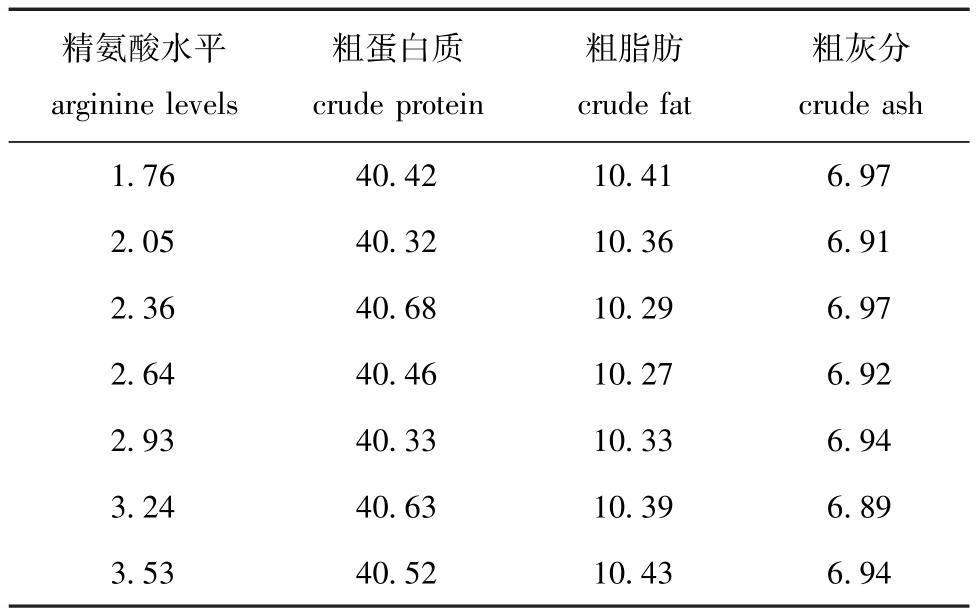
精氨酸水平arginine levels粗蛋白质crude protein粗脂肪crude fat粗灰分crude ash 1.76 40.42 10.41 6.97 2.05 40.32 10.36 6.91 2.36 40.68 10.29 6.97 2.64 40.46 10.27 6.92 2.93 40.33 10.33 6.94 3.24 40.63 10.39 6.89 3.53 40.52 10.43 6.94
1.2.2 试验设计和饲养管理 将试验鱼养殖于黑龙江省松北区松浦试验站车间的可控温水循环系统中,每个缸中水量为160 L,水温为 (22±1)℃,溶解氧大于5 mg/L,保持自然光照。试验前将试验鱼先用3%的盐水消毒2~3 min,然后放入暂养池中,用未添加精氨酸的对照饲料驯化2周,从中挑选出体格健壮、规格整齐、体表无伤、体质量为(3.63±0.08)g的杂交鲟幼鱼630尾,随机分为7组,每组设3个重复,每个重复30尾鱼。7组鱼分别投喂不同精氨酸水平的试验饲料,每天7:00、11:00、16:00和19:00人工饱食投喂4次,并记录投喂量,定期检测水质,及时换水、消毒,确保水质良好。养殖试验共进行8周。
1.2.3 样品的采集与处理 养殖试验结束后,将鱼饥饿24 h。从每缸随机取3尾鱼,用MS-222麻醉剂 (间氨基苯甲酸乙酯甲磺酸盐)麻醉,于尾静脉取血,将全血置于一次性试管中,于冰箱 (4℃)中静置1 h,以3 500 r/min离心10 min,取上层血清分装于 1.5 mL离心管中,暂存于冰箱(-20℃)中,用于血清生化和抗氧化指标的测定;另从每缸随机取3尾鱼,麻醉后在冰盘上解剖,分别取肝脏、肠道样品,暂存于超低温冰箱 (-80℃)中,用于抗氧化指标的测定。
鲟鱼肠道前中后的划分:前肠是胃和幽门盲囊与十二指肠连接处,呈 “乙”状弯曲,先从右往左拐,后又形成一个弯曲为中肠部分,中肠与前肠相比较为细短,肠管的最后一个弯曲处为中肠和后肠的分界点,十二指肠后面较粗的瓣肠部分即为后肠[16-18]。
1.2.4 指标的测定
(1)饲料的营养成分。通过常压干燥法在105℃的烘箱中烘至恒重后计算水分含量;通过凯氏定氮法 (GB/T 6432—1994)、索氏抽提法 (GB/ T6432—1994)分别测定粗蛋白质、粗脂肪含量;采用560℃灼烧法 (GB/T6438—1992)在马氟炉焚烧5 h后计算灰分含量。
(2)精氨酸含量。将饲料先用6 mol/L的HCl 在110℃下水解24 h,经过处理后采用日立L-8900氨基酸自动分析仪 (日立公司,日本)进行分析,测定饲料中精氨酸的含量。
(3)血清生化指标。利用全自动生化分析仪(贝克曼ProCX4,德国)进行测定。各指标测定方法如下:采用双缩脲法、溴甲酚绿法、酶偶联速率法分别测定总蛋白 (TP)、白蛋白 (ALB)、尿素氮 (BUN)含量;采用TP与ALB两者的差值计算球蛋白 (GLB)含量;采用速率法测定谷丙转氨酶(ALT)和谷草转氨酶 (AST)活性;采用酶法测定甘油三酯 (TG)、总胆固醇 (TCHO)和血糖(GLU)含量。
(4)抗氧化指标。采用南京建成试剂盒测定超氧化物歧化酶 (SOD)、丙二醛 (MDA)和谷胱甘肽 (GSH)含量,具体方法参见各试剂盒说明书。
1.3 数据处理
试验数据采用 SPSS 22.0软件进行单因素(ANOVA)方差分析,用Duncan法进行组间多重比较,试验结果均以平均值±标准差来表示,显著性水平设为0.05。
2 结果与分析
2.1 饲喂不同水平精氨酸饲料的杂交鲟幼鱼肠道抗氧化能力
饲料中不同水平精氨酸对杂交鲟幼鱼肠道抗氧化能力的影响见表3。从表3可见:与1.76%精氨酸组 (对照)相比,2.36%、2.64%、2.93%、3.24%精氨酸组前肠 SOD活力显著提高 (P<0.05),各组前肠MDA含量均无显著性差异 (P>0.05),2.64%、2.93%、3.24%精氨酸组前肠GSH含量显著提高 (P<0.05);2.36%、2.64%、2.93%精氨酸组中肠 SOD活力显著提高 (P<0.05),2.36%、2.64%、2.93%精氨酸组中肠MDA含量显著降低 (P<0.05),2.36%、2.64%、2.93%、3.24%精氨酸组中肠GSH含量显著提高(P<0.05);2.64%、2.93%、3.24%精氨酸组后肠SOD活力显著提高 (P<0.05),各组后肠MDA含量均无显著性差异 (P>0.05),2.36%、2.64%、2.93%、3.24%精氨酸组后肠GSH含量显著提高 (P<0.05)。以中肠MDA含量 (y)为指标,得到其与精氨酸水平 (x)的二次曲线回归方程为 y=4.3056x2-23.497x+45.321(R2= 0.82665),得出饲料中最适精氨酸需求量为2.73% (图1)。
表3 饲料中精氨酸水平对杂交鲟幼鱼肠道抗氧化能力的影响
Tab.3 Effects of dietary arginine levels on antioxidative capacity in intestine of juvenile hybrid sturgeon
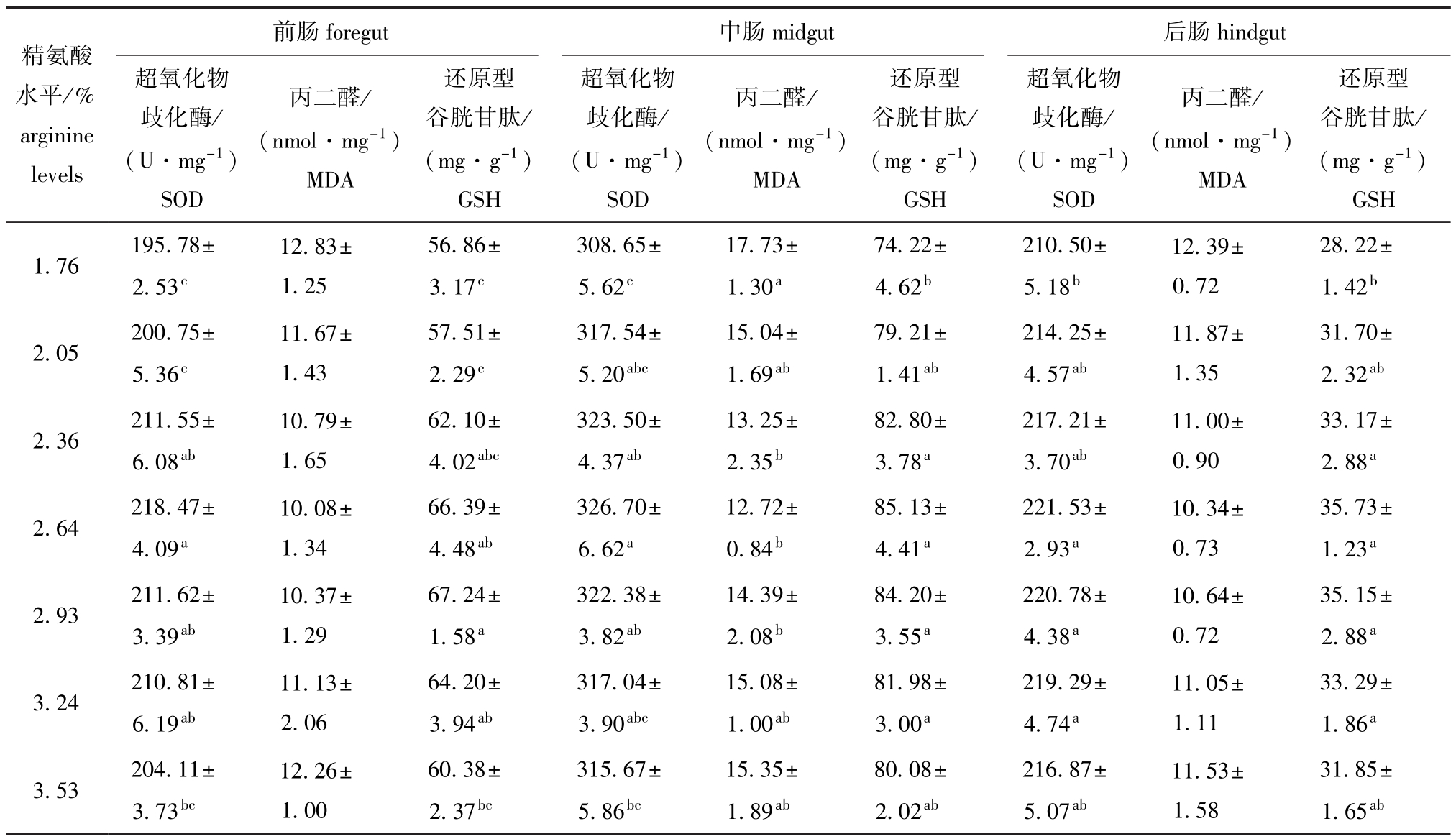
注:同列中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同
Note:The means with different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia
前肠精氨酸水平/% arginine foregut 中肠midgut 后肠hindgut levels还原型谷胱甘肽/ (mg·g-1)GSH 1.76 195.78± 2.53c超氧化物歧化酶/ (U·mg-1)SOD丙二醛/ (nmol·mg-1)MDA还原型谷胱甘肽/ (mg·g-1)GSH超氧化物歧化酶/ (U·mg-1)SOD丙二醛/ (nmol·mg-1)MDA还原型谷胱甘肽/ (mg·g-1)GSH超氧化物歧化酶/ (U·mg-1)SOD丙二醛/ (nmol·mg-1)MDA 12.83± 1.25 56.86± 3.17c308.65± 5.62c17.73± 1.30a74.22± 4.62b210.50± 5.18b12.39± 0.72 28.22± 1.42b2.05 200.75± 5.36c31.70± 2.32ab2.36 211.55± 6.08ab11.67± 1.43 57.51± 2.29c317.54± 5.20abc15.04± 1.69ab79.21± 1.41ab214.25± 4.57ab11.87± 1.35 33.17± 2.88a2.64 218.47± 4.09a10.79± 1.65 62.10± 4.02abc323.50± 4.37ab13.25± 2.35b82.80± 3.78a217.21± 3.70ab11.00± 0.90 35.73± 1.23a2.93 211.62± 3.39ab10.08± 1.34 66.39± 4.48ab326.70± 6.62a12.72± 0.84b85.13± 4.41a221.53± 2.93a10.34± 0.73 35.15± 2.88a3.24 210.81± 6.19ab10.37± 1.29 67.24± 1.58a322.38± 3.82ab14.39± 2.08b84.20± 3.55a220.78± 4.38a10.64± 0.72 33.29± 1.86a3.53 204.11± 3.73bc11.13± 2.06 64.20± 3.94ab317.04± 3.90abc15.08± 1.00ab81.98± 3.00a219.29± 4.74a11.05± 1.11 12.26± 1.00 60.38± 2.37bc315.67± 5.86bc15.35± 1.89ab80.08± 2.02ab216.87± 5.07ab11.53± 1.58 31.85± 1.65ab
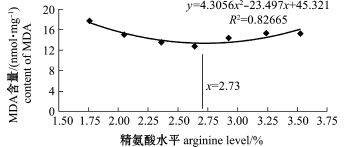
图1 饲料中精氨酸水平与杂交鲟幼鱼中肠MDA含量之间的关系
Fig.1 Relationship between the content of midgut MDA and dietary arginine levels in juvenile hybrid sturgeon
2.2 饲喂不同水平精氨酸饲料的杂交鲟幼鱼血清、肝脏抗氧化能力
表4 饲料中精氨酸水平对杂交鲟幼鱼血清、肝脏抗氧化能力的影响
Tab.4 Effects of dietary arginine levels on antioxidative state in serum and liver of juvenile hybrid sturgeon

血清serum 肝脏liver 精氨酸水平/% arginine丙二醛/ (nmol·mg-1)level超氧化物歧化酶/ (U·mL-1)SOD丙二醛/ (nmol·mL-1)MDA超氧化物歧化酶/ (U·mg-1)SOD MDA 1.76 179.81±3.35 56.12±1.70 1473.51±18.51 33.73±2.58 2.05 182.34±3.99 53.18±5.52 1485.35±26.03 33.47±3.26 2.36 188.11±8.02 51.90±3.02 1499.27±26.33 32.69±2.21 2.64 191.51±3.93 47.41±2.31 1512.89±34.47 31.44±3.40 2.93 187.30±9.94 47.81±2.17 1500.60±32.27 31.93±3.50 3.24 182.11±2.56 53.13±5.45 1483.49±18.18 33.16±2.86 3.53 179.71±6.85 54.88±8.98 1474.35±13.93 33.20±1.41
饲料中不同水平精氨酸对杂交鲟幼鱼血清、肝脏抗氧化能力的影响见表4。从表4可见:血清和肝脏中SOD活力受饲料中精氨酸水平的影响呈先升高后降低的趋势,且在2.64%精氨酸组有最大值,但差异均不显著 (P>0.05);血清和肝脏中MDA含量表现出与SOD相反的变化趋势,最小值也出现在2.64%精氨酸组中,且差异也不显著(P>0.05)。
2.3 饲喂不同水平精氨酸饲料的杂交鲟幼鱼血清蛋白指标
饲料中不同水平精氨酸对杂交鲟幼鱼血清蛋白指标的影响见表5。从表5可见:与1.76%精氨酸组 (对照)相比,仅2.64%精氨酸组TP和ALB含量显著升高 (P<0.05),其他组差异均不显著(P>0.05);饲料中精氨酸水平对GLB含量影响不显著 (P>0.05);2.64%、2.93%精氨酸组BUN含量显著降低 (P<0.05),其他组差异均不显著(P>0.05)。以血清BUN含量 (y)为指标,得到其与精氨酸水平 (x)的二次曲线回归方程为y= 1877x2-103.16x+2.0029(R2=0.97416),得出饲料中最适精氨酸需求量为2.75% (图2)。
表5 饲料中精氨酸水平对杂交鲟幼鱼血清蛋白指标的影响
Tab.5 Effects of dietary arginine levels on serum protein indices in juvenile hybrid sturgeon
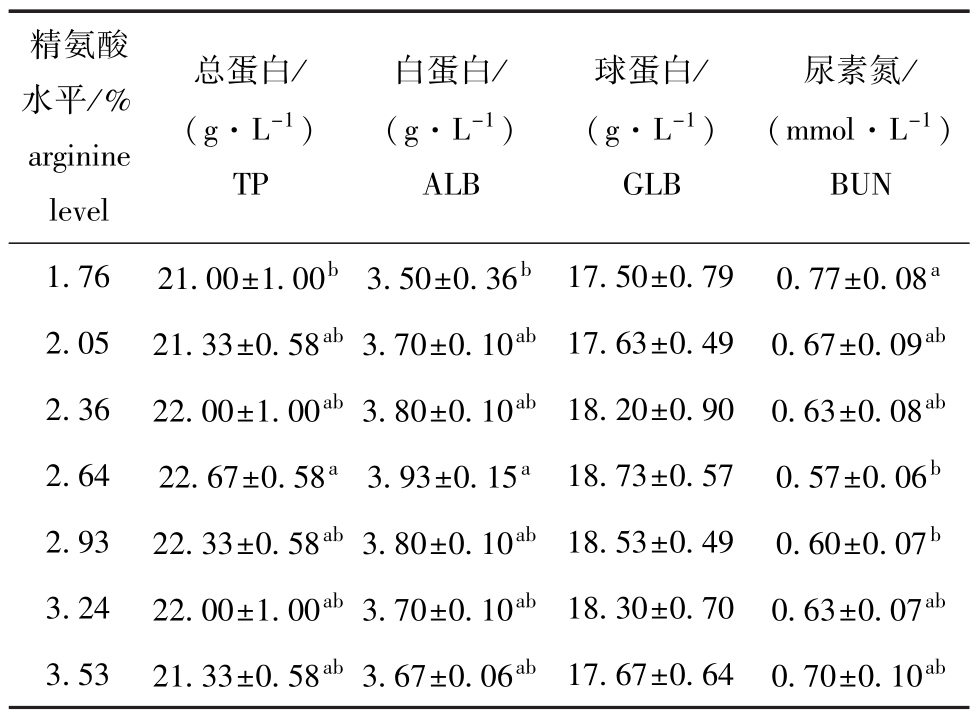
精氨酸水平/% arginine level尿素氮/ (mmol·L-1)BUN 1.76 21.00±1.00b3.50±0.36b 17.50±0.79 0.77±0.08总蛋白/ (g·L-1)TP白蛋白/ (g·L-1)ALB球蛋白/ (g·L-1)GLB a 2.05 21.33±0.58ab3.70±0.10ab 17.63±0.49 0.67±0.09ab2.36 22.00±1.00ab3.80±0.10ab 18.20±0.90 0.63±0.08ab2.64 22.67±0.58a3.93±0.15a 18.73±0.57 0.57±0.06b2.93 22.33±0.58ab3.80±0.10ab 18.53±0.49 0.60±0.07b3.24 22.00±1.00ab3.70±0.10ab 18.30±0.70 0.63±0.07ab3.53 21.33±0.58ab3.67±0.06ab 17.67±0.64 0.70±0.10ab
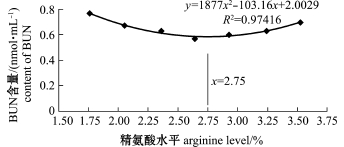
图2 饲料中精氨酸水平与杂交鲟幼鱼血清BUN含量之间的关系
Fig.2 Relationship between the content of serum BUN and dietary arginine levels in juvenile hybrid sturgeon
2.4 饲喂不同水平精氨酸饲料的杂交鲟幼鱼血清中血脂、血糖和转氨酶指标
饲料中不同水平精氨酸对杂交鲟幼鱼血清中血脂、血糖和转氨酶指标的影响见表6。从表6可见:与1.76%精氨酸组 (对照)相比,2.64%、2.93%精氨酸组GLU含量显著升高 (P<0.05),其他组差异均不显著 (P>0.05);2.64%组AST含量显著降低 (P<0.05),其他组差异均不显著(P>0.05);除2.05%、3.53%精氨酸组TG含量差异不显著 (P>0.05)外,其他组均显著降低(P<0.05);各组ALT活力和TCHO含量差异均不显著 (P>0.05)。
3 讨论
3.1 精氨酸对杂交鲟幼鱼抗氧化能力的影响
SOD和GSH分别是鱼体抗氧化系统内主要的抗氧化酶和非酶性抗氧化物的代表[19]。SOD对机体的氧化和抗氧化平衡至关重要,作用于超氧阴离子自由基,使之转化为过氧化氢,从而保护机体细胞免受损伤,是机体抗氧化能力的指示器[20]。GSH具有清除自由基、解毒、维持细胞生长等多种生理功能,它作为机体内最重要的非酶性抗氧化物,可以清除超氧阴离子自由基和过氧化氢等低分子,其含量的高低可以反映机体抗氧化能力的大小[21-22]。MDA是氧自由基攻击生物膜中的多不饱和脂肪酸引发脂质过氧化作用形成的脂质过氧化物,其含量的高低可以反映出机体脂质过氧化的程度,并间接反映机体细胞受损伤程度[23]。同时测定SOD和MDA指标的变化,能够更好地说明机体的抗氧化能力和氧化损伤程度[24]。本试验结果表明,饲料中添加适宜水平的精氨酸可以增加杂交鲟幼鱼肠道SOD活力,提高GSH含量,并降低MDA含量,从而提高鱼体肠道的抗氧化能力,其作用机理可能是谷氨酰胺 (Gln)的调节作用。机体内精氨酸水平增加时,能够促进Gln的生成,Gln在体内可以调节抗氧化酶和非酶系统来增强肠上皮的抗氧化能力[25],同时 Gln还可作为能源物质氧化、清除细胞内的一些强氧化性物质,保护细胞组分免受氧化性损伤[26]。
精氨酸是体内多胺、一氧化氮等活性物质合成的前体物,精氨酸可在一氧化氮合成酶 (NOS)的作用下生成NO。NO是机体内一种多效的信号分子,不仅参与组织的氧化和免疫作用[27],还有利于伤口的复原[28]。研究表明,适量的 NO可以清除机体内的氧自由基,提高抗氧化酶的活性,而过量的精氨酸使血清和肝脏中NO含量集聚增加,过多的NO也会促进过氧化物和脂质氢等自由基的产生,破坏机体的氧化平衡,甚至对机体造成一定的损伤[29]。Li等[30]研究表明,饲料中精氨酸水平对大菱鲆幼鱼血清和肝脏中SOD活力无显著影响。Zhou等[31]研究也表明,石斑鱼血清和肝脏中SOD活力受精氨酸水平的影响不显著,本试验结果与其相似。本试验结果表明,饲料中的精氨酸水平对杂交鲟幼鱼血清和肝脏的抗氧化能力无显著影响。而Buentello等[32]的研究则表明,饲料中精氨酸水平能显著提高斑点叉尾鮰肝脏中SOD活力。这说明,精氨酸对鱼体血清和肝脏抗氧化能力的影响可能受饲料中精氨酸水平和物种间差异的双重影响,其作用机理还需更加深入地研究来证实。
表6 饲料中不同水平精氨酸对杂交鲟幼鱼血脂、血糖和转氨酶指标的影响
Tab.6 Effects of dietary arginine levels on levels of serum lipids and glucose and transaminase activity in juvenile hybrid sturgeon
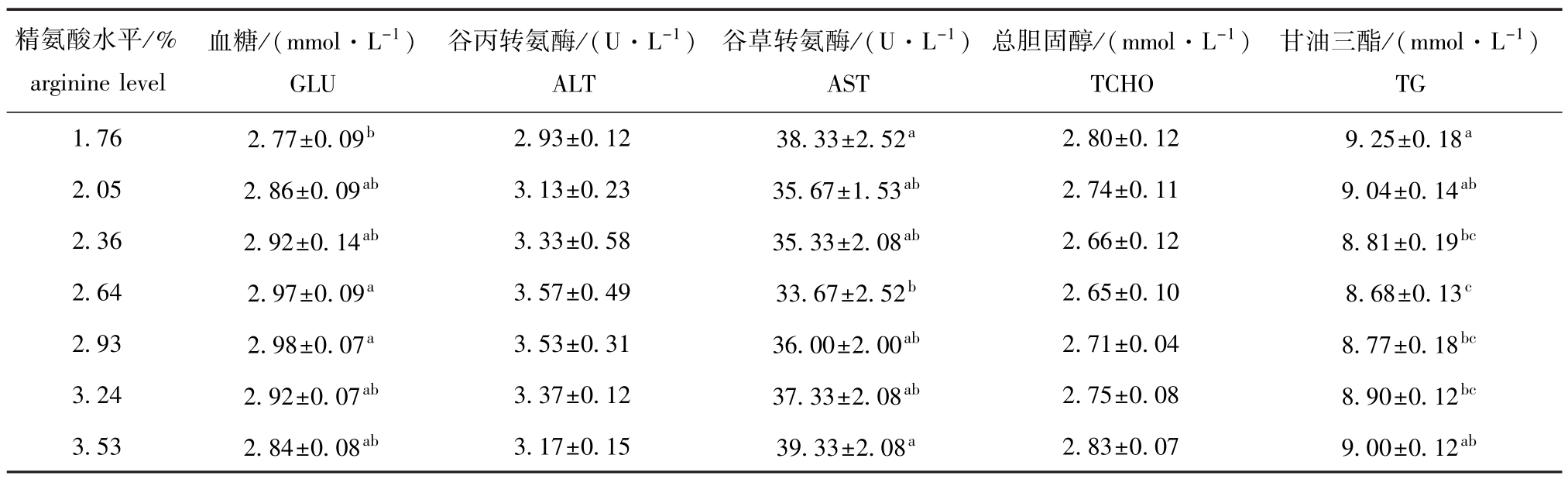
精氨酸水平/% arginine level甘油三酯/(mmol·L-1)TG 1.76 2.77±0.09b 2.93±0.12 38.33±2.52a 2.80±0.12 9.25±0.18血糖/(mmol·L-1)GLU谷丙转氨酶/(U·L-1)ALT谷草转氨酶/(U·L-1)AST总胆固醇/(mmol·L-1)TCHO a 2.05 2.86±0.09ab 3.13±0.23 35.67±1.53ab 2.74±0.11 9.04±0.14ab2.36 2.92±0.14ab 3.33±0.58 35.33±2.08ab 2.66±0.12 8.81±0.19bc2.64 2.97±0.09a 3.57±0.49 33.67±2.52b 2.65±0.10 8.68±0.13c2.93 2.98±0.07a 3.53±0.31 36.00±2.00ab 2.71±0.04 8.77±0.18bc3.24 2.92±0.07ab 3.37±0.12 37.33±2.08ab 2.75±0.08 8.90±0.12bc3.53 2.84±0.08ab 3.17±0.15 39.33±2.08a 2.83±0.07 9.00±0.12ab
3.2 精氨酸对杂交鲟幼鱼血清蛋白代谢相关指标的影响
血液生化指标是反映机体新陈代谢情况的重要指标。血清总蛋白含量的变化反映了机体蛋白吸收和代谢的状况,在机体内具有维持血管渗透压和酸碱度,参与代谢产物的运输和机体免疫等多种生理功能,包括白蛋白和球蛋白两部分。尿素氮是机体血清中非蛋白质类含氮物,其含量高低可以反映体内蛋白质分解代谢和肾功能情况[33],血清中BUN含量与氮沉积形成蛋白的量呈负相关,BUN含量越高,表明净蛋白质合成率越低、氨基酸分解代谢率越高[34]。本试验结果表明,饲料中适宜水平的精氨酸能够显著增加杂交鲟幼鱼血清中TP和ALB的含量,且降低BUN的含量。这说明,饲料中添加适量的精氨酸能够促进鱼体蛋白质的合成,提高机体的代谢水平,增加氮沉积[35-36]。
ALT和AST是动物体内最主要的两个转氨酶,在体内参与转氨基作用,是反映机体蛋白质合成和分解代谢状况的重要指标[37]。Zhou等[38]研究表明,ALT含量与饲料中精氨酸水平呈正相关,而AST含量与生长性能呈负相关。Zhou等[39]对黑鲷的研究表明,血清中ALT含量增加说明饲料中氨基酸的转化增强,因为ALT与氨基酸的脱氨基作用以及氨基酸的转化紧密相关,本试验结果与其相似。本试验结果表明,杂交鲟血清中AST含量随饲料中精氨酸水平的升高呈现先降低后升高的趋势,而ALT含量受饲料精氨酸水平的影响不显著,但也呈现出先升高后降低的趋势。当鱼体氨基酸不平衡时,部分氨基酸通过脱羧基和转氨基作用以能量的形式被消耗,导致机体用于合成蛋白质和其他生理需要的氨基酸量缺乏,致使AST含量升高。这说明,饲料中适宜的精氨酸水平能够提高杂交鲟幼鱼肝脏转化氨基酸和脱氨基能力,提高蛋白质的利用率,并促进蛋白质的合成。
3.3 精氨酸对杂交鲟幼鱼血清中血脂和血糖指标的影响
血清中TG和TCHO含量是反映动物体内脂肪沉积的指标[40]。TG是鱼类脂肪在细胞里的存在形式,也是鱼类代谢的主要产物。当体内有多余的能量时,脂肪组织会以甘油三酯的形式将其储存备用;相反,当鱼体能量缺乏时,机体会将甘油三酯分解成脂肪酸和甘油来维持正常的生理机能。周凡[41]研究表明,随着饲料中精氨酸水平的升高,黑鲷幼鱼血清TG含量逐渐降低。本试验结果表明,TG和TCHO含量随饲料中精氨酸水平的增加呈先降低后升高的趋势,但对TCHO影响不显著。这与Ahmed等[42]对印度鲤的研究结果一致。这说明,饲料中适宜的精氨酸水平能够降低杂交鲟幼鱼血脂含量,减少鱼体脂肪沉积,利于鱼体健康生长。
GLU是动物进行生命活动时可直接利用的能源物质,对维持各组织器官的生理功能具有重要意义。GLU含量在正常范围内升高,表明肠道对营养物质的消化吸收能力增强,一定程度上也提高了肝脏合成糖原代谢的能力,利于减缓不良应激。本试验结果表明,饲料中适量的精氨酸能够提高GLU含量,而TG和TCHO含量则随饲料中精氨酸水平的增加呈先降低后升高的趋势,但对TCHO影响不显著。这与Ahmed等[42]对印度鲤的研究结果一致。这说明,饲料中适宜的精氨酸水平能够提高杂交鲟幼鱼的能量代谢水平,调节鱼体的生长代谢,促进生长。而廖英杰等[15]对团头鲂的研究则表明,饲料中精氨酸水平对GLU无显著影响。这表明,饲料中精氨酸水平对血糖的影响可能受鱼的种类、大小、试验饲料和养殖环境等因素的制约。
参考文献:
[1]Mertz E T.The protein and amino acid needs[M]//Halver J E. Fish Nutrition.New York:Academic Press,1972:143-175.
[2]Wilson R P,Halver J E.Protein and amino acid requirements of fishes[J].Annual Review of Nutrition,1986,6:e225-e244.
[3]Masagounder K,Hayward R S,Firman J D.Comparison of dietary essential amino acid requirements determined from group-housed versus individually-housed juvenile bluegill,Lepomis macrochirus [J].Aquaculture Nutrition,2011,17(2):559-571.
[4]Hart S D,Brown B J,Gould N L,et al.Predicting the optimal dietary essential amino acid profile for growth of juvenile yellow perch with whole body amino acid concentrations[J].Aquaculture Nutrition,2010,16(3):248-253.
[5]National Research Council(NRC).Nutrient Requirements of Fish and Shrimp[M].Washington,DC:National Academie Press,2011:67-68.
[6]万军利,麦康森,艾庆辉.鱼类精氨酸营养生理研究进展[J].中国水产科学,2006,13(4):679-685.
[7]Huggins A K,Skutsch G,Baldwin E.Ornithine-urea cycle enzymes in teleostean fish[J].Comparative Biochemistry and Physiology,1969,28(2):587-602.
[8]Chiu Y N,Austic R E,Rumsey G L.Effect of feeding level and dietary electrolytes on the arginine requirement of rainbow trout (Salmo gairdneri)[J].Aquaculture,1988,69(1-2):79-91.
[9]陈迪,王连生,徐奇友.α-酮戊二酸对杂交鲟肠道形态、消化酶活力和抗氧化能力的影响[J].大连海洋大学学报,2015,30 (4):363-368.
[10]计成,白秀梅.精氨酸的抗热应激作用及在母猪上的应用[J].饲料工业,2011,32(12):1-4.
[11]Hristina K,Langerholc T,Trapecar M.Novel metabolic roles of L-arginine in body energy metabolism and possible clinical applications[J].The Journal of Nutrition,Health&Aging,2014,18 (2):213-218.
[12]Tong B C,Barbul A.Cellular and physiological effects of arginine [J].Mini Rev Med Chem,2004,4(8):823-832.
[13]Huang C C,Lin T J,Lu Y F,et al.Protective effects of L-arginine supplementation against exhaustive exercise-induced oxidative stress in young rat tissues[J].Chin J Physiol,2009,52(5):306-315.
[14]张漓,徐建方,冯连世,等.补充左旋精氨酸对耐力训练大鼠股外肌抗氧化酶系的影响[J].中国运动医学杂志,2007,26 (3):308-312.
[15]廖英杰,刘波,任鸣春,等.精氨酸对团头鲂幼鱼生长、血清游离精氨酸和赖氨酸、血液生化及免疫指标的影响[J].中国水产科学,2014,21(3):549-559.
[16]张小谷,洪一江,汪洪.四种淡水鱼类前肠的组织学比较研究[J].南昌大学学报:理科版,1999,23(4):339-342.
[17]曲秋芝,华育平,曾朝辉,等.史氏鲟消化系统形态学与组织学观察[J].水产学报,2003,27(1):1-6.
[18]徐雪峰.中华鲟消化系统的发育及消化酶活性变化的研究[D].武汉:华中农业大学,2006.
[19]周婷婷,曹俊明,赵红霞,等.谷胱甘肽在水产动物中的营养生理作用研究进展[J].水产科学,2012,31(10):630-634.
[20]Shen W Y,Fu L L,Li W F,et al.Effect of dietary supplementation with Bacillus subtilis on the growth,performance,immune response and antioxidant activities of the shrimp(Litopenaeus vannamei)[J].Aquaculture Research,2010,41(11):1691-1698.
[21]Bell J G,Cowey C B.Roles of vitamin E and selenium in the prevention of pathologies related to fatty acid oxidation in salmonids [M]//Cowey C B,Mackie A M,Bell J G.Nutrition and Feeding in Fish.London:Academic Press,1985:333-347.
[22]Winterbourn C C,Metodiewa D.Reaction of superoxide with glutathione and other thiols[J].Meth Enzymol,1995,251:81-86.
[23]李源,温安祥,骆美琳.谷氨酰胺促泥鳅生长机理的初步研究[J].饲料工业,2014,35(2):37-43.
[24]Kir H M,Dillioglugil M O,Tugay M,et al.Effects of vitamins E,A and D on MDA,GSH,NO levels and SOD activities in 5/6 nephrectomized rats[J].Am J Nephrol,2005,25(5):441-446.
[25]姜俊,冯琳,胡凯,等.谷氨酰胺与鱼类消化系统生长发育以及肠上皮细胞蛋白质合成和抗氧化能力的关系[J].动物营养学报,2011,23(5):735-739.
[26]王学斌,刘凤莲,李东风,等.体内游离谷氨酰胺的抗氧化作用[J].生物物理学报,2004,20(6):429-433.
[27]Muscara M N,Wallace J L.Nitric oxide:therapeutic potential of nitric oxide donors and inhibitors[J].American Journal of Physiology,1999,276:1313-1316.
[28]Heffernan D,Dudley B,McNeil P L,et al.Local arginine supplementation results in sustained wound nitric oxide production and reductions in vascular endothelial growth factor expression and granulation tissue formation[J].Journal of Surgical Research,2006,133(1):46-54.
[29]高运苓,吴信,周锡红,等.精氨酸和精氨酸生素对断奶仔猪氧化应激的影响[J].农业现代化研究,2010,31(4):484-487.
[30]Li Y,Wang Y J,Wang L,et al.Influence of several non-nutrient additives on nonspecific immunity and growth of juvenile turbot,Scophthalmus maximus L.[J].Aquaculture Nutrition,2008,14 (5):387-395.
[31]Zhou Q C,Zeng W P,Wang H L,et al.Dietary arginine require-ment of juvenile yellow grouper Epinephelus awoara[J].Aquaculture,2012,350-353:175-182.
[32]Buentello J A,Reyes-Becerril M,de Jesús Romero-Geraldo M,et al.Effects of dietary arginine on hematological parameters and innate immune function of channel catfish[J].Journal of Aquatic Animal Health,2007,19(3):195-203.
[33]李忠荣,陈婉如,叶鼎承,等.低蛋白质补充氨基酸饲粮对北京鸭生长性能、血清生化指标及粪氮含量的影响[J].动物营养学报,2013,25(2):319-325.
[34]Urschel K L,Shoveller A K,Uwiera R R E,et al.Citrulline is an effective arginine precursor in enterally-fed neonatal piglets[J]. Nutrition,2006,136(7):1806-1813.
[35]Coma J,Carrion D,Zimmerman D R.Use of plasma urea nitrogen as a rapid response criterion to determine the lysine requirement of pigs[J].Journal of Animal Science,1995,73(2):472-481.
[36]Kanjanapruthipong J.Supplementation of milk replacers containing soy protein with threonine,methionine,and lysine in the diets of calves[J].Journal of Dairy Science,1998,81(11):2912-2915.
[37]唐玲,徐奇友,王常安,等.不同水温和饲料蛋白质水平对镜鲤血清生化指标的影响[J].大连海洋大学学报,2011,26 (1):41-46.
[38]Zhou F,Xiong W,Xiao J X,et al.Optimum arginine requirement of juvenile black sea bream,Sparus macrocephalus[J].Aquaculture Research,2010,41(10):e418-e430.
[39]Zhou F,Shao Q J,Xiao J X,et al.Effects of dietary arginine and lysine levels on growth performance,nutrient utilization and tissue biochemical profile of black sea bream,Acanthopagrus schlegelii,fingerlings[J].Aquaculture,2011,319(1-2):72-80.
[40]姜柯君,王际英,张利民,等.饲料中添加小肽对星斑川鲽幼鱼生长性能、体组成及血清生化指标的影响[J].动物营养学报,2013,25(1):222-230.
[41]周凡.饲料赖氨酸和精氨酸对黑鲷幼鱼生长影响及其拮抗作用机理研究[D].杭州:浙江大学,2011.
[42]Ahmed I,Khan M A.Dietary arginine requirement of fingerling Indian major carp,Cirrhinus mrigala(Hamilton)[J].Aquaculture Nutrition,2004,10(4):217-225.
中图分类号:S963.7
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.03.008
文章编号:2095-1388(2016)03-0272-08
收稿日期:2015-09-09
基金项目:黑龙江水产研究所基本科研业务费专项 (HSY201408);国家公益性行业 (农业)专项 (201003055)
作者简介:吴俊光 (1989—),男,硕士研究生。E-mail:w301022@163.com
通信作者:徐奇友 (1969—),男,研究员,硕士生导师。E-mail:xuqiyou@sina.com生长和代谢方面也具有重要作用[12]。Huang等[13]对大鼠的研究表明,精氨酸可以提高大鼠的抗氧化酶活性,降低丙二醛含量,从而降低氧化应激对组织的损伤。张漓等[14]研究指出,小剂量的L-精氨酸对大鼠机体有一定的保护作用,大剂量的L-精氨酸反而促进机体自由基的生成,会对机体造成一定的损伤。廖英杰等[15]对团头鲂的研究表明,饲料中适宜的精氨酸水平可以提高血清中总蛋白和球蛋白含量,并显著降低尿素氮含量和谷草转氨酶活性,从而促进氨基酸代谢和蛋白质合成。
Effects of dietary arginine levels on antioxidative state and serum biochemical indices in juvenile hybrid sturgeon
WU Jun-guang1,2,WANG Lian-sheng1,WANG Chang-an1,LI Jin-nan1,ZHAO Zhi-gang1,LUO Liang1,DU Xue1,XU Qi-you1
(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China)
Abstract:A total of 630 juveniles of hybrid sturgeon(Acipenser schrenkii♀×A.baeri♂)with initial body weight of(3.63±0.08)g were randomly divided into 7 groups with 3 replicates per group and 30 fish per replicate and fed seven isonitrogenous and isolipidic diets containing arginine levels of 1.76%,2.05%,2.36%,2.05%,2.93%,3.24%and 3.53%for 8 weeks to study effects of dietary arginine levels on antioxidative state,and serum biochemical indices of juvenile hybrid sturgeon.The results showed that there were significantly higher activity of superoxide dismutase(SOD)and content of glutathione(GSH)in intestine and lower content of malonaldehyde (MDA)in midgut of the juvenile hybrid sturgeon in 2.64%and 2.93%groups than those in 1.76%group(P<0.05).There were no significant differences in contents of MDA in foregut and hindgut(P>0.05),and in MDA content and SOD activity in serum and liver(P>0.05)in the juveniles fed the diets containing various arginine levels.Significantly elevated contents of serum total protein(TP)and albumin(ALB),and significantly lower activity of glutamic oxalacetic transaminase(AST)were observed in the juveniles in 2.64%group(P<0.05).There were significantly lower content of serum urea nitrogen(BUN)(P<0.05),and significantly higher serum glucose (GLU)in the juveniles in 2.64%and 2.93%groups(P<0.05).The significantly lower contents of serum triglyceride(TG)were found in the juveniles in 2.36%,2.64%,2.93%and 3.24%groups(P<0.05),without significant differences in contents of globulin(GLB)and total cholesterin(TCHO)and the activity of glutamicpyruvic transaminase(ALT)in serum(P>0.05).The findings indicated that appropriate dietary arginine levels led to significant increase in ability of antioxidative state,improvement of metabolism and protein synthesis in fish. Quadratic regression analysis of content of midgut MDA and serum BUN indicates that the optimal dietary arginine requirement is recommended to be 2.73%and 2.75%,respectively.
Key words:arginine;hybrid sturgeon;antioxidative state;serum biochemical index







