不同保存方法对武汉单极虫DNA提取和PCR扩增的影响
陆宏达,刘俊杰,岳蒙蒙,操艮萍,李振伟
(上海海洋大学水产与生命学院,上海201306)
摘要:为探讨不同保存方法对武汉单极虫Thelohanellus wuhanensis DNA提取和PCR扩增的影响,将从患武汉单极虫病的异育银鲫Carassius auratus gibelio鱼苗上分离出含有孢子的孢囊,分别置于100%乙醇、70%乙醇、2.5%戊二醛、10%福尔马林、Bouin’s液、Carnoy’s液和Müller’s液中保存50 d,经计数调整孢子等量后分别进行DNA提取、常规PCR和巢式PCR扩增。结果表明:100%乙醇和70%乙醇保存方法对武汉单极虫孢子DNA提取、常规PCR和巢式PCR扩增均无任何影响,等同于新鲜孢子,可作为孢子的保存方法;2.5%戊二醛和Bouin’s液保存方法只对孢子DNA提取有影响,但均能在常规PCR和巢式PCR扩增后出现特异电泳条带,可作为用于常规PCR和巢式PCR扩增的孢子保存方法;10%福尔马林和Müller’s液保存方法对孢子DNA提取和常规PCR扩增均有影响,但均能在巢式PCR扩增后出现特异电泳条带,故只能作为用于巢式PCR扩增的孢子保存方法;Carnoy’s液保存方法无论在孢子DNA提取还是进行常规PCR和巢式PCR扩增均无阳性结果,故不能用作孢子核酸分子生物学研究的保存方法。研究表明,除100%乙醇和70%乙醇保存方法外,其他保存方法对孢子DNA提取、常规PCR和巢式PCR扩增均有不同程度的影响。
关键词:保存方法;武汉单极虫;DNA提取;PCR扩增
武汉单极虫 Thelohanellus wuhanensis隶属于粘体动物门、粘孢子纲、双壳目、单极虫科、单极虫属[1],该寄生虫的寄主和寄生部位具有特异性,寄生于异育银鲫 Carassius auratus gibelio鱼苗体表鳞片下的鳞囊内,形成孢囊。近年来,患武汉单极虫病的鱼较多,发病一般出现在5月底6月初,此时鱼苗体长为1~7 cm,在鳞囊内形成孢囊,孢囊的数目不等,鱼感染最严重时孢囊数可达30个左右,经2~3个月的发育,孢囊大小能达到1.7 mm左右,9—10月份后孢囊逐渐消退和消失,发病期间,轻者影响鱼的生长,重者引起鱼的死亡,累积死亡率一般为30%~60%。
根据不同的目的,常将患武汉单极虫病的病鱼或病变组织等保存在不同的液体中。如作为标本,常用100%乙醇、70%乙醇和10%福尔马林等保存;而作为用于组织病理显微结构研究的材料,常用 10% 福尔马林、Bouin’s液、Carnoy’s液和Müller’s液等固定保存;作为用于亚显微结构研究的材料,常用2.5%戊二醛溶液固定保存。由于武汉单极虫病的发生具有季节性,只能在6—10月份采集到新鲜的孢子,这就给无病期开展分子生物学相关研究带来了困难。在缺乏新鲜材料而只留有用保存液保存的试验材料时,不同保存液中保存的武汉单极虫是否可用于基因组DNA提取和PCR扩增等分析,以及对DNA提取和PCR扩增效果能产生多大影响的研究受到关注,目前,对粘孢子虫的类似研究尚未见报道。本试验中,将武汉单极虫分别保存在不同的保存液中,以新鲜武汉单极虫为对照,分别探讨不同保存方法对基因组DNA提取、常规PCR和巢式PCR扩增3个阶段的影响,为不同保存方法的武汉单极虫能否作为提取DNA及后续相关研究的试验材料提供依据,以期确定合适的保存方法,对其他粘孢子虫核酸分子水平方面的类似研究提供参考。
1 材料与方法
1.1 材料
患武汉单极虫病的异育银鲫鱼苗采自江苏省扬州市渌洋养殖场。
1.2 方法
1.2.1 病鱼和孢子的保存处理 用解剖工具将病鱼体表鳞片和鱼体组织间的武汉单极虫孢囊分离,并分别置于100%乙醇、70%乙醇、2.5%戊二醛、Bouin’s液、10%福尔马林、Carnoy’s液、Müller’s液中保存。不同保存液配方 (表1)和处理方式按照芮菊生等[2]的方法进行,其中用Bouin’s液固定24 h再用水冲洗后移入 70%乙醇中保存,用Carnoy’s液固定40 min再用95%乙醇冲洗后移入80%乙醇中保存,用Müller’s液固定48 h再用水冲洗后移入70%乙醇中保存。保存50 d后,分别取出不同保存液中的孢囊,切开孢囊,将脱离孢囊的分散孢子分别收集于离心管中,加适量灭菌双蒸馏水对孢子浸洗4 h后以4000 r/min离心,去液,重复浸洗4次基本去除样品中的原保存液,沉淀孢子中加适量灭菌双蒸馏水,参照周珍辉[3]的方法用血细胞计数板进行孢子计数,活鱼体表孢囊中新鲜孢子加适量灭菌双蒸馏水直接计数作为对照组,各组重复计数3次,取其平均值,分别将各组的孢子数调整为6×103个/μL。
1.2.2 DNA提取 按照Zhang等[4]的方法略作改进,分别取各试验组和对照组孢子悬液500 μL,加入500 μL DNA提取裂解液 (10 mmol/L Tris-Cl、pH 8.0、1 mmol/L EDTA、1%SDS、0.2 μg/μL蛋白酶K),在55℃下以120 r/min往复震荡温浴7 h,然后加入500 μL的苯酚∶氯仿∶异戊醇 (体积比为25∶24∶1),上下翻转3 min,用高速冷冻离心机 (Eppendorf 5424 R,德国)以12 000 r/min离心2 min;取上清液,反复抽提3次后,取上清液,加入等量氯仿,上下翻转3 min,以12 000 r/min离心2 min;取上清液,加入40 μL预冷醋酸钠 (3 mol/L,pH 7.0)和800 μL预冷无水乙醇,混匀,以12 000 r/min离心10 min;取沉淀,加70%预冷无水乙醇400 μL,以12 000 r/min离心2 min,留沉淀室温晾干;加入99 μL灭菌双蒸水和1 μL RNase,所得分别为各试验组和对照组武汉单极虫的DNA提取液。
1.2.3 DNA含量、纯度和完整性测定 分别取试验组和对照组武汉单极虫的DNA提取液2 μL,用微量分光光度计 (Colibri,德国)在260 nm和280 nm处分别检测DNA的OD值,得到DNA含量和DNA纯度 (OD260 nm/OD280 nm)。另取5 μL DNA提取液与1 μL 6×loading buffer和1 μL SYBR GreenⅠ核酸染料混匀,用12 g/L的琼脂糖凝胶进行电泳,并用凝胶成像系统 (Bio-Rad Gel DocTMXR+System,美国)拍照。
1.2.4 常规PCR扩增 采用Andree等[5]报道的一对引物MX5(5'CTGCGGACGGCTCAGTAAATCAGT 3')和MX3(5'CCAGGACATCTTAGGGCATCACAGA 3')对提取的DNA进行常规PCR扩增。反应体系 (共25 μL):上、下游引物 (10 μmol/L each)各0.5 μL;Taq DNA酶 (5 U/μL)0.5 μL;10×Buffer[20 mmol/L Tris-Cl(pH 8.0),100 mmol/L KCl,10 mmol/L(NH4)2SO4]2.5 μL;dNTP(0.5 mmol/L dNTP each)2 μL;Mg2+(10 mmol/L MgCl2)1.5 μL;DNA提取液1 μL作为模板;ddH2O 16.5 μL。反应条件:94℃下预变性5 min;94℃下变性30 s,55℃下退火30 s,72℃下延伸90 s,共进行40个循环;最后在72℃下再延伸10 min。常规PCR扩增产物采用与孢子DNA提取液同样的方法进行电泳和拍照。
1.2.5 巢式PCR扩增 采用柴下等[6]设计的一对武汉单极虫巢式PCR引物ART13F(5'ACCCACTTCTGTGGCCTTTC 3')和ART13R(5'AATCCGACCTACAACGCTGG 3')。反应体系和反应条件参照常规PCR扩增,只是反应体系中模板改用常规PCR扩增产物,巢式 PCR扩增产物采用与孢子DNA提取液同样的方法进行电泳和拍照。
1.2.6 PCR产物的鉴定 分别取常规PCR和巢式PCR扩增出的条带,经15 g/L琼脂糖凝胶电泳和分离,用普通琼脂糖凝胶DNA回收试剂盒 (天根生化科技有限公司)纯化回收,分别与载体(pMD 19-T)连接,经大肠杆菌DH5a感受态细胞转化、克隆,送上海生工生物工程有限公司用ABI-PRISM3730测序仪和测序试剂BigDyeterminator 3.1进行正反链同时测序,获得18S rDNA序列,并在GenBank上进行BLAST比对。
2 结果与分析
2.1 DNA提取效果
从表1可见:从100%乙醇和70%乙醇保存液中提取的 DNA含量最高,分别为 95.9、93.6ng/μL,DNA纯度也最高,分别为1.86和1.84,接近从新鲜孢子对照组提取的DNA含量和DNA纯度;从10%福尔马林、Bouin’s和Müller’s保存液中提取的DNA含量和DNA纯度相当,但均低于新鲜孢子且差异较大;从2.5%戊二醛和Carnoy’s保存液中提取的DNA含量和DNA纯度最低,与新鲜孢子差异最大。
表1 不同保存液及其保存的武汉单极虫DNA提取效果
Tab.1 DNA extractions from the parasite Thelohanellus wuhanensis preserved in different preservations
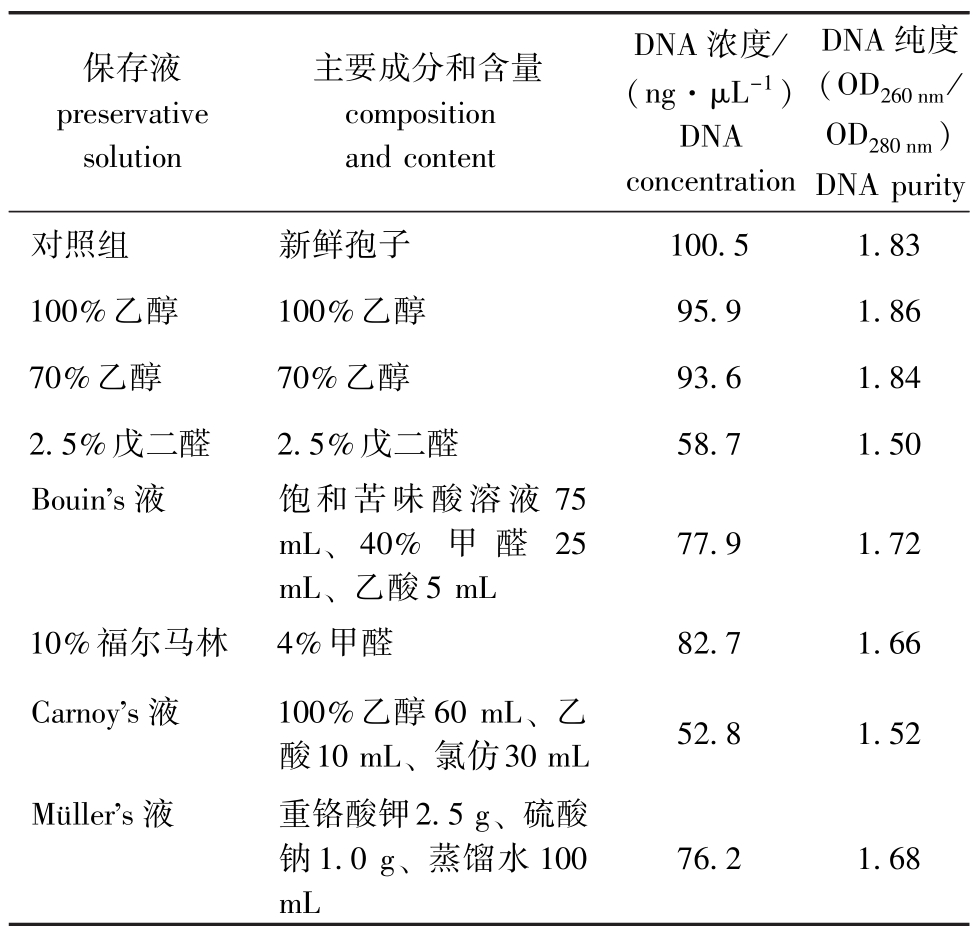
DNA纯度(OD260 nm/ OD280 nm)100.5 1.83 100%乙醇 100%乙醇 95.9 1.86 70%乙醇 70%乙醇 93.6 1.84 2.5%戊二醛 2.5%戊二醛 58.7 1.50 Bouin’s液 饱和苦味酸溶液75 mL、40% 甲 醛 25 mL、乙酸5 mL DNA purity对照组 新鲜孢子保存液preservative solution主要成分和含量composition and content DNA浓度/ (ng·μL-1)DNA concentration 77.9 1.72 10%福尔马林 4%甲醛 82.7 1.66 Carnoy’s液 100%乙醇60 mL、乙酸10 mL、氯仿30 mL 52.8 1.52 Müller’s液 重铬酸钾2.5 g、硫酸钠1.0 g、蒸馏水100 mL 76.2 1.68
从图1可见,从新鲜孢子和用100%乙醇和70%乙醇保存的孢子中提取的DNA经琼脂糖凝胶电泳后,均在高分子量区出现明亮一致的单一条带;而从其他保存液保存的孢子中提取的DNA均未出现这种条带,其中2.5%戊二醛组、Bouin’s液组和Carnoy’s液组在相对分子质量2000 bp以上有暗淡的涂布状核酸弥散现象,10%福尔马林组和Müller’s液组在500~1500 bp间有暗淡的涂布状核酸弥散现象,这说明这些保存方法提取的孢子DNA有严重降解。
2.2 常规PCR扩增
不同保存方法提取的武汉单极虫DNA通过常规PCR扩增,其产物电泳结果见图2-A。以新鲜孢子和用100%乙醇、70%乙醇、2.5%戊二醛、Bouin’s液保存的孢子DNA提取液分别作为模板,常规PCR后均能扩增出一条1584 bp DNA的特异条带,条带整齐,但明亮程度不同。其中100%乙醇组和70%乙醇组条带明亮程度接近对照组,2.5%戊二醛组次之,Bouin’s液组条带暗淡,而10%福尔马林组、Carnoy’s液组和Müller’s液组均未扩增出1584 bp DNA的应有特异条带,10%福尔马林组在该区域出现更为明亮的涂布状核酸弥散现象。扩增出的条带经测序表明,均为1584 bp DNA序列,BLAST结果显示,与GenBank中登录号为JQ 088179的武汉单极虫DNA序列完全一致。

图1 不同保存液中提取的DNA在12 g/L琼脂糖凝胶中的电泳图
Fig.1 Electrophoresis diagram of DNA extractions from the parasite Thelohanellus wuhanensis preserved in different preservations
注:M为Marker DL2000;1为对照组新鲜孢子;2为100%乙醇;3为70%乙醇;4为2.5%戊二醛;5为Bouin’s液;6为10%福尔马林;7为Carnoy’s液;8为Müller’s液
Note:M,Marker DL2000;1,control group;2,100%ethanol;3,70%ethanol;4,2.5%glutaraldehyde;5,Bouin’s solution;6,10%formalin;7,Carnoy’s solution;8,Müller’s solution
2.3 巢式PCR扩增
以第一轮常规PCR扩增产物DNA为模板,经巢式PCR扩增,扩增产物电泳结果见图2-B。除Carnoy’s液组未扩增出特异条带外,其他各组巢式PCR均能扩增出一条853 bp的单一特异条带,但条带明亮程度不同。新鲜孢子、100%乙醇组、70%乙醇组和2.5%戊二醛组条带明亮、清晰,亮度一致,其次为Bouin’s液组、10%福尔马林组,Müller’s液组条带亮度最弱。扩增出的条带经DNA测序,序列均为 853 bp,BLAST结果显示,与GenBank中登录号为KJ813820的武汉单极虫DNA序列完全一致。
3 讨论
3.1 不同方法保存的水生动物可用于DNA不同层次的分析
DNA提取是许多生物分子生物学研究中最基本和关键的一环,在水产动物寄生虫性、病毒性和细菌性等疾病病原体分子生物学方面的研究中也同样重要,而常规PCR扩增和巢式PCR扩增已在病原体检测和疾病诊断上被广泛应用。曾有报道不同保存液对DNA提取的影响,但大多局限于对一些动物如石鳖Acanthochiton seulschnochilon[7]、中华哲水蚤 Calanus sinicus[8]、三角帆蚌 Hyriopsis cumingii[9]和罗非鱼Oreochromis sp.[10]等本身细胞DNA提取的影响,未进行其他后续分子生物学方面影响的探讨,这些研究中,针对DNA提取液经电泳后未出现特异条带的现象,许多学者认为保存液保存的材料不能提取DNA的结论显然是不妥的。未出现特异条带但有暗淡的涂布状弥散是DNA降解的表现,有些DNA量低或降解而不呈现条带的DNA提取液,可经过常规PCR扩增后在琼脂糖凝胶上出现特异条带。巢式PCR扩增比常规PCR扩增灵敏度至少提高103倍[11]或104倍[6],同样有些常规PCR产物量低而不呈现条带,再经巢式PCR扩增后能在琼脂糖凝胶上出现特异条带。总之,常规PCR或巢式PCR能扩增出特异条带,说明在不能显现电泳条带的DNA提取液中存在DNA或降解的DNA片段。本试验中,从武汉单极虫DNA提取、常规PCR和巢式PCR扩增的3个层次上通过比较分析,探讨了不同保存方法及其保存的武汉单极虫材料在不同研究层次的可用性。
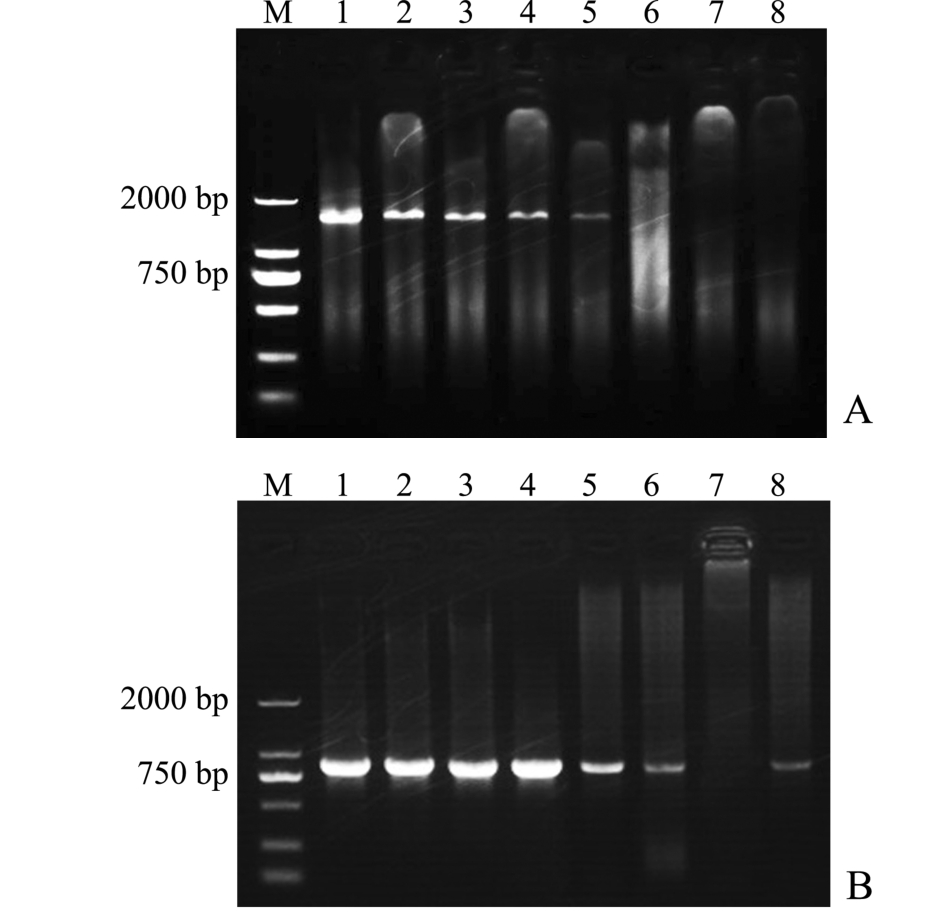
图2 常规PCR(A)、巢式PCR(B)扩增产物在12 g/L琼脂糖凝胶中的电泳图
Fig.2 Electrophoresis diagram of PCR(A)and nested PCR(B)products amplified from DNA extractions of the parasite Thelohanellus wuhanensis preserved in different preservations
注:M为Marker DL2000;1为对照组新鲜孢子;2为100%乙醇;3为70%乙醇;4为2.5%戊二醛;5为Bouin’s液;6为10%福尔马林;7为Carnoy’s液;8为Müller’s液
Note:M,Marker DL2000;1,control group;2,100%ethanol;3,70%ethanol;4,2.5%glutaraldehyde;5,Bouin’s solution;6,10%formalin;7,Carnoy’s solution;8,Müller’s solution
3.2 不同保存方法对武汉单极虫DNA提取和扩增的影响
100 %乙醇和70%乙醇中保存的武汉单极虫DNA提取量分别为95.9、93.6 ng/μL,提取纯度(OD260 nm/OD280 nm) 分别为1.86和1.84,电泳条带均与新鲜孢子对照组相似,均在高分子量区出现,DNA条带清晰,亮度强,这反映了用 100%和70%乙醇保存的孢子DNA提取率高、杂质少且无降解现象。提取的DNA经常规PCR和巢式PCR扩增,电泳后分别在1584 bp和853 bp处出现明亮单一特异条带,与对照组相同。本试验结果表明,用100%乙醇、70%乙醇保存液,对武汉单极虫的DNA提取和PCR扩增均无显著影响,两种保存方法及其保存的材料均可用作DNA提取、常规PCR和巢式PCR扩增的试验材料。100%乙醇具有脱水作用,使得生物产生收缩导致形态改变,而70%乙醇对生物体无收缩作用,既能满足DNA等分子生物学方面研究的需要,又能最大限度地维持生物形态结构,因此,用70%乙醇保存优于用100%乙醇保存。
2.5 %戊二醛常作为生物亚显微结构透射和扫描电镜观察的固定保存液,也用于武汉单极虫亚显微结构的电镜观察[12],用2.5%戊二醛保存的生物材料是否可用于DNA提取和PCR扩增以及是否对上述过程有影响,目前尚未见报道。本试验结果表明,用2.5%戊二醛保存对DNA提取有显著影响,DNA提取含量为58.7 ng/μL,仅为对照组的60%左右,DNA纯度在本试验所用的保存液中最低,OD260 nm/OD280 nm值仅为 1.50, 该比值低于1.80,常表示生物材料受到蛋白等物质污染,琼脂糖凝胶电泳无条带出现,在相对分子质量2000 bp以上有暗淡的涂布状核酸弥散现象,显示了DNA有降解为不完整小片段现象。在常规PCR扩增时能扩增出1584 bp的单一特异条带,但条带与对照组相比其亮度略低,对常规PCR扩增略有影响,这种影响来自于2.5%戊二醛对DNA提取的影响以及可能对常规PCR扩增的直接影响。在巢式PCR扩增阶段,扩增出了一条与对照组亮度一致的853 bp特异条带。表明尽管对DNA提取和常规PCR扩增有影响,但常规PCR能扩增出单一特异条带,而对巢式 PCR的扩增没有影响,因此,2.5%戊二醛保存方法及其保存的武汉单极虫可用作常规PCR扩增和巢式PCR扩增的材料。
10%福尔马林是最常用的生物材料保存液,可以长期保持生物形态学的基本特征,这主要是由于福尔马林能使组织蛋白及DNA等大分子形成稳定、紧密的交联网,从而很好地保持生物体形态,因此,在生物标本长期保存等方面得到了广泛应用,它也是生物显微组织学和疾病组织显微病理研究中常用的组织固定液。但是交联作用会导致抽提裂解细胞过程中DNA的释放出现困难,甚至会剪切核酸骨架,导致DNA片段化。另外,其主要成分甲醛在空气中易氧化成甲酸,而甲酸对DNA有较强的降解作用。本试验中,10%福尔马林保存的武汉单极虫在DNA提取阶段出现了类似现象,提取的DNA含量和纯度明显低于对照组,分别为82.7 ng/μL和1.66,琼脂糖凝胶电泳无条带出现,有暗淡的涂布状核酸弥散的降解现象。在常规PCR扩增后电泳图上也无1584 bp特异条带出现,而在相对分子质量为500~1500 bp处有明显弥散的明亮区,该区可能是在DNA提取阶段,DNA降解为500~1500 bp不同大小的分子小片段,作为模板时常规PCR扩增的仅为这些小片段DNA分子造成的。巢式PCR扩增出现了853 bp单一特异条带,条带亮度明显低于对照组,对巢式PCR扩增有一定的影响,可能是由于常规PCR扩增出的DNA作为模板量过低的原因。本试验结果表明,10%福尔马林保存方法及其保存的武汉单极虫可用作巢式PCR扩增的材料。有报道表明,从福尔马林保存的生物材料可以提取DNA,如福尔马林保存的龟鳖类动物中可以进行 DNA提取,但需要用Na2HPO4等几种不同的药液分别进行较长时间的处理[13],用福尔马林保存的金线鱼 Nemipterus virgatus也可以提取DNA,但需要用加入甲醛结合剂甘氨酸配制而成的缓冲液联合处理等[14],均需要通过较为繁杂的处理过程才能达到较好的DNA提取效果。
Bouin’s液对DNA提取和PCR扩增的影响大于2.5%戊二醛,在DNA提取阶段,发现DNA含量和纯度均较低,琼脂糖凝胶电泳无条带出现。在常规PCR扩增阶段,有条带出现,但条带亮度明显低于对照组,也低于2.5%戊二醛组。对巢式PCR扩增有影响,出现的853 bp单一特异条带亮度明显低于对照组和2.5%戊二醛组。刘丽等[10]认为,不能从保存于Bouin’s液的罗非鱼肌肉和鳍条中提取DNA。本试验中,用Bouin’s液保存的材料,提取的DNA有降解DNA为不完整的小片段现象,在常规PCR扩增和巢式PCR扩增中尽管条带暗淡,但还是能扩增出产物,因此,Bouin’s液保存方法及其保存的武汉单极虫可用作常规PCR和巢式PCR扩增材料。Bouin’s液中的主要成分为甲醛、苦味酸和乙酸,除甲醛对DNA具有损伤作用外,苦味酸盐配合物能以插入的方式对DNA产生作用[15],而乙酸对鲱鱼精DNA的构象、构型、碱基和单、双链断裂等有严重的损伤作用[16],因此,Bouin’s液对DNA提取和PCR扩增的影响应是甲醛、苦味酸和乙酸共同作用的结果,这种共同作用是协同作用还是拮抗作用有待于进一步研究。
Müller’s液的主要成分为重铬酸钾,属于重金属盐的重铬酸钾可引起蛋白质沉淀,对DNA有损伤作用[17]。本试验中,用该保存液保存的武汉单极虫只在巢式PCR扩增出了853 bp单一暗淡的特异条带,故Müller’s液保存方法及其保存的武汉单极虫只可用作巢式PCR扩增材料。
Carnoy’s液的主要成分是乙酸 (10%),乙酸对DNA有多方面的影响[16]。本试验中所用的Carnoy’s液是对武汉单极虫核酸影响最大的保存液,在DNA提取、常规PCR和巢式PCR 3个阶段均未有条带出现。因此,用该液保存的武汉单极虫不能用于DNA提取、常规PCR和巢式PCR扩增的材料。
综上所述,100%乙醇和70%乙醇保存方法对武汉单极虫DNA提取、常规PCR和巢式PCR扩增无任何影响,等同于对照组新鲜孢子,可以作为孢子的保存方法;2.5%戊二醛和Bouin’s液保存方法只对孢子DNA提取有影响,可以作为常规PCR和巢式PCR扩增的孢子保存方法;10%福尔马林和Müller’s液保存方法对孢子DNA提取和常规PCR扩增均有影响,只能作为巢式PCR扩增的孢子保存方法;Carnoy’s液保存方法不能作为孢子核酸分子生物学方面研究的孢子保存方法。
参考文献:
[1]陈启鎏,马成伦.中国动物志:粘体动物门 粘孢子纲[M].北京:科学出版社,1998:573-603.
[2]芮菊生,杜懋琴,陈海明,等.组织切片技术[M].北京:人民教育出版社,1980:3-19.
[3]周珍辉.动物细胞培养技术[M].北京:中国环境科学出版社,2006:93-95.
[4]Zhang J Y,Yokoyama H,Wang J G,et al.Utilization of tissue habitats by Myxobolus wulii Landsberg&Lom,1991 in different carp hosts and disease resistance in allogynogenetic gibel carp:redescription of M.wulii from China and Japan[J].Journal of Fish Diseases,2010,33(1):57-68.
[5]Andree K B,Székely C,Molnár K,et al.Relationships amongmembers of the genus Myxobolus(Myxozoa:Bilvalvidae)based on small subunit ribosomal DNA sequences[J].Journal of Parasitology,1999,85(1):68-74.
[6]柴下,陆宏达,刘俊杰,等.武汉单极虫巢式聚合酶链反应检测方法的建立与优化[J].上海海洋大学学报,2014,23(4):556-563.
[7]陈道海,蔡志德.多板纲动物的不同保存方法对基因组DNA提取的影响[J].湛江师范学院学报,2011,32(3):85-89.
[8]方旅平,林元烧,曹文清.不同保存条件下中华哲水蚤基因组DNA提取的比较[J].海洋科学,2005,29(2):1-4.
[9]许巧情,董明钢.不同固定剂及固定时间对三角帆蚌DNA提取效果比较[J].淡水渔业,2009,39(5):76-79.
[10]刘丽,刘楚吾,张明辉,等.不同保存条件下鱼类组织基因组DNA的提取效果分析[J].广东海洋大学学报,2007,27(6):18-21.
[11]鹿连明,胡秀荣,张利平,等.常规和巢式PCR对柑橘黄龙病菌的检测灵敏度比较[J].热带作物学报,2010,31(8):1280-1287.
[12]竹攸汀,陆宏达,蔡水局.武汉单极虫(粘体门,双壳目)的重描述及基于18S rDNA序列系统发育分析[J].动物分类学报,2012,37(4):681-686.
[13]陈启龙,聂刘旺,程双怀.福尔马林保存的龟鳖类动物基因组DNA的提取方法[J].黄山学院学报,2004,6(6):91-92.
[14]孔啸兰,陈作志,林琳,等.福尔马林固定鱼类标本DNA提取方法的优化[J].中国水产科学,2012,19(6):1068-1073.
[15]霍丽娜,杨天林,李寒玉,等.2,7-二(苄胺酰乙氧基)萘稀土苦味酸配合物的合成、表征及其与DNA的作用[J].应用化学,2013,30(2):159-164.
[16]柯惟中,余多慰,顾柏平,等.乙酸对DNA空间结构微观损伤的Raman光谱特征[J].光谱学与光谱分析,2001,21(6):790-793.
[17]饶朝龙,刘天强,黄冠军,等.重铬酸钾致鲫鱼肝细胞DNA损伤作用研究[J].四川解剖学杂志,2010,18(2):16-17.
中图分类号:S941.51
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.03.003
文章编号:2095-1388(2016)03-0246-06
收稿日期:2015-09-21
基金项目:水产动物遗传育种上海市协同创新中心 (ZF1206);上海市重点学科建设项目 (Y1101)
作者简介:陆宏达 (1960—),男,教授。E-mail:hdlu@shou.edu.cn
Effects of different preservation methods on DNA extraction and PCR amplification in parasite Thelohanellus wuhanensis
LU Hong-da,LIU Jun-jie,YUE Meng-meng,CAO Gen-ping,LI Zhen-wei
(College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China)
Abstract:Spore cysts of parasite Thelohanellus wuhanensis collected from diseased juvenile allogynogenetic crucian carp Carassius auratus gibelio were preserved in 100%ethanol,70%ethanol,2.5%glutaraldehyde,10%formalin,Bouin’s solution,Carnoy’s solution or Müller’s solution for 50 days to explore effects of different preservative methods on DNA extraction,conventional PCR amplification and nested PCR amplification of the parasite,and fresh spores were used as control group.The spores from the experimental groups and control group were counted by blood count plates and adjusted by distilled water with same concentration in each group.DNA extractions,conventional PCR amplifications and nested PCR amplifications of spores with equal number from different groups were made and their products were evaluated through agarose gel electrophoresis to explore the effects of different preservations.The results showed that 100%ethanol and 70%ethanol preservations do not impact DNA extractions,conventional PCR amplifications and nested PCR amplifications,with the same bright and consistent specific electrophoretic bands in agarose gel electrophoresis as those in the fresh spores in the control group,indicating that 100% ethanol and 70%ethanol can be used as the preservative solutions for spores.However,2.5%glutaraldehyde and Bouin’s solution preservations showed influences on the DNA extractions,with specific electrophoresis bands only in the products of the conventional and nested PCR amplification,and thus 2.5%glutaraldehyde and Bouin’s solution can be used as the preservative solutions of spores for the conventional and nested PCR amplifications.It was found that 10%formalin and Müller’s solution preservations led to influences on the DNA extractions and the conventional PCR amplifications,with specific electrophoresis bands only in the nested PCR amplifications.It is conferred that 10%formalin and Müller’s solution can only be used as the preservative solutions of spores for nested PCR amplification.There was no electrophoresis bands from the products of DNA extraction as well as the conventional and nested PCR amplifications in Carnoy’s solution preservation,which cannot be used as the preservative solutions of spores for molecular biology analyses associated with nucleic acid.The findings indicate that except for 100%and 70%ethanol,other preservative methods have different degree of effects on DNA extraction,conventional PCR amplification and nested PCR amplification of the spores.
Key words:preservative method;Thelohanellus wuhanensis;DNA extraction;PCR amplification


