用3种方法提取中华绒螯蟹卵巢总蛋白效果的比较
梁 箫,张 显,闫应朋,刘志强,邱高峰
(上海海洋大学农业部淡水水产种质资源重点实验室,上海201306)
摘要:为了探寻适于中华绒螯蟹Eriocheirsinensis卵巢蛋白质组学研究的总蛋白最佳提取方法,采用RC DC Protein Assay检测蛋白浓度、SDS-PAGE分析蛋白组成等,比较分析了用裂解液法Ⅰ、裂解液法Ⅱ和TCA/丙酮沉淀法提取中华绒螯蟹卵巢蛋白的效果。结果表明:应用3种方法提取的卵巢总蛋白浓度分别为15.59、13.05、0.65 mg/mL,用裂解液法提取的效果最佳,而TCA/丙酮沉淀法不适合用于中华绒螯蟹卵巢总蛋白的提取;SDS-PAGE电泳图谱进一步显示,用裂解液法Ⅱ提取的蛋白样品组成较为丰富,且重复性好,比较适合后续蛋白质组学研究。该研究结果可为中华绒螯蟹卵巢发育蛋白质组学研究提供参考。
关键词:中华绒螯蟹;卵巢;蛋白质;提取方法;SDS-PAGE
中华绒螯蟹Eriocheir sinensis俗称河蟹,分布于朝鲜半岛西海岸和中国渤海、黄海、东海沿岸诸省[1]。因其生长快速、体态丰腴、肉质细嫩、个大味美,且具有很高的食用与经济价值,已成为中国重要的淡水蟹类养殖品种。
近年来,随着中华绒螯蟹养殖规模的不断扩大及其产量的提高,在养殖生产实际中出现了性早熟等问题[2],严重影响了养殖业者的经济收益。因此,充分了解雌蟹卵巢发育的规律及其分子机制具有重要的意义。然而以往的研究,多是从组织学以及细胞学角度研究中华绒螯蟹卵母细胞的发育与成熟[3],对于其卵巢发育成熟过程分子机制的研究非常有限[4]。笔者所在团队在以往的研究中,发现了许多与性腺发育相关的基因[4],为从基因水平研究中华绒螯蟹性腺发育奠定了良好的基础。作为基因功能的执行者与体现者,蛋白质能直接、客观地反映生命机体的变化。通过研究中华绒螯蟹卵巢蛋白质组,可以了解卵巢发育过程中有哪些蛋白发生变化以及是否参与卵母细胞减数分裂成熟过程,这将为研究中华绒螯蟹卵巢发育成熟分子机制提供有力的依据。目前,关于中华绒螯蟹卵巢蛋白质组的研究尚未见报道,有关其他水产动物卵巢蛋白质组的研究也不多见[5]。对于蛋白质组学研究来说,成功制备蛋白样品是蛋白质组学研究的前提条件。中华绒螯蟹的卵巢生化组分复杂,尤其是在卵黄大量积累的阶段,脂肪等胚胎发育的所需物质也会大量积累[6],这些物质会对其总蛋白提取及纯化造成严重干扰。因此,找到一种适合中华绒螯蟹卵巢蛋白样品的制备方法很有必要。
本研究中,以成熟的中华绒螯蟹卵巢为材料,选择3种样品制备方法,通过比较蛋白提取量、SDS-PAGE条带分布情况来分析并确定了适合中华绒螯蟹卵巢总蛋白样品的制备方法。
1 材料与方法
1.1 材料
试验用中华绒螯蟹雌蟹于2014年12月购于上海市崇明县养殖基地。选择体质量为100~150 g、四肢健全且性成熟的个体50只,在冰上迅速解剖,取其卵巢组织放入1.5 mL的离心管中,经液氮冷冻后立即放入超低温冰箱 (-80℃)中保存备用。
1.2 方法
1.2.1 中华绒螯蟹卵巢蛋白样品的提取
(1)裂解液法Ⅰ。取0.1 g中华绒螯蟹卵巢组织,加入1 mL裂解液 (50 mmol/L Tris-HCl,150 mmol/L NaCl,1%TritonX-100,1 mmol/L EDTA,100μg/mL PMSF,pH 7.4),冰上使用高速匀浆机匀浆至卵巢组织完全破碎 (30 s/次,共3次),匀浆后的样品在4℃下以10 000 r/min离心10 min,吸取上清液,每200μL分装于1.5 mL离心管中。
(2)裂解液法Ⅱ。取0.1 g中华绒螯蟹卵巢组织,加入1 mL裂解液 (同裂解液法Ⅰ配方),冰上使用高速匀浆机匀浆至卵巢组织完全破碎 (30 s/次,共3次),匀浆后的样品在4℃下搅拌2 h后,以10 000 r/min高速离心10 min,吸取上清液,每200μL分装于1.5 m L离心管。
(3)TCA/丙酮沉淀法。参考文献[7]中的方法,取0.1 g中华绒螯蟹卵巢组织,加入1 mL预冷的20%TCA/丙酮 (含20 mmol/LDTT),冰上使用高速匀浆机匀浆至均匀 (30 s秒/次,共3次),静置30 min后,4℃下用冷冻离心机以15 000 r/min离心20 min,去除上清液,沉淀分别用80%丙酮和100%丙酮各振荡洗涤2次 (4℃下以15 000 r/min离心10 min),沉淀、室温干燥后,加入10倍量裂解液 (同裂解液法Ⅰ配方),冰上高速匀浆混匀,在4℃下搅拌过夜后,以12 000 r/min离心30 min。吸取上清液,每200μL分装于1.5 mL离心管中。
用3种蛋白样品提取方法分别重复操作3次,制备3份样品。取每次操作中200μL样品,按1∶1比例加入等量上样缓冲液 (0.125 mol/L pH为6.8的Tris-HCl,25%的甘油,3%SDS,0.002% BPB,50 mmol/L DTT)混合,混合后的样品经100℃煮沸,变性5 min,供SDS-PAGE使用。其余样品置于冰箱 (-80℃)中保存备用。
1.2.2 蛋白样品浓度的测定 使用Bio-Rad公司的RC DC Protein Assay试剂盒进行测定,此试剂盒在还原剂和表面活性剂存在的情况下仍然可以准确地测定蛋白的浓度[8]。测定过程中,以牛血清白蛋白 (BSA)作为标准蛋白,在750 nm处测量蛋白样品的吸光值,绘制出标准曲线,并使用该曲线计算出试验用蛋白样品的蛋白浓度。
1.2.3 SDS-PAGE电泳检测 根据各试验需要,选择不同的上样量,使用12%的聚丙烯酰胺凝胶电泳分离,电泳参数为20 mA/胶。电泳结束后,用CBB-G250染色,用Bio-Rad凝胶成像系统拍照记录,用ATTO CSAnalyzer Verbal 3.0软件得到蛋白条带的相对分子质量及灰度值。
1.3 数据处理
所有试验至少重复3次。在统计分析前所有数据均进行正态性检验。如不满足正态性分布,则通过Kruskal-Wallis Test进行评估检验。采用 JMP 10.0.0软件进行统计分析。显著性水平设为0.05。
2 结果与分析
2.1 用3种方法提取的蛋白样品的蛋白浓度
从图1可见:用裂解液法Ⅰ、裂解液法Ⅱ、TCA/丙酮沉淀法提取的蛋白样品的平均蛋白浓度分别为15.59、13.05、0.65 mg/mL;用裂解液法Ⅰ与裂解液法Ⅱ提取的蛋白样品的蛋白浓度无明显差异 (P>0.05),均显著高于用TCA/丙酮沉淀法提取的蛋白样品的蛋白浓度 (P<0.05)。
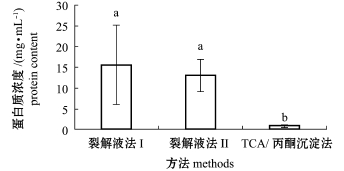
注:标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05)
Note:Themeans with different letters are significant differences at the 0.05 probability level,and the means with the same letters are not significant differences
图1 用3种方法提取的卵巢蛋白样品的蛋白浓度Fig.1 Protein concentration of sam p les p repared by
the threemethods
2.2 SDS-PAGE电泳的最佳上样量
使用裂解液法Ⅱ提取的蛋白样品,加入不同上样量后,经SDS-PAGE电泳所得结果如图2所示。从图2可见:同一样品在上样量为5μg时,SDSPAGE图谱中可见3条明显的蛋白条带和少量其他蛋白条带;当上样量增加到15μg时,图谱中3条蛋白条带的量明显增加,并有少量其他蛋白条带出现;当上样量从15μg增加到30μg时,图谱中各蛋白条带无明显差异,但当上样量为30μg时,在浓缩胶与分离胶交界处有样品残留的现象出现(图中箭头所示)。根据试验结果,可得出最佳上样量为15μg。
2.3 用3种方法提取的蛋白样品的SDS-PAGE
用3种方法所提取的蛋白样品的SDS-PAGE结果如图3所示。从SDS-PAGE胶上可看出,用3种方法提取的蛋白样品的蛋白条带组成存在明显的差异,其中用裂解液法Ⅰ和裂解液法Ⅱ提取的蛋白样品呈现的条带组成基本相似,但后者的条带浓度明显大于前者,而用TCA/丙酮沉淀法提取的蛋白样品的条带非常少,肉眼仅可见两条条带。
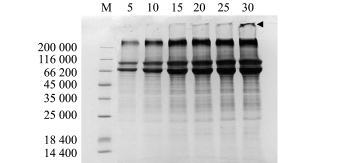
注:M为标准蛋白;5~30分别为上样量5、10、15、20、25、30μg的样品;箭头示残留样品
Note:M,standard Marker;5-30,loading quantities of protein sample;the head arrow shows the residual sample
图2 同一样品不同上样量的SDS-PAGE电泳图谱
Fig.2 SDS-PAGE map of the different loading quantity of sam p les
基于SDS-PAGE蛋白条带,选择最为明显的A、B、C、D、E 5条蛋白条带,使用ATTO CS Analyzer Verbal 3.0软件检测蛋白条带的灰度值,其平均值如表1所示。分析A、B条带发现,用裂解液法Ⅰ和裂解液法Ⅱ提取的蛋白样品中均可检测出这2条条带,其中用裂解液法Ⅱ提取的蛋白样品中A、B条带的灰度值大于用裂解液法Ⅰ提取的蛋白样品中A、B条带的灰度值,而用TCA/丙酮沉淀法提取的蛋白样品中未检测出这两条条带,A、B条带的灰度值均为0。分析C、D、E条带发现,用3种方法提取的蛋白样品中均可检测出这3条条带。总体上看,用裂解液法Ⅱ提取的蛋白样品中各条带的灰度值大于用其他两种方法提取的蛋白样品中各条带的灰度值,用TCA/丙酮沉淀法提取的蛋白样品中各条带的灰度值最小。
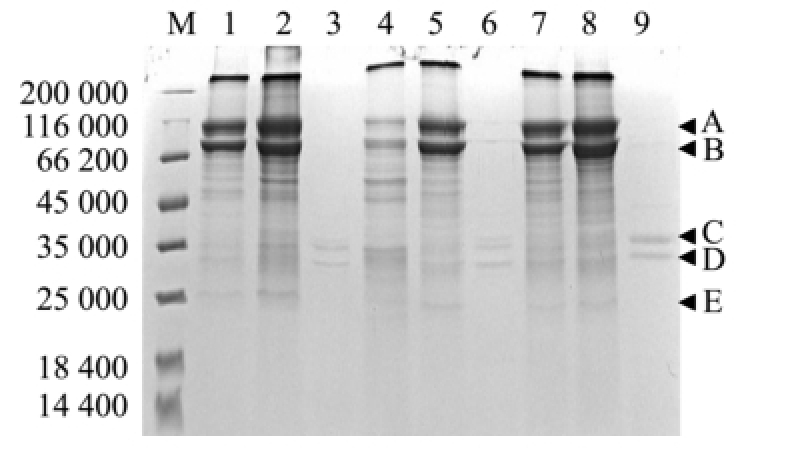
注:M为标准蛋白;1、4、7为用裂解法Ⅰ提取的3组蛋白样品;2、5、8为用裂解液法Ⅱ提取的3组蛋白样品;3、6、9为用TCA/丙酮沉淀法提取的3组蛋白样品;箭头A、B、C、D、E表示条带;上样量为15μg
Note:M,standard Marker;1,4,7,the3 samples prepared using lysis solutionmethodⅠ;2,5,8,the3 samples prepared using lysis solution methodⅡ;3,6,9,the 3 samples prepared using TCA-acetone precipitation;the head arrows indicate the protein bands A,B,C,D and E;the loading quantities of protein samples are 15μg per lane
图3 用3种方法提取的蛋白样品的SDS-PAGE图谱比较
Fig.3 SDS-PAGE m ap of the protein sam p les prepared by threemethods
表1 用3种方法提取的卵巢蛋白样品的SDS-PAGE图谱中蛋白条带的灰度值
Tab.1 Intensity value of p rotein bands in SDS-PAGE map of the ovary protein sam p les prepared by threemethods
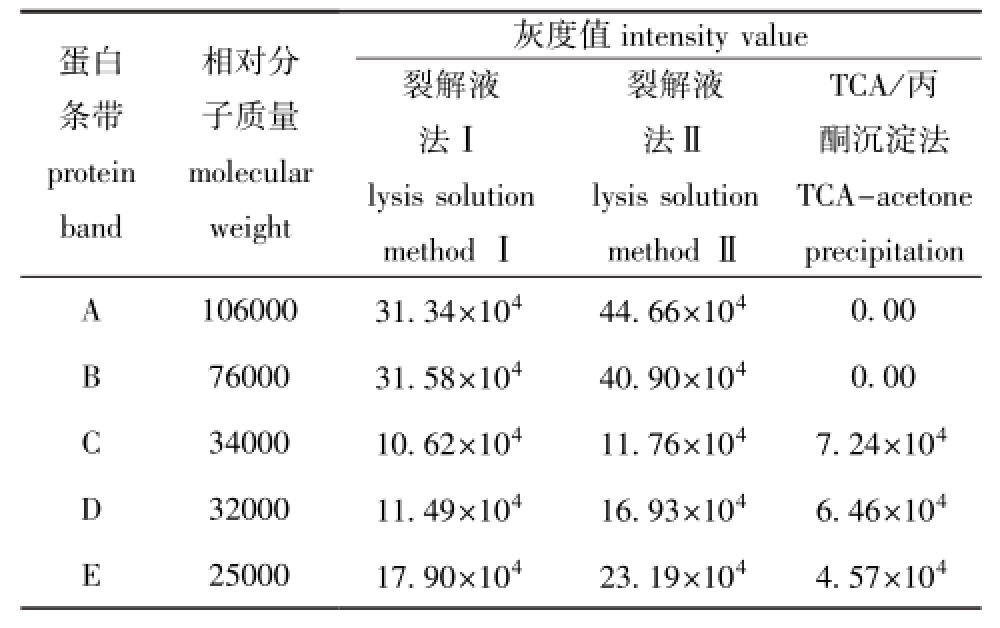
蛋白条带protein band相对分子质量molecular灰度值intensity value TCA/丙酮沉淀法TCA-acetone裂解液法Ⅱlysis solution methodⅡweight裂解液法Ⅰlysis solution methodⅠprecipitation A 106000 31.34×104 44.66×1040.00 B 76000 31.58×104 40.90×104 0.00 C 34000 10.62×104 11.76×104 7.24×104D 32000 11.49×104 16.93×104 6.46×104E 25000 17.90×104 23.19×104 4.57×104
3 讨论
从蛋白浓度测定结果以及SDS-PAGE图谱的结果综合来看,用裂解液法Ⅰ提取的中华绒螯蟹卵巢蛋白含量最多,蛋白组成也较为丰富,但3次重复操作所提蛋白含量差异很大,在图中形成较大的误差范围,说明此方法在实际操作时的随机性很大,导致重复性不佳。其原因可能是由于裂解液法Ⅰ的裂解时间较短,在此时间内卵巢蛋白没有充分溶解,同时成熟卵巢中所含的大量脂肪也会影响蛋白的溶解程度。用裂解液法Ⅱ所提取的蛋白样品的蛋白浓度虽低于用裂解液法Ⅰ,但SDS-PAGE图谱中所呈现的蛋白组成与其相似,且蛋白条带浓度要大于裂解液法Ⅰ,重复性也较好。形成这一结果的原因可能是由于裂解液法Ⅰ对样品的裂解时间较短,在短时间内多溶解了小分子的蛋白、肽或游离的氨基酸,而对大分子量蛋白的溶解性不好。蛋白含量测定试验中通过试剂盒可以检测出这些小分子蛋白,但在凝胶电泳试验中,由于对可观测到的蛋白分子量有一定的限制,故出现了裂解液法Ⅰ与裂解液法Ⅱ相比,所得蛋白含量高而电泳条带浓度低的现象。另外,裂解液法Ⅱ在低温搅拌2 h的过程中,有部分蛋白可能发生了降解现象,从而影响了蛋白定量的结果。通常在蛋白样品提取制备以及保存的过程中,蛋白酶的存在可能导致样品中蛋白发生不同程度的降解。自然界中,根据蛋白酶活性中心的不同,可将其分为4大类,分别为丝氨酸蛋白酶、酸性蛋白酶、巯基蛋白酶和金属蛋白酶[9]。在本研究中,中华绒螯蟹生活在天然水体中,而天然水体多为中性偏弱碱性,此环境下丝氨酸蛋白酶和金属蛋白酶具有活性,可能降解相关蛋白。因此,笔者在蛋白样品提取的裂解液中,加入了代表性的丝氨酸酶抑制剂PMSF和金属蛋白酶抑制剂EDTA。根据试验结果,用裂解液法Ⅱ提取的蛋白量略少于裂解液法Ⅰ,其原因可能是由于在裂解液中,添加的两种蛋白酶抑制剂PMSF和EDTA浓度略低,无法完全抑制样品中某些蛋白的降解;或是由于其余两大类的蛋白酶巯基蛋白酶和酸性蛋白酶发挥了作用,促使某些蛋白发生降解现象。为避免此情况再次出现,笔者考虑在之后的研究中,裂解液中添加4类蛋白酶抑制剂混合物,并在允许范围内加大各蛋白酶抑制剂的浓度。
TCA/丙酮沉淀法是传统的蛋白提取方法之一,其特点是在样品的提取过程中可以有效地去除样品中的盐离子、脂类、核酸等干扰物。然而在本试验中,用TCA/丙酮沉淀法所提取的中华绒螯蟹卵巢蛋白含量最少,且蛋白组成单一,甚至连成熟卵巢中蛋白含量最高的卵黄蛋白都未能提取出来。分析其原因,可能是由于蛋白沉淀后再溶解较为困难;或是方法中的多次洗涤降低了蛋白的丰度[7]。故TCA/丙酮沉淀法不适合中华绒螯蟹卵巢蛋白样品制备以及后续蛋白质组学研究。
综上所述,本试验中3种蛋白样品制备方法中,裂解液法Ⅱ可较好地提取蛋白样品,且重复性好,比较适合后续蛋白质组学研究。本研究结果对于今后通过蛋白质组学手段研究中华绒螯蟹卵巢发育成熟机制具有重要的理论意义。
参考文献:
[1] 赵乃纲,堵南山,包祥生,等.河蟹的人工繁殖与增养殖[M].合肥:安徽科学技术出版社,1988.
[2] 张世勇,傅洪拓,乔慧,等.中华绒螯蟹遗传育种研究进展[J].中国农学通报,2013,29(20):39-45.
[3] 顾志敏,何林岗.中华绒螯蟹卵巢发育周期的组织学细胞学观察[J].海洋与湖沼,1997,28(2):138-145.
[4] Qiu Gaofeng,Yamano K,Unuma T.Cathepsin C transcripts are differentially expressed in the final stages of oocytematuration in kuruma prawn Marsupenaeus japonicus[J].Comp Biochem Physiol B:Biochem Mol Biol,2005,140(2):171-181.
[5] Sewell Dr M A,Eriksen S,Middleditch M J.Identification of protein components from themature ovary of the sea urchin Evechinus chloroticus(Echinodermata:Echinoidea)[J].Proteomics,2008,8 (12):2531-2542.
[6] 成永旭,堵南山,赖伟.中华绒螯蟹成熟卵巢的脂类及脂肪酸组成[J].中国水产科学,1999,6(1):79-81.
[7] 王为刚,王艺磊,张子平,等.拟穴青蟹卵巢蛋白质双向电泳的样品制备方法[J].水产科学,2011,30(6):352-355.
[8] Liang Xiao,Yoshida A,Osatomi K,et al.Changes in sarcoplasmic proteins of cultured yellowtail Seriola quinqueradiata burnt meat [J].Jpn JFood Chem Safety,2012,19(1):14-22.
[9] 杨金龙,李无霜,梁箫,等.不同保存方法对厚壳贻贝样品蛋白提取效果的比较[J].海洋科学,2013,37(8):23-27.
Comparative extraction of total proteins in ovary of Chinesem itten handed crab Eriocheir sinensis by differentm ethods
LIANG Xiao,ZHANG Xian,YAN Ying-peng,LIU Zhi-qiang,QIU Gao-feng
(Key Laboratory of Freshwater Aquatic Genetic Resources,Ministry of Agriculture,Shanghai Ocean University,Shanghai201306,China)
Abstract:The extraction effects of two lysis buffermethods and trichloroacetic acid/acetone precipitation method on total proteins in ovary of China mitten crab handed Eriocheir sinensis were comparatively studied for the proteomics by RC DC protein assay in order to search for the optimal extractionmethod to detect the protein level,and the protein composition was analyzed by SDS-PAGE.The results showed that the protein concentration was 15.59 mg/mL and 13.05 mg/mL by lysis buffermethods and 0.65 mg/mL,by trichloroacetic acid/acetone precipitation method,indicating better by lysis buffer methods than by trichloroacetic acid/acetone precipitation.The SDSPAGE maps analysis revealed that the sample extracted by lysis buffer methodⅡshowed more protein bands,and had high reproducibility.The findings indicate that lysis buffermethodⅡis the bettermethod for the proteomics of ovary proteins in Chinamitten handed crab,providing a reference for proteomics of Chinamitten handed crab.
Key words:Eriocheir sinensis;ovary;protein;extraction method;SDS-PAGE
中图分类号:S917.4
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.02.013
文章编号:2095-1388(2016)02-0190-04
收稿日期:2015-05-19
基金项目:上海海洋大学博士启动基金资助项目;国家自然科学基金资助项目 (41476130);上海高校水产学一流学科建设项目
作者简介:梁箫 (1983—),女,博士,讲师。E-mail:x-liang@shou.edu.cn
通信作者:邱高峰 (1965—),男,教授。E-mail:gfqiu@shou.edu.cn



