大蒜素对鲫非特异免疫指标影响的研究
康淑媛1、2,王 荻1,卢彤岩1
(1.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306)
摘要:为评价大蒜素对鲫Carassius auratus非特异性免疫功能的影响,在鲫基础饲料中分别添加250、500 mg/kg的大蒜素,并对鲫进行42 d的养殖试验,其中试验的第1~28天饲喂含大蒜素的试验饲料,第29~42天饲喂不含大蒜素的基础饲料。结果表明:与投喂基础饲料的对照组相比,添加250 mg/kg剂量的大蒜素能显著提高鲫血清补体C3活力 (P<0.05),而添加500 mg/kg剂量的大蒜素则能显著抑制鲫血清补体C3、C4活力 (P<0.05),改投不含大蒜素的基础饲料后,该剂量组C4活性仍显著低于对照组 (P<0.05);添加250、500mg/kg剂量的大蒜素能显著提高鲫血清、肝胰脏、肾脏和脾脏中溶菌酶 (LZM)活力 (P<0.05),改投不含大蒜素的基础饲料的14 d内,250、500 mg/kg剂量组血清LZM活性及500 mg/kg剂量组肾脏和脾脏LZM活性仍有显著升高 (P<0.05);添加250 mg/kg剂量的大蒜素能显著提高肝胰脏和脾脏中一氧化氮 (NO)含量 (P<0.05),添加500mg/kg大蒜素能显著提高血清和脾脏中NO含量(P<0.05),但该剂量显著抑制肝胰脏NO含量(P<0.05),250、500 mg/kg剂量组肾脏中NO含量在第42天时均显著高于对照水平(P<0.05)。研究表明,鲫基础饲料中大蒜素的适宜添加剂量为250 mg/kg。
关键词:大蒜素;鲫;非特异免疫指标
大蒜素 (Garlicin)又名大蒜新素,是大蒜的提取液或合成物,主要成分为二烯丙基三硫化物[1]。大蒜素具有健胃杀菌、解毒保健、护肝降脂、诱食增食、驱虫杀虫、促生长和提高免疫力等生物活性,且在动物体内无积存、无耐药性、毒性低、无 “三致” (致癌、致畸、致突变),现已作为一种饲料添加剂及免疫调节剂,广泛应用于水产养殖业中[2-6]。鲫Carassius auratus是中国淡水养殖的主要经济鱼类之一[7]。非特异免疫防御机制是鱼类抵抗病原入侵的第一道防线,主要包括补体C3、补体C4、溶菌酶 (LZM)、一氧化氮 (NO)、超氧化物歧化酶 (SOD)、丙二醛 (MDA)等非特异免疫体液因子、巨噬细胞和单核细胞的吞噬等[8]。目前,有关大蒜素对暗纹东方鲀[9]、鲤[10]、镜鲤[11]、虹鳟[12]、 草鱼[13]和异育银鲫[14]等鱼免疫功能影响的研究已见报道。本试验中,在鲫饲料中添加两种不同水平的大蒜素,投喂饲养一段时间后,通过测定鲫血清补体 C3、补体 C4、LZM、NO,以及鲫肝胰脏、肾脏和脾脏中的LZM和NO指标,评价不同添加剂量的大蒜素对鲫非特异性免疫功能的影响,以期为大蒜素在水产养殖业中的广泛应用提供理论依据。
1 材料与方法
1.1 材料
试验鱼购自黑龙江省哈尔滨市某水产市场,初始体质量为 (280±15)g;饲料为鲤鱼商品料 (批号083),购自正大饲料有限公司。
试验药品大蒜素 (批号162033),购自北京渔经生物技术有限公司,二烯丙基三硫醚含量为60%。
试验仪器包括:3K15离心机 (美国Sigma公司)、FJ 200-S调速混匀器 (上海标准模型厂)、T-214电子天平 (德国赛多利斯公司)、XMTD-4000电热恒温水浴锅 (北京市永光明医疗仪器厂)、FJ 200-S数显高速分散均质机 (上海标准模型厂)、Ultrospec 2100 pro紫外分光光度计。
1.2 方法
鲫在自动循环水鱼缸 (100 cm×50 cm×50 cm)中暂养7 d后开始正式试验,暂养期间水温为(25±1)℃,持续充气,并投喂全价基础饲料。
1.2.1 样品的采集 将试验鲫随机分成 A(对照)、B、C 3组,每组设3个重复,每个重复放25尾鱼。将大蒜素分别以0、250、500 mg/kg剂量添加到基础饲料中,混匀后用绞肉机、制粒机制成直径5 mm的3种试验饲料颗粒,置于阴凉通风处晾干,于冰箱(-20℃)中保存待用。试验期间,每天8:00和17:00按鲫体质量的2.5%分别投喂3种试验饲料,连续投喂28 d后改投基础饲料14 d。
分别于试验的第7、14、28、35、42天从每个重复组中随机选取5尾鱼,从其尾静脉采血,将血液以3500 r/min离心15 min,取血清;再将鱼解剖,取其肝胰脏、肾脏和脾脏组织,将血清与组织样品均置于超低温冰箱 (-80℃)中保存待测。
1.2.2 样品的处理 将血清样品在37℃下水浴融化后即可检测补体C3、补体C4、LZM活性和NO含量。将肝胰脏、肾脏和脾脏样品与预冷的生理盐水按质量 (g)与体积 (mL)比为1∶9稀释,匀浆,根据检测指标及试剂盒要求进行离心,并取组织上清液于冰箱 (-40℃)中保存,用于LZM活性和NO含量的测定。
1.2.3 指标的测定 分别采用生物素双抗体夹心酶联免疫吸附法(ELISA)、比浊法、硝酸还原酶法测定补体C3与C4、LZM活性、NO含量。各指标的测定均使用南京建成生物技术研究所的试剂盒。
1.3 数据处理
试验数据以平均值±标准误(mean±S.E.)表示。用SPSS 19.0软件进行ANOVA方差分析和Duncan多重比较,显著性水平设为0.05。
2 结果与分析
2.1 饲料中添加不同水平大蒜素对鲫血清补体C3 和C4活性的影响
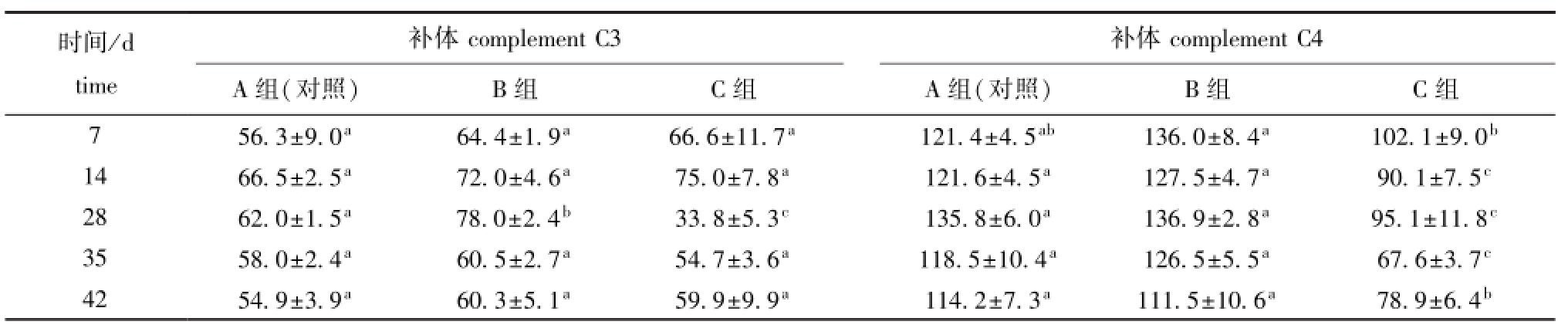
由表1可知:B组血清补体C3活性仅在第28天时显著高于对照组 (A组)和C组 (P<0.05),并达到最大值,C组血清补体C3活性在第28天时显著低于对照组和B组 (P<0.05),并达到最小值;B组血清补体C4活性与对照组无显著性差异(P>0.05),C组血清补体C4活性显著低于对照组和B组 (P<0.05),且在第35天时达到最小值。
表1 摄食添加不同水平大蒜素饲料对鲫血清补体C3和C4含量的影响
Tab.1 Effects of different dietary levels of garlicin on contents of com p lement C3 and C4 in serum of crucian carp Carassius auratus U/m L
注:同行中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同
Note:Themeanswith different letterswithin the same line are significant differences at the 0.05 probability level,and themeanswith the same letters within the same line are not significant differences,et sequentia
时间/d补体补体complement C3 time complement C4 A组(对照) B组 C组 A组(对照) B组 C组7 56.3±9.0a 64.4±1.9a 66.6±11.7a 121.4±4.5ab 136.0±8.4a 102.1±9.0b14 66.5±2.5a 72.0±4.6a 75.0±7.8a 121.6±4.5a 127.5±4.7a 90.1±7.5c28 62.0±1.5a 78.0±2.4b 33.8±5.3c 135.8±6.0a 136.9±2.8a 95.1±11.8c35 58.0±2.4a 60.5±2.7a 54.7±3.6a 118.5±10.4a 126.5±5.5a 67.6±3.7c42 54.9±3.9a 60.3±5.1a 59.9±9.9a 114.2±7.3a 111.5±10.6a 78.9±6.4b
表2 摄食添加不同水平大蒜素饲料对鲫血清和肝胰脏溶菌酶活性的影响
Tab.2 Effects of different dietary levels of garlicin on activities of lysozyme(LZM)in serum and hepatopancreas of crucian carp Carassius auratus
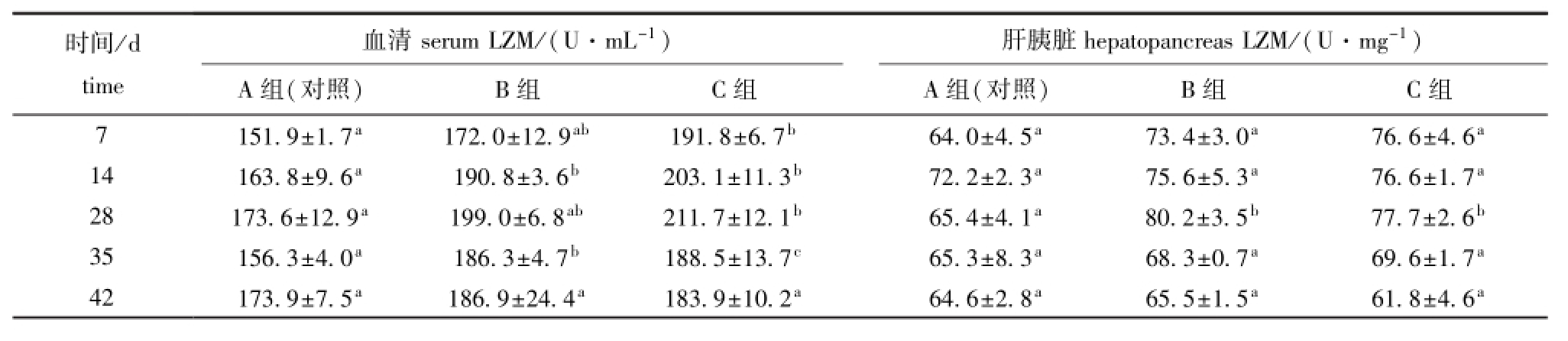
时间/d 血清serum LZM/(U·m L-1) 肝胰脏hepatopancreas LZM/(U·mg-1)time A组(对照) B组 C组 A组(对照) B组 C组7 151.9±1.7a 172.0±12.9ab 191.8±6.7b 64.0±4.5a 73.4±3.0a 76.6±4.6a14 163.8±9.6a 190.8±3.6b 203.1±11.3b 72.2±2.3a 75.6±5.3a 76.6±1.7a28 173.6±12.9a 199.0±6.8ab 211.7±12.1b 65.4±4.1a 80.2±3.5b 77.7±2.6b35 156.3±4.0a 186.3±4.7b 188.5±13.7c 65.3±8.3a 68.3±0.7a 69.6±1.7a42 173.9±7.5a 186.9±24.4a 183.9±10.2a 64.6±2.8a 65.5±1.5a 61.8±4.6a
2.2 不同添加水平大蒜素对鲫溶菌酶活性的影响
由表2可知:B组血清LZM活性在第14天和第35天时显著高于对照组 (P<0.05),C组血清LZM活性在第7~35天时均显著高于对照组 (P<0.05),B组和C组均在第28天时达到最大值;B、C组肝胰脏LZM活性均在第28天时显著高于对照组 (P<0.05),并达到最大值。
由表3可知:B组肾脏LZM活性在第14天时显著高于对照组 (P<0.05),并达到最大值,C组肾脏LZM活性在第7~35天时均显著高于对照组(P<0.05),并在第28天时达到最大值;B组脾脏LZM活性在第14、28天时显著高于对照组 (P<0.05),并在第14天时达到最大值,C组脾脏LZM活性在第14、28、35天时均显著高于对照组 (P<0.05),并在第14天时达到最大值。
表3 摄食添加不同水平大蒜素饲料对鲫肾脏和脾脏溶菌酶活性的影响
Tab.3 Effects of different dietary levels of garlicin on activities of LZM in kidney and sp leen of crucian carp Carassius auratus
U/mg
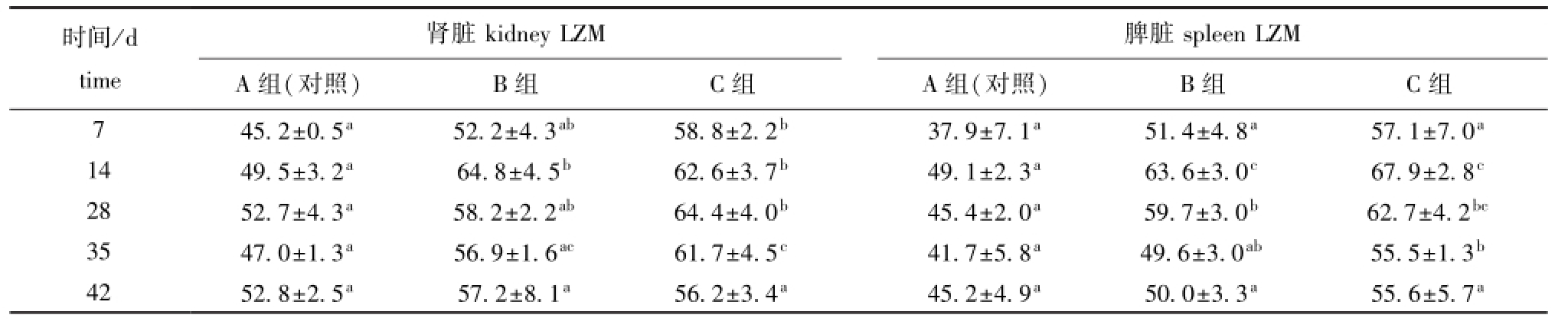
时间/d脾脏肾脏kidney LZM time spleen LZM A组(对照) B组 C组 A组(对照) B组 C组7 45.2±0.5a 52.2±4.3ab 58.8±2.2b 37.9±7.1a 51.4±4.8a 57.1±7.0a14 49.5±3.2a 64.8±4.5b 62.6±3.7b 49.1±2.3a 63.6±3.0c 67.9±2.8c28 52.7±4.3a 58.2±2.2ab 64.4±4.0b 45.4±2.0a 59.7±3.0b 62.7±4.2bc35 47.0±1.3a 56.9±1.6ac 61.7±4.5c 41.7±5.8a 49.6±3.0ab 55.5±1.3b42 52.8±2.5a 57.2±8.1a 56.2±3.4a 45.2±4.9a 50.0±3.3a 55.6±5.7a
2.3 不同添加水平大蒜素对鲫NO含量的影响
由图1可知:C组鲫血清NO含量仅在第14、28天时显著高于对照组 (P<0.05),B组血清NO含量与对照组、C组无显著性差异 (P>0.05);B组鲫肝胰脏NO含量在第28、35天时显著高于对照组和C组 (P<0.05),并第28天时达到最大值,C组肝胰脏NO含量仅在第14、35天时显著低于对照组和B组 (P<0.05);B、C组鲫肾脏NO含量均在第42天时显著高于对照组 (P<0.05);B组和C组鲫脾脏NO含量均在第14天时显著高于对照组 (P<0.05),并达到最大值,且C组显著高于B组 (P<0.05);其余时间点各组织的各组间NO含量均无显著性差异 (P>0.05)。
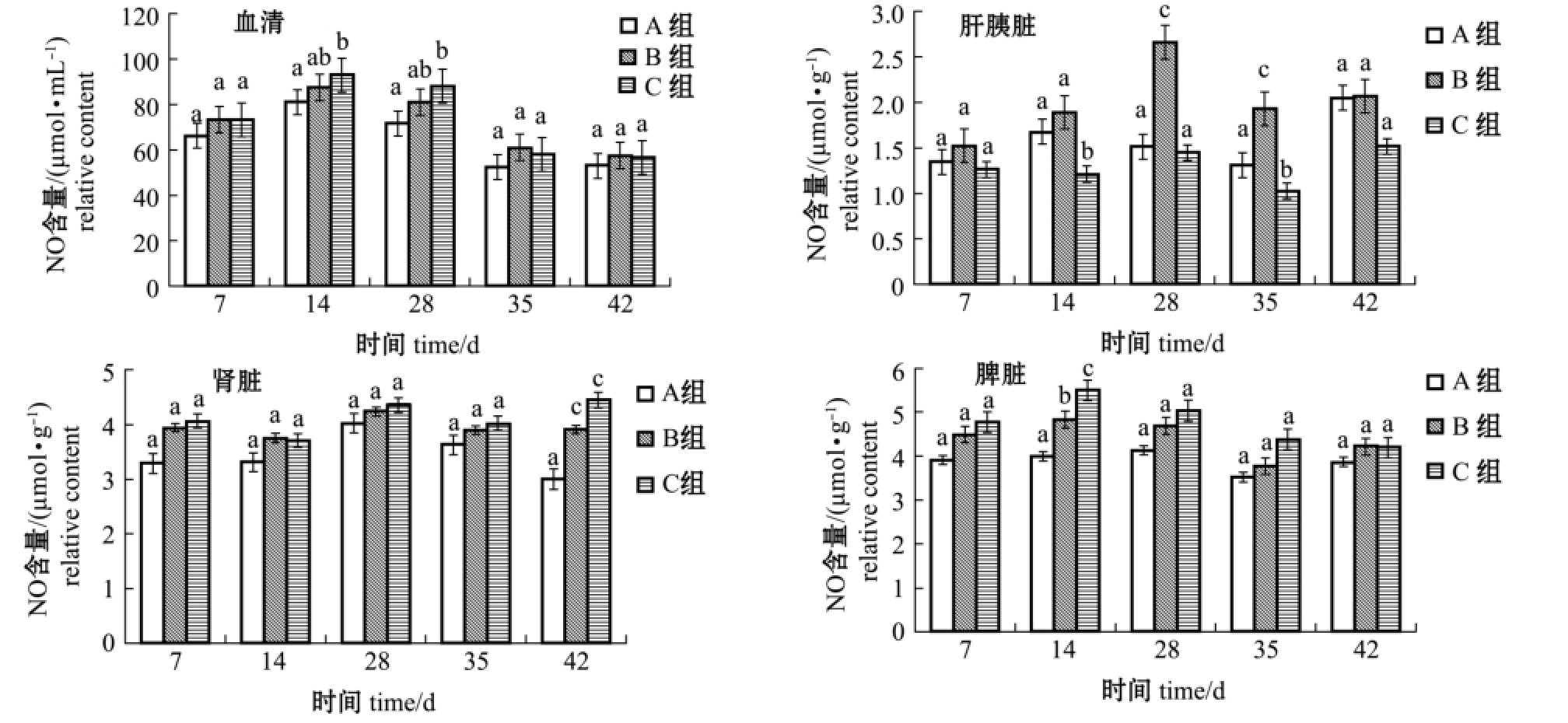
注:标有不同小写字母者表示同一时间点组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05)
Note:Themeans with different letters are significant differences at same time at the 0.05 probability level,and themeans with the same letters are not significant differences
图1 摄食添加不同水平大蒜素饲料对鲫血清、肝胰脏、肾脏、脾脏中NO含量的影响
Fig.1 Effects of different dietary levels of gar licin on con tents of NO in serum,hepatopancreas,kidney,and sp leen of crucian carp Carassius auratus
3 讨论
3.1 大蒜素对补体C3、C4活性的影响
补体系统是鱼体非特异免疫系统中重要的组成部分,鳟科、鲤科等养殖鱼类旁路途径的活性比哺乳动物高出5~60倍,不需要抗体即可激活补体反应[15]。补体C3是补体系统中含量最多的成分,能发挥溶菌杀菌、免疫调节、免疫复合物溶解和清除等生物学功效[16-18]。补体C4是补体系统经典途径中的主要成分,它在机体防御过程中可以调节吞噬细胞机制、清除病原微生物,并通过活化炎性细胞对靶细胞的杀伤作用等来提高机体的免疫机能[19]。周显青等[20]研究发现,维生素C只有在一定剂量范围内才能促进补体C3和C4合成,低于此范围对补体的产生无影响,高于此范围则产生抑制作用,且此剂量范围在不同动物间存在一定差异。可见,给药剂量、动物种类是影响补体C3和C4合成的重要因素。
本试验结果显示,不同剂量的大蒜素在饲喂相同时间后对鲫血清补体C3、C4活力的影响不同。连续投喂含大蒜素的饲料28 d后,250 mg/kg大蒜素显著提高了血清补体C3活力,顾雪飞等[10]研究表明,在每千克鲤饲料中添加30 g新鲜大蒜素,饲喂30 d后可以显著提高鲤血清中补体C3活力,与本试验结果基本一致。改投不含大蒜素的基础饲料2周后,250 mg/kg剂量组鲫血清补体C3活力下降到对照水平,但此剂量大蒜素对血清补体C4无显著影响,这与徐奇友等[11]报道的低剂量(0.5%)大蒜茎粉显著提高血清C4活力的结果不同。而投喂500 mg/kg大蒜素显著抑制鲫血清补体C3、C4活力,这可能与高剂量大蒜素会减弱补体C3、C4对吞噬细胞机制的调节作用,破坏炎性细胞对靶细胞的杀伤作用有关,改投不含大蒜素的基础饲料后,补体C3活力升高并恢复到对照水平,但补体C4活力仍显著低于对照组。
3.2 大蒜素对LZM活性的影响
LZM是水生动物体内重要的非特异性免疫防御因子,广泛存在于鱼类体表的黏液、鳃、血清、肠胃分泌液和吞噬细胞的溶酶体颗粒中,它在水产动物抵抗病原微生物感染中具有重要作用[21-23]。鱼类 LZM的杀菌活性远强于高等脊椎动物LZM[24]。LZM能对某些细菌发挥先天抵抗作用,破坏细菌细胞壁结构,致使细菌内容物溢出,从而杀死细菌,亦可诱导其他免疫因子的合成和分泌[24-26]。 国 内 外 研 究 表 明, 种 属[27-28]、 环境[29-30]、 温度[31-32]、 pH[33-34]、 给药剂 量[35-37]、给药时间[10]等复杂原因可造成不同动物间LZM活性的差异。
本试验结果表明,经过一段时间饲喂后,剂量为250、500 mg/kg的大蒜素均能提高鲫血清、肝胰脏、肾脏和脾脏LZM活性,并在一定时间范围内达到酶活力最高峰,增强鲫的非特异性免疫力,从而提高鲫的抗病力。这可能与大蒜素可激活组织中巨噬细胞的分泌功能,促使溶菌酶大量释放功能,增强鱼体非特异性免疫功能有关[23,38]。曹丹等[9]研究表明,在饲料中添加100 mg/kg的大蒜素,能提高暗纹东方鲀脾脏中LZM活性。宋文华等[13]发现,添加不同剂量的大蒜素在经过一段时间饲喂后能提高草鱼血清LZM活性。徐奇友等[11]发现,在镜鲤饲料中添加0.5%和2.5%的大蒜茎粉,均可提高鱼血清LZM活性。吕富等[14]研究表明,饲料中添加大蒜渣可显著提高异育银鲫肝胰脏和肌肉中LZM活性。李婵等[12,39]在饲料中添加15 mg/kg大蒜素后,虹鳟鳃和肝脏中LZM活性显著提高。以上研究结果均与本试验结果相同。改投不含大蒜素的基础饲料一段时间内,250 mg/kg和500 mg/kg剂量组鲫血清LZM活性及500 mg/kg剂量组鲫肾脏和脾脏LZM活性仍有显著升高,但随着饲养时间的延长,以上各组织器官中LZM活性均恢复到对照水平。由此说明,停喂大蒜素后,鲫体内LZM活性在一段时间内仍保持较高水平。本试验中高剂量组鲫血清、肝胰脏、肾脏和脾脏LZM活性好于低剂量组,这说明添加剂量对鲫各组织器官中LZM活性具有重要影响作用。
3.3 大蒜素对NO含量的影响
NO是体内非特异性防御反应系统的组成部分,它在机体内是由诱导型一氧化氮合成酶 (iNOS)或结构型一氧化氮合成酶 (nNOS)与底物作用生成,能对抑制脂质过氧化、清除氧自由基发挥重要的作用[40-41]。 曹丽萍等[42]在研究黄芪多糖(APS)对鲤免疫细胞的免疫活性作用时发现,低浓度的黄芪多糖可促进巨噬细胞产生NO,高浓度黄芪多糖却表现为抑制作用。张晋强等[43]以腹腔注射的方式给予小鼠5种不同浓度的APS,发现100 mg/kg和200 mg/kg剂量的APS可显著促进巨噬细胞中NO的产生。可见,动物体内NO的生成与给药剂量密切相关。
本试验结果显示,250 mg/kg剂量的大蒜素显著提高了鲫肝胰脏和脾脏中NO含量,500 mg/kg的大蒜素显著提高了鲫血清和脾脏中NO含量,而500 mg/kg的剂量则显著抑制了肝胰脏中NO含量。究其原因,可能是不同剂量大蒜素对鲫各组织选择性作用不同,故产生NO的量也不同。本试验中各剂量组鲫血清、肝胰脏和脾脏NO含量均随含大蒜素饲料的停喂而恢复到对照水平,而肾脏中NO含量在第42天时仍显著高于对照水平,出现此现象的具体原因仍需进一步研究。冯永辉等[44]研究表明,黑大蒜提取物能显著增强小鼠NK细胞的杀伤活性,促进NO的分泌,增强其细胞免疫应答。蔡春芳等[45]在银鲫饲料中添加0.5%大蒜素,表现出显著的免疫增强作用和一定程度的促生长作用。
综上所述,投喂添加500 mg/kg大蒜素饲料能显著提高鲫部分组织器官的非特异免疫指标活性,且停止投喂含大蒜素的饲料后,鲫血清、肾脏和脾脏中LZM活性仍显著高于对照水平,但此剂量会抑制鲫血清补体C3和C4活性,并降低其肝胰脏中NO含量;而投喂添加250 mg/kg大蒜素饲料,均能提高鲫各组织的非特异免疫指标,且停喂含大蒜素的饲料后,鲫血清中LZM活性在一段时间内仍能保持较高水平。因此,建议鲫基础饲料中大蒜素的添加剂量为250 mg/kg,且需长期投喂。
参考文献:
[1] 刘清华,王璐璐.大蒜素治疗肝病的药理机制[J].山东医药,2013,53(29):96-97.
[2] 章稳宏,李钰皓,汪明,等.大蒜素在医药和畜牧业中的应用研究进展[J].江苏农业科学,2009(6):24-26.
[3] 李春红,冯雪建,陈洁,等.大蒜素对动物免疫调节作用的研究进展[J].安徽农业科学,2008,36(9):3687-3689.
[4] Bakri IM,Douglas CW I.Inhibitory effect of garlic extract on oral bacteria[J].Archives of Oral Biology,2005,50(7):645-651.
[5] Salem M L,Hossain M S.Protective effect of black seed oil from Nigella sativa against murine cytomegalovirus infection[J].International Journal of Immunopharmacology,2000,22(9):729-740.
[6] 梅四卫,朱涵珍.大蒜素的研究进展[J].中国农学通报,2009,25(9):97-101.
[7] 聂品.鱼类非特异性免疫研究的新进展[J].水产学报,1997,21(1):69-73.
[8] Fletcher TC.Non-specific defensemechanisms of fish[J].Developmental and Comparative Immunology Supp,1982,10(2):123-132.
[9] 曹丹,周洪琪.不同添加剂对暗纹东方鲀生长和脾脏溶菌酶活力的影响[J].水产科技,2002(3):17-19.
[10] 顾雪飞,陈玉清,刘敏.中草药对鲤血清和免疫器官溶菌酶活性的影响[J].淡水渔业,2007,37(2):30-33.
[11] 徐奇友,唐玲,王常安,等.大蒜茎粉和牛至草粉对镜鲤抗氧化、非特异免疫以及肌肉品质的影响[J].华北农学报,2010,25(S2):133-139.
[12] 李婵,徐奇友,许红,等.几种饲料添加剂对虹鳟(Oncorhynchusmykiss Walbaum)免疫活性和抗氧化能力的影响[J].安徽农业大学学报,2008,35(3):456-461.
[13] 宋文华,张涛,富丽静,等.大蒜素、枸杞多糖对草鱼血清非特异性免疫指标的影响[J].河北渔业,2011(6):12-18,21.
[14] 吕富,黄金田,丁研,等.大蒜渣对异育银鲫生长、消化酶活性及免疫功能的影响[J].安徽农业科学,2012,40(26):12928-12930.
[15] 李凌,吴灶和.鱼类体液免疫研究进展[J].海洋科学,2001, 25(11):20-22.
[16] Ndong D,Chen Y Y,Lin Y H,et al.The immune response of tilapia Oreochromismossambicus and its susceptibility to Streptococcus iniae under stress in low and high temperatures[J].Fish&Shellfish Immunology,2007,22(6):686-694
[17] 王志平,张士璀,王光锋.鱼类补体系统成分及补体特异性和功能的研究进展[J].水生生物学报,2008,32(5):760-769.
[18] 汪进益,范慧敏,刘中民,等.体外循环围术期患者血清补体C3、C4水平变化及临床意义[J].同济大学学报:医学版,2006,27(4):21-23.
[19] 吉红,朱天和,周继术.日粮中鱼粉添加量对鲤鱼种生长、生物学性状及血清生化指标的影响[J].西北农林科技大学学报:自然科学版,2008,36(7):33-39.
[20] 周显青,牛翠娟,孙儒泳.维生素C和酸应激对中华鳖幼鳖血清补体C3和C4含量的影响[J].动物学报,2003,49(6):769-774.
[21] 黄旭雄,周洪琪,宋理平.急性感染对中国明对虾非特异免疫水平的影响[J].水生生物学报,2007,31(3):325-331.
[22] Dunier M,Siwicki A K,Demaël A.Effects of organophosphorus insecticides:effects of trichlorfon and dichlorvos on the immune response of carp(Cyprinuscarpio):III.in vitro effectson lymphocyte proliferation and phagocytosis and in vivo effects on humoral response[J].Ecotoxicology and Environmental Safety,1991,22 (1):79-87.
[23] Simser JA,Macaluso K R,Mulenga A,et al.Immune-responsive lysozymes from hemocytes of the American dog tick,Dermacentor variabilis and an embryonic cell line of the Rocky Mountain wood tick,D.andersoni[J].Insect Biochemistry and Molecular Biology,2004,34(12):1235-1246.
[24] Fernandez-Trujillo M A,Bejar J,Gallardo J B,et al.Molecular cloning and characterization of C-type lysozyme from Senegalese sole(Solea senegalensis)[J].Aquaculture,2007,272(S1):S255.
[25] 汪成竹,姚鹃,吴凡,等.免疫多糖(酵母细胞壁)对中华鳖非特异性免疫功能的影响[J].华中农业大学学报,2006,25 (4):421-425.
[26] Benkerroum N.Antimicrobialactivity of lysozyme with special relevance to milk[J].African Journal of Biotechnology,2008,7 (25):4856-4867.
[27] Beintema J J,Terwisscha van Scheltinga A C.Plant lysozymes [J].EXS,1996,75:75-86.
[28] Losso JN,Nakai S,Charter E A.Lysozyme[M]//Naidu A S. Natural Food Antimicrobial Systems.Boca Raton:CRC Press,2000:185-210.
[29] Möck A,Peters G.Lysozyme activity in rainbow trout,Oncorhynchusmykiss(Walbaum),stressed by handling,transport and water pollution[J].Journal of Fish Biology,1990,37(6):873-885.
[30] Rφed K H,Larsen H JS,Linder R D,et al.Genetic variation in lysozyme activity in rainbow trout(Oncorhynchusmykiss)[J]. Aquaculture,1993,109(3-4):237-244.
[31] Kyomuhendo P,Myrnes B,Nilsen IW.A cold-active salmon goose-type lysozyme with high heat tolerance[J].Cellular and Molecular Life Sciences,2007,64(21):2841-2847.
[32] Kusuda R,Kawahara I,HamaguckiM.Activities and characteriza-tion of lysozyme in skin mucus extract,serum and kidney extract of yellowtail[J].Nippon Suisan Gakkaishi,1987,53(2):211-214.(in Japanese)
[33] Fletcher TC,White A.Lysozyme activity in the p laice(Pleuronectes platessa L.)[J].Experientia,1973,29(10):1283-1285.
[34] Miyazaki T.Influences of pH and temperature on lysozyme activity in the plasma of Japanese flounder and Japanese char[J].Fish Pathology,1998,33(1):7-10.
[35] 郭腾飞,黄旭雄,苏明,等.饲料锌添加水平对凡纳滨对虾免疫抗菌机能和溶菌酶mRNA及Toll受体mRNA表达的影响[J].水产学报,2011,35(7):1081-1089.
[36] Biswas G,Korenaga H,Nagamine R,et al.Immune stimulant effects of a nucleotide-rich baker's yeast extract in the kuruma shrimp,Marsupenaeus japonicus[J].Aquaculture,2012,366-377:40-45.
[37] Clerton P,Troutaud D,Verlhac V,et al.Dietary vitamin E and rainbow trout(Oncorhynchusmykiss)phagocyte functions:effect on gutand on head kidney leucocytes[J].Fish&Shellfish Immunology,2001,11(1):1-13.
[38] Paulsen SM,Engstad R E,Robertsen B.Enhanced lysozyme production in Atlantic salmon(Salmo salar L.)macrophages treated with yeastβ-glucan and bacterial lipopolysaccharide[J].Fish& Shellfish Immunology,2001,11(1):23-37.
[39] 李婵,白岚,徐奇友,等.不同促生长剂对虹鳟生长性能及非特异性免疫机能的影响[J].大连水产学院学报,2008,23 (3):179-184.
[40] Hogg N,Struck A,Goss SP,et al.Inhibition ofmacrophage-dependent low density lipoprotein oxidation by nitric-oxide donors [J].Journal of Lipid Research,1995,36(8):1756-1762.
[41] Wink D A,Michell JB.Chemical biology of nitric oxide:insights into regulatory,cytotoxic,and cytoprotective mechanisms of nitric oxide[J].Free Radical Biology and Medicine,1998,25(4-5):434-456.
[42] 曹丽萍,丁炜东,张柳,等.香菇多糖和黄芪多糖对鲤免疫细胞的活性和IL-1β体外诱生表达的影响[J].水产学报,2008,32(4):628-635.
[43] 张晋强,李彦东,马海利,等.黄芪多糖对小鼠腹腔巨噬细胞iNOS基因表达及NO生成的影响[J].动物医学进展,2013,34(1):55-59.
[44] 冯永辉,王庆辉,王美茹,等.黑大蒜提取物对小鼠细胞免疫应答影响的初步探讨[J].中国免疫学杂志,2010,26(11):982-985.
[45] 蔡春芳,宋学宏,潘兴法,等.几种抗病促生长剂对银鲫生长和免疫力的影响[J].水利渔业,2002,22(2):21-23.
Effects of garlicin on nonspecific immune indices of crucian carp Carassius auratus
KANG Shu-yuan1,2,WANG Di1,LU Tong-yan1
(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai201306,China)
Abstract:A 42 day feeding trailwas conducted to evaluate impactof diets supplemented with garlicin at a dose of 250 mg/kg and 500 mg/kg on non-specific immune function of crucian carp Carassius auratus.The crucian carp with initial body weight of(280±15)g was fed the diets containing garlicin in the early 28 days,and then fed the control dietwithout supplementation of garlicin for the rest later days.The results showed that the serum C3 activity was increased significantly in the fish fed the diet containing garlicin at a rate of250 mg/kg compared with the fish in the control group(P<0.05).However,the serum C3,and C4 activitieswere shown to be decreased significantly in the fish fed the diet containing garlicin ata rate of500 mg/kg(P<0.05)and the serum C4 activity was still declined significantly(P<0.05)in the fish fed the control diet.The fish fed the diets containing garlicin ata rate of 250 mg/kg and 500 mg/kg had significantly higher LZM activities in serum,hepatopancreas,kidney and spleen (P<0.05)than the fish fed the control diet did.There was significantly higher LZM activity in serum in the fish fed the diet containing garlicin at a rate of 250 mg/kg and significantly higher LZM activities in serum,kidney and spleen in the fish fed the diet containing garlicin ata rate of500 mg/kg garlicin(P<0.05)even when the fish fed the control diet.Therewere significantly higher contents of NO in hepatopancreas and spleen in the fish fed the diet containing garlicin at a rate of250mg/kg,and in serum and spleen in the fish fed the diet containing garlicin ata rate of500 mg/kg(P<0.05),instead of hepatopancrease,compared with the fish in the control group(P<0.05). There were significantly higher contents of NO in kidney in the fish fed the diet containing garlicin at a rate of 250 mg/kg and 500 mg/kg in 42 days(P<0.05)than in the fish fed the control diet.It is recommended that the optimal addition of garlic in feed was at a dose of 250 mg/kg diet.
Key words:garlicin;Carassius auratus;nonspecific immune index
中图分类号:S948
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.02.009
文章编号:2095-1388(2016)02-0168-06
收稿日期:2015-05-29
基金项目:公益性行业 (农业)科研专项 (201203085)
作者简介:康淑媛 (1989—),女,硕士研究生。E-mail:kangshuyuan0116@163.com
通信作者:卢彤岩 (1967—),女,博士,研究员。E-mail:lutongyan@hotmail.com



