摘要:为研究创伤弧菌Vibrio vulnificus对药物的敏感性,减少珍珠龙趸养殖业中的病害影响,从患病珍珠龙趸 (pearl gentian)(棕点石斑鱼Epinephelus fuscoguttatus♀×鞍带石斑鱼E.lanceolatus♂)肝肾中分离出一株病原菌,编号为X11XC26,并对其进行了鉴定及耐药性分析。经攻毒试验证明,该菌对斜带石斑鱼E.coioides有较强的致病性,半数致死浓度 (LD50)为1.70×105CFU/g,呈急性感染型;对该菌株进行常规生理生化试验、API(32E)系统鉴定和16S rDNA、rctB、topA、mreB、rpoD等5种管家基因序列分析,可将该菌株鉴定为创伤弧菌;通过纸片扩散K-B法测试了该菌株对16种药物的敏感性,结果显示,该菌株对氧氟沙星、诺氟沙星、环丙沙星、恩诺沙星和阿莫西林5种药物敏感,对多粘菌素B等11种药物不敏感。本研究中从患病珍珠龙趸体内分离出创伤弧菌在国内属首次报道,而该菌株较强的耐药性应引起人们的关注。
关键词:珍珠龙趸;创伤弧菌;药物敏感;管家基因
创伤弧菌Vibrio vulnificus是一种革兰氏阴性嗜盐菌,隶属于弧菌科Vibrio、弧菌属Vibrio,生活在温带和热带生态系统中,是水域常见的一类细菌[1-2]。1976年,Holli从血液中分离出该菌,鉴定为乳酸阴性嗜盐弧菌,1979年,Farmer正式将其命名为创伤弧菌[3]。创伤弧菌是一类重要的病原菌,已报道的感染对象有鳗鲡Anguilla anguilla、大菱鲆Scophthalmusmaximus、黄姑鱼Nibea albiflora、矛尾复虾虎鱼Synechogobius hasta等,该菌均能引起这些鱼类严重的出血和溃烂症状[4-7]。创伤弧菌同时还是人鱼共患菌,能引起创口感染及原发性败血症,死亡率超过了50%[8]。
石斑鱼是海水养殖中重要的养殖种类。珍珠龙趸 (pearl gentian)又称珍珠斑或龙虎斑,是由棕点石斑鱼Epinephelus fuscoguttatus♀与鞍带石斑鱼Epinephelus lanceolatus♂杂交培育出来的新品种。育苗成功后,在天津、山东、海南、福建、广东等地得到广泛推广[9]。珍珠龙趸结合了父本生长快速和母本肉质细腻的特点,又具有虎斑头、龙胆尾的外形,可作为观赏鱼养殖,被称为 “石斑鱼的后起之秀”[10-11]。珍珠龙趸适应能力强,适合网箱、池塘多种养殖模式,特别是高密度养殖[12]。然而随着养殖规模的不断扩大,病害问题接连发生,尤其是细菌性疾病 (弧菌病)的影响最为广泛[13-14],制约了水产养殖业的发展。目前,关于珍珠龙趸的研究多集中在育种、养殖方面,未见有关珍珠龙趸弧菌病的报道[15-16]。
2011年,海南新村养殖的珍珠龙趸突发大量死亡,笔者从病鱼体内分离出一株细菌,采用生理生化方法和分子生物学方法对致病菌进行鉴定,同时研究了该株菌对16种药物的敏感性,以期为该病毒的防治研究提供参考依据。
1.1 材料
患病珍珠龙趸于2011年取自发生严重疾病的海南新村珍珠龙趸养殖场,病鱼体表观察无明显症状。健康斜带石斑鱼Epinephelus coioides体质量为(31.7±5.4)g,体长为 (11.4±0.6)cm,取自深圳某养殖场。
1.2 方法
1.2.1 组织样品的制备 将患病的珍珠龙趸解剖后观察到病鱼肝脏、肾脏肿大,随机选取2尾濒死病鱼的肝、肾组织,分别划线于TCBS和营养琼脂平板,28℃下培养过夜,将得到的优势细菌 (编号为X11XC26)纯化培养,同时取肾脏组织固定,做组织病理切片以观察组织结构。
1.2.2 菌株致病性检测 将健康斜带石斑鱼在实验室暂养7 d后随机分为E1、E2、E3、E4、对照组,每组设3个平行,试验组、对照组每个平行分别放 10、7尾鱼。将供试菌 X11XC26接种到2216E斜面上培养12~16 h,用无菌生理盐水制备4个浓度梯度的菌悬液,分别对试验组鱼进行腹腔注射,剂量为0.2 m L/尾,对照组注射等量生理盐水。注射菌液后正常饲养,观察并记录7 d内的情况,在试验组濒死鱼肝、肾中划线分离细菌,利用寇式法计算半数致死浓度 (LD50,CUF/g):
其中:Xg为死亡率为100%组剂量的对数;d为相邻两组剂量对数之差;∑P为各组死亡率之和。
1.2.3 菌株形态及生理生化特性分析 将菌株X11XC26用革兰氏染色后镜检观察染色情况。取纯培养的细菌,接种于2216E斜面培养基中,按常规生理生化鉴定步骤进行试验[17],同时做API (32E)系统鉴定。
1.2.4 16S rDNA、mreB、rctB、rpoD、topA序列的测定和分析 采用煮沸法提取分离菌DNA用作PCR模板。PCR反应程序:94℃下预变性5 min;94℃下变性1 min,48~63℃下退火2 min,72℃下延伸10 min,共进行35个循环。PCR反应体系(共50μL):Premix rTaq 25μL,上、下游引物各1.5μL,DNA 2μL,ddH2O 20μL。PCR引物见表1[18-19]。取5μL PCR产物在10 g/L琼脂糖凝胶中电泳,在130 V、25 min条件下检测结果。将扩增所得阳性产物送英潍捷基 (广州)公司进行测序。
1.2.5 菌株对药物的敏感试验 按照NCCL试验操作标准[20],采用纸片扩散 K-B法,取100μL菌悬液 (浓度约为108CFU/mL)涂布于MHA培养基上,10 min后贴药敏纸片,于28℃下培养24 h后,观察并测量抑菌圈直径。根据抑菌圈直径的大小判断菌株对药物的敏感性。
表1 引物信息
Tab.1 The primers used in the experiment
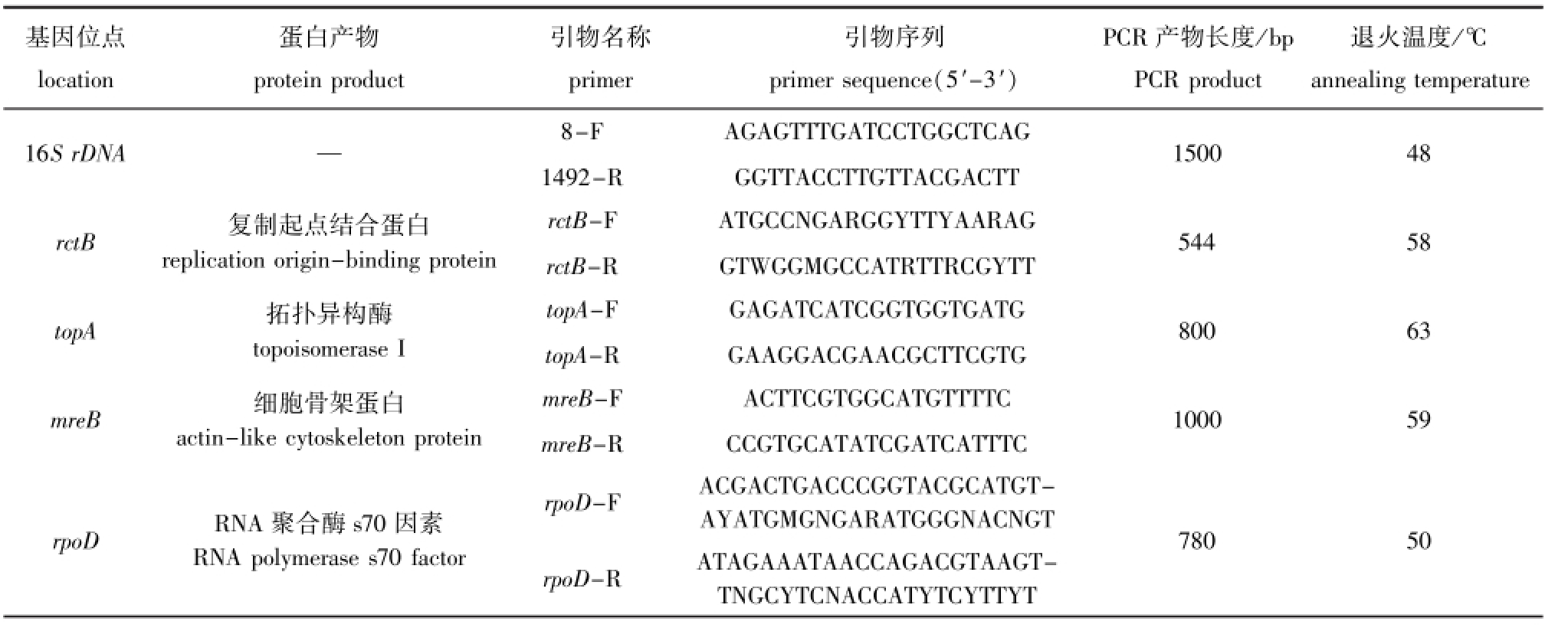
退火温度/℃annealing temperature 16S rDNA — 8-F AGAGTTTGATCCTGGCTCAG 1492-R GGTTACCTTGTTACGACTT基因位点location蛋白产物protein product引物名称primer引物序列primer sequence(5′-3′)PCR产物长度/bp PCR product 1500 48 rctB 复制起点结合蛋白replication origin-binding protein rctB-F ATGCCNGARGGYTTYAARAG rctB-R GTWGGMGCCATRTTRCGYTT 544 58 topA 拓扑异构酶topoisomerase I topA-F GAGATCATCGGTGGTGATG topA-R GAAGGACGAACGCTTCGTG 800 63 mreB 细胞骨架蛋白actin-like cytoskeleton protein mreB-F ACTTCGTGGCATGTTTTC mreB-R CCGTGCATATCGATCATTTC 1000 59 rpoD RNA聚合酶s70因素RNA polymerase s70 factor rpoD-F ACGACTGACCCGGTACGCATGTAYATGMGNGARATGGGNACNGT rpoD-R ATAGAAATAACCAGACGTAAGTTNGCYTCNACCATYTCYTTYT 780 50
2.1 病原菌的分离
将患病的珍珠龙趸肝、肾组织划线于TCBS平板及营养琼脂平板培养12~18 h后,观察到两种平板上均有优势细菌存在,且TCBS平板中上只有该种细菌存在。将平板上的细菌纯化分离后得到一菌株,将其命名为X11XC26。
2.2 患病珍珠龙趸肾组织的病理观察
通过对患病珍珠龙趸肾组织的病理学观察,发现患病鱼肾脏组织已纤维化,且可见大量细菌聚集(图1)。
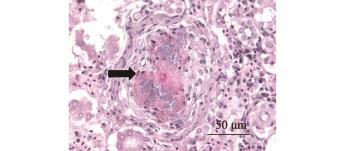
图1 肾脏组织病理学切片
Fig.1 Histopathological section of the kidney
2.3 菌株X11XC26的致病性
人工感染试验结果表明,菌株X11XC26对健康斜带石斑鱼有强致病性 (表2),计算得出其半数致死浓度LD50为1.70×105CFU/g。取感染后斜带石斑鱼的肝、肾组织,进行细菌分离、纯化,得到的菌株命名为X11-01。
表2 菌株X11XC26对斜带石斑鱼人工感染结果
Tab.2 Pathogenicity of X11XC26 strain to orange-spotted grouper Epinephelus coioides
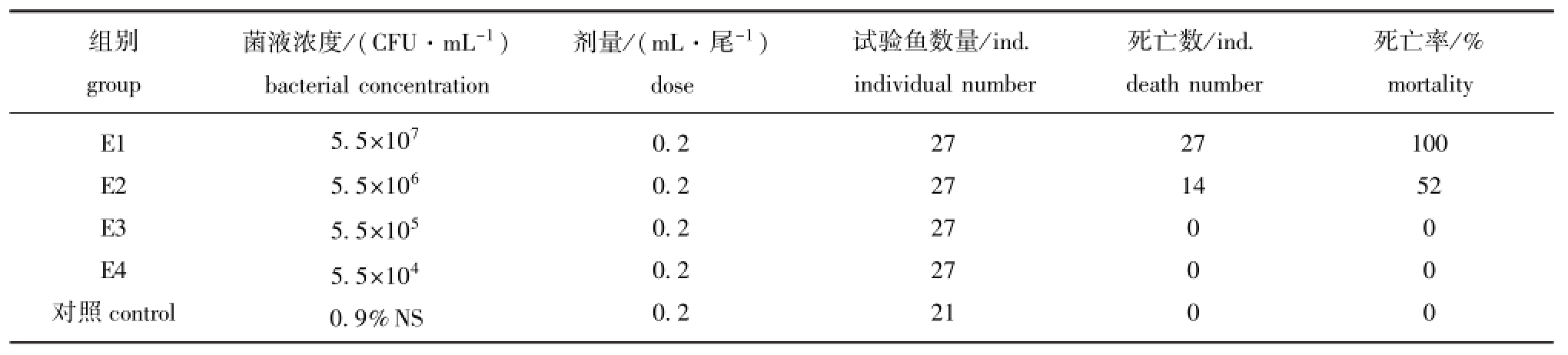
组别group菌液浓度/(CFU·m L-1)bacterial concentration剂量/(m L·尾-1)dose试验鱼数量/ind. individual number死亡数/ind. death number死亡率/% mortality E1 E2 E3 E4对照control 5.5×1075.5×1065.5×1055.5×1040.9%NS 0.2 0.2 0.2 0.2 0.2 27 27 27 27 21 27 14 100 52 0 0 0 0 0 0
2.4 菌株形态及生理生化特征
经革兰氏染色发现,菌株X11XC26和X11-01均为革兰氏阴性细菌,呈短杆状;TCBS生长呈绿色,O/129(150μg/片)敏感;该菌在3%NaCl胨水、6%NaCl胨水中均能生长,在无盐胨水、8%NaCl胨水、10%NaCl胨水中不生长;该菌在28、35℃下均能生长,在4、15、42℃下均不生长;氧化酶、过氧化氢酶为阳性,VP反应为阴性,能利用葡萄糖、麦芽糖 (表3)。
表3 菌株X11XC26和X11-01的主要生理生化指标检测结果
Tab.3 M ain phenotyp ic traits of strains X11XC26 and X11-01
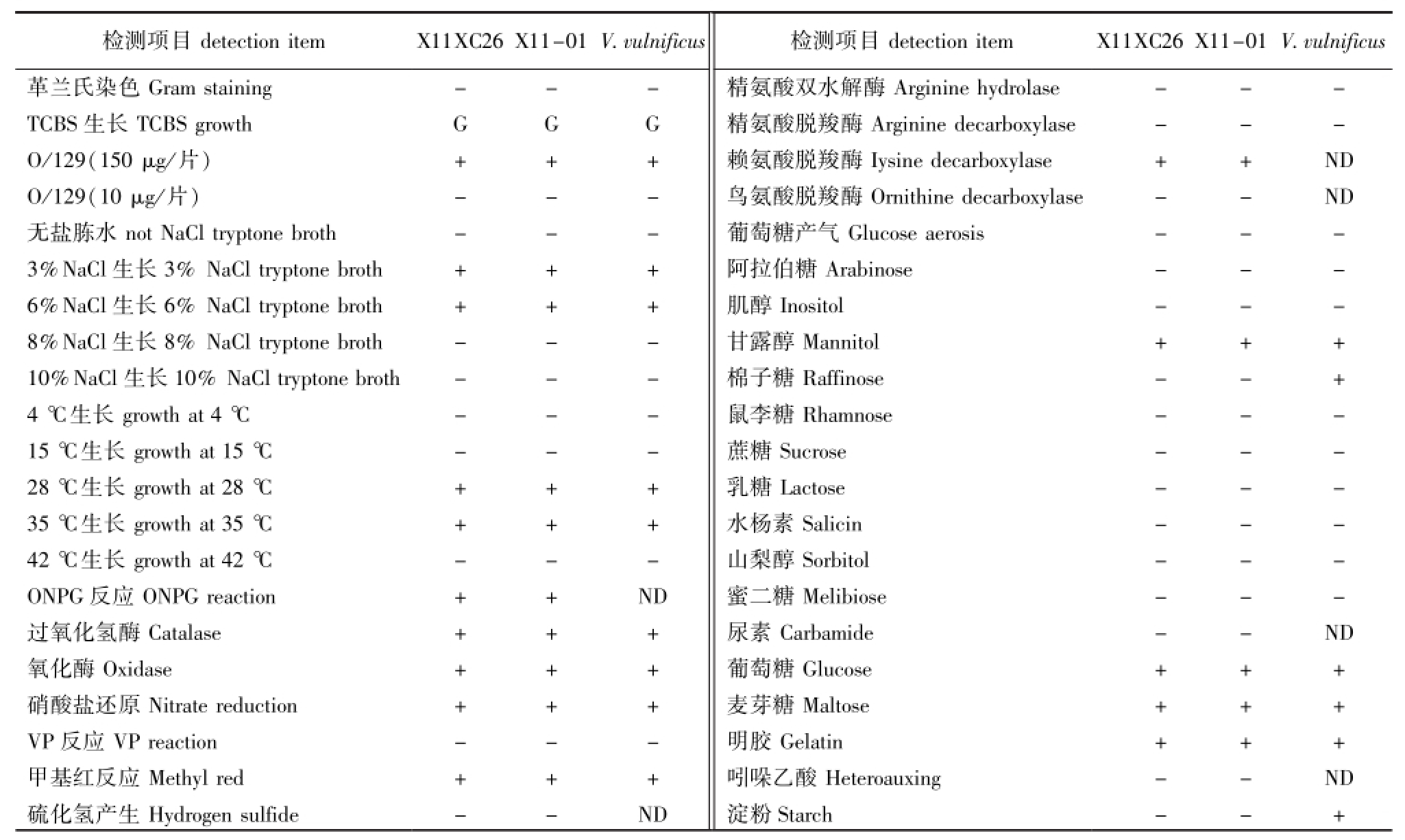
注:+表示阳性;-表示阴性;G表示绿色;ND表示没有可提供的数据
Note:+,represents positive;-,represents negative;G,represents green;ND,no data
检测项目detection item X11XC26 X11-01 V.vulnificus革兰氏染色Gram staining - - -TCBS生长TCBS growth G G G O/129(150μg/片) + + + O/129(10μg/片) - - -无盐胨水not NaCl tryptone broth - - -3%NaCl生长3%NaCl tryptone broth + + + 6%NaCl生长6%NaCl tryptone broth + + + 8%NaCl生长8%NaCl tryptone broth - - -10%NaCl生长10%NaCl tryptone broth - - -4℃生长growth at 4℃ - - -15℃生长growth at 15℃ - - -28℃生长growth at 28℃ + + + 35℃生长growth at 35℃ + + + 42℃生长growth at 42℃ - - -ONPG反应ONPG reaction + + ND过氧化氢酶Catalase + + +氧化酶Oxidase + + +硝酸盐还原Nitrate reduction + + + VP反应VP reaction - - -甲基红反应Methyl red + + +硫化氢产生Hydrogen sulfide - - ND vulnificus精氨酸双水解酶检测项目detection item X11XC26 X11-01 V. Arginine hydrolase - - -精氨酸脱羧酶Arginine decarboxylase - - -赖氨酸脱羧酶Iysine decarboxylase + + ND鸟氨酸脱羧酶Ornithine decarboxylase - - ND葡萄糖产气Glucose aerosis - - -阿拉伯糖Arabinose - - -肌醇Inositol - - -甘露醇Mannitol + + +棉子糖Raffinose - - +鼠李糖Rhamnose - - -蔗糖Sucrose - - -乳糖Lactose - - -水杨素Salicin - - -山梨醇Sorbitol - - -蜜二糖Melibiose - - -尿素Carbamide - - ND葡萄糖Glucose + + +麦芽糖Maltose + + +明胶Gelatin + + +吲哚乙酸Heteroauxing - - ND淀粉Starch - - +
2.5 16S rDNA、mreB、rctB、topA、rpoD序列和系统发育学分析
双向测序得到菌株X11XC26的上述5个基因片段,将基因按照mreB-rctB-rpoD-topA的顺序串联起来,与创伤弧菌菌株进行比对,利用MEGA 6.0软件构建NJ系统树,进行系统进化分析 (图2和图3)。结果发现,该株病原菌与创伤弧菌能自然聚类,结合形态学及生理生化特征确定X11XC26菌株为创伤弧菌Vibrio vulnificus。
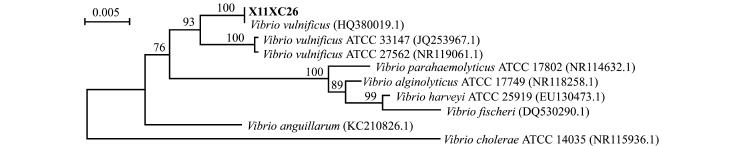
图2 菌株X11XC26的16S rDNA序列分析聚类结果
Fig.2 Dendrogram of 16S rDNA sequence analysis of strain X11XC26
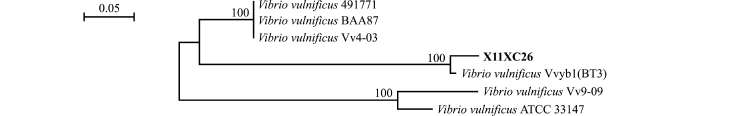
图3 菌株X11XC26 4个基因串联序列的系统进化树
Fig.3 Phylogenetic constructions of four concatenated genes in strain X11XC26
2.6 菌株的药敏试验
利用纸片法测定16种抗菌药物对菌株X11XC26与X11-01的作用效果,两株菌株对氧氟沙星、诺氟沙星、环丙沙星、恩诺沙星、阿莫西林等5种药物均敏感,对多粘菌素B、卡那霉素、青霉素G、庆大霉素、四环素、呋喃唑酮、利福平、复方新诺明、红霉素、氯霉素、头孢克肟等11种抗生素均不敏感 (表4)。
表4 致病菌X11XC26与X11-01对不同抗菌药物的敏感性
Tab.4 Antibacterial activities of different antim icrobial agents to the pathogens X11XC26 and X11-01
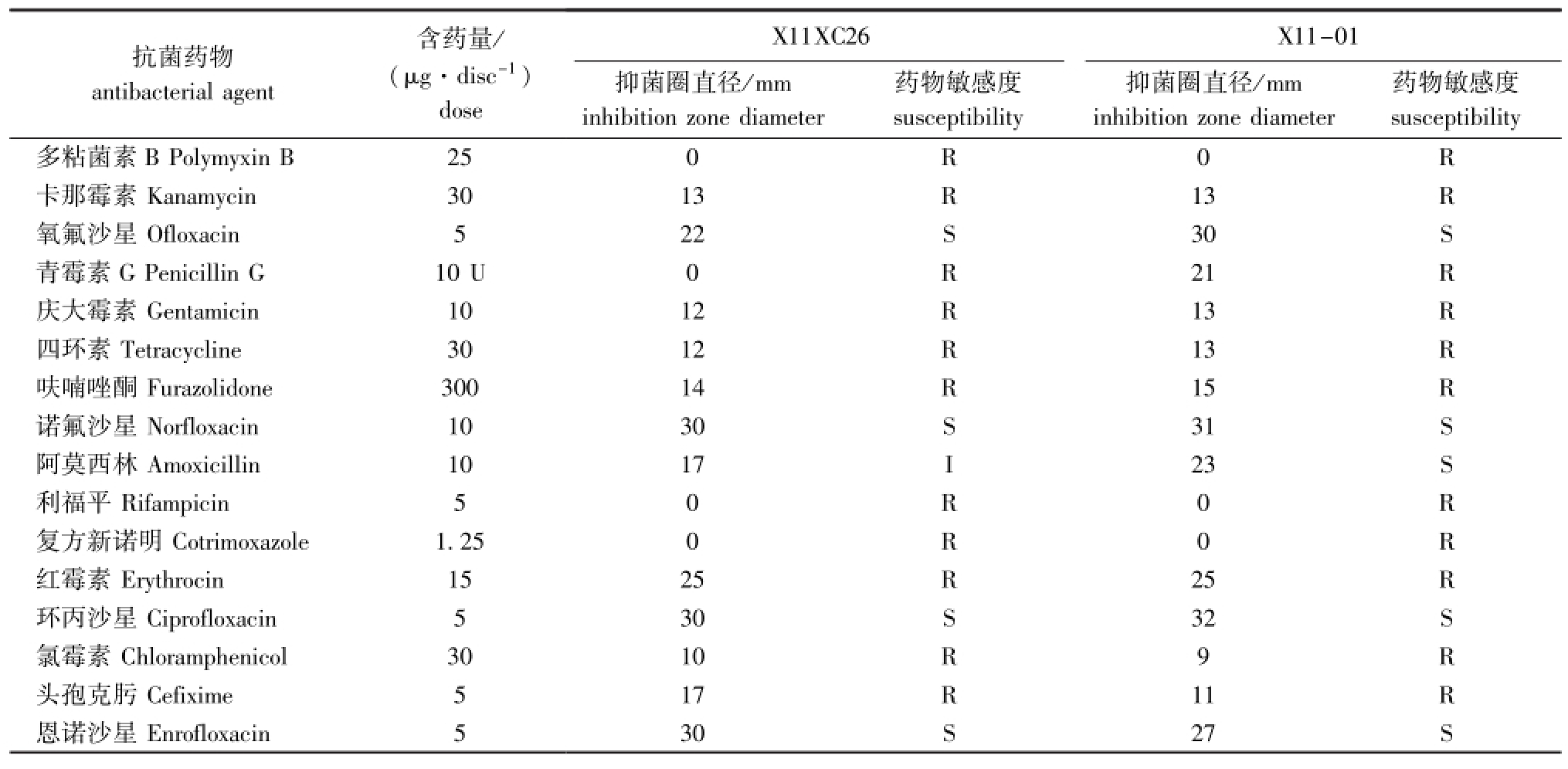
注:R为不敏感;I为中度敏感;S为高度敏感
Note:R,resistance;I,medium sensitivity;S,high sensitivity
抗菌药物antibacterial agent含药量/ (μg·disc-1) 药物敏感度susceptibility药物敏感度抑菌圈直径/mm inhibition zone diameter dose X11XC26 X11-01抑菌圈直径/mm inhibition zone diameter susceptibility多粘菌素Enrofloxacin 5 30 S 27 S B Polymyxin B 25 0 R 0 R卡那霉素Kanamycin 30 13 R 13 R氧氟沙星Ofloxacin 5 22 S 30 S青霉素G Penicillin G 10 U 0 R 21 R庆大霉素Gentamicin 10 12 R 13 R四环素Tetracycline 30 12 R 13 R呋喃唑酮Furazolidone 300 14 R 15 R诺氟沙星Norfloxacin 10 30 S 31 S阿莫西林Amoxicillin 10 17 I 23 S利福平Rifampicin 5 0 R 0 R复方新诺明Cotrimoxazole 1.25 0 R 0 R红霉素Erythrocin 15 25 R 25 R环丙沙星Ciprofloxacin 5 30 S 32 S氯霉素Chloramphenicol 30 10 R 9 R头孢克肟Cefixime 5 17 R 11 R恩诺沙星
创伤弧菌是一类 “机会性”人类病原菌,能引起肠胃炎、败血症等症状,致死率较高。若将携带创伤弧菌的水产品流通,很容易引发大面积的感染。1992年,中国报道了首例由创伤弧菌引起的疾病,创伤弧菌主要通过伤口感染或食用未煮熟的贝类传播,其中食用生海鲜为主要的人类感染途径,如牡蛎Ostrea plicatula、文蛤Meretrixmeretrix、贻贝Mytilus edulis[21]等。曹敏华等[22]的研究显示,仅珠海地区89种海产品中,创伤弧菌的总阳性检出率就达 43.82%,其中牡蛎的检出率达到了60.87%。石亚素等[23]从舟山市区114份海虾样品中检出了23份创伤弧菌样品,检出率为20.18%。以上两位研究者均发现创伤弧菌的检出率呈季节性变化,在4—9月污染率较高,此结果与 Cantet等[24]的研究结果吻合。根据基因型和表型的不同,创伤弧菌可被分为3个生物型:生物性Ⅰ型,为人类病原菌,分布在世界各地;生物性Ⅱ型,能感染鱼和人类,全世界均有分布;生物性Ⅲ型,主要在以色列地区有报道,能引发人类弧菌病[2,25]。由于创伤弧菌的严重危害,该菌在2006年被 《Emerging Infectious Diseases》杂志列入最危险的细菌之列[26]。
本试验中,人工感染试验确认菌株X11XC26有强致病性,LD50为1.70×105CFU/g。感染后的斜带石斑鱼游动缓慢,取濒死鱼解剖观察到肝、肾组织充血肿大。从人工感染发病死亡的石斑鱼体内分离到菌株X11-01,该菌株与X11XC26菌株生理生化特性表现一致,由此可确定菌株X11XC26的致病性。试验中,选取健康斜带石斑鱼验证该菌株的病原性,且能复制出患病珍珠龙趸的典型症状,该试验有效地证实了此次分离到的创伤弧菌的致病性。创伤弧菌具有 “人鱼共患性”,本试验中首次从珍珠龙趸中分离到创伤弧菌,创伤弧菌宿主范围的增大应该得到重视。
本试验中,将mreB-rctB-rpoD-topA基因串联后,与NCBI中登录的创伤弧菌的基因比对,结果显示,菌株X11XC26与菌株Vvyb1的一致性达100%。菌株Vvyb1为生物性Ⅲ型菌株,但菌株X11XC26的生物性型尚需通过测定生物型相关基因才能确定。对16种抗菌药物的敏感性试验结果表明,菌株X11XC26对氧氟沙星、诺氟沙星、环丙沙星、恩诺沙星等4种喹诺酮类药物及阿莫西林敏感,对其余的11种药物不敏感,耐药性强。珍珠龙趸为中国新兴的水产养殖鱼类,但其耐药性极强。抗菌药物在中国水产动物疾病防治中占主要地位,但药物的过度使用易造成细菌的耐药性,同时细菌间相互获得耐药基因也是耐药性产生的重要原因[27-28]。因此,合理且有效使用抗菌药物迫在眉睫,同时,应该找寻其他的途径进行疾病的预防,如中草药的应用[29-30]等。此外,还应研究疾病发生的流行病学和病原菌的耐药机制,寻找其他合理有效的方法预防疾病的发生[31-32]。
参考文献:
[1] Cañigral I,Moreno Y,Alonso JL,et al.Detection of Vibrio vulnificus in seafood,seawater and wastewater samples from a Mediterranean coastal area[J].Microbiological Research,2010,165(8):657-664.
[2] Sanjuán E,González-Candelas F,Amaro C.Polyphyletic origin of Vibrio vulnificus biotype 2 as revealed by sequence-based analysis [J].Applied and Environmental Microbiology,2011,77(2):688-695.
[3] 邢丽萍,周虓.创伤弧菌生物学研究进展[J].中国卫生检验杂志,2011,21(7):1833-1836.
[4] 许斌福,林天龙,董传甫,等.鳗鲡创伤弧菌的分子鉴定[J].中国人兽共患病杂志,2005,21(11):995-997.
[5] 于兰萍,王斌,李艳,等.大菱鲆出血性败血症病原菌的分离与鉴定[J].大连水产学院学报,2008,23(5):335-339.
[6] 马爱敏,闫茂仓,常维山,等.黄姑鱼创伤弧菌的分离和鉴定[J].中国人兽共患病学报,2008,24(10):960-964.
[7] 毕可然,张晓君,梁利国,等.矛尾复虾虎鱼溃疡病病原创伤弧菌的鉴定[J].海洋科学,2011,35(7):20-25.
[8] 姬华,陈艳,刘秀梅,等.创伤弧菌控制措施与风险评估的研究进展[J].食品与发酵工业,2013,39(2):123-127.
[9] 郑石勤.珍珠龙胆 石斑鱼明日之星[J].海洋与渔业,2011 (3):47.
[10] 孟振,刘新富,雷霁霖.略论我国海水鱼类苗种繁育和种质改良的研究[J].渔业信息与战略,2012,27(3):224-231.
[11] 梁华芳,黄东科,吴耀华,等.温度和盐度对龙虎斑存活与摄食的影响[J].广东海洋大学学报,2013,33(4):22-26.
[12] 李样红,韩巍,彭树锋,等.珍珠龙趸高位池养殖技术研究[J].科学养鱼,2013(2):41-42.
[13] 杨少丽,王印庚,董树刚.海水养殖鱼类弧菌病的研究进展[J].海洋水产研究,2005,26(4):75-83.
[14] 吴后波,潘金培.弧菌属细菌及其所致海水养殖动物疾病[J].中国水产科学,2001,8(1):89-93.
[15] 郭泽雄,郑冠雄,沈铭辉,等.珍珠龙胆石斑鱼高位池无公害养殖技术研究[J].科学养鱼,2014(7):42-43.
[16] 陈超,孔祥迪,李炎璐,等.棕点石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代胚胎及仔稚幼鱼发育的跟踪观察[J].渔业科学进展,2014,35(5):135-144.
[17] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[18] Pascual J,Macián M C,Arahal D R,etal.Multilocus sequence analysis of the central clade of the genus Vibrio by using the 16S rRNA,recA,pyrH,rpoD,gyrB,rctB and toxR genes[J].International Journal of Systematic and Evolutionary Microbiology,2010,60(1):154-165.
[19] Cano-Gomez A,Høj L,Owens L,etal.Multilocus sequence analysis provides basis for fastand reliable identification of Vibrio harveyi-related species and reveals previousmisidentification of importantmarine pathogens[J].Systematic and Applied Microbiology,2011,34(8):561-565.
[20] CLSI.Performance standards for antimicrobial susceptibility testing:sixteenth informational supplement[M].Wayne,PA:Clinical and Laboratory Standards Institute,2006.
[21] Espiñeira M,Atanassova M,Vieites JM,et al.Validation of a method for the detection of five species,serogroups,biotypes and virulence factors of Vibrio by multiplex PCR in fish and seafood [J].Food Microbiology,2010,27(1):122-131.
[22] 曹敏华,邝琳,黄琳,等.珠海地区海产品中创伤弧菌污染状况和药敏分析[J].国际检验医学杂志,2014,35(15):2011-2012,2015.
[23] 石亚素,潘军航,张全忠,等.2010年舟山市市售海虾中创伤弧菌的定量检测及其基因分型[J].中国卫生检验杂志,2012,22(8):1848-1849.
[24] Cantet F,Hervio-Heath D,Caro A,et al.Quantification of Vibrio parahaemolyticus,Vibrio vulnificus and Vibrio cholerae in French Mediterranean coastal lagoons[J].Research in Microbiology,2013,164(8):867-874.
[25] Williams T C,Froelich B,Oliver JD.A new culture-basedmethod for the improved identification of Vibrio vulnificus from environmental samples,reducing the need for molecular confirmation [J].Journal ofMicrobiologicalMethods,2013,93(3):277-283.
[26] Chung P H,Chuang S K,Tsang T,et al.Cutaneous injury and Vibrio vulnificus infection[J].Emerging Infectious Diseases,2006,12(8):1302-1303.
[27] 李爱华.水产养殖中使用的抗菌药物及细菌耐药性[J].中国水产科学,2002,9(1):87-91.
[28] 王瑞旋,耿玉静,冯娟,等.杂色鲍哈维弧菌耐药质粒的鉴定和分析[J].南方水产科学,2012,8(2):1-6.
[29] 王瑞旋,方伟彬,郭志勋,等.苍术和番石榴的不同炮制方法及部位对水产病原菌抑制效果的影响[J].南方水产科学,2013,9(5):132-136.
[30] 何爱华,张曦,陶琳丽,等.6种中草药对4种淡水鱼致病菌体外抑菌作用的研究[J].南方水产科学,2011,7(2):73-76.
[31] 田丁,许斌福,林能锋,等.创伤弧菌外膜蛋白免疫刺激复合物对欧洲鳗鲡的免疫保护性分析[J].水生生物学报,2010,34(2):431-435.
[32] 冯立芳,程立斌,何珊珊,等.创伤弧菌物种特异性检测靶标基因的发掘及评价[J].水产学报,2013,37(5):790-800.
Identification and drug sensitivity of a pathogenic Vibrio vulnificus isolated from pearl gentian,a hybrid of brownmarbled grouper Epinephelus fuscoguttatus♀×E.lanceolatus♂
Abstract:A bacterium strain X11XC26 was isolated from pearl gentian,a hybrid of brownmarbled Epinephelus fuscoguttatus♀×E.lanceolatus♂,whose virulence to grouper Epinephelus coioides was confirmed by pathogenicity assays,with LD50of 1.70×105CFU/g in the fishes infected by intraperitoneal injection.The physiological test revealed that it had significantly similar characteristics to Vibrio vulnificus.The phylogenetic analysis of 16S rDNA,rctB,topA,mreB and rpoD genes revealed that the strain X11XC26 showed the high similarity to V.vulnificus.Itwas found that the strain X11XC26 was sensitive to norfloxacin,ofloxacin,ciprofloxacin,enrofloxacin and amoxicilin,and not sensitive to polymyxin K-B.The strain X11XC26 of V.vulnificus isolated for the first time from pearl gentian is not reported until now,and should be paid more attention to its drug resistance.
Key words:pearl gentian;Vibrio vulnificus;drug sensitivity;housekeeping gene
中图分类号:S941.4
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.02.008
文章编号:2095-1388(2016)02-0162-06
收稿日期:2015-06-04
基金项目:国家自然基金青年基金资助项目 (31202027);中国水产科学研究院院级基本科研业务费 (2014KX0604);海南省科技兴海项目 (2015XH03);海南省自然科学基金资助项目 (314179)