表1 玛丽鱼二倍体染色体的计数结果
Tab.1 Chromosom e counts in the d ip loidy sailfin molly Poecilia latipinna
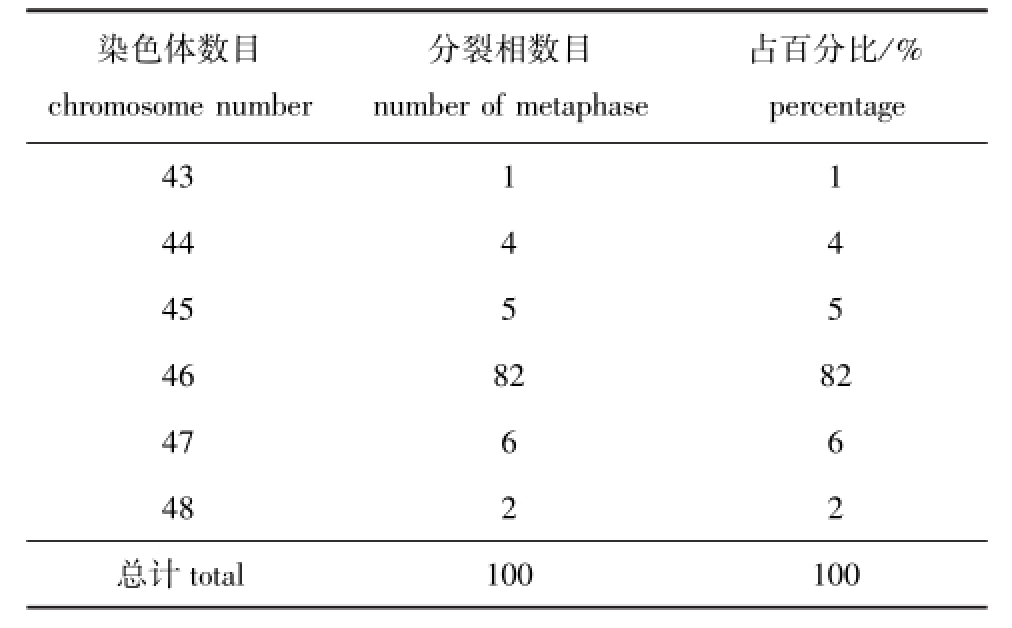
染色体数目chromosome number分裂相数目number ofmetaphase占百分比/% percentage 43 1 1 44 4 4 45 5 5 46 82 82 47 6 6 48 2 2总计total 100 100
摘要:为获得玛丽鱼Poecilia latipinna细胞遗传学数据,以玛丽鱼的鳃丝和鳍条为试验材料,采用秋水仙素浸泡、低渗处理和热滴片法制备染色体标本,分析其染色体的核型和银染 (Ag-NORs)。结果表明:玛丽鱼具有23对染色体,核型2n=46t,NF=46;Ag-NORs出现在t2和t9的染色体末端,其数目具有多态性,未发现性染色体。本研究结果可为研究玛丽鱼的遗传方式提供基础资料。
关键词:玛丽鱼;染色体核型;银染
玛丽鱼 Poecilia latipinna隶属于脊索动物门Chordata、硬骨鱼纲 Osteichthyes、鳉形目 Cyprinodontiformes、花鳉科Cyprinodontidae、花鳉属Poecilia,是一种具有较高经济价值的观赏鱼,原产于北美洲佛罗里达半岛、墨西哥湾和美国北卡罗来纳州大西洋沿海一带,后引进到亚洲,并有多种人工改良品种。玛丽鱼体色多样,有白玛丽、黑玛丽、黄玛丽和杂交后的多色玛丽。雄鱼背鳍竖直,像一张帆,用来引诱雌鱼,其臀鳍已变成棒状结构,用来与雌鱼完成体内受精。玛丽鱼是一种卵胎生鱼,受精与胚胎发育在体内进行,且胚胎发育所需的营养成分主要来自卵本身的养分。玛丽鱼在淡水和半咸水环境中均可栖息生存,耐污能力强,在低溶氧环境中亦可存活,以藻类及其他有机物为食物来源[1]。
目前,国内外对花鳉科其他鱼类的研究较为深入,如剑尾鱼属Xiphophorus的剑尾鱼Xiphophorus helleri和月光鱼Xiphophorusmaculatus。对玛丽鱼的研究主要集中在生理[2]、雄性体长与形态发育[3]、生态[1]、动物行为[4]和分子系统发育[5]等方面,而对其核型组成、Ag-NORs方面的研究尚未见报道。本研究中,对玛丽鱼染色体核型和带型进行了分析,旨在探究玛丽鱼遗传物质的特点,为深入研究其遗传方式提供基础资料。
1.1 材料
试验用玛丽鱼取自北京市观赏鱼市场,将试验鱼带回实验室后养殖于水族箱中,养殖水温为26℃。选取45日龄左右、体长为1~2 cm的幼鱼10尾,剪取鳃丝和鳍条,制备染色体标本;选取3~4月龄的玛丽鱼10尾,只用其鳃丝部分,制备染色体标本。
1.2 方法
1.2.1 染色体标本的制备 参照Haaf等[6]和周丽青等[7]的方法并稍作改进。室温下,将玛丽鱼放入0.01%秋水仙素溶液中6 h,剪取鳃丝和鳍条,在25℃下置于10 mL 0.037 5 mol/L KCl溶液中分别低渗约30、50 min。
将低渗后的鳃丝放入甲醇与冰醋酸 (体积比为9∶1)的固定液中浸泡8 min,再放入纯冰乙酸中浸泡处理1~2 min;用卡诺氏固定液固定2次(每次均为50 min),之后放入冰箱 (4℃)中固定。取蒸馏水和冰乙酸,并按体积比1∶1混合,将固定过的鳃丝放入其中,轻轻摇动,1 min后取出鳃丝,所得液体用于滴片。
将低渗后的鳍条用卡诺氏液固定3次,每次30 min,之后放在冰箱(4℃)中过夜,次日用50%的冰醋酸液处理10min,再用移液枪反复吹打,然后静置,使杂质沉降,吸取上层液体用于滴片。
用加湿器稍微加湿空气 (空气湿度50%),室温下采用热滴片方法,将细胞悬液滴到控温电热板(50~60℃)的干净玻片上,5 min后吸除玻片上残留的液体。
用磷酸盐缓冲液 (pH 7.2)将吉姆萨原液按9∶1的比例稀释成工作液 (现用现配)。取干燥后的染色体标本片染色20 min后取出,用蒸馏水冲洗以去除染液,干燥后即可用于观察分析。
1.2.2 核型分析 使用Olympus BX63型显微镜观察处理后,对染色体标本片进行染色体计数,并选择10个优良分裂相在油镜下摄影。使用 ImageJ 1.48软件对染色体进行测量,并按其特点用VideoTesT-Karyo 3.1染色体核型分析软件进行同源染色体配对,按照Levan等[8]的划分标准进行分类。
1.2.3 银染 参照Howell等[9]的方法略作修改。将制备好的染色体标本片放于洁净培养皿中,并置于60~70℃水浴中,在标本上滴加50%硝酸银与2%明胶 (内含1%甲酸)以2∶1比例混合的混合液,覆盖玻片。2~4min后取出玻片,用预热蒸馏水冲洗,并于干燥后镜检和拍照。
2.1 玛丽鱼鳃丝细胞染色体数目的确定
选取玛丽鱼鳃丝细胞100个中期分裂相染色体,计数确定其染色体数目。结果显示,玛丽鱼染色体的数目在100个中期分裂相中,出现最多的是46,占细胞总数的82% (表1)。因此,可以确定玛丽鱼的染色体数目为2n=46。
表1 玛丽鱼二倍体染色体的计数结果
Tab.1 Chromosom e counts in the d ip loidy sailfin molly Poecilia latipinna

染色体数目chromosome number分裂相数目number ofmetaphase占百分比/% percentage 43 1 1 44 4 4 45 5 5 46 82 82 47 6 6 48 2 2总计total 100 100
2.2 玛丽鱼染色体核型分析
选取染色体分散好且数目完整的中期分裂相10个,测量染色体臂长度,计算其相对长度,得出玛丽鱼染色体形态参数。从表2可知,玛丽鱼染色体二倍体体细胞的46条染色体可配对成23对同源染色体,按Leven等[8]的划分标准,23对染色均为端部着丝粒染色体 (t)。
表2 玛丽鱼染色体对的相对长度、臂比及其分类类型(平均值±标准差)
Tab.2 Relative length,arm ratio and classified types of chrom osome in sailfin molly Poecilia latipinna (mean±S.D.)

染色体序号chromosome pair No.类型type 1 6.62±0.43 ∞相对长度/% relative length臂比arm ratio t 5.57±0.13 ∞ t 3 5.42±0.08 ∞ t 4 5.26±0.11 ∞ t 5 5.16±0.12 ∞ t 6 4.96±0.09 ∞ t 7 4.74±0.04 ∞ t 8 4.66±0.05 ∞ t 9 4.57±0.04 ∞ t 10 4.43±0.04 ∞ t 11 4.39±0.05 ∞ t 12 4.30±0.03 ∞ t 13 4.20±0.05 ∞ t 14 4.13±0.03 ∞ t 15 4.03±0.06 ∞ t 16 3.91±0.09 ∞ t 17 3.82±0.08 ∞ t 18 3.77±0.07 ∞ t 19 3.69±0.05 ∞ t 20 3.66±0.05 ∞ t 21 3.55±0.05 ∞ t 22 2.80±0.50 ∞ t 23 2.37±0.51 ∞2 t
在试验结果中,未发现异型性染色体、次缢痕和随体结构的存在,因此,玛丽鱼的核型公式可表示为2n=46t,且NF=46。根据测量结果,配对玛丽鱼各对同源染色体,即可得玛丽鱼染色体核型图(图1)。试验过程中发现,用同一条鱼细胞制作的染色体标本中,鳃丝比鳍条所呈现的染色体中期分裂相较多。同样是使用鳃丝,幼鱼比成鱼的鳃丝更易获得较多染色体中期分裂相。
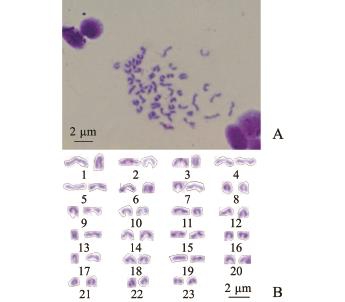
图1 玛丽鱼染色体中期分裂相和染色体核型
Fig.1 M etaphase chromosom es and karyotype of sailfin m olly Poecilia latipinna
2.3 鳃丝细胞银染核型
在玛丽鱼鳃丝细胞的中期分裂相中,Ag-NORs的数量有两种情况 (图2),细胞中有2个Ag-NORs和1个Ag-NORs出现的中期分裂相频率分别为78.8%与21.2%,分别位于t2和t9中的一条染色体上,且银染点出现在染色体靠近着丝粒的末端。
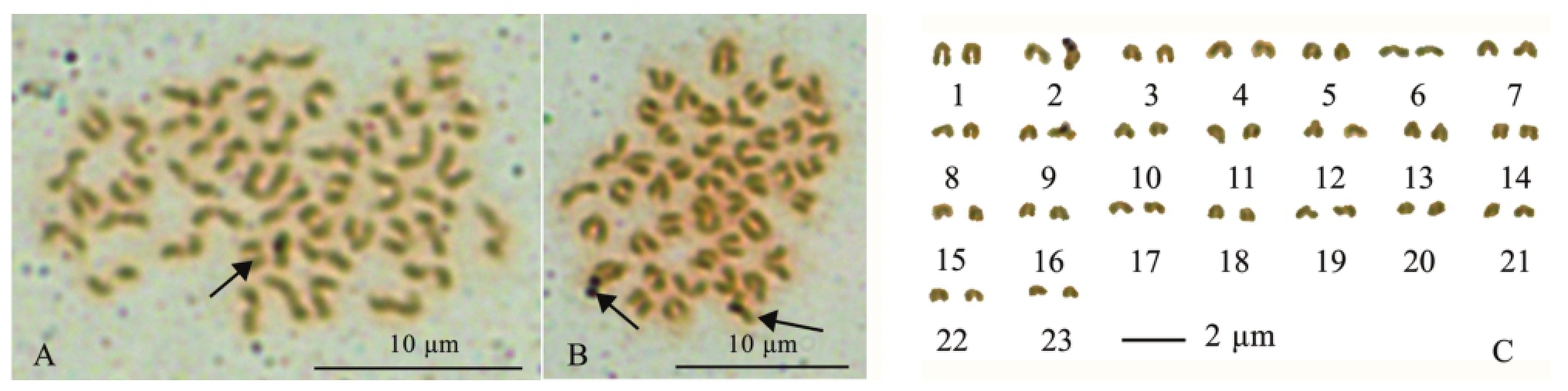
注:A为细胞中具1个Ag-NORs的中期分裂相;B、C分别为细胞中具有2个Ag-NORs的中期分裂相及其核型图 (箭头指银染位点)
Note:A,themetaphase with one Ag-NORs in cells;B,C,themetaphase with two Ag-NORs in cells and its karyotype(arrow showing silver dying sites)
图2 玛丽鱼的Ag-NORs数目
Fig.2 Number of Ag-NORs in sailfin molly Poecilia latipinna
玛丽鱼染色体的Ag-NORs在玛丽鱼间期鳃丝细胞中细胞中数量也存在差异 (图3),数目为1个或2个。细胞中有2个Ag-NORs和1个Ag-NORs出现的频率分别为72.8%与27.2%,含有2 个Ag-NORs的细胞数量明显多于含有1个Ag-NORs的细胞。
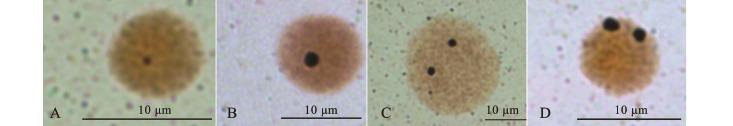
图3 玛丽鱼染色体Ag-NORs之间的相对大小
Fig.3 Dimension of Ag-NORs in sailfin molly Poecilia latipinna
对试验获得的间期核观察可知,玛丽鱼间期核中的NORs呈现大小不一的现象,小的为圆点状,大的类似圆盘状 (图3),但这种差异不大。
本试验中,采用秋水仙素直接浸泡鱼体和热滴片的方法制备染色体标本片,试验准备阶段需将载玻片反复清洗备用。低渗处理时间会影响细胞染色体分裂相,不同鱼类低渗时间差别不大[10]。在滴片过程中,环境温度和湿度对中期分裂相的分散程度影响很大。
3.1 玛丽鱼的核型分析
关于玛丽鱼的核型研究国内外未见报道,国外对花鳉科鱼类核型的研究较多。Nanda等[11]在研究花鳉科鱼类的性染色体过程中,对帆鳍玛丽Poecilia velifera、孔雀鱼 Poecilia reticulata、Poeciliasphenops、剑尾鱼和月光鱼进行了C带显带试验和合成探针的DNA杂交试验。结果表明:帆鳍玛丽具有23对染色体,通过探针杂交试验表明,雌性可能存在W染色体;孔雀鱼含有雄性异性性染色体,共有23对染色体;Poecilia sphenops则是ZZ/ ZW性别决定系统,具有23对染色体;剑尾鱼和月光鱼都是24对染色体且未发现性染色体。本试验中,玛丽鱼的染色体数目为2n=46,其染色体数目与花鳉科的其他鱼类比较接近。在鱼类系统进化上,根据学者对于鱼类演化类群的划分[12-13],玛丽鱼属于高位类鱼类。
3.2 玛丽鱼染色体Ag-NORs
核仁组织者 (NORs)存在于染色体上的次溢痕部位,与物种间亲缘关系联系密切[14]。1977年,Kligerman等[15]最早将Ag-NORs方法用来研究鱼类染色体,之后对鱼类NORs的研究不断深入,国内学者也对多种鲤科鱼类进行了Ag-NORs的研究[16-17]。NORs的数目一般是比较固定的,同一科属中的不同种都可能是一致的。在剑尾鱼的银染试验中发现,其Ag-NORs数量为1~2个,但绝大多数为2个[18]。在很多鱼类中发现,NORs具有多态性,不仅数目具有多态性,而且NORs的位置结构也有不同类型。玛丽鱼和剑尾鱼Ag-NOR的数量很相似,本研究中发现,玛丽鱼NORs显示的数目为1~2个,且2种数目的NORs出现的频率也不相同。
玛丽鱼Ag-NORs的大小也有不同,有点状和圆盘状两种,这也反映出Ag-NORs的结构多态性。银染的面积大小和银染的强弱是由NORs的转录活性决定的,根据染色体上NORs与rDNA之间的对应关系可知,NORs的银染与否以及NORs银染强度均与rDNA的转录活性息息相关,Ag-NORs表现出的多态性在一定程度上反映了rDNA的转录活性[19]。大多数鱼类只含有一对存在Ag-NORs的染色体[20],例如蓝曼龙 Trichogaster trichopterus[21]、布氏石斑鱼Epinephelus bleekeri[22]、麦穗鱼Pseudorasbora parva[19]和六带石斑鱼Epinephelus sexfasciatus[23]等,而且Ag-NORs都是位于一对同源染色体上。玛丽鱼Ag-NORs并非在一对同源染色体上,且t2与t9上的Ag-NORs大小不同,这说明玛丽鱼细胞中这两个NORs转录活性不同。类似的情况也出现在准噶尔雅罗鱼Leuciscusmerzbacheri中,2个Ag-NORs不在一对同源染色体上[24]。由于NORs一般位于次缢痕区域,玛丽鱼染色体中很有可能存在次缢痕,但此结构在玛丽鱼中并未发展到能够分辨的程度。
本试验中并未发现玛丽鱼的性染色体,未来需要通过其他分子生物学手段,进一步探究玛丽鱼是否存在性染色体以及性别决定机制。目前世界各国实验室的模式生物试验用鱼种类包括:斑马鱼、剑尾鱼、青鳉、河鲀等[25],玛丽鱼具有同这些模式生物试验用鱼相似的生物学特性,是潜在的又一模式生物,未来对其基因组的深入研究,将会对动物遗传以及动物进化的研究起到很大帮助。
参考文献:
[1] Kumaraguru Vasagam K P,Rajagopal S,Balasubramanian T.Effect of salinity on gestation period,fry production,and growth performance of the sailfin molly(Poecilia latipinna Lesueur)in captivity [J].Israeli Journalof Aquaculture-Bamidgeh,2005,57(3):191-196.
[2] 郑曙明,陈章宝,贺蓉.甲基睾酮对孔雀鱼、玛丽鱼性逆转的试验[J].四川动物,1997,16(4):183-185.
[3] Snelson Jr F F.Size and morphological variation in males of the sailfin molly,Poecilia latipinna[J].Environmental Biology of Fishes,1985,13(1):35-47.
[4] Farr JA,Travis J,Trexler JC.Behavioural allometry and interdemic variation in sexual behaviour of the sailfin molly,Poecilia latipinna(Pisces:Poeciliidae)[J].Animal Behaviour,1986,34(2):497-509.
[5] Breden F,Ptacek M B,Rashed M,etal.Molecular phylogeny of the live-bearing fish genus Poecilia(Cyprinodontiformes:Poeciliidae)[J].Molecular Phylogenetics and Evolution,1999,12(2):95-104.
[6] Haaf T,Schmid M.An early stage of ZW/ZZ sex chromosome differentiation in Poecilia sphenops var.melanistica(Poeciliidae,Cyprinodontiformes)[J].Chromosoma,1984,89(1):37-41.
[7] 周丽青,杨爱国,柳学周,等.半滑舌鳎染色体核型分析[J].水产学报,2005,29(3):417-419.
[8] Levan A,Fredga K,Sandberg A A.Nomenclature for centromeric position on chromosomes[J].Hereditas,1964,52(2):201-220.
[9] Howell W M,Black D A.Controlled silver-staining of nucleolus organizer regions with a protective colloidal developer:a 1-step method[J].Experientia,1980,36(8):1014-1015.
[10] 刘博,李雅娟,李霞,等.不同倍性泥鳅鳍细胞培养及染色体标本制备方法的研究[J].大连海洋大学学报,2013,28(6):557-562.
[11] Nanda I,Schartl M,Epplen J T,et al.Primitive sex chromosomes in poeciliid fishes harbor simple repetitive DNA sequences[J]. Journal of Experimental Zoology,1993,265(3):301-308.
[12] 余先觉,周曦,李渝成,等.中国淡水鱼类染色体[M].北京:科学出版社,1989.
[13] 杨坤,王子健,祝东梅,等.麦穗鱼的组型分析和DNA含量测定[J].华中农业大学学报,2012,31(3):371-375.
[14] 常重杰,杜启艳,余其兴.泥鳅的 Ag-NORs带和C带研究[J].河南师范大学学报:自然科学版,2000,28(2):71-73.
[15] Kligerman A D,Bloom SE.Distribution of F-bodies,heterochromatin,and nucleolar organizers in the genome of the centralmudminnow,Umbra limi[J].Cytogenet Cell Genet,1977,18(4):182-196.
[16] 周密,康杨,李渝成,等.鲤科七种鱼的银染核型研究[J].动物学研究,1988,9(3):225-229.
[17] 任修海,崔建勋,余其兴.六种鲤科鱼类核仁组织者区的研究[J].遗传,1993,15(4):11-13.
[18] 高文.剑尾鱼和魣鳉的核型及银染带型和C带研究[J].杭州师范学院学报:自然科学版,2004,3(5):408-413.
[19] 杨坤,祝东梅,王卫民.麦穗鱼鳍条组织培养及染色体Ag-NORs和C-带研究[J].南方水产科学,2013,9(3):20-25.
[20] 白文林,马力.Ag-NORs多态性及其在动物遗传育种研究中的应用[J].西南民族学院学报:自然科学版,2000,26(3):324-329.
[21] 陈友铃,吴文珊,汪彦愔.蓝曼龙(Trichogaster trichopterus)的染色体组型、Ag-NORs及C-带型的研究[J].福建师范大学学报:自然科学版,2005,21(2):86-89.
[22] 蔡岩,周永灿,谢瑞敏,等.布氏石斑鱼的染色体核型、银染和C-带[J].水产学报,2012,36(5):647-651.
[23] 吉华松,周永灿,蔡岩,等.六带石斑鱼染色体核型和银染研究[J].水产科学,2011,30(8):463-466.
[24] 王佳君,胡文革,孔磊.准噶尔雅罗鱼染色体核型及带型的初步研究[J].动物学杂志,2010,45(6):120-126.
[25] 龙华,汪登强,陈建武,等.几种实验用鱼的研究现状[J].实验动物与比较医学,2005,25(3):175-181.
Karyotype and Ag-NORs of sailfin molly Poecilia latipinna
Abstract:Themetaphase chromosome spreadingwas conducted in gills and fins cells of sailfinmolly Poecilia latipinna by colchicine-low concentration-hot film drops,and Ag-NORs were analyzed to obtain cytogenetic data of sailfin molly.The results showed that the karyotype of sailfin molly composed of 2n=46t,NF=46.Ag-NORswere found on the end of chromosome No.2 and chromosome No.9,and the Ag-NORs polymorphismswere individually specific,while no sex chromosome was observed in this fish.The findingswill provide reference to genetic pattern of sailfinmolly.
Key words:Poecilia latipinna;karyotype;Ag-NORs
中图分类号:S917.4
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.02.006
文章编号:2095-1388(2016)02-0151-05
收稿日期:2015-06-23
基金项目:中国农业大学科技基金资助项目 (88057007)