翅碱蓬栽培对原油污染土壤理化性质的影响
何洁1、2、3,吉志新3、4,王庆芝1、3,刘长发2,周一兵3、4
(1.大连海洋大学海洋科技与环境学院,辽宁大连116023;2.大连海洋大学辽宁省高校近岸海洋环境科学与技术重点实验室,辽宁大连116023;3.大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁 大连116023;4.大连海洋大学水产与生命学院,辽宁大连116023)
摘要:为研究植物对原油污染土壤的生物修复作用,以中国北方滩涂优势种植物翅碱蓬Suaeda heteroptera为试验对象,将其在含不同原油浓度 (0、4000、8000、12 000、16 000、20 000 mg/kg)的土壤中进行盆栽试验,测定翅碱蓬栽培前后土壤的pH、总有机碳 (TOC)、全氮、全磷含量和脱氢酶活性,分析翅碱蓬对原油污染土壤理化性质的影响。结果表明:翅碱蓬能够降低偏碱土壤的pH值,使之趋近中性,能使土壤TOC值略升高,使脱氢酶活性明显提高,全氮含量明显升高,而低浓度原油试验组土壤全磷含量基本正常。研究表明,翅碱蓬对轻度原油污染土壤有较好的修复功能。
关键词:翅碱蓬;原油;土壤理化性质
在土壤受石油污染日趋严重的情况下,寻求行之有效的修复方式迫在眉睫。在现有修复技术中,生物修复具有费用低、环境影响小、应用范围广、无二次污染的特点,比用物理和化学方法修复更具有发展前途。目前,生物修复技术已由细菌修复拓展到真菌修复、植物修复和微生物-植物联合修复,其中植物修复是首选的方法。长期以来,人们一直在筛选或选育能够促进石油烃分解的植物,希望通过植物种群多样性和植物生长来改善根际土壤微生物的种类和数量,强化对污染石油烃的分解和利用。但是,石油污染环境中存在着很多依赖自然演替而适应污染的植物,如野生狗牙根Cynodon dactylon的生长可增加土壤微生物的种类,改善根际土壤的微环境,修复石油污染土壤[1],它不但能够降低土壤中的石油烃含量[2],而且能够改善土壤中酶的活性[3]。因此,挖掘自然生态系统中能修复石油污染土壤的植物资源显得尤为重要。
翅碱蓬Suaeda heteroptera为一年生草本耐盐植物,是一种优良的耐盐牧草[4]。翅碱蓬的开发和人工种植,有益于盐碱环境的绿化和植被修复,可以消除裸露的盐碱荒地,防止水土流失,维护和挽救濒临破坏的生态系统[5]。同时,翅碱蓬在对原油污染土壤的生物修复方面具有较大潜力,有被用于参与植物修复土壤的趋势[6]。目前,国内外已有原油污染土壤对不同植物生长发育影响的研究,以及个别植物在原油污染土壤中生长对生物修复的作用研究[7]。
本研究中,通过不同浓度原油污染对翅碱蓬生长的影响试验,确定原油对翅碱蓬危害的阈值及性状特征,并通过翅碱蓬对土壤理化性质的改善,研究翅碱蓬对土壤原油污染的耐性、抗性和修复能力,以期为翅碱蓬用于原油污染土壤的修复提供基础数据。
1 材料与方法
1.1 材料
翅碱蓬种子购于山东省东营市农业科学研究所,试验土壤取自大连市旅顺龙王塘海滩,海水为沙滤海水,淡水为自来水,石油取自辽河油田。
1.2 方法
1.2.1 试验设计 取一定量的试验土壤以原油作为暴露污染物,分别按照原油添加量为0、4000、8000、12 000、16 000、20 000 mg/kg(土壤)设置6个原油浓度处理组,分别喷洒在试验土壤中,边喷边搅拌,以保证原油的均匀分布,于室内干湿交替平衡1个月,每个处理组设3个平行。
取上述6种浓度的原油污染土壤各0.2 kg分别置于塑料花盆 (直径为9.5 cm)中,翅碱蓬种子用高锰酸钾消毒后,每盆平均播种1.2 g,约为283粒,记为种植组。同时,在每种浓度原油污染土壤下设置未种植翅碱蓬的对照组。翅碱蓬的培养条件:光暗比为14∶10,光强为8800 lx,土壤盐度为10~16,白天温度为22℃,夜间温度为18℃,相对湿度为75%,每日早晚各浇水一次,每盆分别浇水25 mL(盐度为35),保证含水率为20%~30%。
发芽后第30、60、90、120、150、180天分别测定土壤中的pH值、总有机碳含量;试验第180天时测定土壤中的脱氢酶活性和全氮、全磷含量。
1.2.2 指标的测定 采用玻璃电极-甘汞电极pH计法 (JENCO6010)测定pH值;采用总有机碳分析仪测定土壤的总有机碳 (TOC)含量;分别用氯化三苯基四氮挫 (TTC)比色法、凯氏定氮法(GB 7173-87)、酸溶-钼锑抗比色法 (GB 7853-87)测定土壤的脱氢酶活性和全氮、全磷含量。
2 结果与分析
2.1 翅碱蓬对土壤pH的影响
种植翅碱蓬前后,不同浓度原油污染土壤的pH随浓度和时间的变化如表1所示。从表1可见:相同原油浓度下,种植组土壤pH高于对照组,随着时间的变化,种植组土壤pH整体呈先升高后降低的趋势,这是因为土壤pH受到翅碱蓬根系分泌物及微生物酸碱性的影响,而变化趋势与植物的生长周期有关;同一时间下,不同原油浓度的种植组,随着原油浓度的增加,土壤pH虽有波动但变化不大。
表1 翅碱蓬对不同浓度原油污染土壤pH的影响
Tab.1 Effect of seepweed herb Suaeda heteroptera on pH in the oil polluted soil
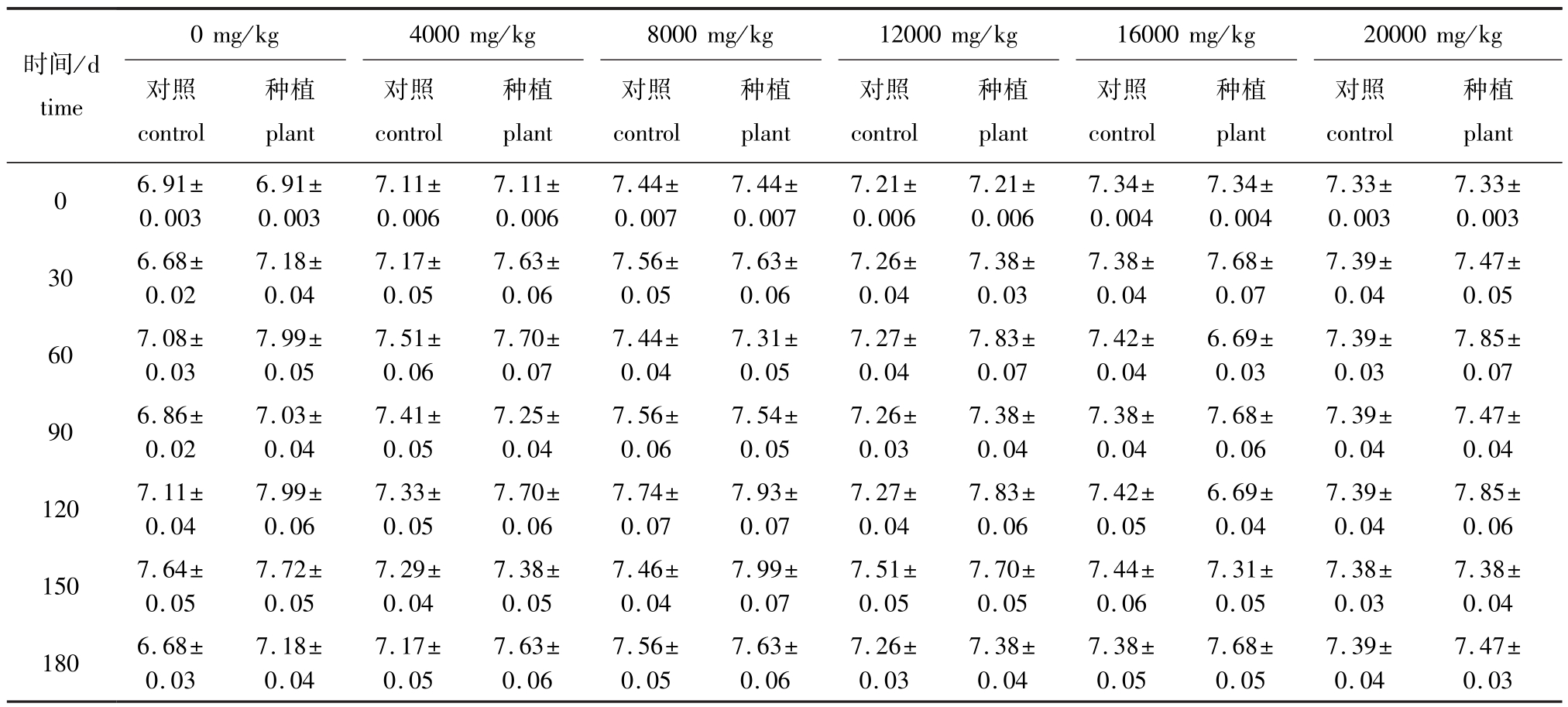
时间/d time 0 mg/kg 4000 mg/kg 8000 mg/kg 12000 mg/kg 16000mg/kg 20000 mg/kg对照control种植plant对照control种植plant对照control种植plant对照control种植plant对照control种植plant对照control种植plant 0 6.91± 0.003 6.91± 0.003 7.11± 0.006 7.11± 0.006 7.44± 0.007 7.44± 0.007 7.21± 0.006 7.21± 0.006 7.34± 0.004 7.34± 0.004 7.33± 0.003 7.33± 0.003 30 6.68± 0.02 7.18± 0.04 7.17± 0.05 7.63± 0.06 7.56± 0.05 7.63± 0.06 7.26± 0.04 7.38± 0.03 7.38± 0.04 7.68± 0.07 7.39± 0.04 7.47± 0.05 60 7.08± 0.03 7.99± 0.05 7.51± 0.06 7.70± 0.07 7.44± 0.04 7.31± 0.05 7.27± 0.04 7.83± 0.07 7.42± 0.04 6.69± 0.03 7.39± 0.03 7.85± 0.07 90 6.86± 0.02 7.03± 0.04 7.41± 0.05 7.25± 0.04 7.56± 0.06 7.54± 0.05 7.26± 0.03 7.38± 0.04 7.38± 0.04 7.68± 0.06 7.39± 0.04 7.47± 0.04 120 7.11± 0.04 7.99± 0.06 7.33± 0.05 7.70± 0.06 7.74± 0.07 7.93± 0.07 7.27± 0.04 7.83± 0.06 7.42± 0.05 6.69± 0.04 7.39± 0.04 7.85± 0.06 150 7.64± 0.05 7.72± 0.05 7.29± 0.04 7.38± 0.05 7.46± 0.04 7.99± 0.07 7.51± 0.05 7.70± 0.05 7.44± 0.06 7.31± 0.05 7.38± 0.03 7.38± 0.04 180 6.68± 0.03 7.18± 0.04 7.17± 0.05 7.63± 0.06 7.56± 0.05 7.63± 0.06 7.26± 0.03 7.38± 0.04 7.38± 0.05 7.68± 0.05 7.39± 0.04 7.47± 0.03
2.2 翅碱蓬对土壤TOC含量的影响
种植翅碱蓬前后不同浓度原油污染土壤的TOC含量随时间和浓度的变化如表2所示。从表2可见:相同原油浓度下,种植组土壤中TOC含量均有随时间的延长总体上呈先升高后降低的趋势,0、4000、8000 mg/kg低浓度原油污染土壤种植组,在试验的前90 d内,土壤TOC含量升高明显,90 d后,TOC含量逐渐降低,12 000、16 000、20 000 mg/kg高浓度原油污染土壤种植组,在试验的前60 d内,TOC含量升高明显,90 d时,略有下降,至120 d时再次升高,之后逐渐下降,其变化趋势与植物的生长周期有关;同一时间下,低浓度原油污染试验组中对照组与种植组TOC含量差别不大,而高浓度原油污染试验组中种植组TOC含量大多高于对照组,说明翅碱蓬对高浓度原油污染土壤的TOC含量有一定的影响。
2.3 翅碱蓬对土壤脱氢酶活性的影响
从表3可见:种植翅碱蓬180 d时,除原油浓度为12 000 mg/kg的种植组土壤脱氢酶活性略低于不种植的对照组外,其余原油浓度下种植组土壤脱氢酶活性均高于对照组,这可能是由于翅碱蓬根系能够分解释放有益于酶类形成的物质,并为酶类的产生提供了必要的条件;除原油浓度为4000 mg/kg的对照组和种植组土壤脱氢酶活性较不加原油的土壤下降外,其他原油浓度组较不加原油的土壤脱氢酶活性均有所升高。脱氢酶活性的升高,有利于对原油组分的降解。
表2 翅碱蓬对不同浓度原油污染土壤TOC含量的影响
Tab.2 Effect of seepweed herb Suaeda heteroptera on total organic carbon content in the oil polluted soil mg/g
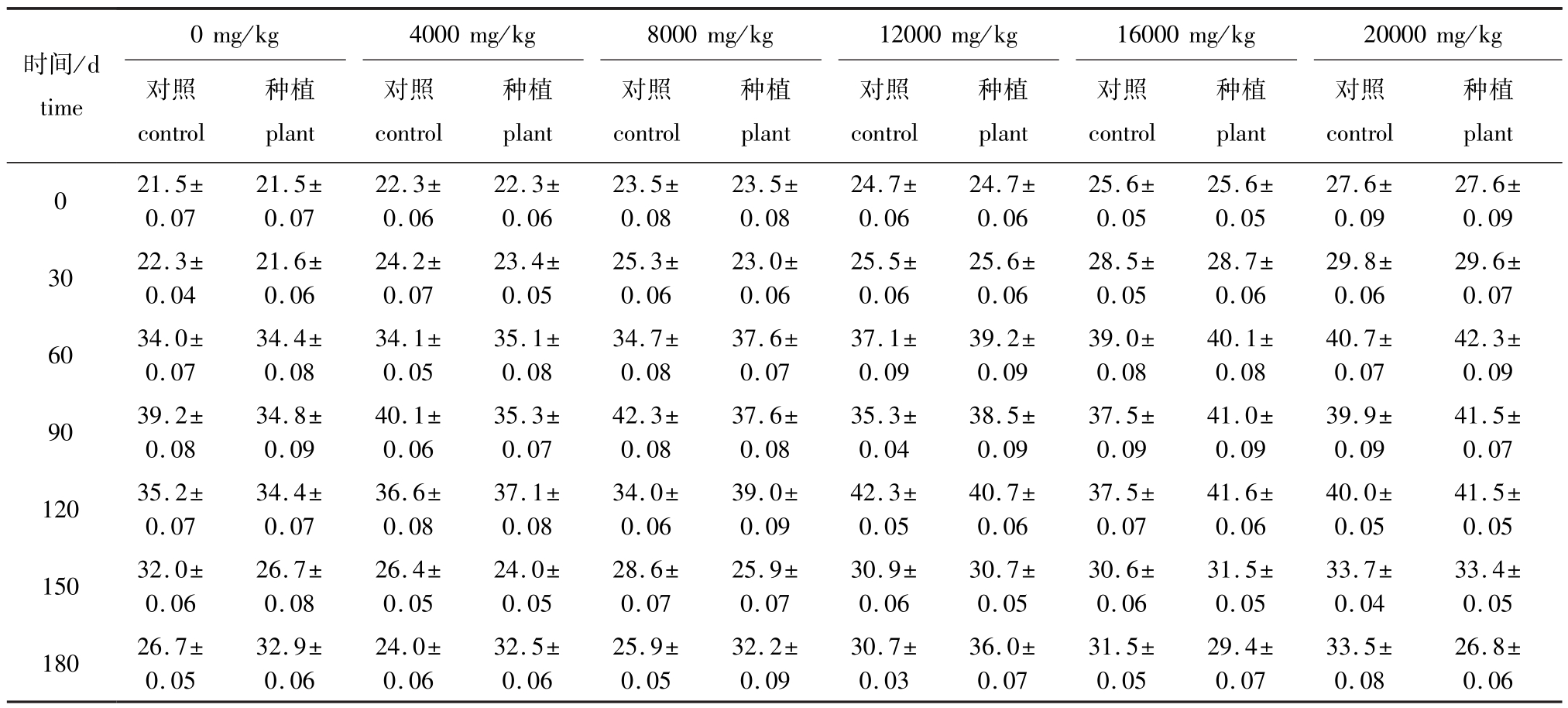
时间/d time 0 mg/kg 4000 mg/kg 8000 mg/kg 12000 mg/kg 16000mg/kg 20000 mg/kg对照control种植plant对照control种植plant对照control种植plant对照control种植plant对照control种植plant对照control种植plant 0 21.5± 0.07 21.5± 0.07 22.3± 0.06 22.3± 0.06 23.5± 0.08 23.5± 0.08 24.7± 0.06 24.7± 0.06 25.6± 0.05 25.6± 0.05 27.6± 0.09 27.6± 0.09 30 22.3± 0.04 21.6± 0.06 24.2± 0.07 23.4± 0.05 25.3± 0.06 23.0± 0.06 25.5± 0.06 25.6± 0.06 28.5± 0.05 28.7± 0.06 29.8± 0.06 29.6± 0.07 60 34.0± 0.07 34.4± 0.08 34.1± 0.05 35.1± 0.08 34.7± 0.08 37.6± 0.07 37.1± 0.09 39.2± 0.09 39.0± 0.08 40.1± 0.08 40.7± 0.07 42.3± 0.09 90 39.2± 0.08 34.8± 0.09 40.1± 0.06 35.3± 0.07 42.3± 0.08 37.6± 0.08 35.3± 0.04 38.5± 0.09 37.5± 0.09 41.0± 0.09 39.9± 0.09 41.5± 0.07 120 35.2± 0.07 34.4± 0.07 36.6± 0.08 37.1± 0.08 34.0± 0.06 39.0± 0.09 42.3± 0.05 40.7± 0.06 37.5± 0.07 41.6± 0.06 40.0± 0.05 41.5± 0.05 150 32.0± 0.06 26.7± 0.08 26.4± 0.05 24.0± 0.05 28.6± 0.07 25.9± 0.07 30.9± 0.06 30.7± 0.05 30.6± 0.06 31.5± 0.05 33.7± 0.04 33.4± 0.05 180 26.7± 0.05 32.9± 0.06 24.0± 0.06 32.5± 0.06 25.9± 0.05 32.2± 0.09 30.7± 0.03 36.0± 0.07 31.5± 0.05 29.4± 0.07 33.5± 0.08 26.8± 0.06
表3 翅碱蓬对不同浓度原油污染土壤脱氢酶活性的影响 (180 d)
Tab.3 Effect of seepweed herb Suaeda heteroptera on dehydrogenase activity in the oil polluted soil(180 d) U/g
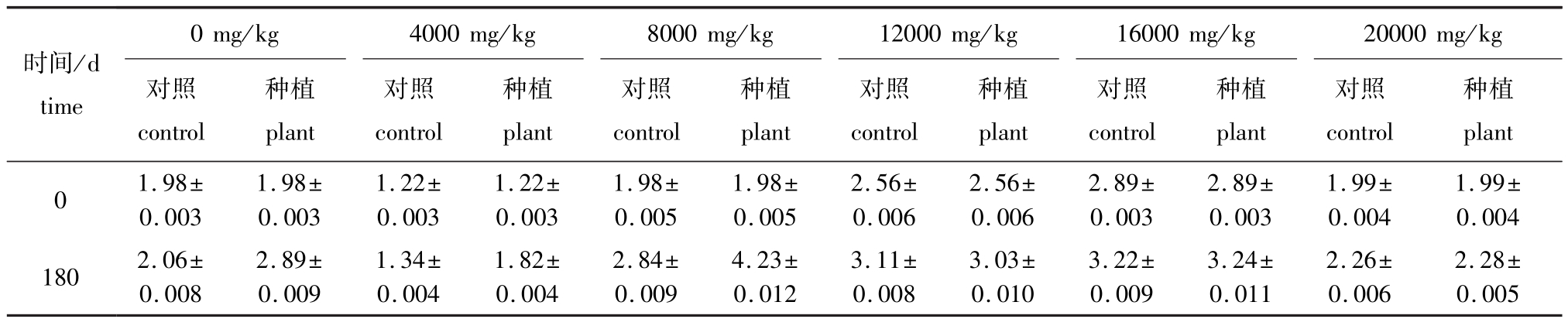
时间/d time 0 mg/kg 4000 mg/kg 8000 mg/kg 12000 mg/kg 16000mg/kg 20000 mg/kg对照control种植plant对照control种植plant对照control种植plant对照control种植plant对照control种植plant对照control种植plant 0 1.98± 0.003 1.98± 0.003 1.22± 0.003 1.22± 0.003 1.98± 0.005 1.98± 0.005 2.56± 0.006 2.56± 0.006 2.89± 0.003 2.89± 0.003 1.99± 0.004 1.99± 0.004 180 2.06± 0.008 2.89± 0.009 1.34± 0.004 1.82± 0.004 2.84± 0.009 4.23± 0.012 3.11± 0.008 3.03± 0.010 3.22± 0.009 3.24± 0.011 2.26± 0.006 2.28± 0.005
2.4 翅碱蓬对土壤全氮含量的影响
从表4可见:种植翅碱蓬180 d时,除原油浓度为12 000 mg/kg的种植组土壤全氮含量低于对照组外,其余原油浓度下种植组土壤全氮含量均高于对照组;随着原油浓度的逐渐增加,翅碱蓬组土壤中的全氮含量呈逐渐升高的趋势,而对照组土壤中全氮含量则呈先升高后下降的趋势,但均高于试验初始值;除原油浓度为4000、8000 mg/kg的种植组外,其余原油浓度种植组土壤全氮含量均较不加原油的土壤有所升高。
表4 翅碱蓬对不同浓度原油污染土壤全氮含量的影响 (180 d)
Tab.4 Effect of seepweed herb Suaeda heteroptera on total nitrogen content in the oil polluted soil(180 d) mg/g
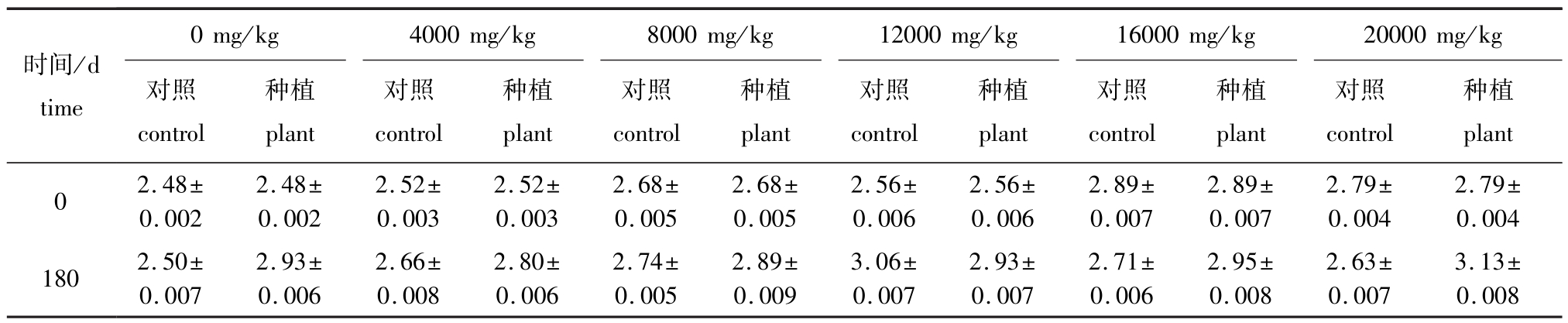
时间/d time 0 mg/kg 4000 mg/kg 8000 mg/kg 12000 mg/kg 16000mg/kg 20000 mg/kg对照control种植plant对照control种植plant对照control种植plant对照control种植plant对照control种植plant对照control种植plant 0 2.48± 0.002 2.48± 0.002 2.52± 0.003 2.52± 0.003 2.68± 0.005 2.68± 0.005 2.56± 0.006 2.56± 0.006 2.89± 0.007 2.89± 0.007 2.79± 0.004 2.79± 0.004 180 2.50± 0.007 2.93± 0.006 2.66± 0.008 2.80± 0.006 2.74± 0.005 2.89± 0.009 3.06± 0.007 2.93± 0.007 2.71± 0.006 2.95± 0.008 2.63± 0.007 3.13± 0.008
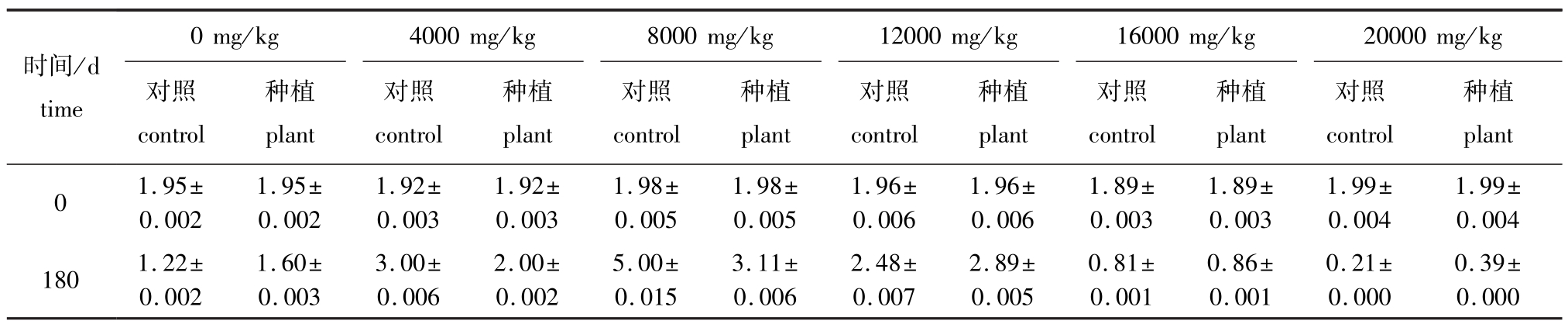
2.5 翅碱蓬对土壤全磷含量的影响
从表5可见:种植翅碱蓬180 d,除原油浓度为4000、8000 mg/kg的种植组土壤全磷含量低于对照组外,其他原油浓度种植组土壤全磷含量均高于对照组,说明在原油浓度低于8000 mg/kg的土壤中,种植翅碱蓬能够保持全磷含量的基本正常,但种植翅碱蓬对高浓度原油污染的土壤则无任何影响。
表5 翅碱蓬对不同浓度原油污染土壤全磷含量的影响 (180 d)
Tab.5 Effect of seepweed herb Suaeda heteroptera on total phosphorus content in the oil polluted soil(180 d) mg/g
时间/d time 0 mg/kg 4000 mg/kg 8000 mg/kg 12000 mg/kg 16000mg/kg 20000 mg/kg对照control种植plant对照control种植plant对照control种植plant对照control种植plant对照control种植plant对照control种植plant 0 1.95± 0.002 1.95± 0.002 1.92± 0.003 1.92± 0.003 1.98± 0.005 1.98± 0.005 1.96± 0.006 1.96± 0.006 1.89± 0.003 1.89± 0.003 1.99± 0.004 1.99± 0.004 180 1.22± 0.002 1.60± 0.003 3.00± 0.006 2.00± 0.002 5.00± 0.015 3.11± 0.006 2.48± 0.007 2.89± 0.005 0.81± 0.001 0.86± 0.001 0.21± 0.000 0.39± 0.000
3 讨论
一般来说,各土壤理化指标相互影响。土壤酸碱度又称土壤反应,它是土壤溶液的酸碱反应,主要取决于土壤溶液中氢离子的浓度,以pH表示。土壤酸碱度一般可分为以下几级:pH<4.5时为极强酸性,pH=4.5~5.5时为强酸性,pH=5.5~6.5时为酸性,pH=6.5~7.5时为中性,pH= 7.5~8.5时为碱性,pH=8.5~9.5时为强碱性,pH>9.5时为极强碱性。
根系分泌物可以改变土壤的pH值,主要原因是根系分泌物中含有氢离子和大量低分子量有机酸,如乳酸、醋酸、甲酸、苹果酸、草酸、丙酮酸等,它们增加了土壤中氢离子的浓度,酸化了根际土壤[8]。由此推断,在翅碱蓬根际环境中会形成一个缓冲体系,调节土壤的pH值,而缓冲体系的调节能力与翅碱蓬的生长周期和原油对植物的毒性有关。本试验中,180 d时翅碱蓬种植组pH维持在7.18~7.68,表明翅碱蓬在本试验条件下,能够调节土壤pH,使之趋近中性。试验中土壤TOC含量变化较大,相同原油浓度下的种植组与对照组,种植组土壤中TOC含量随时间的延长呈先升高后降低的趋势,这与土壤中TOC的来源和翅碱蓬的分泌物及根际微生物有关,而分泌物又与微生物的量及翅碱蓬的生长周期相关。对不同原油浓度的试验组,高浓度原油组 (16 000、20 000 mg/kg)的土壤会刺激翅碱蓬释放更多的分泌物,进一步增加根际微生物总量,故高浓度原油种植组土壤TOC含量低于对照组,而原油的降解也影响土壤TOC含量。
土壤酶在土壤物质循环中发挥着重要的作用,并与多种土壤因子密切相关,能反映土壤品质的变化。土壤酶活性变化受多种因素作用,如土壤酸碱性、pH、可溶性盐等[9],而原油污染的加入,能够改变土壤的理化性质,从而影响脱氢酶活性。原油污染与土壤酶的相互作用可表现在两个方面:(1)原油组分直接与其发生作用,抑制土壤酶的活性;(2)原油组分本身能够直接被酶分解,成为可被微生物利用的营养物质,使土壤中微生物数量增加,酶活性呈现激活效应。即使不能被酶分解,且毒性较大的组分,经过适应变异后,这些微生物将会产生分解酶,使得该组分被分解。实际上,原油组分、酶、土壤微生物之间是相互作用和相互影响的,且土壤酶活性与微生物活性相关[10]。本试验中,不同原油浓度下种植翅碱蓬的各组土壤脱氢酶活性明显高于对照组,说明翅碱蓬根系的存在有益于土壤酶活性的提高。
土壤中的氮、磷、钾营养元素是土壤的重要组成部分,又是生态系统中极其重要的生态因子,能显著影响生态系统的生产力[11]。本试验中,从各试验组氮、磷测定结果来看,氮含量变化不大,而磷含量则随原油浓度有较大波动,原油浓度为8000、12 000 mg/kg的试验组磷含量较高,说明氮和磷作为主要营养元素,与翅碱蓬的生长有关。曾从盛等[12]对闽江口湿地不同土地利用方式下表层土壤氮、磷、钾含量的研究中也曾指出,研究土壤中主要营养元素的分布特征是湿地生态系统地球化学驯化研究的重要基础,有助于植物根际生态系统的研究。土壤有机碳与磷具有相关性,是因为磷的移动性小,主要受有机质和成土母质的共同影响,它和有机质一样,均呈上多下少分布[13]。
综上,种植翅碱蓬试验组的土壤理化性质,如土壤TOC含量、脱氢酶活性、pH等指标能够直接反映土壤的营养指标和生态状况,说明翅碱蓬对改善土壤的理化指标有益。
4 结论
本试验中研究了不同原油浓度污染下,种植翅碱蓬前后土壤的理化性质,包括pH、TOC含量、脱氢酶活性、全氮含量、全磷含量的变化。结果表明:
(1)各浓度原油污染土壤的pH有波动,种植组pH值维持在7.18~7.68之间,表明翅碱蓬在本试验条件下能够调节土壤pH,使之趋近中性。
(2)相同浓度原油污染土壤种植组中TOC含量随时间的增加呈先升高后降低的趋势,外源原油污染对土壤中的TOC含量也有影响,但随着试验的进行,翅碱蓬根际的调节能够使土壤中的原油组分有所变化,土壤TOC含量开始下降。
(3)种植翅碱蓬的试验组土壤中脱氢酶活性明显高于对照组,说明根系的存在有益于脱氢酶活性的保持。
(4)种植翅碱蓬的试验组土壤中全氮含量随原油浓度的升高呈逐渐升高的趋势,种植组土壤中的全氮含量基本上高于对照组,且高于初始值,说明翅碱蓬根系的活动有利于土壤全氮含量的升高。
(5)种植翅碱蓬对低浓度 (≤8000 mg/kg)原油浓度污染土壤,能够保持土壤中全P含量基本正常,但对高浓度 (>8000 mg/kg)原油污染土壤则无任何影响。
参考文献:
[1] 刘继朝,崔岩山,张燕平,等.狗牙根对石油污染土壤的修复效果研究[J].水土保持学报,2009,23(2):166-168.
[2] 岳冰冰,李鑫,任芳菲,等.石油污染对紫花苜蓿的部分生理指标的影响[J].草业科学,2011,28(2):236-240.
[3] 岳冰冰,李鑫,任芳菲,等.石油污染地土壤微生物群落的碳源利用特性[J].应用生态学报,2011,22(12):3259-3264.
[4] 朱兴运,李锋瑞,毛玉林,等.改良硫酸盐盐土的理想牧草[J].中国草业科学,1998(D):45-47.
[5] 张涛,张启鸣.土壤原油污染对两种藜科植物幼苗生长的影响[J].大连教育学院学报,2005,25(1):46-49.
[6] 许崇彦,刘宪斌,刘占广,等.碱蓬对原油烃污染的海岸带修复的初步研究[J].安全与环境学报,2007,7(1):37-39.
[7] 孙清,陆秀君,梁成华.土壤的原油污染研究进展[J].沈阳农业大学学报:自然科学版,2002,33(5):390-393.
[8] 陈龙池,廖利平,汪思龙,等.根系分泌物生态学研究[J].生态学杂志,2002,21(6):57-62.
[9] 王涵,高树芳,罗丹,等.Cd、Pb污染土壤中蛋白酶、酸性磷酸酶、脱氢酶活性的变化[J].农业环境科学学报,2010,29(3):500-505.
[10] 雷海清.克螨特、霸螨灵光降解和对土壤脱氢酶活性影响的研究[D].长沙:湖南农业大学,2003:6-7.
[11] Mitsch W J,Gosselin K J.Wetlands[M].New York:John Wiley &Sone,2000:155-204.
[12] 曾从盛,钟春棋,仝川,等.闽江口湿地不同土地利用方式下表层土壤N、P、K含量研究[J].水土保持学报,2009,23(3):87-91.
[13] 熊汉锋,廖勤周,吴庆丰,等.湖北梁子湖湿地土壤养分的分布特征和相关性分析[J].湖泊科学,2005,17(1):93-96.
Influence of seepweed herb Suaeda heteroptera on physical and chemical properties in soil contaminated by oil
HE Jie1,2,3,JI Zhi-xin3,4,WANG Qing-zhi1,3,LIU Chang-fa2,ZHOU Yi-bing3,4
(1.College of Marine Science and Environment,Dalian Ocean University,Dalian 116023,China;2.Key Laboratory of Nearshore Marine Environmental Science and Technology in Liaoning Province,Dalian Ocean University,Dalian 116023,China;3.Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province,Dalian Ocean University,Dalian 116023,China;4.College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China)
Abstract:Seepweed herb Suaeda heteroptera as a plant in north China was cultivated in soil containing crude petroleum at a rate of 0,4000,8000,12 000,16 000,and 20 000 mg/kg in a pot,and the soil physical and chemical properties including pH,contents of total organic carbon(TOC),total nitrogen,and total phosphorus and dehydrogenase activity were determined 30,60,90,120,150 and 180 days after cultivation to understand the roles of seepweed herb in bioremediation of the soil contaminated by the different concentrations of crude oil.The results showed that the cultivation of seepweed herb led to lower pH,near to neutral,in the slightly alkaline soil,and resulted in promotion of the TOC to a favorable level.In addition,there were significantly higher dehydrogenase activity and total nitrogen content in soil in the experimental groups than those in the control group.Even in the soil in low crude petroleum concentration group,the total phosphorus content was in a normal level,indicating that the seepweed herb has good bioremediation in the soil contaminated lightly by crude oil.
Key words:Suaeda heteroptera;crude oil;soil physical and chemical property
中图分类号:Q93-3
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.01.013
文章编号:2095-1388(2016)01-0075-05
收稿日期:2015-05-26
基金项目:辽宁省自然科学基金资助项目 (2015020616);国家自然科学基金资助项目 (41171389);国家海洋公益性行业科研专项(201305002,201305043);大连海洋大学博士启动基金资助项目 (017027)
作者简介:何洁 (1966—),女,博士,副教授。E-mail:hejie@dlou.edu.cn




