饲料中不同糖源对杂交鲟幼鱼生长性能、血清生化指标和肌肉营养成分的影响
宋娇1,姜海波1,姜志强2,陈立侨3,王庆奎4,袁海文1,杨家和1,姚俊杰1
(1.贵州大学动物科学学院,贵州 贵阳550025;2.大连海洋大学,农业部北方海水增养殖重点实验室,辽宁 大连116023;3.华东师范大学生命科学学院,上海200240;4.天津农学院水产科学系,天津300384)
摘要:为探讨不同糖源对鲟鱼生长、饲料利用、血清生化指标和肌肉营养组成的影响,共配制5种含有不同糖源 (葡萄糖、蔗糖、糊精、玉米淀粉、小麦淀粉)的等氮、等脂试验饲料,饲养初始体质量为(31.88±1.96)g的杂交鲟Acipenser baerii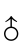 ×Acipenser schrenckii
×Acipenser schrenckii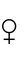 幼鱼8周。结果表明:各试验组的成活率和日摄食率无显著性差异 (P>0.05);葡萄糖组终末体质量、增重率、特定生长率和蛋白质沉积率均显著低于其他各组 (P<0.05),而饲料系数则显著高于其他各组 (P<0.05);糊精组干物质表观消化率和蛋白质表观消化率均为最高,且显著高于葡萄糖组和蔗糖组 (P<0.05),但与玉米淀粉组和小麦淀粉组无显著性差异 (P>0.05);葡萄糖组的血糖、血清胆固醇和血清甘油三酯含量均为最高,其中血糖和血清胆固醇指标显著高于其他各组 (P<0.05),而血清甘油三酯指标则与蔗糖组无显著性差异 (P>0.05),但显著高于其他3个试验组 (P<0.05);糊精组肌糖原含量显著高于其他各组 (P<0.05),而其余各组间则无显著性差异 (P>0.05),糊精组肝糖原含量最低,且显著低于葡萄糖组和小麦淀粉组 (P<0.05);葡萄糖组粗脂肪含量最高,且显著高于其他各组 (P<0.05),小麦淀粉组粗蛋白质含量最高,且显著高于其他各组(P<0.05),但与玉米淀粉组无显著性差异 (P>0.05)。研究表明,在本试验条件下,玉米淀粉和小麦淀粉更适宜作为杂交鲟幼鱼饲料糖源。
幼鱼8周。结果表明:各试验组的成活率和日摄食率无显著性差异 (P>0.05);葡萄糖组终末体质量、增重率、特定生长率和蛋白质沉积率均显著低于其他各组 (P<0.05),而饲料系数则显著高于其他各组 (P<0.05);糊精组干物质表观消化率和蛋白质表观消化率均为最高,且显著高于葡萄糖组和蔗糖组 (P<0.05),但与玉米淀粉组和小麦淀粉组无显著性差异 (P>0.05);葡萄糖组的血糖、血清胆固醇和血清甘油三酯含量均为最高,其中血糖和血清胆固醇指标显著高于其他各组 (P<0.05),而血清甘油三酯指标则与蔗糖组无显著性差异 (P>0.05),但显著高于其他3个试验组 (P<0.05);糊精组肌糖原含量显著高于其他各组 (P<0.05),而其余各组间则无显著性差异 (P>0.05),糊精组肝糖原含量最低,且显著低于葡萄糖组和小麦淀粉组 (P<0.05);葡萄糖组粗脂肪含量最高,且显著高于其他各组 (P<0.05),小麦淀粉组粗蛋白质含量最高,且显著高于其他各组(P<0.05),但与玉米淀粉组无显著性差异 (P>0.05)。研究表明,在本试验条件下,玉米淀粉和小麦淀粉更适宜作为杂交鲟幼鱼饲料糖源。
关键词:杂交鲟;糖源;生长;血清生化指标;肌肉组成
糖是廉价的饲料能量物质,在饲料中添加适宜的糖,不仅可以满足动物机体自身营养代谢的需要,还可以有效地减少蛋白质参与机体能量代谢的比例,起到节约蛋白质的效果[1],并能降低饲料成本,减少鱼体氨氮的排泄,减轻对水体的污染[2]。然而,鱼类对糖的利用能力是有限的,一般认为,草食性鱼类对糖的利用效率最高,杂食性鱼类次之,肉食性鱼类最低。另一方面,不同的鱼类对糖源的利用能力也有一定的差异性,如军曹鱼Rachycentron canadum[3]、 虹 鳟 Oncorhynchus mykiss[4]、罗非鱼 Oreochromis niloticus[5]、大菱鲆Scophthalmus maximus[6]、鲫 Carassius auratus[7]、青鱼Mylopharyngodon piceus[8]等对多糖的利用效率高于单糖。而草鱼Ctenopharyngodon idella[9-10]、大鳞大麻哈鱼Chinook salmon[11]、石斑鱼Epinephelus malabaricus[12]等对单糖和双糖的利用效率则高于多糖。
鲟鱼是中国重要的冷水性养殖鱼类,近年来,随着其亲鱼培育、人工繁育等关键技术持续获得突破,人工养殖技术不断提高,鲟鱼养殖产业获得迅猛发展。然而,与产业飞速发展相比,其饲料营养研究则较为滞后。目前,关于鲟鱼对饲料糖源利用的研究仅针对高首鲟Acipenser transmontanus、中华鲟Acipenser sinensis等品种开展了一些工作,但结果却不尽相同。Hung等[13]认为,高首鲟对单糖的利用能力优于多糖,而这恰好与Lin等[14]、Deng等[15]的研究结论相反,针对中华鲟[16]的研究也发现,其对多糖的利用率较高。当前中国鲟鱼养殖品种达10余种,其中杂交鲟因生长速度快、适应性强和抗病力强等优点,已成为中国鲟鱼养殖产业中的重要支柱品种[17],但目前尚未见有关杂交鲟对不同糖源利用的研究报道。鉴于此,本试验中以杂交鲟Acipenser baeri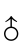 ×Acipenser schrenckii
×Acipenser schrenckii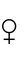 幼鱼为研究对象,以其生长性能、饲料利用、血清生化指标和肌肉营养成分等为评价指标,探讨了其对葡萄糖、蔗糖、糊精、玉米淀粉和小麦淀粉等不同糖源的利用能力,旨在为丰富鲟鱼糖类营养生理研究提供科学依据,为合理优化杂交鲟鱼饲料配方提供指导。
幼鱼为研究对象,以其生长性能、饲料利用、血清生化指标和肌肉营养成分等为评价指标,探讨了其对葡萄糖、蔗糖、糊精、玉米淀粉和小麦淀粉等不同糖源的利用能力,旨在为丰富鲟鱼糖类营养生理研究提供科学依据,为合理优化杂交鲟鱼饲料配方提供指导。
1 材料与方法
1.1 材料
试验用杂交鲟幼鱼购于遵义市绥阳县芙蓉江鲟鱼繁养有限公司,体质量为25~35 g。
1.2 方法
1.2.1 试验饲料的配制 本试验中共配制5种等氮、等脂的试验饲料,分别选择葡萄糖、蔗糖、糊精、玉米淀粉、小麦淀粉为糖源,以鱼粉为蛋白源,混合油脂 (鱼油∶豆油=1∶1)为脂肪源,晶体纤维素为填充成分,羧甲基纤维素钠为黏合剂,并添加0.1%的Y2O3作为指示剂 (表1)。
首先将饲料原料粉碎后过60目筛,按配方称重后混合50 min,然后加入油脂混合30 min,加水混合30 min,最后使用螺杆挤压机制成直径为2 mm的颗粒饲料,于通风阴凉处风干至水分含量小于10%后,保存于冰箱 (-20℃)中备用。
1.2.2 试验设计及养殖管理 将试验幼鱼暂养在贵州大学动物科学学院水产养殖实验室的40个室内流水聚乙烯养殖水槽中,水槽容积为300 L,水源为经充分曝气的河水,暂养1周后,称重,将幼鱼随机分配到20个有效体积为250 L的水槽中,每个水槽放10尾幼鱼,投喂不同试验饲料,每组饲料设4个重复。
试验阶段每天投喂2次 (8:00、17:00),饱食投喂,投喂1 h后收集残饵,烘干称重,用于计算摄食量。粪便样品于收集残饵后开始收集,时间为第2周至第7周,将收集的粪便样品烘干,保存于冰箱 (-20℃)中备用。每日早晨投饵前清除水槽内粪便,饲养周期为8周。试验采取流水养殖方式,水温为18~20℃,溶解氧大于5 mg/L,氨氮小于0.05 mg/L,pH为7.6~8.4,自然光照。1.2.3 样品的采集及指标的测定
(1)样品的采集。饲养试验结束后,于采样前将幼鱼饥饿24 h,称重,用于计算增重率、特定生长率、饲料系数等指标。从每个养殖水槽随机取5尾幼鱼,用MS-222麻醉后,从每尾鱼的尾静脉采血,血液于离心机中以2000 r/min离心10 min,取上清液迅速用液氮冷冻并置于超低温冰箱 (-80℃)中保存,用于测定血清生化指标。采血完成后,解剖鱼体取其背部肌肉、肝脏,迅速用液氮冷冻并置于超低温冰箱 (-80℃)中保存,用于测定其肌肉营养成分和肌糖原、肝糖原等指标。
表1 不同糖源的试验饲料配方及其一般营养成分 (干物质)
Tab.1 Ingredients and proximate compositions of experimental diets(dry matter) w/%

注:1)其他包括鱼粉 60%、鱼油 1.5%、豆油 1.5%、氯化胆碱 0.11%、羧甲基纤维素钠 3%、微晶纤维素 7.35%、维生素预混料0.44%、矿物质预混料6%、三氧化二钇0.1% 2)维生素预混料及矿物质预混料含量见文献 [18]
Note:1)Other ingredients include 60%fish meal,1.5%fish oil,1.5%soybean oil,0.11%choline chloride,3%carboxymethyl cellulose,7.35%microcrystalline cellulose,0.44%vitamin premix,6%mineral premix,and 0.1%yttrium oxide 2)Vitamin and mineral premix content is shown in reference[18]
组别group原料ingredient葡萄糖glucose蔗糖sucrose糊精dextrin玉米淀粉corn starch小麦淀粉wheat starch其他1)other营养成分proximate composition水分moisture灰分ash粗蛋白质crude protein粗脂肪crude lipid葡萄糖glucose 2080 7.41 14.47 35.88 10.12蔗糖sucrose 20 80 6.27 13.83 36.03 9.40糊精dextrin 20 80 7.34 14.07 36.65 9.33玉米淀粉corn starch 20 80 7.74 14.14 36.73 9.89小麦淀粉wheat starch 20 80 7.60 14.44 36.21 9.93
(2)样品的分析。饲料、肌肉和粪便样品的常规营养成分分析采用AOAC(1995)[19]方法,采用105℃烘干恒重法测定水分含量,采用凯氏定氮法(FOSS,Kjeltec 2200,Denmark)测定粗蛋白质含量,采用索氏抽提法 (FOSS,SoxtecTM2043,Denmark)测定粗脂肪含量,采用550℃高温灼烧法测定粗灰分含量,采用电感耦合等离子体发射光谱仪 (ICP-OES,VISTA-MPX,VARIAN,USA)测定指示剂Y2O3的含量,采用南京建成生物工程研究所生产的试剂盒测定糖原含量和血清葡萄糖、甘油三酯、胆固醇含量,具体操作方法参照说明书,所有分析均进行4次重复。
(3)指标的计算。生长性能、饲料利用和试验饲料营养组分表观消化率等相关指标的计算公式如下:
增重率(WGR)=(Wf-Wi)/Wi×100%,
成活率(SR)=Nf/Ni×100%,
特定生长率(SGR)=(ln Wf-ln Wi)/t×100%,
饲料系数(FCR)=(Wt-Wr)/(W2+Wd-W1),
日摄食率(DFI)=(Wt-Wr)/[(W1+W2+Wd)/ 2]/t×100%,
蛋白质沉积率(PDR)=(Wf×Pf-Wi×Pi+Wd× Pi)/P×100%,
干物质表观消化率(ADC)=(1-饲料中Y2O3含量/粪便中Y2O3含量)×100%,
粗蛋白质表观消化率(ADC)=[1-(饲料中Y2O3含量×粪便中粗蛋白质含量)/(粪便中Y2O3含量×饲料中粗蛋白质含量)]×100%。
其中:Wi、Wf分别为试验初始、终末鱼体平均质量 (g);Ni、Nf分别为试验初始、终末存活鱼尾数;t为试验时间 (d);W1、W2分别为试验初始、终末鱼体总质量 (g);Wt为试验期间投入饲料质量(g);Wr为残饵料质量 (g);Wd为死亡鱼体总质量 (g);Pi、Pf分别为鱼体初始、终末蛋白质质量(g);P为试验期间总蛋白质摄入质量 (g)。
1.3 数据处理
试验数据以平均值±标准差 (mean±S.D.)表示,采用 SPSS 17.0软件进行单因素方差分析(One-Way ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同糖源组杂交鲟幼鱼的生长性能
从表2可见,饲料中添加不同糖源,各组杂交鲟幼鱼的存活率、日摄食率均无显著性差异 (P>0.05);葡萄糖组的终末平均体质量、增重率、特定生长率均最低,且显著低于其他各组 (P<0.05),而其他组间则无显著性差异 (P>0.05);葡萄糖组饲料系数最高,且显著高于其他各组(P<0.05),而其他组间则无显著性差异 (P>0.05);葡萄糖组蛋白质沉积率也是最低,且显著低于其他各组 (P<0.05),蔗糖组次之,虽与小麦淀粉组无显著性差异 (P>0.05),但显著低于糊精组和玉米淀粉组 (P<0.05),而糊精组、玉米淀粉组和小麦淀粉组组间无显著性差异 (P>0.05)。
表2 不同糖源对杂交鲟幼鱼生长和饲料利用的影响
Tab.2 Effects of different carbohydrates on growth performance and feed utilization of juvenile hybrid sturgeon
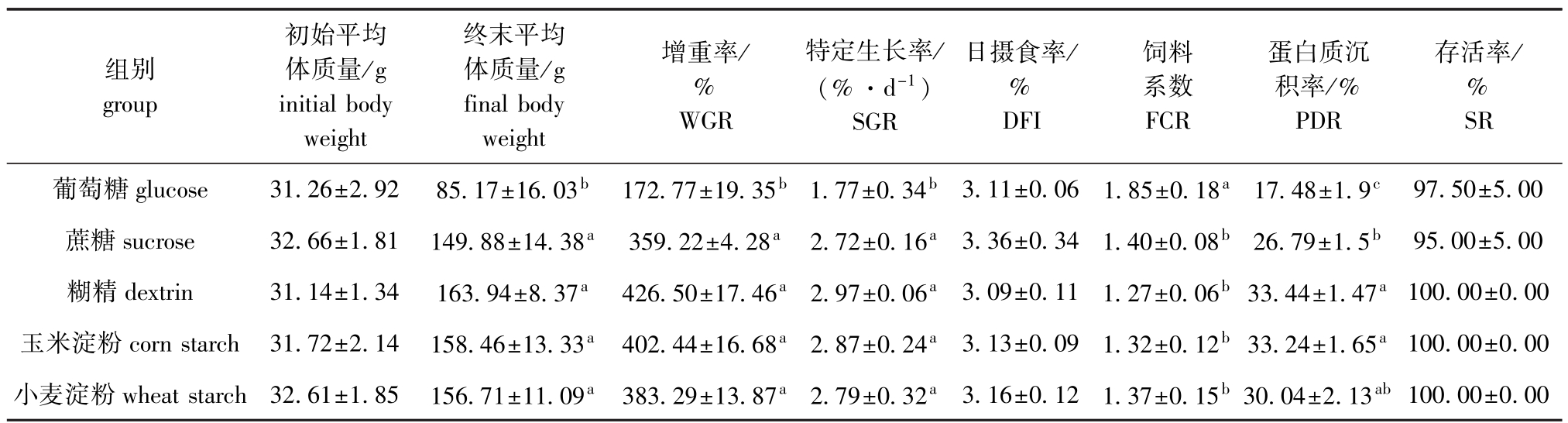
注:同列中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同
Note:The means with different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia
组别group初始平均体质量/g initial body weight终末平均体质量/g final body weight增重率/ % WGR特定生长率/ (%·d-1)SGR日摄食率/ % DFI饲料系数FCR蛋白质沉积率/% PDR存活率/ % SR葡萄糖glucose 31.26±2.92 85.17±16.03b 172.77±19.35b 1.77±0.34b 3.11±0.06 1.85±0.18a 17.48±1.9c97.50±5.00蔗糖sucrose 32.66±1.81 149.88±14.38a 359.22±4.28a 2.72±0.16a 3.36±0.34 1.40±0.08b 26.79±1.5b 95.00±5.00糊精dextrin 31.14±1.34 163.94±8.37a 426.50±17.46a 2.97±0.06a 3.09±0.11 1.27±0.06b33.44±1.47a100.00±0.00玉米淀粉corn starch 31.72±2.14 158.46±13.33a 402.44±16.68a 2.87±0.24a 3.13±0.09 1.32±0.12b33.24±1.65a100.00±0.00小麦淀粉wheat starch 32.61±1.85 156.71±11.09a 383.29±13.87a 2.79±0.32a 3.16±0.12 1.37±0.15b30.04±2.13ab100.00±0.00
2.2 不同糖源组杂交鲟幼鱼消化率的变化
从表3可见:糊精组的干物质表观消化率和蛋白质表观消化率均为最高,与玉米淀粉组和小麦淀粉组无显著性差异 (P>0.05),但均显著高于葡萄糖组和蔗糖组 (P<0.05);葡萄糖组干物质和粗蛋白质表观消化率均为最低,其中干物质表观消化率显著低于糊精组和玉米淀粉组 (P<0.05),粗蛋白质表观消化率显著低于其他各组 (P<0.05)。
表3 杂交鲟幼鱼对不同糖源饲料干物质和粗蛋白质的表观消化率的影响
Tab.3 Effects of different carbohydrates on apparent digestibility coefficients(ADC)of dry matter and protein in juvenile hybrid sturgeon %
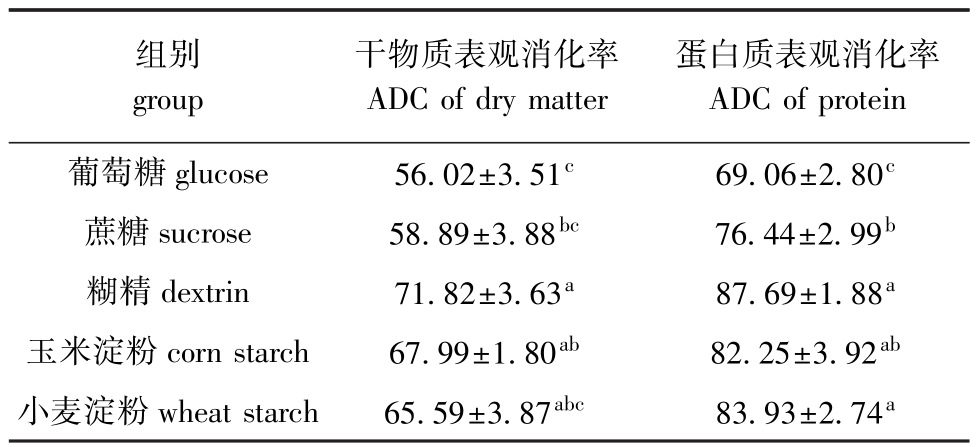
组别group干物质表观消化率ADC of dry matter蛋白质表观消化率ADC of protein葡萄糖glucose 56.02±3.51c 69.06±2.80c蔗糖sucrose 58.89±3.88bc 76.44±2.99b糊精dextrin 71.82±3.63a 87.69±1.88a玉米淀粉corn starch 67.99±1.80ab 82.25±3.92ab小麦淀粉wheat starch 65.59±3.87abc 83.93±2.74a
2.3 不同糖源组杂交鲟幼鱼血清生化指标的变化
从表4可见:各试验组血清生化指标中,葡萄糖组血糖浓度最高,且显著高于其他组 (P<0.05),而小麦淀粉组最低,显著低于其他组 (P<0.05);葡萄糖组血清甘油三酯含量最高,虽与蔗糖组无显著性差异 (P>0.05),但显著高于其他3 组 (P<0.05),玉米淀粉组最低,虽与糊精组无显著性差异 (P>0.05),但显著低于其他各组 (P<0.05);葡萄糖组血清总胆固醇含量最高,且显著高于其他各组 (P<0.05),其次为糊精组和小麦淀粉组,两组间无显著性差异 (P>0.05),蔗糖组最低,且显著低于其他各组 (P<0.05)。
表4 不同糖源对杂交鲟幼鱼血清生化指标的影响
Tab.4 Effects of different carbohydrates on haematological parameters of juvenile hybrid sturgeon mmol/L
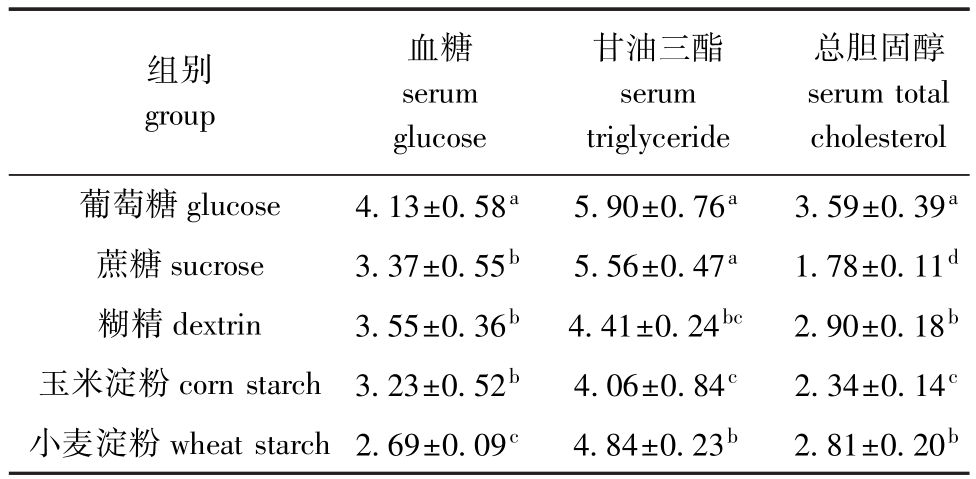
组别group血糖serum glucose甘油三酯serum triglyceride总胆固醇serum total cholesterol葡萄糖glucose 4.13±0.58a 5.90±0.76a 3.59±0.39a蔗糖sucrose 3.37±0.55b 5.56±0.47a 1.78±0.11d糊精dextrin 3.55±0.36b 4.41±0.24bc 2.90±0.18b玉米淀粉corn starch 3.23±0.52b 4.06±0.84c 2.34±0.14c小麦淀粉wheat starch 2.69±0.09c 4.84±0.23b 2.81±0.20b
2.4 不同糖源组杂交鲟幼鱼糖原含量的变化
从表5可见:糊精组肌糖原含量最高,且显著高于其他各组 (P<0.05),其他组间则无显著性差异 (P>0.05),玉米淀粉组最低;葡萄糖组肝糖原含量最高,虽与小麦淀粉组无显著性差异 (P>0.05),但显著高于其他3组 (P<0.05),而糊精组最低,且显著低于葡萄糖组和小麦淀粉组 (P<0.05)。
表5 不同糖源对杂交鲟幼鱼糖原的影响
Tab.5 Effects of different carbohydrates on glycogen contents in muscle and liver of juvenile hybrid sturgeon mg/g
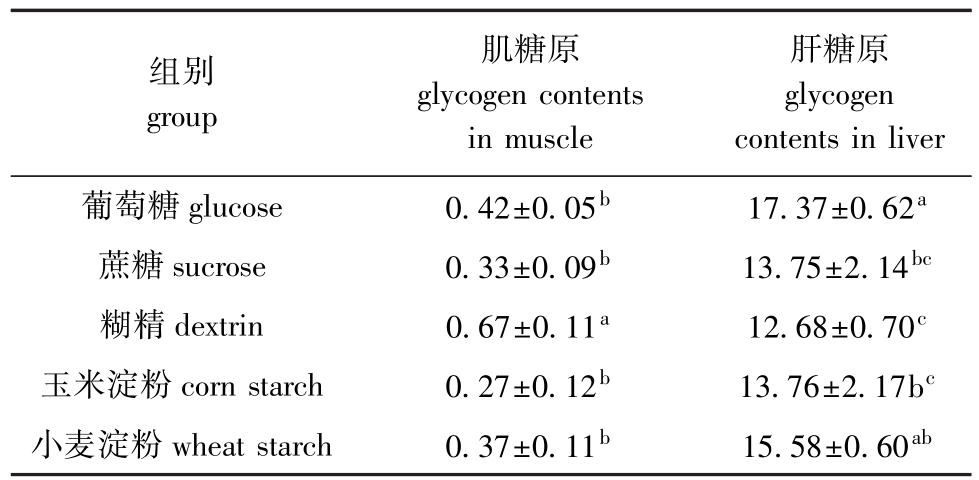
组别group肌糖原glycogen contents in muscle肝糖原glycogen contents in liver葡萄糖glucose 0.42±0.05b 17.37±0.62a蔗糖sucrose 0.33±0.09b 13.75±2.14bc糊精dextrin 0.67±0.11a 12.68±0.70c玉米淀粉corn starch 0.27±0.12b 13.76±2.17bc小麦淀粉wheat starch 0.37±0.11b 15.58±0.60ab
2.5 不同糖源组杂交鲟幼鱼肌肉营养成分的变化
从表6可见:饲喂不同糖源的杂交鲟幼鱼,各组间水分和粗灰分含量无明显差异 (P>0.05);小麦淀粉组粗蛋白质含量最高,且显著高于葡萄糖组、蔗糖组和糊精组 (P<0.05),而与玉米淀粉组无显著性差异 (P>0.05),玉米淀粉组粗蛋白质含量次之,虽与糊精组无显著性差异 (P>0.05),但显著高于葡萄糖组和蔗糖组 (P<0.05);葡萄糖组粗脂肪含量最高,且显著高于其他各组 (P<0.05),而其他组间则无显著性差异 (P>0.05)。
表6 不同糖源对杂交鲟幼鱼肌肉营养成分的影响 (干基)Tab.6 Effects of different carbohydrates on the proximate
chemical composition in juvenile hybrid sturgeon (dry weight basis) w/%
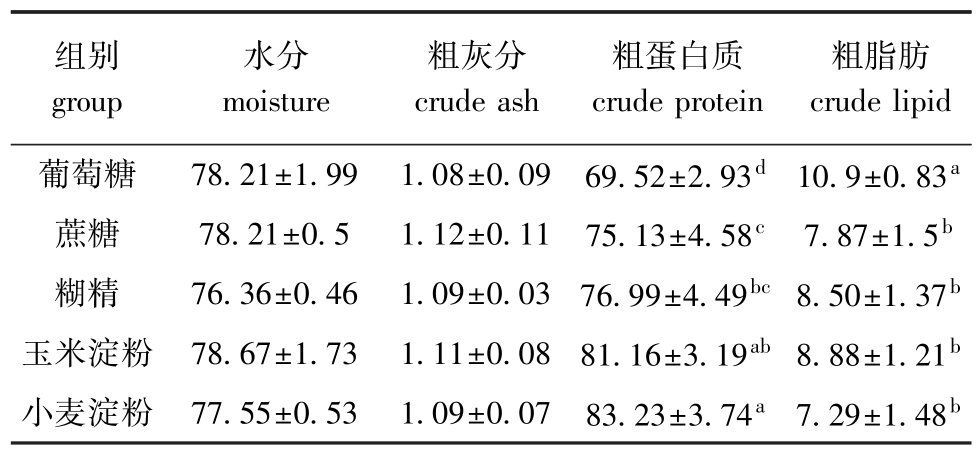
组别group水分moisture粗灰分crude ash粗蛋白质crude protein粗脂肪crude lipid葡萄糖 78.21±1.99 1.08±0.09 69.52±2.93d 10.9±0.83a蔗糖 78.21±0.5 1.12±0.11 75.13±4.58c 7.87±1.5b糊精 76.36±0.46 1.09±0.03 76.99±4.49bc8.50±1.37b玉米淀粉 78.67±1.73 1.11±0.08 81.16±3.19ab8.88±1.21b小麦淀粉 77.55±0.53 1.09±0.07 83.23±3.74a7.29±1.48b
3 讨论
3.1 不同糖源对杂交鲟幼鱼生长的影响
不同鱼类对糖源的选择与利用具有较大的差异性,一般分为三类:第一类,利用大分子糖的效果优于小分子糖类[9,15,20], 如大菱鲆[6]、 青鱼[7-8]、鲫[7]、军曹鱼[3-4];第二类,利用小分子糖的效果优于大分子糖类,如大鳞大麻哈鱼[11]、草鱼[9-10]、点带石斑鱼[12];第三类,鱼类对糖源的利用效果与糖分子大小无关,如罗非鱼[21]。
关于鲟鱼对不同糖源的利用研究,国内外学者的研究结果呈现一定的差异,主要表现为两种情况。第一类:如周俊[16]利用含不同糖源的饲料饲喂中华鲟幼鱼,结果发现,其对糊精、淀粉类糖源的利用优于葡萄糖;Deng等[15]使用马铃薯淀粉和葡萄糖作为高首鲟饲料糖源,经过8周养殖试验,结果显示,马铃薯淀粉组幼鱼生长性能更佳;Lin等[14]研究了不同投喂模式下高首鲟对不同糖源的利用效率,结果显示,相同投喂模式下淀粉组鲟鱼的生长性能均优于葡萄糖组。第二类:如 Hung等[13]研究发现,选择葡萄糖比淀粉更适宜作为高首鲟饲料糖源;随后Hung等[22]进一步研究发现,高首鲟对饲料糖源的利用能力依次为葡萄糖>麦芽糖>蔗糖=糊精=玉米淀粉>半乳糖=果糖=纤维素。本试验结果显示,多糖组 (糊精组、玉米淀粉组和小麦淀粉组)幼鱼的生长性能和饲料利用相关指标更佳,表明杂交鲟幼鱼对糖源的利用能力属于上述第一类情况,即利用大分子糖的效果优于小分子糖,这可能是由于不同鱼类的生理特性和吸收利用能力不同所致。对于大分子糖利用能力较好的鱼类来说,饲料葡萄糖吸收过快,导致无法及时有效利用,造成高血糖应激,从而影响了鱼类生长。多糖在被鱼体吸收之前需要酶的水解过程,从而缓解了吸收速度,使鱼体有足够时间调节糖代谢酶系对糖的分解转化速率,这种持续而温和的诱导作用可能更好地促使鱼类生长[23]。而草鱼等鱼类摄入葡萄糖后,鱼体能够很快的将其氧化,分解为CO2,释放ATP,有利于机体氨基酸的活化和蛋白质的合成,促进鱼体生长,表现为利用小分子糖的能力较好[24]。当鱼类的吸收利用能力无明显差异时,则表现为对糖源的利用与糖分子大小无关。
3.2 饲料中不同糖源对杂交鲟幼鱼干物质和粗蛋白质表观消化率的影响
本试验结果表明,糊精组幼鱼干物质和蛋白质表观消化率均为最高,但与玉米淀粉组和小麦淀粉组无显著性差异 (P>0.05),而葡萄糖组上述两项指标则为最低。这一结果与对条纹鲈Morone saxatilis[25]、军曹鱼[4]等鱼类的研究结论相似。Rawles等[25]在条纹鲈日粮中分别添加葡萄糖和糊精作为糖源,结果表明,葡萄糖组蛋白质表观消化率显著低于糊精组 (P<0.05)。任鸣春[4]报道,军曹鱼葡萄糖组干物质和粗蛋白质表观消化率均低于淀粉组。这可能是由于葡萄糖是单糖,摄食后不需要消化,在短时间内大量吸收,占据了消化道内壁大量吸收位点,从而影响鱼类对氨基酸的吸收[7]。
3.3 不同糖源对杂交鲟幼鱼血清生化指标的影响
本试验结果显示,杂交鲟幼鱼血糖浓度受到糖源种类的影响显著,葡萄糖组血糖浓度最高,且显著高于其他各组 (P<0.05)。这与对军曹鱼[3]、杂交鲈M.Chrysops ×M.saxatilis
×M.saxatilis [26]、罗非鱼Oreochromis niloticus×O.aureus[27]、团头鲂Megalobrama amblycephala[28]等鱼类的研究结论相似。对于鲟鱼来说,Deng等[29]研究发现,高首鲟口服等量的葡萄糖、麦芽糖、玉米糊精、马铃薯糊精、玉米淀粉和土豆淀粉,血糖浓度最高的组为葡萄糖组。鱼类对淀粉等大分子糖类需要进行消化降解成葡萄糖后才能被吸收,而小分子的单糖则会被较快吸收,此时胰岛素分泌速度又无法跟上鱼类对糖的吸收速度,使吸收的葡萄糖不能被很好地利用,进而表现出持久的高血糖[29]。
[26]、罗非鱼Oreochromis niloticus×O.aureus[27]、团头鲂Megalobrama amblycephala[28]等鱼类的研究结论相似。对于鲟鱼来说,Deng等[29]研究发现,高首鲟口服等量的葡萄糖、麦芽糖、玉米糊精、马铃薯糊精、玉米淀粉和土豆淀粉,血糖浓度最高的组为葡萄糖组。鱼类对淀粉等大分子糖类需要进行消化降解成葡萄糖后才能被吸收,而小分子的单糖则会被较快吸收,此时胰岛素分泌速度又无法跟上鱼类对糖的吸收速度,使吸收的葡萄糖不能被很好地利用,进而表现出持久的高血糖[29]。
甘油三酯和总胆固醇统称为血脂,虽然它们只占全鱼脂类极少的一部分,但是它转运于各组织之间,在代谢上十分活跃,可反映出鱼体内脂质代谢的情况[29]。关于糖源对血脂的影响,国内外众多学者均进行了相关研究,吴彬等[21]对罗非鱼的研究显示,胆固醇含量不受糖源的影响,而甘油三酯则受到明显的影响,其中葡萄糖组甘油三酯含量最低。苗淑彦等[6]则发现,大菱鲆幼鱼总胆固醇和甘油三酯均受糖源的影响,整体来说,糊精组总胆固醇和甘油三酯含量均高于葡萄糖组。Deng等[15]对高首鲟进行研究时发现,淀粉组血清甘油三酯含量高于葡萄糖组。然而,本研究结果与以上研究均有所差异,本研究结果显示,葡萄糖组总胆固醇和甘油三酯含量均高于其他各组。甘油三酯和胆固醇合成所需的碳骨架和还原性物质均来自于糖酵解过程的产物乙酰辅酶A和NADPH,杂交鲟摄食含葡萄糖饲料后,鱼体血糖含量明显升高,进而导致组织中的碳水化合物含量增加,这刺激了鱼体的糖酵解过程,由此产生大量的乙酰辅酶A和NADPH,进而转化为甘油三酯和总胆固醇的合成[30]。同时鱼的种类不同可能是产生该结果的另一原因,但仍有待于进一步深入研究。
3.4 不同糖源对杂交鲟幼鱼糖原含量的影响
糖原作为机体的能量储存物质,主要存在于肌肉与肝脏中[31]。本试验结果表明,葡萄糖组幼鱼肝糖原含量显著高于蔗糖组、糊精组和玉米淀粉组(P<0.05)。这与对鲫[32]、大菱鲆[6]等鱼类的研究结论相似。这可能是由于当鱼类摄食含葡萄糖饲料后,葡萄糖能较快地被吸收,血糖含量迅速提升,但胰岛素的分泌速度却无法与之相适应,使吸收的葡萄糖不能很好地被利用,最后多余的葡萄糖则以糖原的形式储存在于肝脏中[6]。对于肌糖原而言,糊精组肌糖源含量显著高于其他组 (P<0.05),其他组间无显著性差异 (P>0.05),说明糊精在肌肉中沉积、转换为脂肪的效率最高。然而,大菱鲆幼鱼[6]肌糖原含量却并未受到显著影响,这可能是由鱼的种类差异造成的。
3.5 不同糖源对杂交鲟幼鱼肌肉营养成分的影响
本研究发现,不同糖源对杂交鲟肌肉粗蛋白质和粗脂肪含量的影响明显,其中葡萄糖组粗蛋白质含量最低,脂肪含量最高,这与对中华鲟[16]、鲫[32]等鱼类的研究结果相似。然而,Cui等[20]却发现,葡萄糖组军曹鱼肌肉粗蛋白质含量最低,但粗脂肪含量与其他各组无显著性差异 (P>0.05)。
综上所述,在本试验条件下,以杂交鲟幼鱼的生长性能、血清生化指标和肌肉营养成分为评价指标,综合考虑投入产出比,建议使用玉米淀粉或小麦淀粉作为杂交鲟幼鱼的饲料糖源。
参考文献:
[1] 麦康森.水产动物营养与饲料学[M].2版.北京:中国农业出版社,2011:99-100.
[2] 蒋利和,吴宏玉,黄凯,等.饲料糖水平对吉富罗非鱼幼鱼生长和肝代谢功能的影响[J].水产学报,2013,37(2):245-255.
[3] 崔现军.军曹鱼(Rachycentron canadum)糖代谢机理的研究[D].湛江:广东海洋大学,2010.
[4] 任鸣春.军曹鱼和虹鳟糖类营养生理研究[D].青岛:中国海洋大学,2012.
[5] Anderson J,Jackson A J,Matty A J,et al.Effects of dietary carbohydrate and fibre on the tilapia Oreochromis niloticus(Linn.)[J]. Aquaculture,1984,37(4):303-314.
[6] 苗淑彦,苗惠君,聂琴,等.饲料中不同种类的碳水化合物对大菱鲆生长性能和代谢反应的影响[J].水产学报,2013,37(6):910-919.
[7] 蔡春芳,王永玲,陈立侨,等.饲料糖种类和水平对青鱼、鲫生长和体成分的影响[J].中国水产科学,2006,13(3):452-459. [8] 赵永志.青鱼对饲料糖的利用[D].苏州:苏州大学,2009.
[9] Tian Lixia,Liu Yongjian,Hung S S O.Utilization of glucose and cornstarch by juvenile grass carp[J].North American Journal of Aquaculture,2004,66(2):141-145.
[10] 田丽霞,刘永坚,刘栋辉,等.葡萄糖和玉米淀粉对草鱼生长和肠系膜脂肪沉积的影响[J].水产学报,2000,24(5):438-441.
[11] Buhler D R,Halver J E.Nutrition of salmonoid fish:Ⅸ.carbohydrate requirements of Chinook salmon[J].The Journal of Nutrition,1961,74(3):307-318.
[12] Shiau S Y,Lin Y H.Carbohydrate utilization and its protein-sparing effect in diets for grouper(Epinephelus malabaricus)[J].Animal Science,2001,73(2):299-304.
[13] Hung S S O,Fynn-Aikins K,Lutes P B,et al.Ability of juvenile white sturgeon(Acipenser transmontanus)to utilize different carbohydrate source[J].The Journal of Nutrition,1989,119(5):727-733.
[14] Lin J H,Cui Yibo,Hung S S O,et al.Effects of feeding strategy and carbohydrate sources on carbohydrate utilization by white sturgeon(Acipenser transmontanus)and hybrid tilapia(Oreochromis niloticus×O.aureus)[J].Aquaculture,1997,148(2-3):201-211.
[15] Deng Dongfang,Hemre G I,Storebakken T,et al.Utilization of diets with hydrolyzed potato starch,or glucose by juvenile white sturgeon(Acipenser transmontanus),as affected by Maillard reaction during feed processing[J].Aquaculture,2005,248(1-4):103-109.
[16] 周俊.糖对中华鲟幼鱼生长影响的研究[D].武汉:华中农业大学,2006.
[17] 孙大江,曲秋芝,张颖,等.中国的鲟鱼养殖[J].水产学杂志,2011,24(4):67-70.
[18] Guo Zhiqiang,Zhu Xiaoming,Liu Jiashou,et al.Effect of dietary protein level on growth performance,nitrogen and energy budget of juvenile hybrid sturgeon Acipenser baerii ×A.gueldenstaedtii
×A.gueldenstaedtii [J].Aquaculture,2012,338/341:89-95.
[J].Aquaculture,2012,338/341:89-95.
[19] Cunniff P.Official Methods of Analysis of AOAC International [M].16th ed.Arlington VA:AOAC International,1995.
[20] Cui Xianjun,Zhou Qicun,Liang Haiou,et al.Effects of dietary carbohydrate sources on the growth performance and hepatic carbohydrate metabolic enzyme activities of juvenile cobia(Rachycentron canadum Linnaeus)[J].Aquaculture Research,2010,42 (1):99-107.
[21] 吴彬,彭淇,陈斌,等.日粮中不同糖源对吉富罗非鱼(Oreochromis niloticus)稚鱼养殖效果与机理研究[J].海洋与湖沼,2013,44(4):1050-1055.
[22] Hung S S O,Fynn-Aikins K.Carbohydrate utilization and its impact on some metabolic and histological parameters in white sturgeon[M].Paris:Institut National de la Recherche Agronomique,1993:127-136.
[23] Suárez M D,Sanz A,Bazoco J,et al.Metabolic effects of changes in the dietary protein:carbohydrate ratio in eel(Anguilla anguilla)and trout(Oncorhynchus mykiss)[J].Aquaculture International,2002,10(2):143-156.
[24] 田丽霞,刘永坚,刘栋辉,等.草鱼对葡萄糖和淀粉作为能源的利用研究[J].中山大学学报:自然科学版,2001,40(2):104-106.
[25] Rawles S D,GatlinⅢ D M.Carbohydrate utilization in striped bass(Morone saxatilis)and sunshine bass(M.chrysops ×M. saxatilis
×M. saxatilis )[J].Aquaculture,1998,161(1-4):201-212.
)[J].Aquaculture,1998,161(1-4):201-212.
[26] Hutchins C G,Rawles S D,GatlinⅢD M.Effects of dietary carbohydrate kind and level on growth,body composition and glycemic response of juvenile sunshine bass(Morone chrysops ×M. saxatilis
×M. saxatilis )[J].Aquaculture,1998,161(1-4):187-199.
)[J].Aquaculture,1998,161(1-4):187-199.
[27] Shiau S Y,Liang H S.Carbohydrate utilization and digestibility by tilapia,Oreochromis niloticus×O.aureus,are affected by chromic oxide inclusion in the diet[J].The Journal of Nutrition,1995,125(4):976-982.
[28] Ren Mingchun,Habte-Tsion H M,Xie Jun,et al.Effects of dietary carbohydrate source on growth performance,diet digestibility and liver glucose enzyme activity in blunt snout bream,Megalobrama amblycephala[J].Aquaculture,2015,438:75-81.
[29] Deng Dongfang,Refstie S,Hung S S O.Glycemic and glycosuric responses in white sturgeon Acipenser transmontanus after oral administration of simple and complex carbohydrates[J].Aquaculture,2001,199(1-2):107-117.
[30] 刘迎隆,麦康森,徐玮,等.摄食不同淀粉含量饲料对军曹鱼血清生化指标的影响[J].水生生物学报,2015,39(1):46-51.
[31] Webb K A Jr,Rawlinson L T,Holt G J.Effects of dietary starches and the protein to energy ratio to growth and feed efficiency of juvenile cobia,Rachycentron canadum[J].Aquaculture Nutrition,2010,16(5):447-456.
[32] Tan Q,Xie S,Zhu X,et al.Effect of dietary carbohydrate sources on growth performance and utilization for gibel carp(Carassius auratus gibelio)and Chinese longsnout catfish(Leiocassis longirostris Günther)[J].Aquaculture Nutrition,2006,12(1):61-70.
Effects of dietary carbohydrate sources on growth,feed utilization and haematological parameters of juvenile hybrid sturgeon Acipenser baeri ×A.schrenckii
×A.schrenckii
SONG Jiao1,JIANG Hai-bo1,JIANG Zhi-qiang2,CHEN Li-qiao3,WANG Qing-kui4,YUAN Hai-wen1,YANG Jia-he1,YAO Jun-jie1
(1.College of Animal Sciences,Guizhou University,Guiyang 550025,China;2.Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China;3.School of Life Sciences,East China Normal University,Shanghai 200240,China;4.Fisheries Science Department,Tianjin Agricultural University,Tianjin 300384,China)
Abstract:An 8-week feeding trial was conducted to investigate the effects of different carbohydrate sources on growth,feed utilization,haematological parameters and muscle composition of juvenile hybrid sturgeon Acipenser baeri ×A.schrenckii
×A.schrenckii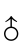 (initial weight,31.88 g±1.96 g).In the experiment,the juvenile hybrid sturgeon was fed five experimental diets containing 20%of glucose,sucrose,dextrin,corn starch and wheat starch.The results showed that there were no significant differences in survival rate and daily food intake rate in the hybrids fed the diets containing different carbohydrate sources(P>0.05).The juvenile hybrid sturgeon fed the diets containing glucose had significantly lower final body weight,weight gain rate,specific growth rate and protein deposition rate and higher food conversion ratio than the juveniles fed the control diet(P<0.05).The maximal apparent digestibility of dry matter and protein was observed in the hybrids fed the diets containing dextrin,significantly higher than that in the hybrids fed the diets containing glucose and sucrose groups(P<0.05),without significantly different from the hybrids fed the diets containing corn starch and wheat starch(P>0.05).There was significantly higher serum glucose level in the hybrids fed the diets containing glucose than that in the others,without significant differences between sucrose,dextrin and corn starch groups(P>0.05),in which there was significantly higher than in the wheat starch group(P<0.05).The maximal levels of serum triglyceride and total cholesterol were found in the hybrids in glucose group,significantly higher triglyceride level than in the dextrin,corn starch and wheat starch groups(P<0.05),and significantly higher total cholesterol level than in other groups(P<0.05).The maximal muscular glycogen content was in the hybrids in dextrin group(P<0.05),without significant difference in other groups(P>0.05).However,the minimal liver glycogen content was observed in dextrin group,significantly lower than in the hybrids in glucose and wheat starch groups(P<0.05).There was the maximal crude lipid content in the hybrids fed the diet containing glucose,significantly higher than that in the other groups(P<0.05).The maximal crude protein level was found in the hybrids in wheat starch group,significantly higher than in the other groups(P<0.05)except for corn starch group(P>0.05).The findings indicated that corn starch and wheat starch were the optimal dietary carbohydrate sources for juvenile hybrid sturgeon under the conditions in present experiment.
(initial weight,31.88 g±1.96 g).In the experiment,the juvenile hybrid sturgeon was fed five experimental diets containing 20%of glucose,sucrose,dextrin,corn starch and wheat starch.The results showed that there were no significant differences in survival rate and daily food intake rate in the hybrids fed the diets containing different carbohydrate sources(P>0.05).The juvenile hybrid sturgeon fed the diets containing glucose had significantly lower final body weight,weight gain rate,specific growth rate and protein deposition rate and higher food conversion ratio than the juveniles fed the control diet(P<0.05).The maximal apparent digestibility of dry matter and protein was observed in the hybrids fed the diets containing dextrin,significantly higher than that in the hybrids fed the diets containing glucose and sucrose groups(P<0.05),without significantly different from the hybrids fed the diets containing corn starch and wheat starch(P>0.05).There was significantly higher serum glucose level in the hybrids fed the diets containing glucose than that in the others,without significant differences between sucrose,dextrin and corn starch groups(P>0.05),in which there was significantly higher than in the wheat starch group(P<0.05).The maximal levels of serum triglyceride and total cholesterol were found in the hybrids in glucose group,significantly higher triglyceride level than in the dextrin,corn starch and wheat starch groups(P<0.05),and significantly higher total cholesterol level than in other groups(P<0.05).The maximal muscular glycogen content was in the hybrids in dextrin group(P<0.05),without significant difference in other groups(P>0.05).However,the minimal liver glycogen content was observed in dextrin group,significantly lower than in the hybrids in glucose and wheat starch groups(P<0.05).There was the maximal crude lipid content in the hybrids fed the diet containing glucose,significantly higher than that in the other groups(P<0.05).The maximal crude protein level was found in the hybrids in wheat starch group,significantly higher than in the other groups(P<0.05)except for corn starch group(P>0.05).The findings indicated that corn starch and wheat starch were the optimal dietary carbohydrate sources for juvenile hybrid sturgeon under the conditions in present experiment.
Key words:hybrid sturgeon;carbohydrate source;growth;haematological parameter;muscle composition
中图分类号:S963.16
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.01.010
文章编号:2095-1388(2016)01-0058-07
收稿日期:2015-04-20
基金项目:贵州省科学技术基金资助项目 (黔科合J字 [2013]2096号);贵州大学引进人才科研项目 (贵大人基合字 [2012]019号);国家 “十二五”科技支撑计划项目 (2012BAD25B00);国家公益性行业 (农业)科研专项 (201203065)
作者简介:宋娇 (1991—),女,硕士研究生。E-mail:evalynsong@163.com
通信作者:姜海波 (1980—),男,博士,副教授。E-mail:jhb99412@126.com
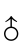 ×Acipenser schrenckii
×Acipenser schrenckii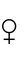 幼鱼8周。结果表明:各试验组的成活率和日摄食率无显著性差异 (P>0.05);葡萄糖组终末体质量、增重率、特定生长率和蛋白质沉积率均显著低于其他各组 (P<0.05),而饲料系数则显著高于其他各组 (P<0.05);糊精组干物质表观消化率和蛋白质表观消化率均为最高,且显著高于葡萄糖组和蔗糖组 (P<0.05),但与玉米淀粉组和小麦淀粉组无显著性差异 (P>0.05);葡萄糖组的血糖、血清胆固醇和血清甘油三酯含量均为最高,其中血糖和血清胆固醇指标显著高于其他各组 (P<0.05),而血清甘油三酯指标则与蔗糖组无显著性差异 (P>0.05),但显著高于其他3个试验组 (P<0.05);糊精组肌糖原含量显著高于其他各组 (P<0.05),而其余各组间则无显著性差异 (P>0.05),糊精组肝糖原含量最低,且显著低于葡萄糖组和小麦淀粉组 (P<0.05);葡萄糖组粗脂肪含量最高,且显著高于其他各组 (P<0.05),小麦淀粉组粗蛋白质含量最高,且显著高于其他各组(P<0.05),但与玉米淀粉组无显著性差异 (P>0.05)。研究表明,在本试验条件下,玉米淀粉和小麦淀粉更适宜作为杂交鲟幼鱼饲料糖源。
幼鱼8周。结果表明:各试验组的成活率和日摄食率无显著性差异 (P>0.05);葡萄糖组终末体质量、增重率、特定生长率和蛋白质沉积率均显著低于其他各组 (P<0.05),而饲料系数则显著高于其他各组 (P<0.05);糊精组干物质表观消化率和蛋白质表观消化率均为最高,且显著高于葡萄糖组和蔗糖组 (P<0.05),但与玉米淀粉组和小麦淀粉组无显著性差异 (P>0.05);葡萄糖组的血糖、血清胆固醇和血清甘油三酯含量均为最高,其中血糖和血清胆固醇指标显著高于其他各组 (P<0.05),而血清甘油三酯指标则与蔗糖组无显著性差异 (P>0.05),但显著高于其他3个试验组 (P<0.05);糊精组肌糖原含量显著高于其他各组 (P<0.05),而其余各组间则无显著性差异 (P>0.05),糊精组肝糖原含量最低,且显著低于葡萄糖组和小麦淀粉组 (P<0.05);葡萄糖组粗脂肪含量最高,且显著高于其他各组 (P<0.05),小麦淀粉组粗蛋白质含量最高,且显著高于其他各组(P<0.05),但与玉米淀粉组无显著性差异 (P>0.05)。研究表明,在本试验条件下,玉米淀粉和小麦淀粉更适宜作为杂交鲟幼鱼饲料糖源。




