 芽孢杆菌对刺参池塘有机物的降解效果及鉴定
芽孢杆菌对刺参池塘有机物的降解效果及鉴定 芽孢杆菌对刺参池塘有机物的降解效果及鉴定
芽孢杆菌对刺参池塘有机物的降解效果及鉴定摘要:为修复刺参Apostichopus japonicus养殖池塘底质环境,根据菌株对底泥中有机质 (COD)、氨氮(NH+4-N)和亚硝酸盐 (NO-2-N)的去除率,从刺参养殖池塘底泥和商品益生菌中筛选高效降解刺参养殖池塘底质有机污染物的潜在益生芽孢杆菌,并对筛选出的优良菌株的产酶能力和降解特性进行了研究。结果表明:从分离的11株细菌中经过筛选最终获得3株优良菌株 (N1、DL、R),它们能同时高效降解底泥中COD、NH+4-N和NO-2-N,5 d内对COD的最大去除率分别为45.71%、23.98%、24.97%,对NH+4-N的最大去除率分别为60.54%、36.15%、36.74%,对NO-2-N的最大去除率分别为52.10%、14.41%、28.82%;根据菌株生理生化特性以及16S rDNA序列分析,N1、DL、R菌株分别为白翎芽孢杆菌Bacillus baekryungensis、地衣芽孢杆菌B.licheniformis和解淀粉芽孢杆菌B.amyloliquefaciens。本研究结果可为进一步开发高效的刺参养殖池塘底质有机污染物降解益生菌及复方制剂提供参考。
关键词:刺参;池塘底泥;修复;芽孢杆菌;分离筛选
刺参Apostichopus japonicus具有极高的营养价值和药用价值,自1953年以来,中国、日本、俄罗斯等国开始了刺参的人工养殖。近年来,刺参养殖规模迅速扩大,2010年中国刺参总产量达10万t,产值超过200亿元[1-2],池塘养殖已成为人工养殖刺参的主要方式之一。然而长期单一的刺参养殖模式导致池塘中残饵、粪便等有机物不断积累,造成高温季节水中氨氮、亚硝酸盐含量不断升高,水质恶化,并诱发各种疾病发生[3]。养殖户为了控制海参疾病常使用化学药剂,进而导致养殖环境生态平衡被破坏以及药物残留等一系列问题产生[4]。
应用益生菌可快速去除水中残留有机物,降低氨氮、亚硝酸盐含量,提高生物体免疫力,减少疾病频发,是当今健康绿色养殖的重要手段[3]。然而,现今在刺参养殖中使用的益生菌主要源于针对鱼、虾养殖所用的益生菌[5-6],由于不同来源的微生物适应性不同,在实际应用中常受到环境条件、土著菌群和养殖品种等影响,造成有益微生物修复效果具有明显的差异[7],且针对刺参源益生菌的研究也较少[8-9]。为了增加刺参源益生菌种,从不同地区刺参养殖环境中筛选有益微生物具有重要意义。目前,用来降解有机污染物的有益菌主要是芽孢杆菌,该菌具有较强的环境适应能力和生存能力[10],有些菌株还具有降解磷、 氮等功能[11-12],且在海水中分布广泛,同时该菌也是刺参养殖池塘的优势菌之一[13]。本研究中,从刺参养殖池塘底泥中分离筛选出对环境修复效果较好的芽孢杆菌,旨在为刺参养殖池塘环境修复提供优异菌株。
1.1 材料
富集培养基:刺参养殖池塘底泥10 g,刺参饵料 (含粗蛋白质20%,粗脂肪2%~4%,粗纤维7%,粗灰分22.5%,水分5%,钙3%)10 g,陈海水1000 mL。
选择培养基:在富集培养基基础上每1000 mL加入琼脂粉15 g。
PY-SW 纯化培养基:蛋白胨10 g,酵母膏0.5 g,葡萄糖0.5 g,可溶性淀粉0.5 g,FeSO4· 7H2O 0.01 g,Na2HPO40.01g,琼脂15 g,陈海水1000 mL。
有机物降解培养基:刺参池塘底泥15 g,刺参饵料15 g,陈海水1000 mL,煮沸,静置48 h后用纱布过滤,以5000 r/min离心10 min,取上清液。
上述培养基配制完成后,调节 pH为7.0~7.5,121℃下灭菌20 min,备用。
1.2 方法
1.2.1 底泥的采集与处理 在辽宁省大连市皮口镇随机选择两个未发病且产量较高的刺参养殖池塘,每个池塘随机选取3个地点采集底泥,去除大颗粒石块并混匀后装入灭菌的容器中,带回实验室,于4℃下贮藏备用。
1.2.2 细菌的富集与分离 分别取底泥样品10 g置于无菌试管中,加入90 mL无菌生理盐水,充分混匀;将各样品液于80℃下水浴10 min(以杀灭大部分非芽孢细菌)[10]后,按10%的比例分别接种于90 mL富集培养基中,在20℃条件下摇床振荡培养1 d,按1%的接种量转接富集培养基中继续振荡培养1 d,如此连续富集驯化3次。
取最后1次富集培养液1 mL,同时将目前市面上用于改善养殖池塘水质、底质评价效果较好的两种商品益生菌,各取1 g;3个原样按10倍稀释法稀释,取合适稀释度的菌液0.1 mL,涂布于选择培养基上,20℃下培养3 d,选择生长有30~50个菌落的平板,挑取生长良好的优势菌落,经纯化培养基多次划线纯化获得单菌株,分别编号保种。
1.2.3 初筛 将细菌用纯化培养基活化后采用平板涂布法接种于选择培养基上,置于20℃下培养,记录细菌的单菌落生长情况,经多次试验后选取能在48~72 h内生长良好的细菌,进行革兰氏染色和芽孢染色,选取革兰氏染色为阳性且有芽孢的菌株进行下一步试验。
1.2.4 复筛 通过对底泥有机物培养基中化学耗氧量(COD)、氨氮(NH+4-N)和亚硝酸盐(NO-2-N)降解能力的测定,筛选合适的芽孢菌株。试验组为各初筛菌株,将每个菌株接种于150 mL的底泥和饵料液体培养基中,接菌浓度均为1.0×106cfu/mL(即时以血球计数板计数)[14],对照组(C)不加细菌,加等量的生理盐水。试验组和对照组均设4个平行,在20℃条件下培养5 d后,取一部分培养液,以6000 g离心10 min,测定上清液中COD含量。再取一部分培养液,用0.45 μm的微孔滤膜抽滤后测定NH+4-N和NO-2-N含量。
1.2.5 菌株产酶活力的测定 采用点种法[15],以菌株在淀粉培养基、酪素琼脂培养基、纤维素培养基和脂酶 (Tween80)培养基[16]上的水解圈直径与菌落直径之比来初步测定菌株的产酶能力。
1.2.6 菌株对COD、NH+4-N、NO-2-N的去除规律
试验设计同 “1.2.4”节,每日测定复筛菌株对底泥、饵料中COD、NH+4-N、NO-2-N的去除率,测定方法同 “1.2.4”节,共测定5 d。
1.2.7 菌株的鉴定 采用生理生化试验与16S rDNA序列测定相结合的方法进行菌株的鉴定。
采用 《常见细菌系统鉴定手册》方法[16]进行菌株生理生化鉴定,细菌微量生化反应管购自杭州天和微生物试剂有限公司。16S rDNA序列测定:采用水煮法[17]提取所选细菌的DNA,并以此为模板进行PCR扩增,将得到的PCR产物送至北京华大基因科技有限公司进行测序,所得序列用Blast软件与GenBank中有关的16S rRNA进行比对。
1.3 数据处理
利用碱性高锰酸钾法测定COD含量,用纳氏试剂法测定NH+4-N含量,用重氮-偶氮光度法测定NO-2-N含量[18]。去除率计算公式为
去除率=(1-试验值/本底值)×100%。
利用SPSS 19.0软件对试验数据进行统计分析,采用Duncan法进行多重比较,显著性水平设为0.05。
2.1 菌株的筛选
2.1.1 芽孢杆菌的初步筛选 从刺参养殖池塘底泥和商品益生菌中共分离纯化得到11株细菌,分别记为N1~N8(分离自底泥)和DL、L、R(分离自商品益生菌)。革兰氏染色和芽孢染色结果表明,N1、N2、N4、N5、DL、R均为革兰氏阳性且具有芽孢的杆菌。
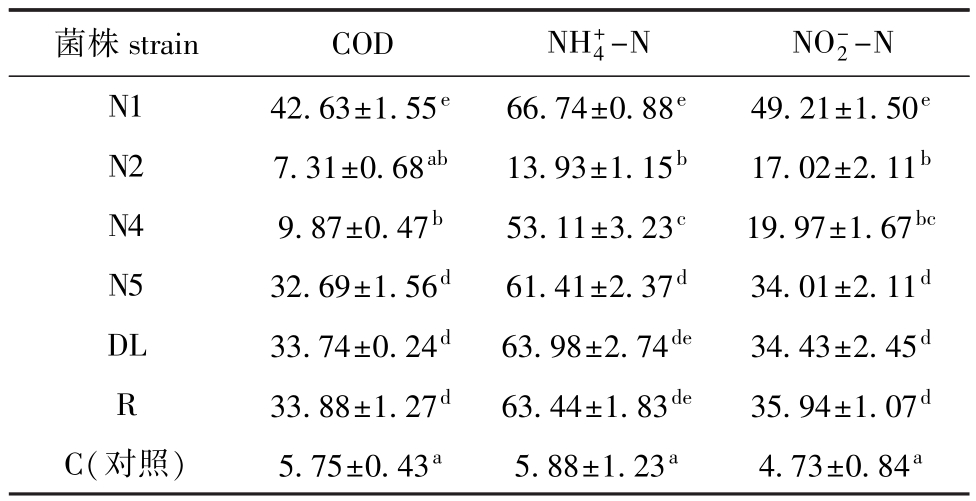
2.1.2 复筛 以养殖池塘底泥和刺参饵料为底物,测定了芽孢杆菌对底泥和饵料中有机物、NH+4-N 和NO-2-N的降解能力。从表1可见,与对照组(C)相比,各种细菌对培养基中有机物、NH+4-N 和NO-2-N均有较高的去除率,但不同菌株之间降解性能有显著性差异 (P<0.05)。多重比较分析发现:N1菌株对3种指标的去除能力均为最佳,对COD、NO-2-N的去除率显著高于其他菌株(P<0.05),对NH+4-N的去除率显著高于除DL、R菌株之外的其余各菌株(P<0.05);其次为R、DL、N5菌株,而N2、N4菌株对3种指标的去除能力较差,且显著低于其他菌株(P<0.05)。根据上述分析,最终选取N1、N5、DL、R 4株芽孢杆菌作为潜在益生菌进行后续研究。
表1 各菌株对刺参池塘底泥和饵料中COD、NH+4-N、NO-2-N的去除率
Tab.1 Degradation rates of COD,NH+4-N,and NO-2-N in sediments and diet in sea cucumber Apostichopus japonicus ponds by different strains of Bacillus %
注:同列中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同字母者表示组间无显著性差异 (P>0.05)
Note:The means with different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences
菌株strain COD NH+4-N NO-2-N N1 42.63±1.55e 66.74±0.88e 49.21±1.50eN2 7.31±0.68ab 13.93±1.15b 17.02±2.11bN4 9.87±0.47b 53.11±3.23c 19.97±1.67bcN5 32.69±1.56d 61.41±2.37d 34.01±2.11dDL 33.74±0.24d 63.98±2.74de 34.43±2.45dR 33.88±1.27d 63.44±1.83de 35.94±1.07dC(对照) 5.75±0.43a 5.88±1.23a 4.73±0.84a
2.2 筛选菌株的产酶特性
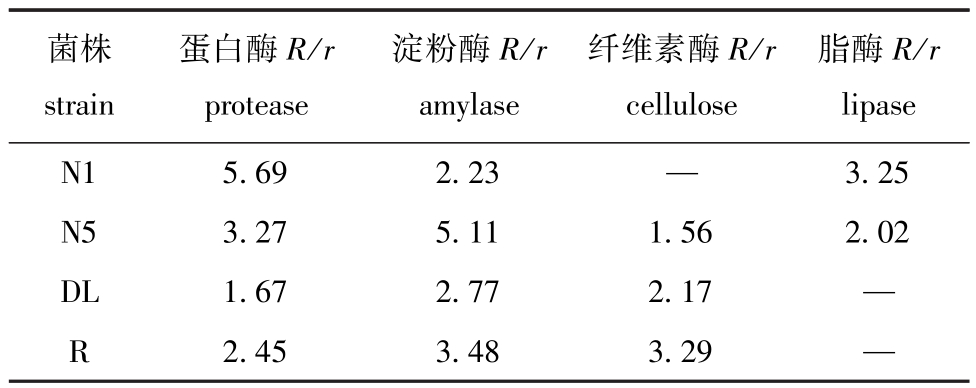
从表2可见:4株芽孢杆菌的产酶特性各有不同,N1产蛋白酶、脂酶、淀粉酶,不产纤维素酶;N5产淀粉酶、蛋白酶、纤维素酶和脂酶;而DL 和R均产蛋白酶、淀粉酶、纤维素酶,不产脂酶。在相同细胞浓度下,各菌株的产酶能力也不同。
表2 各菌株的产酶能力
Tab.2 Enzyme production capacity of different strains
注:细菌的产酶能力以细菌产生的透明水解圈直径大小 (R)与菌落直径大小 (r)的比值表示。—表示水解圈不清晰或无
Note:Diameter ratio of hydrolytic circle to single bacterial colony stands for the activity of enzyme.—means the unclear or none hydrolytic circle
菌株strain蛋白酶R/r protease淀粉酶R/r amylase纤维素酶R/r cellulose脂酶R/r lipase N1 5.69 2.23 —3.25 N5 3.27 5.11 1.56 2.02 DL 1.67 2.77 2.17 —R 2.45 3.48 3.29—
2.3 筛选菌株对有机物的降解规律
从图1~图2可见:在试验的4~5 d内,随着培养时间的延长,各菌株对COD、NH+4-N、NO-2-N的去除率较对照组均有显著增加 (P<0.05);自第3天起,N1菌株对COD、NH+4-N、NO-2-N的去除效果均明显高于其他菌株。
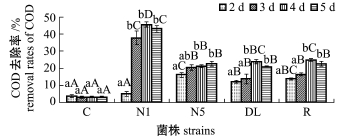
图1 COD去除率随时间的变化
Fig.1 Variation in COD degradation rate with time
注:不同小写字母表示同一菌株不同时间之间有显著性差异(P<0.05),不同大写字母表示同一时间不同菌株之间有显著性差异 (P<0.05),相同字母表示组间无显著性差异 (P>0.05),下同
Note:The means with different letters are significantly different (P<0.05)within one strain at different time,the means with different capital letters being significantly different(P<0.05)in different strains at same time,and the means with the same letters are not significant differences,et sequentia

图2 氨氮和亚硝酸盐去除率随时间的变化
Fig.2 Variation in removal rates of ammonia nitrogen and nitrite nitrogen with time
从图1可见:4株菌均在第2天时对COD的去除显出效果;其中N1、DL、R菌株在第4天时,对COD的去除率最大,分别为45.71%、23.98%、24.97%,在第5天时均有所下降;而 N5菌株在第5天时去除率最大,为22.70%。
从图2可见:4株菌均在第1天时对NH+4-N的去除显出效果,均在第3天时对NH+4-N的去除率最大,第4天时去除率开始下降;其中N1菌株在第3天时的去除效果最好,去除率为60.54%,而N5、DL、R菌株在第3天时的去除率分别为26.02%、36.15%、36.74%。
从图2还可见:4株菌均在第1天时对NO-2-N的去除显出效果;N1、R、DL菌株均在第4天时对NO-2-N的去除率最大,其中N1菌株的降解效果最好,为52.10%,R、DL菌株的去除率分别为28.82%、14.41%;而N5菌株在第3天时去除率最大,为15.61%;自第2天起,N1菌株的去除率显著高于其他菌株 (P<0.05),表现出最好的NO-2-N去除能力。
2.4 细菌鉴定
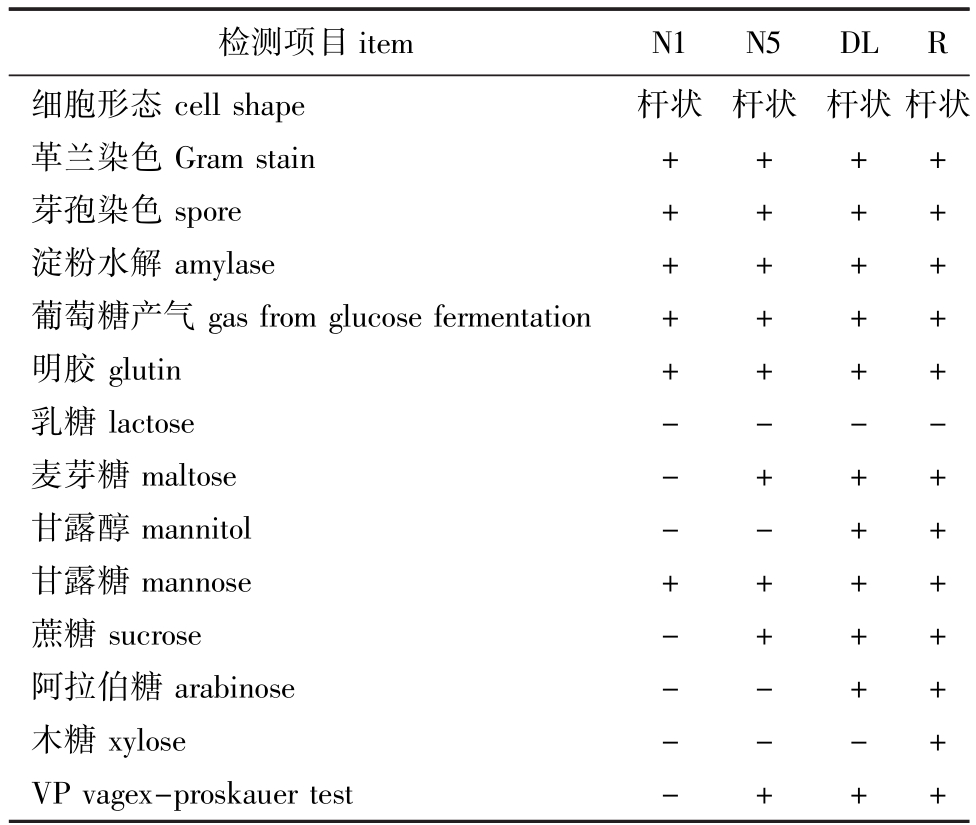
各菌株的生理生化反应结果如表3所示。将各菌株的16S rDNA序列与GenBank中相关属种的16S rDNA序列进行同源性比对,其中N1菌株与B.baekryungensis strain(KF933693.1)的相似度达到100%,经对比 《常见细菌系统鉴定手册》 (以下称为 《手册》),该菌与 《手册》描述的生理生化反应特征相比,除甘露糖外其他均一致,因此,可以鉴定 N1菌株为白翎芽孢杆菌;N5菌株与B.cereus(KJ528873.1)相似度达到100%,该菌与《手册》描述的生理生化反应特征相比,结果均一致,因此,可以鉴定N5菌株为蜡状芽孢杆菌;DL菌株与B.licheniformis(KP119810.1)的相似度达到100%,该菌与 《手册》描述的生理生化反应特征相比,除甘露醇外其他均一致,因此,可以鉴定DL菌株为地衣芽孢杆菌;R菌株与B.amyloliquefaciens(HQ831421.1)的相似度达到99%,该菌与《手册》描述的生理生化反应特征均一致,因此,可以鉴定R菌株为解淀粉芽孢杆菌。
表3 菌株的生理生化特性
Tab.3 Physiological and biochemical characters of the different strains
注:+为阳性,-为阴性
Note:+,positive reaction;-,negative reaction
检测项目item N1 N5 DL R细胞形态cell shape革兰染色Gram stain芽孢染色spore淀粉水解amylase葡萄糖产气gas from glucose fermentation明胶glutin乳糖lactose麦芽糖maltose甘露醇mannitol甘露糖mannose蔗糖sucrose阿拉伯糖arabinose木糖xylose VP vagex-proskauer test杆状+ + + + + ---+ ----杆状+ + + + + -+ -+ + --+杆状杆状+ + + + + -+ + + + + -+ + + + + + -+ + + + + + +
本研究中共筛选获得4株芽孢杆菌对底泥中COD、NH+4-N、NO-2-N有去除作用,且不同菌株对不同物质的降解能力有所不同,其中白翎芽孢杆菌N1菌株显示出对COD、NH+4-N、NO-2-N的综合降解能力最强,对COD的去除率达到45.71%。这比假单胞菌对 COD的去除率 (50%)[9]略低,比常温解淀粉芽孢杆菌 (42.33%)[8]略高,但明显高于低温白翎芽孢杆菌 (28.97%)[8]。由此可见,不同菌株对COD的降解能力存在较大差异,即使同一种白翎芽孢杆菌,不同分离株的降解能力差异也较大。另外,本试验中为了能反映菌株的实际使用效果,采用测试底物为50%的池塘底泥加上50%的饵料,而闫法军等[8]的试验中测试底物为纯刺参饵料,其有机质较底泥中的有些物质易降解,因此,本试验中分离的白翎芽孢杆菌可作为刺参池塘底泥有机质修复的潜在益生菌。
有关地衣芽孢杆菌和解淀粉芽孢杆菌应用到鱼、虾的报道较多[19-20],但应用地衣芽孢杆菌修复刺参水质的研究尚未见报道,而应用解淀粉芽孢杆菌的研究仅见闫法军等[8]有过报道。本研究中分离的解淀粉芽孢杆菌与之相比,COD降解能力较低,但具有较高的NH+4-N降解能力,地衣芽孢杆菌也显示出相同的特性。作者认为,可以利用该菌株对NH+4-N降解能力强的特性与其他益生菌复配,以有效去除氨氮。蜡状芽孢杆菌N5菌株表现出对刺参底泥NH+4-N较高的降解能力,但有报道认为,蜡状芽孢杆菌某些菌株可引起刺参腐皮综合征[21],因此,蜡状芽孢杆菌作为益生菌应用需进行更广泛深入地研究。
细菌产酶是细菌降解有机物的直接原因,细菌产酶种类和数量是否符合该底泥有机质决定了该底泥有机物去除率的大小[22]。理论上,细菌产酶数量越高,有机质去除率越高,本研究中分离的N1菌株与其余3菌株相比,其蛋白酶和脂酶含量较高,淀粉酶含量较低,无纤维素酶,试验结果显示,该菌株对有机质的去除率较高,说明该菌株的产酶能力与对有机质的去除能力是相符的。
目前,益生菌对水质改良效果的研究较多,但对益生菌作用规律的研究较少,益生菌对水化学因子的降解规律研究有助于确定益生菌的使用周期和使用效果。本试验表明,4株菌对COD、NH+4-N、NO-2-N的去除率变化趋势基本一致,多数在试验的第3天去除率呈明显上升趋势,第4天达最大,然后呈下降趋势。这种降解规律不仅为这4株菌的进一步试验研究提供了合理的测定时间,也为益生菌在实际生产中的应用周期提供了试验依据。
参考文献:
[1] Jiang Senhao,Dong Shuanglin,Gao Qinfeng,et al.Comparative study on nutrient composition and growth of green and red sea cucumber,Apostichopus japonicus(Selenka,1867),under the same culture conditions[J].Aquaculture Research,2013,44(2):317-320.
[2] Ministry of Agriculture,People's Republic of China.China Fishery Statistical Yearbook of 2011[M].Beijing:China Agriculture Press,2012:26-26.
[3] 刘文珍.水产养殖中微生物的应用及研究进展[J].水产科学,2010,29(1):57-62.
[4] 俞慎,王敏,洪有为.环境介质中的抗生素及其微生物生态效应[J].生态学报,2011,31(15):4437-4446.
[5] 田功太,刘飞,段登选,等.EM菌对海参养殖水体主要污染物净化效果的研究[J].山东农业大学学报:自然科学版,2012,43(3):381-386.
[6] 王路平,吴垠,班红琴,等.微生态制剂对刺参幼参在封闭式循环养殖系统中的应用研究[J].中国微生态学杂志,2009,21 (6):497-499.
[7] Wang Yanbo,Xu Zirong,Xia Meisheng.The effectiveness of commercial probiotics in northern white shrimp Penaeus vannamei ponds[J].Fisheries Science,2005,71(5):1036-1041.
[8] 闫法军,田相利,董双林,等.刺参养殖池塘降解有机污染物常、低温芽孢杆菌的分离筛选[J].中国海洋大学学报,2013,43(6):17-24.
[9] 闫法军,田相利,董双林,等.刺参池塘低温有机污染物降解细菌的分离筛选及其降解特性[J].中国水产科学,2012,19(4):626-634.
[10] Hanson M L,Wendoff W L,Houck K B.Effect of heat treatment of milk on activation of Bacillus spores[J].Journal of Food Protection,2005,68(7):1484-1486.
[11] 卢显芝,田秀平,郝建朝,等.解磷芽孢杆菌及其对养殖池塘水体磷组分的转化研究[J].黑龙江八一农垦大学学报,2008,20(6):19-22.
[12] 谢凤行,张峰峰,周可,等.一株解淀粉芽胞杆菌的分离鉴定及水质净化效果的研究[J].环境科学学报,2012,32(11):2781-2788.
[13] 牛宇峰.刺参养殖池塘异养菌数量变动及区系组成的初步研究[D].青岛:中国海洋大学,2009.
[14] 杨文博.微生物学实验[M].北京:化学工业出版社,2004.
[15] 杨志平,孙飞雪,刘志明,等.刺参肠道潜在产酶益生菌的筛选和鉴定[J].大连海洋大学学报,2013,28(1):17-20.
[16] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-379.
[17] 陶天申,杨瑞馥,东秀珠.原核生物系统学[M].北京:化学工业出版社,2007:63.
[18] 雷衍之.养殖水环境化学[M].北京:中国农业出版社,2006.
[19] 郭荷梅.地衣芽孢杆菌及其在水产养殖生产中的应用[J].北京农业,2012(21):125.
[20] 张娟,杨彩梅,曹广添,等.解淀粉芽孢杆菌及其作为益生菌的应用[J].动物营养学报,2014,26(4):863-867.
[21] 骆艺文,郝志凯,王印庚,等.一株引起刺参“腐皮综合征”的蜡样芽孢杆菌[J].水产科技情报,2009,36(2):60-63.
[22] 姜军坡,朱宝成,王世英.以滤纸酶活力为指标优化解淀粉芽孢杆菌Tu-115菌株产纤维素酶液体发酵条件[J].饲料工业,2014,35(20):43-47.
Identification and evaluation of degradation of organic material pollutants in sea cucumber Apostichopus japonicus culture ponds by three Bacillus strains
Abstract:Potential beneficial Bacillus with high efficient degradation of organic pollutants was screened from sediments in sea cucumber Apostichopus japonicu culture ponds on the base of removal rate of COD,NH+4-N,and NO-2-N and enzyme production capacity from sea cucumber culture pond sediment to improve the pond environment and to prepare probiotics.The three strains(N1,DL and R)selected from 11 strains isolated as potential probiotics had efficient degradation of COD at revomal rate of 45.71%in N1,23.98%in DL,and 24.97%in R in 5 days.The revomal rates of NH+4-N were found to be 60.54%in N1,36.15%in DL,and 36.74%in R.The revomal rates of NO-2-N were found to be 52.10%in N1,14.41%in DL,and 28.82%in R.The physiological and biochemical characteristics and 16S rDNA sequence analysis revealed that the strain N1 was B.baekryungensi,strain DL B.licheniformis and strain R B.amyloliquefaciens.The findings provide foundation with further development of the production or compound preparations with efficient degradation of organic pollutants in sea cucumber culture pond sediment.
Key words:Apostichopus japonicus;culture pond sediment;repairing;Bacillus;isolation and screening
中图分类号:S968.9
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.01.004
文章编号:2095-1388(2016)01-0019-05
收稿日期:2015-05-10
基金项目:国家 “十二五”科技支撑计划项目 (2011BAD13B03);国家海洋公益性行业科研专项 (201405003);辽宁省海洋与渔业厅重大项目 (201402);科技部农业科技转化项目 (2014GB2B000366)