
图1 dmatp6v0c基因编码区序列和氨基酸序列
Fig.1 Encoding sequence and amino acid sequence of dmatp6v0c gene
注:起始密码子 (ATG)用单下划线标出,终止密码子 (TAA)用双下划线标出
Note:The initiation codon(ATG)and the stopping codon(TAA)are underlined by double and single lines repectively
摘要:为探求南极鱼ATP酶类在低温适应下的作用,从鳞头犬牙南极鱼Dissostichus mawsoni的cDNA文库中克隆atp6v0c基因 (dmatp6v0c),并转染到HeLa细胞中,通过流式细胞仪检测细胞在低温胁迫下 (10℃)的死亡率,获得了dmatp6v0c基因的全部编码序列,其长度为462 bp,并将其插入到真核表达载体pcDNA3.1(-)上用于体外表达。结果表明,与对照组相比,在低温胁迫下,过表达dmatp6v0c基因的HeLa细胞死亡率从 (19.23±1.87)%显著降低到(8.13±0.04)%(P<0.05)。研究表明,在低温胁迫下dmatp6v0c基因过表达能显著降低HeLa细胞的死亡率,试验结果可为dmatp6v0c基因作为鱼类耐寒育种的候选基因提供理论依据。
关键词:鳞头犬牙南极鱼;低温胁迫;dmatp6v0c基因;Hela细胞;细胞死亡率
水体温度直接影响鱼类的生存,冬季的低温会对热带鱼类的养殖造成巨大的经济损失[1-2]。研究发现,寻找关键基因用于改善热带鱼类的耐寒性能成为解决这一问题的有效手段,而作为生长在极端低温环境下的南极鱼类,可为挖掘与寒冷相关的候选基因提供宝贵的研究材料[3]。
ATP6V0C(ATPase-H+transporting lysosomal vacuolar proton)是微囊 ATP酶 (V-ATPase)V0结构域的c亚基[4-5]。V-ATPase是一种与细胞膜相关的多亚基蛋白复合体,也是受ATP驱动的质子泵,可通过水解ATP获得能量来跨膜转运质子[6-7]。V-ATPase包括V0和V1两个结构域,V0结构域由a、c、c′、c″、d和e 6个亚基组成,而V1结构域由A、B、C、D、E、F、G和H 8个亚基组成[8]。V1结构域的作用是水解ATP,而完整V0结构域的作用是质子的跨膜运输,利用V1结构域水解ATP释放的能量来驱动质子的跨膜运输[9]。V-ATPase位于许多真核细胞的多种细胞膜上,如溶酶体、核小体、高尔基体延伸出来的微囊和分泌泡[6]。在哺乳动物中,V-ATPase的各亚基除了作为质子泵的组成部分外,还有其他功能:V0结构域的a亚基控制V-ATPase在细胞中的不同定位[9],c亚基参与细胞间的交流[10],e亚基在细胞融合过程中起作用[11];V1结构域的B和C亚基调控V-ATPase和 actin细胞骨架的功能,E亚基调控细胞生长过程中Racl信号通路[12]。
研究表明,V-ATPase的功能主要是囊泡酸性环境的维持、囊泡和微囊的融合[13-14]、能量转运和细胞pH的变化[15]等。而编码V-ATPase V0结构域c亚基的atp6v0c基因在鱼类中扮演了不同的角色。Chung等[16]研究发现,斑马鱼atp6v0c的一种亚型atp6v0c2在神经元中特异表达,参与神经元中神经递质的储存和分泌,并调节斑马鱼的神经兴奋。Chen等[3]通过对南极鱼和热带鱼类的转录组比较分析,表明与斑马鱼相比,鳞头犬牙南极鱼Dissostichus mawsoni的atp6v0c基因表达量显著上升,暗示atp6v0c基因在极地鱼类低温适应方面发挥了重要作用。本研究中,为探索南极鱼dmatp6v0c基因在低温适应下的作用,从鳞头犬牙南极鱼Dissostichus mawsoni的cDNA文库[3]中克隆了dmatp6v0c基因,并将其插入到真核表达载体中,用于在HeLa细胞中瞬时的高效表达,在低温胁迫下,检测过表达dmatp6v0c基因对HeLa细胞死亡率的影响,以此来评估dmatp6v0c基因的抗寒功能,旨在为体外快速选育与抗寒相关的候选基因提供有效的方法。
1.1 材料
试验用 Taq酶、DNA连接酶、DL2000 DNA Marker、DL5000 DNA Marker、反转录试剂盒等均购自TaKaRa公司;限制性内切酶XhoⅠ和BamHⅠ购自NEB公司;pcDNA3.1(-)载体购自Invitrogen公司;胶回收和质粒小提试剂盒均购自OMEGA Bio-Tek公司;高温细胞培养箱 (Galaxy 170S)、低温细胞培养箱 (Galaxy170R)均购自Eppendrof公司;培养基 DMEM [含有青霉素(10 000 IU)和链霉素 (10 000 μg/mL)的混合液]、胰蛋白酶均购自Hyclone公司;胎牛血清购自Gibco公司;TurboFect购自Thermo公司;其他常规试剂由省部共建水产种质资源发掘与利用教育部重点实验室提供。
1.2 方法
1.2.1 dmatp6v0c基因的克隆及真核表达重组质粒的构建 根据本实验室之前对Dissostichus mawsoni cDNA文库的测序结果[3],通过同源比对筛选得到dmatp6v0c编码区基因序列。将dmatp6v0c编码区基因序列和pcDNA3.1(-)上多个可用的酶切位点进行序列比对后,选取pcDNA3.1(-)上的XhoⅠ和BamHⅠ酶切位点进行基因插入。结合保护碱基和酶切位点,利用Primer 5软件设计引物序列为
Forward:5′CTGACTCGAGATGTCGGCCGAAAGTCCC 3′;
Reverse:5′CGTCGGATCCTTATTTCGTGGAGAGGATCAGG 3′(划线部分为酶切位点)。
本研究中,从Dissostichus mawsoni cDNA文库中PCR扩增出该基因。将pcDNA3.1(-)载体和dmatp6v0c基因片段同时用XhoⅠ和BamHⅠ进行双酶切,对酶切产物分别进行切胶回收,将胶回收后的基因片段用T4连接酶于16℃下连接过夜,将连接产物转化至大肠杆菌DH-5α感受态细胞中,涂布于平板 (含100 μg/mL氨苄青霉素)上筛选。选取部分菌斑接种到含100 μg/mL氨苄青霉素的液体培养基中,于37℃摇床中以250 r/min培养13 h。用T7和BGH reverse通用引物对单克隆菌液进行菌液PCR鉴定。反应体系 (共20 μL):菌液1 μL,T7 primer 1 μL,BGH reverse primer 1 μL,dNTP 2 μL,10×reaction buffer 2 μL,Taq enzyme 0.2 μL,ddH2O 12.8 μL。反应条件为:98℃下预变性5 min;98℃下变性10 s,55℃下退火5 s,72℃下延伸1 min,共进行35个循环;最后在72℃下再延伸10 min。将PCR产物用15 g/L琼脂糖凝胶进行电泳,并对条带进行分析。阳性菌液送生工生物工程 (上海)股份有限公司进行测序验证,并将送测的菌液保留备份。对测序成功的备份菌液进行扩大培养,然后严格按照质粒小提试剂盒说明书方法进行质粒提取,提取的质粒保存于冰箱(-20℃)中,用于转染试验。
菌液PCR引物序列为
T7 promoter primer:5′TAATACGACTCACTATAGGG 3′;
BGH reverse primer:5′TAGAAGGCACAGTCGAGGCT 3′。
试验所用引物均由生工生物工程 (上海)股份有限公司合成,并且进行PAGE纯化。
1.2.2 重组质粒酶切验证 将pcDNA3.1(-)空载体和pcDNA3.1(-)-dmatp6v0c重组质粒分别进行双酶切。酶切体系 (共50 μL):DNA 1 μg,Xho Ⅰ1 μL,BamHⅠ1 μL,10×cut smart buffer 5 μL,用ddH2O补至50 μL。37℃下酶切2 h,对酶切产物用10 g/L琼脂糖凝胶进行电泳,验证其条带大小。
1.2.3 HeLa细胞的培养 将冻存的HeLa细胞从液氮中取出,于37℃水浴中解冻,然后以1000 r/min离心5 min,去冻存液,迅速向冻存管中加入1 mL 37℃完全培养基 (90 mL DMEM高糖培养基加上10 mL FBS,使用前再加入1 mL双抗),用移液器轻轻吹散细胞,将吹散的细胞连同培养基一起转移到直径为100 mm的细胞培养皿中,并向平板中加入9 mL完全培养基,然后将平板置于37℃、5%CO2的高温培养箱中培养。
1.2.4 转染试验及低温处理策略 转染前将4× 105cells HeLa细胞接种于直径为100 mm的培养皿中,培养24~48 h,待细胞汇合度达到70% ~80%后,用无血清的DMEM培养基稀释15 μg质粒至970 μL,混匀后加入30 μL TurboFect,于室温中静置20 min,然后分别加入到细胞密度适中的培养皿中,轻轻晃动使转染混合液均匀分布,然后置于高温培养箱 (37℃)中培养2 d。转染了pcDNA3.1(-)-dmatp6v0c重组质粒的细胞作为试验组细胞,转染了pcDNA3.1(-)空载体的细胞作为对照组细胞,然后将试验组细胞及对照组细胞分别在低温培养箱 (10℃)中培养3 d。
1.2.5 转染HeLa细胞后基因转录的表达鉴定清洗在10℃下培养3 d的试验组细胞以及对照组细胞,提取RNA,利用无RNase的DNase消化细胞RNA,然后严格按照反转录试剂盒说明书方法进行反转录。利用反转录后的cDNA作为模板,进行PCR扩增。反应体系 (共20 μL):模板1 μL,Forward引物1 μL,Reverse引物1 μL,dNTP 2 μL,10×reaction buffer 2 μL,Taq enzyme 0.2 μL,ddH2O 12.8 μL。反应条件为:95℃下预变性5 min;95℃下变性10 s,58℃下退火5 s,72℃下延伸1 min,共进行34个循环;最后在72℃下再延伸10 min。将PCR产物用15 g/L琼脂糖凝胶进行电泳分析以及测序验证。
1.2.6 细胞死亡率的检测 荧光染料碘化丙啶(Propidium iodide,PI)是一种可对细胞核染色的试剂,但不能透过活细胞膜,当细胞死亡时会导致细胞膜破损,这样会让PI穿过破损的细胞膜而对核染色[17]。收集10℃下低温处理3 d后的HeLa细胞,用预冷的体积分数为75%的乙醇对其进行固定,4℃下过夜。用含5 μg/mL RNAase和20 μg/mL PI的PBS,在避光的室温条件下处理细胞30 min,然后用流式细胞仪分别对染色后的细胞进行细胞死亡率检测,每个样品重复检测3次。
1.3 数据处理
试验结果以平均值±标准差 (mean±S.D.)表示,采用SPSS软件进行统计学处理,用t检验进行差异显著性检验,显著性水平设为0.05。
2.1 dmatp6v0c基因的克隆
本研究中,对Dissostichus mawsoni cDNA文库进行测序,然后与已知的NCBI数据库进行同源比对,获得dmatp6v0c基因的编码区序列,按此序列设计引物Forward/Reverse,并使用PCR方法扩增出dmatp6v0c基因片段,经测序表明,该基因的编码区片段全长为462 bp,其核苷酸序列和氨基酸序列如图1所示。

图1 dmatp6v0c基因编码区序列和氨基酸序列
Fig.1 Encoding sequence and amino acid sequence of dmatp6v0c gene
注:起始密码子 (ATG)用单下划线标出,终止密码子 (TAA)用双下划线标出
Note:The initiation codon(ATG)and the stopping codon(TAA)are underlined by double and single lines repectively
2.2 dmatp6v0c基因真核表达重组质粒酶切验证
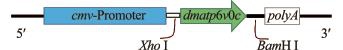
图2 pcDNA3.1(-)-dmatp6v0c示意图
Fig.2 Structure of pcDNA3.1(-)-dmatp6v0c
为了使dmatp6v0c基因能够在HeLa细胞中表达,将其插入到真核表达载体pcDNA3.1(-)上,插入位置如图2所示。为了验证dmatp6v0c基因编码区462 bp核苷酸序列是否成功插入到pcDNA3.1 (-)载体上,分别对pcDNA3.1(-)-dmatp6v0c重组质粒和pcDNA3.1(-)空载体用XhoⅠ和BamHⅠ限制性内切酶进行双酶切。酶切产物经琼脂糖凝胶电泳检测,可见质粒变成线性条带,重组质粒被切开成2个条带,一条大小为462 bp,另一条大小为5371 bp;而空载体只有一条可见带,大小为5371 bp(图3)。此结果表明,dmatp6v0c基因片段成功插入到pcDNA 3.1(-)载体上,形成重组质粒,可进行下一步的转染试验。
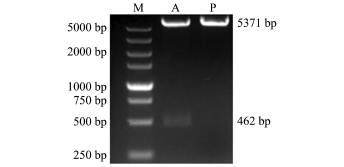
注:M为 DL5000 DNA Marker;A为双酶切后的 pcDNA3.1 (-)-dmatp6v0c质粒;P为双酶切后的pcDNA3.1(-)空载体Note:M,DL5000 DNA Marker;A,pcDNA3.1(-)-dmatp6v0c cut by double enzyme;P,pcDNA3.1(-)plasmid cut by double enzyme
2.3 转染HeLa细胞后基因转录表达的鉴定
为了验证重组质粒在HeLa细胞中的转录表达,本研究中分别对试验组和对照组HeLa细胞的RNA进行了反转录PCR。转染了pcDNA3.1(-)-dmatp6v0c重组质粒的HeLa细胞作为试验组细胞,转染了pcDNA3.1(-)空载体的HeLa细胞作为对照组细胞。PCR产物经琼脂糖凝胶电泳检测,试验组的PCR产物大小为462 bp,而对照组未出现条带 (图4)。这表明dmatp6v0c基因在Hela细胞中成功地进行了转录,可进行细胞死亡率检测试验。
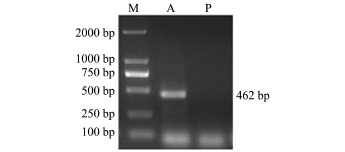
图4 HeLa细胞中过表达dmatp6v0c基因转录结果
Fig.4 Gene transcription of overexpression of dmatp-6v0c gene in HeLa cell line
注:M为DL2000 DNA Marker;A为试验组;P为对照组
Note:M,DL2000 DNA Marker;A,experimental group;P,control group
2.4 HeLa细胞的死亡率
为了检测低温下HeLa细胞的死亡率,本研究中对经低温 (10℃)处理后的细胞进行PI染色,然后使用流式细胞仪进行检测,结果如图5所示。散点图5-A中用椭圆形标记的细胞群为PI阳性细胞群,即为死亡细胞群;用长方形标记的细胞群为PI阴性细胞群,即为活细胞。通过统计PI阳性细胞比率计算细胞的死亡率。从图5-A可知,与对照组相比,试验组死亡细胞群中的细胞较少。试验组和对照组中的细胞死亡率如图5-B所示,试验组HeLa细胞的死亡率为 (8.13±0.04)%,对照组为 (19.23±1.87)%,试验组显著低于对照组(P<0.05)。由此可见,过表达dmatp6v0c基因可以减少低温下HeLa细胞的死亡率。

图5 过表达dmatp6v0c基因后HeLa细胞的死亡率
Fig.5 Mortality of Hela cells in overexpression of dmatp6v0c gene
注:*表示与对照组有显著性差异 (P<0.05)
Note:*means significant difference compared with the control group(P<0.05)
鱼类在低温适应过程中会通过增强氧化磷酸化,以提供足够的能量维持身体的各项机能[18-19]。Coppe等[20]通过对生活在-1.86℃的南极冰鱼Channichthyidae转录组进行分析,发现其转录组中124个候选的重复基因中有34个在线粒体中表达,其中ATP5S(ATP synthase,H+transporting,mitochondrial F0 complex,subunits)就是一种ATPase。ATP5S是一种ATP合成酶,它通过增强鱼类线粒体中氧化磷酸化效率来增加ATP产生[21]。Belogru-dov[22]在动物细胞中过表达atp5s基因后,发现细胞中线粒体内膜的嵴增多增厚,而这种变化可以增加ATP合成体基片的交换速率;另外,过表达atp5s基因的细胞中细胞呼吸速率是普通细胞的2倍。以上结果表明,过表达atp5s基因能通过增强细胞有氧呼吸来增加 ATP。除此之外,Gracey等[23]通过对低温压力下鲤转录组进行分析,结果也表明,低温下通过氧化磷酸化途径产生的ATP有增加的趋势。与ATP合成酶相同,ATP6V0C也参与到氧化磷酸化的过程中,本试验中,HeLa细胞低温下过表达dmatp6v0c基因能降低细胞的死亡率,这说明在低温下代偿性的加强生物体氧化磷酸化的过程,能更多地提供ATP来维持机体的生理活动。
低温胁迫下,生物体中不仅ATP合成酶类表达量增加,而且其他ATP酶类的活性也会增强。例如P-ATPase,通过水解ATP产生的能量来运输各种离子。孔祥会等[24]通过测定锯缘青蟹鳃中的P-ATPase活性,发现与在常温下生活的锯缘青蟹相比,低温驯化后的锯缘青蟹鳃中的P-ATPase (Na+,K+-ATPase、Mg2+-ATPase、Ca2+-ATPase和Ca2+,Mg2+-ATPase)活性均随着驯化温度的降低而升高。另外,对南极鱼和罗非鱼的相关研究结果也支持这一结论[25-26]。低温下生物体鳃的P-ATPase活性增强的作用是以水解ATP产生的能量来维持鳃的呼吸,以及运输离子来维持鳃的渗透压平衡,从而保证体内氧的供应和基础代谢的正常进行[24]。ATP6V0C作为V-ATPase的V0结构域的c亚基,它能通过水解ATP释放能量驱动溶酶体膜上的质子泵将H+泵入溶酶体内,从而形成并维持溶酶体的酸性环境。因为只有在酸性环境条件下溶酶体才会与其他膜结构融合,借此达到清除无用的生物大分子以及损伤和死亡细胞的目的[27-28]。低温诱导的氧化应激产生的死亡细胞,可以通过这种方式予以清除[29]。笔者推测,低温下dmatp6v0c基因的过表达能够加速清理由于低温胁迫而产生的死亡细胞,清理出这些对细胞生长有害的物质,能更好地维持细胞稳态,其具体机制还有待进一步研究。
本研究中首次通过在 HeLa细胞中过表达dmatp6v0c基因,发现该基因可以减少低温胁迫下HeLa细胞的死亡率,表明在 HeLa细胞中dmatp6v0c基因具有抗寒的功能,本研究结果为dmatp6v0c基因成为提高生物体耐寒能力的功能基因提供了理论依据,同时提供了一种体外快速评估候选基因抗寒能力的方法。
参考文献:
[1] 胡雪松,李池陶,徐伟,等.黑龙江鲤、德国镜鲤选育系与荷包红鲤抗寒品系生长及越冬体重损失的初步研究[J].水产学报,2010,34(8):1182-1189.
[2] 朱华平,卢迈新,黄樟翰,等.低温对罗非鱼基因组DNA甲基化的影响[J].水产学报,2013,37(10):1460-1467.
[3] Chen Z Z,Cheng C H C,Zhang J F,et al.Transcriptomic and genomic evolution under constant cold in Antarctic notothenioid fish [J].Proceedings of the National Academy of Science of the United States of America,2008,105(35):12944-12949.
[4] Smith A N,Borthwick K J,Kamt F E.Molecular cloning and characterization of novel tissue-specific isoforms of the human vacuolar H+-ATPase C,G and D subunits,and their evaluation in autosomal recessive distal renal tubular acidosis[J].Gene,2002,297:169-177.
[5] Hanada H,Hasebe M,Moriyama Y.Molecular cloning of cDNA encoding the 16 KDa subunit of vacuolar H(+)-ATPase from mouse cerebellum[J].Biochemical and Biophysical Research Communications,1991,176(3):1062-1067.
[6] Toei M,Saum R,Forgac M.Regulation and isoform function of the V-ATPases[J].Biochemistry,2010,49(23):4715-4723.
[7] Nishi T,Forgac M.The vacuolar H+-ATPases-nature's most versatile proton pumps[J].Nature Reviews Molecular Cell Biology,2002,3(2):94-103.
[8] Marshansky V,Rubinstein J L,Gruber G.Eukaryotic V-ATPase:novel structural findings and functional in sights[J].Biochimica et Biophysica Acta(BBA)Bioenergetics,2014,1837(6):857-879.
[9] Lu X D,Qin W X,Li J J,et al.The growth and metastasis of human hepatocellular carcinoma xenografts are inhibited by small interfering RNA targeting to the subunit ATP6L of proton pump[J]. Cancer Research,2005,65(15):6843-6849.
[10] Inoue T,Forgac M.Cysteine-mediated cross-linking indicates that subunit C of the V-ATPase is in close proximity to subunits E and G of the V1 domain and subunit a of the V0 domain[J]. Journal of Biology and Chemistry,2005,280(30):27896-27903.
[11] Home W C,Sanjay A,Bmzzaniti A,et al.The role(s)of Src kinase and Cbl proteins in the regulation of osteoclast differentiation and function[J].Immunol Reviews,2005,208(1):106-125.
[12] Tehrani S,Faecio R,Chandrasekar I,et al.Cortactin has all essential and specific role in osteoclast actin assembly[J].Molecular Biology of the Cell,2006,17:2882-2895.
[13] Yamamoto A,Tagawa Y,Yoshimori T,et al.Bafilomycin A1 prevents maturation of autophagic vacuoles by inhibiting fusion between autophagosomes and lysosomes in rat hepatoma cell line,H-4-II-E cells[J].Cell Struction and Function,1998,23(1):33-42.
[14] Yoshimori T,Yamamoto A,Moriyama Y,et al.Bafilomycin A1,a specific inhibitor of vacuolar-type H(+)-ATPase,inhibits acidification and protein degradation in lysosomes of cultured cells[J].The Journal of Biological and Chemistry,1991,266(26):17707-17712.
[15] Schuldiner S,Fishkes H,Kanner B I.Role of a transmembrane pH gradient in epinephrine transport by chromafin granule membrane-vesicles[J].Proceedings of the National Academy of Sciences of the United States of America,1978,75(8):3713-3716.
[16] Chung AY,Kim M J,Kim D,et al.Neuron-specific expression of atp6v0c2 in zebrafish CNS[J].Developmental Dynamics,2010,239(9):2501-2508.
[17] Nicoletti I,Migliorati G,Pagliacci M,et al.A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry[J].Journal of Immunological Methods,1991,139(2):271-279.
[18] O'Brien K M.Mitochondrial biogenesis in cold-bodied fishes[J]. The Journal of Experimental Biology,2011,214:275-285.
[19] Somero G N.Adaptation of enzymes to temperature:searching for basic“strategies”[J].Comparative Biochemistry and Physiology,2004,139(3):321-333.
[20] Coppe A,Agostini C,Marino I A,et al.Genome evolution in the cold:Antarctic icefish muscle transcriptome reveals selective duplications increasing mitochondrial function[J].Genome Biology Evolve,2012,5(1):45-60.
[21] Belogrudov G I.Recent advances in structure-functional studies of mitochondrial factor B[J].Journal of Bioenerg and Biomembr,2009,41:137-143.
[22] Belogrudov G I.Coupling factor B affects the morphology of mitochondria[J].Journal of Bioenerg and Biomembr,2010,42:29-35.
[23] Gracey A Y,Fraser E J,Li W Z,et al.Coping with cold:an integrative,multitissue analysis of the transcriptome of a poikilothermic vertebrate[J].Proceedings of the National Academy of Science of the United States of America,2004,101(48):16970-16975.
[24] 孔祥会,王桂忠,李少菁.低温驯化锯缘青蟹鳃抗氧化防护、ATPase及膜脂肪酸组成变化[J].水生生物学报,2007,31 (1):59-66.
[25] Gonzalez-Cabrera P J,Dowd F,Pedibhotla V K,et al.Enhanced hypo-osmoregulation induced by warm-acclimation in Antarctic fish mediated by increased gill and kidney Na+/K(+)-ATPase activities[J].The Journal of Experimental Biology,1995,198(Pt 11):2279-2291.
[26] Sun L T,Chen G R,Chang C F.Characteristics of blood parameters and Na+/K(+)-ATPase in chilled comato-tilapia cultured in various salinities[J].Comp Biochem Physiol,1994,107(A):641-646.
[27] Bayer M J,Reese C,Buhler S,et al.Vacuole membrane fusion:V0 functions after trans-SNARE pairing and is coupled to the Ca2+-releasing channel[J].Journal of Cell Biology,2003,162:211-222.
[28] Baars T L,Petri S,Peters C,et al.Role of the V-ATPase in regulation of the vacuolar fission-fusion equilibrium[J].Mol Biol Cell,2007,18:3873-3882.
[29] Qi Z H,Liu Y F,Luo S W,et al.Molecular cloning,characterization and expression analysis of tumor suppressor protein p53 from orange-spotted grouper,Epinephelus coioides in response to temperature stress[J].Fish&Shellfish Immunology,2013,35(5):1466-1476.
Cloning of atp6v0c gene from Antarctic notothenioid fish Dissostichus mawsoni and identification of its cold tolerance in HeLa cell
Abstract:The atp6v0c gene of Antaratic notothenioid fish Dissostichus mawsoni was cloned from Antarctic notothenioid fish cDNA library,and then transfected the dmatp6v0c gene obtained into the HeLa cell to detect cell viability under cold stress(10℃)by flow cytometry to investigate the ATPase responsive for the cold adaptation in Antarctic notothenioid fish.The complete coding sequence with 462 bp of dmatp6v0c gene was cloned and sequenced,and the dmatp6v0c coding sequence was inserted into the pcDNA3.1(-)vector by XhoI and BamHI restriction sites for gene expression in HeLa cell.The results showed that over-expression of dmatp6v0c gene in HeLa cell was found to reduce the cell mortality from 19.23%±1.87%to 8.13%±0.04% (P<0.05)under cold stress compared with the control group.The findings indicated that the expression level of dmatp6v0c was heavily involved in cell viability under cold stress and that dmatp6v0c could be considered as a candidate for breeding cold resistant fish.
Key words:Dissostichus mawsoni;cold stress;dmatp6v0c gene;HeLa cell;cell mortality
中图分类号:Q291
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.01.002
文章编号:2095-1388(2016)01-0007-06
收稿日期:2015-04-05
基金项目:国家 “973”重点基础研究发展计划项目 (2010CB126304);国家基金委重点项目 (31130049);上海市一流学科水产基础生物学项目