玻勒虹彩病毒单克隆抗体的制备及初步应用
景宏丽1,林祥梅1,梅琳1,张旻1,王娜1,高隆英2,张利峰3,吴绍强1
(1.中国检验检疫科学研究院,北京100029;2.深圳蛇口出入境检验检疫局,广东 深圳518067;3.北京出入境检验检疫局,北京100026)
摘要:为了制备抗玻勒虹彩病毒 (Bohle virus,BIV)的单克隆抗体,应用杂交瘤细胞技术,制备了1株稳定分泌抗玻勒虹彩病毒单克隆抗体的杂交瘤细胞株 (3A4),并对其单克隆抗体特性进行分析和初步应用。结果表明:单抗3A4腹水效价为105以上,属于IgG3型,κ链;单抗3A4与大鲵虹彩病毒 (ADIV)、流行性造血器官坏死病毒 (EHNV)发生反应,与其他病毒株和细胞株不发生反应;单抗3A4可识别相对分子质量为50 000的蛋白;应用捕获ELISA方法对样品进行检测,建立的捕获ELISA方法能用于蛙病毒的检测。该单抗为BIV的快速诊断及流行病学监测提供了检测试剂。
关键词:玻勒虹彩病毒 (BIV);捕获ELISA;单克隆抗体
玻勒虹彩病毒 (Bohle virus,BIV)是从澳大利亚北部的患病土著青蛙Limnodynastes ornatus上分离获得[1],其属于虹彩病毒科、蛙病毒属。
蛙病毒的病毒颗粒较大 (直径为150~180 nm),呈二十面体对称。基因组为150~170 kb的双链DNA,在胞核和胞质中均可进行复制。蛙病毒属除了玻勒虹彩病毒外,还包括欧鮰病毒 (European catfish virus,ECV)和流行性造血器官坏死病毒 (Epizootic haematopoietic necrosis virus,EHNV)等[2]。其中EHNV和BIV的基因长度分别为126、109 kb,但二者的免疫原性、病毒扩增温度和形态学分析等都有很高的相似性[3-5],特别是主要衣壳蛋白 (MCP)基因具有相当的保守性。
为了有效控制蛙病毒疾病,世界动物卫生组织(OIE)已于2009年正式将 “蛙病毒感染”列入必须申报的水生动物疫病名录[6]。迄今为止,全世界已经分离到十几个该属的病毒,并且还在不断的增加[6-10]。该病在美洲、亚洲和欧洲都有流行,近年来中国也有从牛蛙和大鲵中分离到蛙病毒的相关报道[6,11]。蛙病毒属病毒宿主范围广泛,包括鱼类、两栖类、爬行类和一些易感染的其他动物种类[12]。玻勒虹彩病毒,在人工感染试验中发现除了能够感染各种蛙类,还能够感染一些鱼类[13-14]。蛙病毒属病毒具有共同的抗原性,可以通过建立免疫学检测方法进行鉴定和监测。
目前对于玻勒虹彩病毒的研究很多方面还处于空白。尽管已经有一些分子生物学方法[15-16]和细胞分离法的相关报道,但这些方法都有一定不足,如检测时间长、操作复杂或者依赖贵重仪器等。本试验中,制备了抗玻勒虹彩病毒的单克隆抗体,并对其单克隆抗体的特性进行了分析鉴定,旨在为进一步研制玻勒虹彩病毒检测方法及研究玻勒虹彩病毒相关蛋白奠定基础。
1 材料与方法
1.1 材料
试验动物购于北京军事科学与医学研究院;抗玻勒虹彩病毒山羊多克隆抗体、SP2/0细胞、鱼类细胞株和病毒株等均由中国检验检疫科学研究院水生实验室保存;RPMI1640购于HyClone公司;特级胎牛血清购于杭州四季青公司;HAT、HT和聚乙二醇 (PEG1500)均购于 Gibco公司;硫酸盐TMB、辣根过氧化物酶 (HRP)标记的山羊抗小鼠IgG和免疫佐剂等均购于Sigma公司;SBA抗体分型试剂盒由美国Shouthern Biotech生产;其他试剂均为国产分析纯,试验中其他耗材购于Corning公司;二氧化碳培养箱为SANYO公司产品,Avanti J-30I超速离心机为Beckman公司产品。
1.2 方法
1.2.1 抗原制备及动物免疫 将由CHSE细胞在22.5℃下扩增的BIV病毒,以6000 r/min离心40 min后,再以24 000 r/min离心2 h,收集沉淀,用0.4mL 8.5%的生理盐水重悬。免疫程序参照文献 [17]。
1.2.2 细胞融合与筛选 从免疫的BALB/c鼠眼球采血,分离血清,该血清作为抗体检测时的阳性对照血清。按常规融合方法[17-18]进行细胞融合。阳性杂交瘤细胞筛选时,采用间接ELISA方法检测为阳性孔时用有限稀释法进行细胞亚克隆。
1.2.3 单克隆抗体的制备 取6~8周龄雌性BALB/c小鼠,腹腔注射无菌的液体石蜡 (0.5 mL/只),1周后,腹腔注射阳性杂交瘤细胞 (0.5 mL/只)。具体制备方法参照文献 [17]。
1.2.4 单克隆抗体的生物学鉴定
(1)MAb效价测定。采用间接ELISA方法,即取纯化后的BIV病毒3μg/mL包埋ELISA板,腹水以10倍比进行稀释,以免疫前小鼠血清作为阴性对照,当P/N≥2.1时的最大稀释度作为MAb效价。具体操作参照文献 [17,19]。
(2)MAb亚型分析。应用SBA抗体分型试剂盒鉴定亚型,按照操作说明书方法进行。
(3)Western-blotting分析鉴定。将纯化的BIV和浓缩的CHSE细胞裂解液进行SDS-PAGE分析,将蛋白转印到硝酸纤维膜上,用100 g/L脱脂奶粉4℃ 下封闭过夜。洗膜后,加入腹水抗体(1∶10 000),37℃下孵育1 h。洗膜后,加入辣根过氧化物酶 (HRP)标记的山羊抗小鼠 IgG (1∶5000),37℃下孵育1 h,洗膜,用DAB显色。
(4)单克隆抗体的特异性鉴定。参照文献[17,19]中的方法,即使用实验室保藏的病毒株和细胞株,包括草鱼呼肠孤病毒 (Grass carp reovirus,GCRV)、鲤春病毒 (Spring viraemia of carp virus,SVCV)和大鲵虹彩病毒 (Andrias davidianus iridov irus,ADIV)等代替BIV作为包被抗原 (浓度约为3μg/mL),同时设BIV阳性对照,以SP2/ 0细胞培养物上清液作为阴性对照。用间接ELISA检测单克隆抗体的特异性。
(5)捕获ELISA方法鉴定。包埋纯化的鼠单克隆抗体,每孔10μg/mL,于4℃下过夜,用 PBST洗涤,用3%的BSA封闭,37℃下静置60 min;洗涤后加入10倍比稀释的BIV细胞培养物(原浓度为5×106cfu/mL),每孔100μL,37℃下静置90min;洗涤后,再加入抗BIV的山羊多克隆抗体,每孔10μg/mL,37℃下反应90 min;洗涤后加入辣根过氧化物酶 (HRP)标记的小鼠抗山羊IgG的二抗,每孔100μL,37℃下再反应90 min;洗涤后,每孔100μL,避光发色,阳性显色,阴性未显示时终止,室温暗处反应5 min;用2 mol/L H2SO4终止反应,用酶标仪测定。
结果判定标准:测定波长为450 nm时各孔的吸光度 (A)值,计算阳性光吸收值与阴性光吸收值之比 (P/N),当P/N≥2.1时判定为阳性。
1.2.5 捕获ELISA方法应用 将病毒悬液BIV (浓度为5×106pfu/mL),分别用健康的虹鳟内脏组织和牛蛙内脏组织按照1∶10的比例制备两份样品,标记为1#和2#;而健康虹鳟内脏组织样品标记为3#,健康牛蛙内脏组织样品标记为4#。将4份样品用上述捕获ELISA方法进行检测,阳性对照为BIV病毒悬液,阴性对照为EPC等鱼类细胞碎片悬液。
2 结果与分析
2.1 杂交瘤细胞株的建立
用间接ELISA方法进行筛选,经过多次克隆和筛选获得1株能稳定分泌抗BIV单克隆抗体的杂交瘤细胞株,命名为3A4。
2.2 抗体效价和亚型分析
采用间接ELISA法测得腹水的效价为105以上。抗体分型试剂盒检测结果表明,该抗体亚型属于IgG3型,κ链。
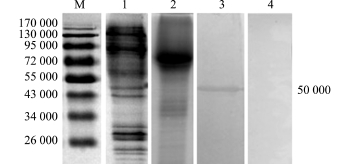
2.3 用W estern blot法检测有关蛋白
如图1所示,MAb对应的抗原决定簇位点位于BIV的相对分子质量为50 000的蛋白带上, MAb与CHSE细胞裂解液不反应。
2.4 单克隆抗体的特异性鉴定
间接ELISA检测结果显示,单克隆抗体EHNV和ADIV的P/N值均明显高于GCRV、SVCV和细胞株的P/N值,而与阳性对照值无明显差异 (表1)。
表1 MAb和病毒及细胞的ELISA反应结果 (P/N值)
Tab.1 Result of MAb obtained w ith various and cell lines in ELISA(P/N value)
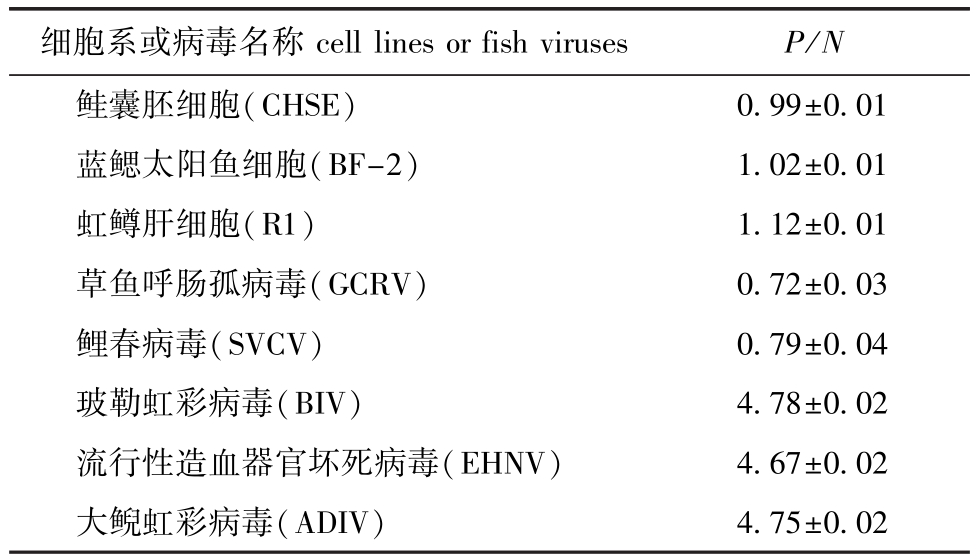
细胞系或病毒名称 cell lines or fish viruses P/N鲑囊胚细胞(CHSE)0.99±0.01蓝鳃太阳鱼细胞(BF-2) 1.02±0.01虹鳟肝细胞(R1) 1.12±0.01草鱼呼肠孤病毒(GCRV) 0.72±0.03鲤春病毒(SVCV) 0.79±0.04玻勒虹彩病毒(BIV) 4.78±0.02流行性造血器官坏死病毒(EHNV) 4.67±0.02大鲵虹彩病毒(ADIV)4.75±0.02
2.5 捕获ELISA方法的鉴定
应用单克隆抗体与多克隆抗体建立的捕获ELISA法能够检测出BIV病毒细胞培养物,检测的最低病毒滴度为5×104pfu/mL,如表2所示。
表2 捕获ELISA方法的鉴定结果 (P/N值)
Tab.2 The sensitivity assay of antigencapture ELISA (P/N value)
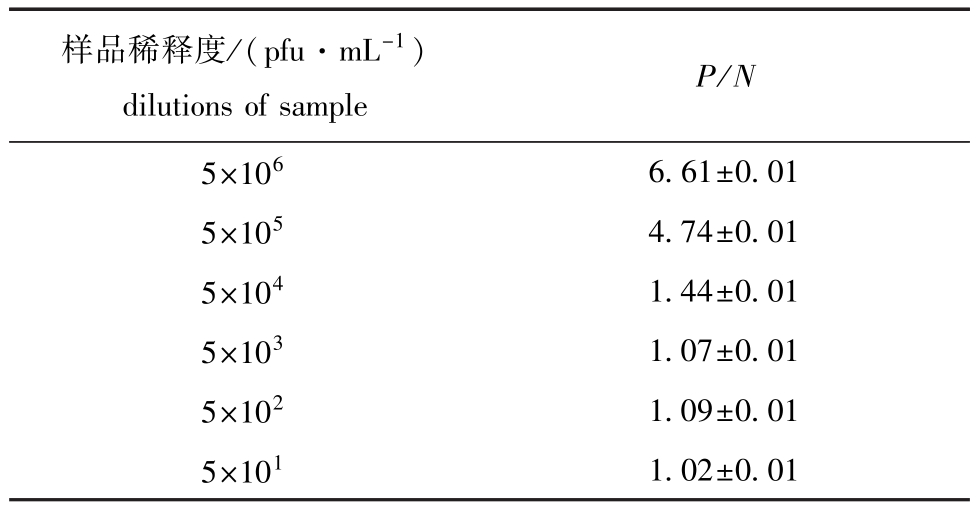
样品稀释度/(pfu·mL-1)P/N dilutions of sample 5×1066.61±0.01 5×105 4.74±0.01 5×104 1.44±0.01 5×103 1.07±0.01 5×102 1.09±0.01 5×1011.02±0.01
2.6 捕获ELISA方法的应用
应用ELISA方法检测4份样品,根据建立的ELISA方法判定标准,结果显示,1#和2#为阳性, 3#和4#为阴性,如表3所示。
表3 ELISA检测样品结果 (OD值,P/N值)
Tab.3 Results of the samp les detected by ELISA(OD value,P/N value)
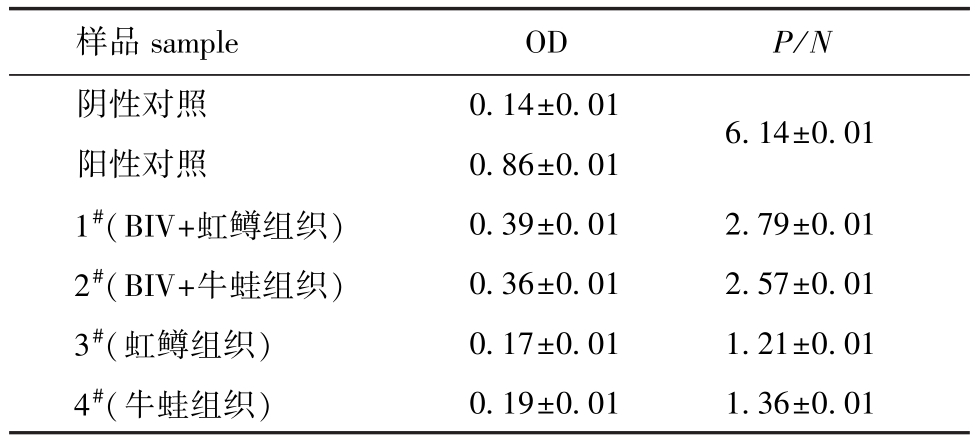
样品sample OD P/N阴性对照 0.14±0.016.14±0.01阳性对照 0.86±0.01 1#(BIV+虹鳟组织) 0.39±0.01 2.79±0.01 2#(BIV+牛蛙组织) 0.36±0.01 2.57±0.01 3#(虹鳟组织) 0.17±0.01 1.21±0.01 4#(牛蛙组织)0.19±0.01 1.36±0.01
3 讨论
本试验中采用玻勒虹彩病毒作为免疫原,成功地制备出抗玻勒虹彩病毒的单克隆抗体。Westernblotting结果显示,单克隆抗体针对抗原决定簇位点位于相对分子量为50 000左右的蛋白上。
根据国际病毒分离委员会2012年的第九次报告,蛙病毒属的成员可能含有100~130个基因,蛙病毒中能查到的接近50 000的蛋白除了结构蛋白MCP外,只有可溶性功能蛋白磷酸转移酶(phosphotrasferase) 和解旋酶 (helicase)。其中MCP蛋白为461个氨基酸,分子量为50 000~51 000,最为接近该值,且MCP的量很大。2011年江育林等[6]已经证实,ADIV与BIV的MCP基因片段序列相似性达到96.6%。而GenBank中能查到的蛙病毒属成员中该基因的相似性也都大于95%。本试验中单克隆抗体的特异性分析结果也显示,该单克隆抗体能够特异性地识别 EHNV、ADIV和BIV,进一步证实了这3种病毒具有共同抗原位点。由此可见,本试验中制备的单克隆抗体针对的抗原位点可能在玻勒虹彩病毒的MCP上,所制备的单克隆抗体是属特异性的,即可以把蛙病毒属的成员和该属以外的其他病毒区别开来。
在单克隆抗体应用方面,应用建立的捕获ELISA方法检测样品的结果显示,BIV病毒和内脏组织的混合样品 (1#和2#)与分别对应的内脏组织样品 (3#和4#)的OD值差异较大,且P/N值均大于2.1。这一结果表明,建立的捕获ELISA方法能检测出鱼组织或者蛙组织中的BIV病毒,也进一步暗示了建立的捕获ELISA方法能够用于患病鱼类或者两栖类中蛙病毒的检测。但是在实际临床应用方面,还需要进一步研究。
参考文献:
[1] Speare R,Smith JR.An iridovirus-like agent isolated from the ornate burrowing frog Limnodynastes ornatus in northern Australia [J].Dis Aquat Organ,1992,14:51-57.
[2] 世界动物卫生组织(OIE).水生动物疾病诊断手册[M].3版.国家质量监督检验检疫总局译.北京:中国农业出版社,2000: 38-43.
[3] Bayley A E,Hill B J,Feist SW.Susceptibility of the European common frog Rana temporaria to a panel of ranavirus isolates from fish and amphibian hosts[J].Dis Aquat Organ,2013,103(4): 171-183.
[4] Hyatt A D,Gould A R,Zupanovic Z,et al.Comparative studies of piscine and amphibian iridoviruses[J].Arch Virol,2000,145 (2):301-31.
[5] Marsh IB,Whittington R,Rourke J,et al.Rapid differentiation of Australian,European and American ranaviruses based on variation in major capsid protein gene sequence[J].Mol Cell Probes,2002, 16(2):137-151.
[6] 江育林,张旻,景宏丽,等.患病中国大鲵中分离到一株虹彩病毒及其特性的研究[J].病毒学报,2011,27(3):274-282.
[7] Cunningham A A,Hyatt A D,Russe P,et al.Emerging epidemic diseases of frogs in Britain are dependenton the source of ranavirus agent and the route of exposure[J].Epidemiol Infect,2007,135 (7):1200-1212.
[8] Fox SF,Greer A L,Torres CR,et al.First case of ranavirus-associated morbidity and mortality in natural populations of the South American frog Atelognathus patagonicus[J].Dis Aquat Organ, 2006,72(1):87-92.
[9] Harp E M,Petranka JW.Ranavirus in wood frogs(Rana sylvatica):potential sources of transmission within and between ponds [J].JWildl Dis,2006,42(2):307-318.
[10] Hyatt A D,Williamson M,Coupar B EH,etal.First identification of a ranavirus from green pythons(Chondropython viridis)[J].J Wildl Dis,2002,38(2):239-252.
[11] 张奇亚,李正秋,江育林,等.沼泽绿牛蛙病毒的分离及其细胞感染的初步研究[J].水生生物学报,1996,20(4):390-392.
[12] Whittington R J,Becker JA,DennisM M.Iridovirus infections in finfish-critical review with emphasis on ranaviruses[J].J Fish Dis,2010,33(2):95-122.
[13] Cullen B R,Owens L.Experimental challenge and clinical cases of Bohle iridovirus(BIV)in native Australian anurans[J].Dis Aquat Organ,2002,49(2):83-92.
[14] Coupar B E,Goldie H SG,Hyatt A D,et al.Identification of a Bohle iridovirus thymidine kinase gene and demonstration of activity using vaccinia virus[J].Arch Virol,2005,150(9):1797-1812.
[15] Pallister J,Gould A,Harrison D,et al.Development of real-time PCR assays for the detection and differentiation of Australian and European ranaviruses[J].JFish Dis,2007,30(7):427-438.
[16] Zhang M,Jing H L,Zhang L F,et al.A loop-mediated isothermal amplification method for the detection of members of the genus Ranavirus[J].Arch Virol,2013,158(10):2121-2126.
[17] 景宏丽,王静波,曹欢,等.病毒性出血性败血症病毒单克隆抗体的制备及其特性分析[J].细胞分子与免疫学,2013,29 (4):400-406.
[18] 李强,迟刚,李莹,等.仿刺参体腔细胞单克隆抗体的制备及特性分析[J].大连海洋大学学报,2010,25(6):542-546.
[19] 景宏丽,张旻,王娜,等.鲤春血症病毒单克隆抗体的建立及免疫学特性的鉴定[J].检验检疫学刊,2014(3):55-59.
Preparation and prelim inary application ofmonoclonal antibodies against Bohle virus
JING Hong-li1,LIN Xiang-mei1,MEILin1,ZHANG Min1,WANG Na1, GAO Long-ying2,ZHANG Li-feng3,WU Shao-qiang1
(1.Chinese Academy of Inspection and Quarantine,Beijing 100029,China;2.Shekou Entry-Exit Inspection and Quarantine Bureau in Shenzhen, Shenzhen 518067,China;3.Beijing Entry-Exit Inspection and Quarantine Bureau,Beijing 100026,China)
Abstract:One monoclonal antibody(MAb)(3A4)against Bohle virus(BIV)was prepared by immunizing BALB/cmice and the MAb(3A4)characteristics and application were studied by indirectenzyme-linked immunoassay(ELISA)and western-blotting.An antigen-capture ELISA was developed and the sampleswere detected by BIV.The indirect ELISA revealed that the titer ofMAb(3A4)asciteswas105,and belonged to IgG3 subclass and κchain.The MAb(3A4)did not reactwith other fish viruses or fish cells lines in the ELISA test except BIV,Andrias davidianus iridovirus(ADIV)and epizootic haematopoietic necrosis virus(EHNV).In the western blotting using MAb 3A4,a 50 000 protein band was observed when BIV was used as antigen.The antigen-capture ELISA confirmed that the ELISA was able to detect virus from amphibian,and the obtained MAb was applied to rapid diagnosis and detection of BIV in aquaculture.
Key words:Bohle virus(BIV);antigen-capture ELISA;monoclonal antibody
中图分类号:S941
文献标志码:A
收稿日期:2014-12-24
基金项目:“十二五”国家科技支撑计划项目 (2013BAD12B02);质检公益行业科研专项 (201310221)
作者简介:景宏丽 (1984—),女,工程师。E-mail:jinghongli8451@126.com
通信作者:吴绍强 (1970—),男,研究员。E-mail:sqwu@sina.com
DOI:10.16535/j.cnki.dlhyxb.2015.05.010
文章编号:2095-1388(2015)05-0505-04