虹鳟肠炎红嘴病病原菌的确定及其生长特性研究
连浩淼1、2,卢彤岩1,刘红柏1,尹家胜1,张辉2,李绍戊1
(1.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070;2.东北农业大学动物科技学院,黑龙江哈尔滨150030)
摘要:为了确定虹鳟Oncorhynchusmykiss肠炎红嘴病的病原菌,采用分离纯化的方法从患病虹鳟肝脏和脾脏内分离到一种细菌 (BH1206),通过人工感染试验并且采用常规生化鉴定、API20E试剂盒、Biolog鉴定系统和分子测序方法对该菌进行判断,采用纸片法对该菌进行药敏试验。结果表明:BH1206菌株为患病虹鳟的致病菌,感染该菌后虹鳟体表呈现出血点,吻端红肿及溃烂,有红色脓状物包裹肛门,肠道出血,内部脏器均有不同程度的病变;该菌为革兰阴性、氧化酶阴性的非发酵型需氧杆菌;根据生理特征及分子鉴定结果分析,BH1206菌株为鲁氏耶尔森菌Yersini ruckeri;BH1206菌株在温度为28~30℃时生长状态最佳,在pH为6.5~7.5范围内生长状态最佳,在NaCl浓度为3%内的培养基中能生长并且NaCl含量为0时生长状态最佳;BH1206菌株对利福平、多黏菌素、阿莫西林完全耐药,对复方新诺明、庆大霉素、卡那霉素、羧苄青霉素、强力霉素、诺氟沙星、氨苄西林、青霉素、链霉素、四环素、环丙沙星、左氧氟沙星、红霉素、氧氟沙星、恩诺沙星、氯霉素、呋喃唑酮、新霉素均有不同程度的敏感。研究表明,虹鳟肠炎红嘴病病原菌为鲁氏耶尔森菌,药敏试验结果可以为该病的防治提供参考。
关键词:虹鳟;鲁氏耶尔森菌;16S rRNA;药敏试验
虹鳟Oncorhynchusmykiss作为一种珍贵的鲑科鱼类,具有肉味鲜美、营养丰富、蛋白质含量高、生长迅速等特点,在1959年被引入中国后逐渐成为主要的冷水鱼养殖品种之一。但是在养殖过程中,由于养殖密度增加、水环境恶化、饲料质量不佳和管理不当等因素,虹鳟细菌性病害频发[1-3]。目前,中国养殖虹鳟所患细菌性疾病主要有疖疮病、弧菌病、烂鳃病、肠炎病等[4],疾病已经严重影响了虹鳟鱼类的健康养殖,同时影响了人类饮食健康。国内外已报道了嗜水气单胞杆菌 Aeromonas hydrophila[5]、迟钝爱德华菌Edwardsiella tarda[6]、弧菌Vibriosis[7]、约氏黄杆菌Flavobacterium johnsoniae[8]、杀鲑气单胞菌杀鲑亚种 Aeromonas salmonicida[9]等几种虹鳟的致病菌,但中国还没有对虹鳟感染鲁氏耶尔森菌Yersini ruckeri的系统性研究报道。
2013年7月,青海地区某冷水鱼养殖厂虹鳟发生急性传染病,造成虹鳟大量死亡。病鱼主要症状表现为吻端红肿,体表和肠道出血,肛门红肿,有红色囊肿包裹肛门等,此症状表现为虹鳟肠炎红嘴病。本研究中,从发病虹鳟组织中分离出一种可疑致病菌,并对其进行了病原性确定,在API 20E试剂条及常规生化鉴定的基础上,应用Bioloy微生物鉴定系统进行初步鉴定,并且采用16S rRNA序列测定系统发育分析的方法对该菌进行鉴定,并对该菌的生长特性以及药物敏感性进行了分析,以期为虹鳟鲁氏耶尔森菌的防治提供有效参考。
1 材料与方法
1.1 材料
患病虹鳟采自青海地区某冷水鱼养殖厂,体质量为20~50 g。健康虹鳟购自牡丹江某冷水鱼养殖基地,平均体质量为20 g左右。
1.2 方法
1.2.1 常规生化鉴定及API生化鉴定 在无菌条件下,从患病鱼肝脏和脾脏处取样划线接种于TSA琼脂平板上,28℃下倒置培养24 h,挑取单个优势菌落在TSA平板上纯化培养,获得纯培养菌株,编号为BH1206。肉眼观察菌落形态、大小、颜色,革兰染色后应用光学显微镜观察细菌形态特征,同时应用API20E试剂条和常规生化鉴定管 (杭州天和微生物有限公司)鉴定。
1.2.2 Biolog系统鉴定 供试菌株在TSA培养基上连续接种2~3次后,划线接种到BUG培养基上,于28℃下培养24 h,用无菌棉签蘸生理盐水湿润后轻轻擦拭培养基上的单菌落,转入无菌稀释缓冲液中,混匀得到菌悬液,测定其浊度,控制在浊度标准的±3%以内。然后接种培养到96孔板上,置于28℃培养箱内培养。分两次读数,在接种到板上4~6 h读一次,之后16~24 h再读一次。
1.2.3 人工感染试验 将健康虹鳟置于室内水族箱中暂养一周,试验期间水温为 (14±1)℃,放养密度为30尾/m3。
将优势菌株BH1206接种于TSA琼脂平板上, 28℃下恒温培养24 h后,用无菌生理盐水洗下,并参照麦氏比浊法将菌悬液稀释至1.3×104、1.3× 105、1.3×106、 1.3×107、 1.3×108、 1.3×109、1.3×1010、1.3×1011CFU/mL。人工感染试验设8组,分别记为A、B、C、D、E、F、G、H组。从每组随机选取虹鳟10尾,按照0.1mL/20 g(体质量)的剂量,将每尾鱼腹腔注射不同浓度的菌液,并且设立注射等比例生理盐水的对照组,分别于12、24、48、72 h后观察记录鱼的死亡情况及病理症状,同时按改良的寇氏法计算菌株的半致死量(LD50)。
取具有自然发病症状的人工感染鱼,在无菌条件下进行细菌再分离培养,并比较分离到的细菌和攻毒用菌株的理化特征,若为同种细菌则说明所分离纯化的细菌为病原菌。
1.2.4 16S rRNA序列测定及系统发育分析 将BH1206菌株接种于TSB液体培养基中,28℃下以220 r/min震摇16 h后离心收集菌液,按照细菌基因组DNA提取试剂盒说明书提取细菌DNA并作为PCR模板DNA。利用细菌16S rRNA通用引物F27: 5′-AGAGTTTGATCMTGGCTCAG-3′和R1492:5′-GRTACCTTGTTACGACTT-3′对BH1206菌株16S rRNA基因进行扩增[10]。PCR产物由上海生工生物工程股份有限公司进行序列测定。
将BH1206菌株的16S rRNA序列与GenBank数据库中已知的气单胞菌属不同种和其他水产常见致病菌16S rRNA的核苷酸序列进行比较分析,采用ClustalW软件进行多序列匹配排列 (Multiple A-lignments),用软件包 Mega 5.0进行系统发育分析[11]。用Neighbor-joining法,使用Kimura-2-parameter模型构建分子系统树,抽样1000次重复检测分子系统树各分支的置信度。
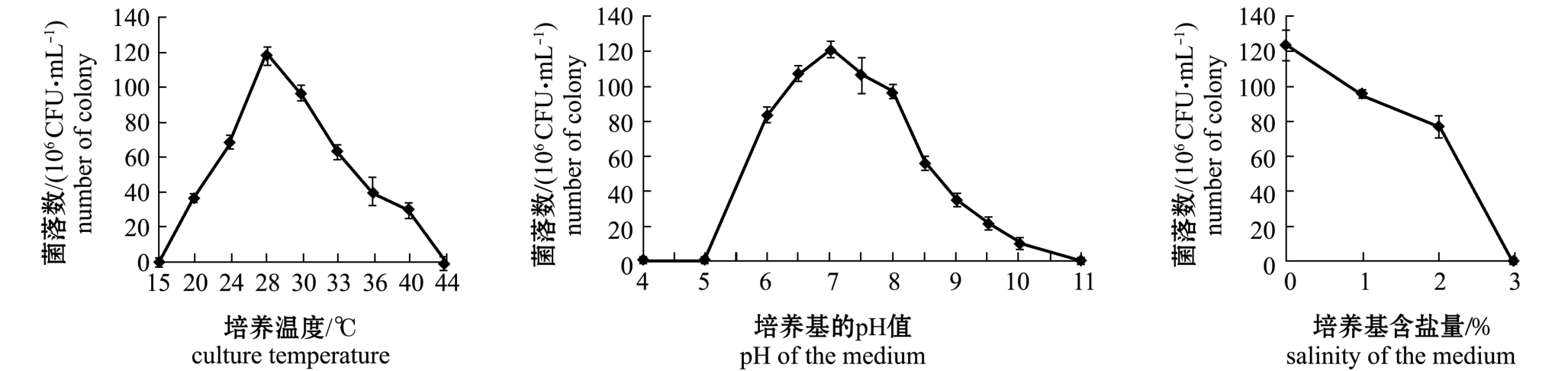
1.2.5 生长特性测定 无菌条件下将BH1206菌株接种于TSB培养基中,28℃下以220 r/min震摇过夜培养,将1 mL菌液接种于50 mL TSB培养基扩大培养,用紫外分光光度计测定OD600nm值达到0.556。无菌条件下取扩大培养菌液稀释106倍后的菌液0.1 mL,均匀涂布于 TSA培养基上,于15、20、24、28、30、32、36、40℃下培养14 h观察计数;取稀释后的菌液均匀涂布于pH值分别为 4.0、 5.0、 6.0、 6.5、 7.0、 7.5、 8.0、 8.5、9.0、9.5、10.0、11.0的 TSA培养基上,以及含盐量为0%、1%、2%、3%、4%的TSA培养基上,28℃下培养16 h,观察计数。
1.2.6 药敏试验 采用扩散法 (K-B法)进行药敏试验。将BH1206菌株挑入MH肉汤培养基中, 28℃下震荡培养过夜后将菌液浓度调至1.0×107CFU/mL,取0.1mL培养菌液均匀涂布于9 cm MH琼脂平板上,按4片/平板等距贴上药敏纸片 (杭州天和微生物有限公司),测定分离菌株对21种常见药物的敏感程度。将处理好的平板倒置于培养箱中,25℃下培养24 h,测定其抑菌圈直径,并根据CLSI标准进行药敏结果判定[10]。
2 结果与分析
2.1 人工感染试验
从患病虹鳟的肝脏和脾脏中分离到一株优势菌株,编号为BH1206,通过腹腔注射的方式进行人工感染试验。不同菌液浓度下虹鳟的死亡率见表1,随着菌液浓度的增大,死亡率不断增大。采用改良后的寇氏法计算菌株的半致死剂量LD50,结果表明,以腹腔注射方式对20 g左右虹鳟的半致死剂量为6.46×107CFU/mL。
人工感染的患病鱼出现病症与自然发病症状相一致,表现为吻端红肿出血,体表有出血点,肛门处有红色囊肿物包裹。解剖病鱼发现,肝部出血,脾肿大,肠壁充血,肠腔有血色液体。
通过镜鉴未发现寄生虫,另外从肝脏和脾脏分离出的细菌经纯化培养,通过形态观察、理化特征鉴定和16S rRNA序列测定,发现与BH1206菌株一致,由此证明,BH1206菌株为虹鳟肠炎红嘴病的病原菌。
表1 分离菌株对虹鳟的人工感染试验结果
Tab.1 Artificial challenge of rainbow trout w ith BH1206 strain
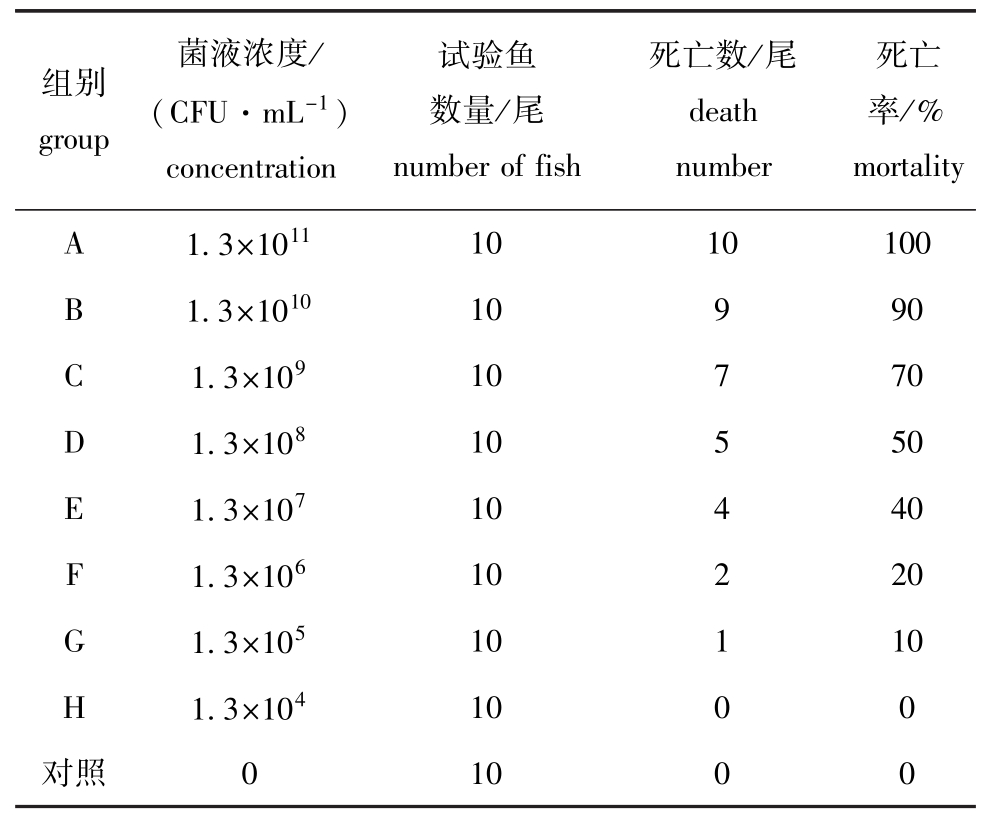
组别group菌液浓度/ (CFU·mL-1) concentration试验鱼数量/尾number of fish死亡数/尾death number死亡率/% mortality A 1.3×101110 10 100 B 1.3×1010 10 9 90 C 1.3×109 10 7 70 D 1.3×108 10 5 50 E 1.3×107 10 4 40 F 1.3×106 10 2 20 G 1.3×105 10 1 10 H 1.3×104 10 0 0对照010 0 0
2.2 BH1206菌株的生长特性
从温度、pH和含盐量3个方面对BH1206菌株的生长特性进行测定。结果表明:该菌在20~40℃范围内能生长,温度为28~30℃时生长状态最佳;在pH为6~10范围内能生长,在 pH为6.5~7.5时生长状态最佳;在NaCl浓度为3%内的培养基中能生长,并且NaCl含量为0时生长状态最佳 (图1)。
2.3 BH1206菌株的形态及生化特征
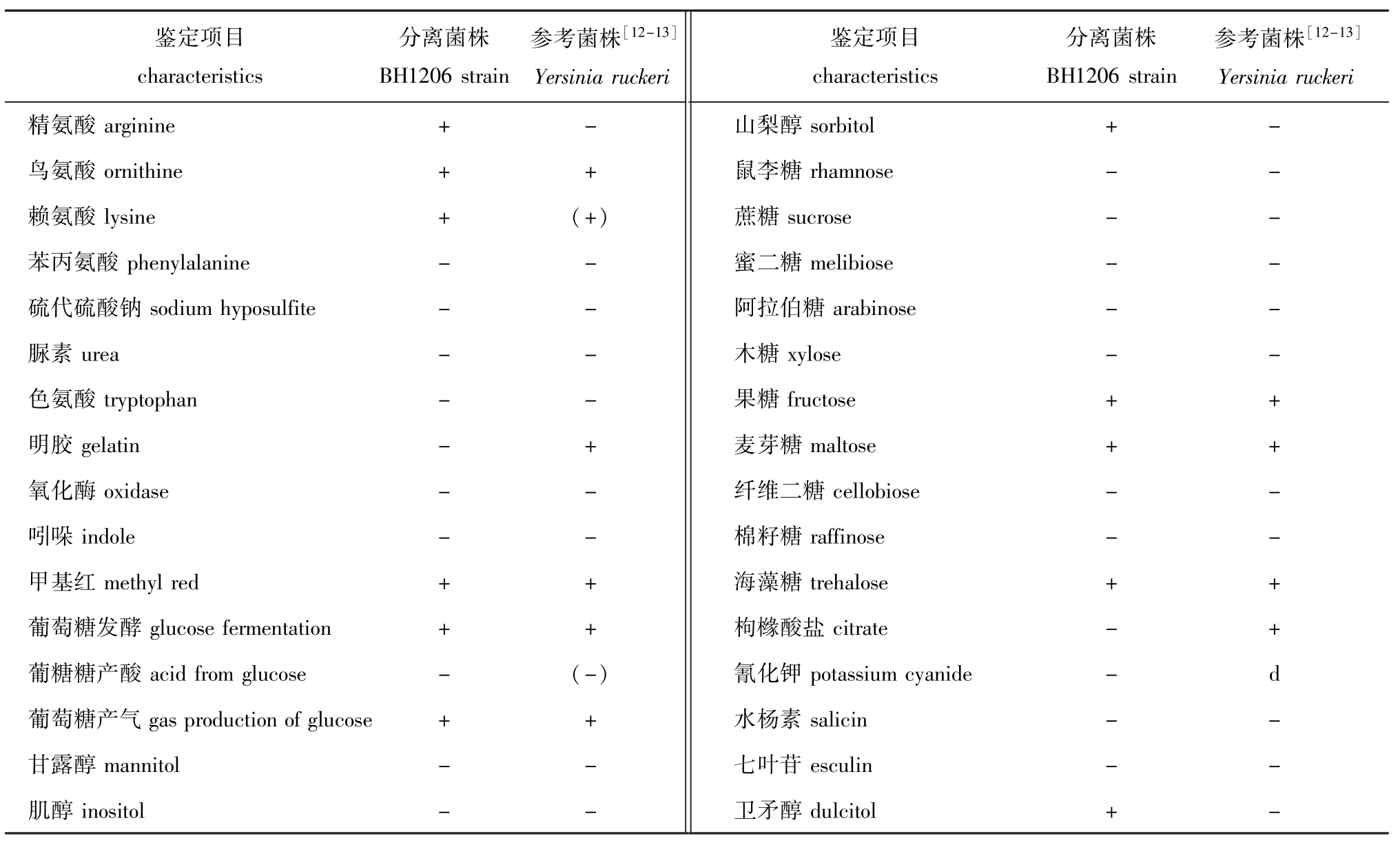
BH1206菌株在TSA平板上生长良好,形成表面光滑、边缘整齐、稍微隆起的白色菌落,菌落直径为1.1~1.5 mm。该菌为革兰阴性短杆菌,采用API 20E试剂条及常规生化鉴定管鉴定BH1206菌株,其生化特征表现为氧化酶反应阴性,为非发酵型需氧菌,其他生理生化特征见表2。
在Biolog系统鉴定过程中,供试菌株BH1206能够充分利用糊精、D-麦芽糖、D-海藻糖、N-乙酰-D-葡萄糖胺、D-葡萄糖、D-甘露糖、D-果糖、D-半乳糖、肌苷、甘氨酸-L-脯氨酸、L-丙氨酸、D-半乳糖醛酸、D-葡萄糖酸、柠檬酸等多种碳源,且4~6 h和16~24 h的读数结果一致。Biolog系统读取值显示,BH1206菌株与鲁氏耶尔森菌的相似值为0.617,按照 Biolog系统读取的16~24 h相似值>0.50,即可判定为系统给出的对应菌种。
通过上述3种常规生理生化方法鉴定可知, BH1206菌株为鲁氏耶尔森菌。
2.4 16S rRNA序列的测定及系统发育分析
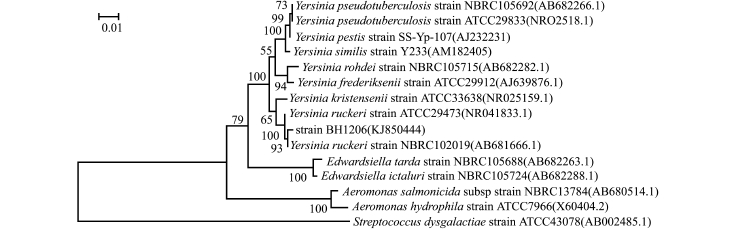
PCR扩增BH1206菌株的16S rRNA基因片段约1500 bp,测序结果表明,该片段大小为1446 bp,在GenBank中的登陆序列号为KJ850444,同源性检索结果表明,BH1206菌株与参考株鲁氏耶尔森菌核苷酸的一致性达到98%。
从NCBI核苷酸数据库中选取14株水产动物致病菌的16S rRNA序列进行系统发育学分析,利用Mega 5.0软件构建进化树,结果如图2所示。BH1206与鲁氏耶尔森菌 (NBRC102019 和ATCC29473)聚成一个分支,与气单胞菌属、爱德华菌属和链球菌属的细菌遗传距离较远。
综合常规生理生化和16S rRNA序列分析结果表明,BH1206菌株为鲁氏耶尔森菌。
2.5 药敏试验
BH1206菌株对21种抗菌药物的敏感性研究表明:该菌株对氟喹诺酮类药物如氧氟沙星、环丙沙星、诺氟沙星、恩诺沙星、左氧氟沙星敏感;对氯霉素、四环素、强力霉素、羧苄青霉素和复方新诺明敏感;对氨苄西林、青霉素、庆大霉素、卡那霉素、链霉素、新霉素和呋喃唑酮中度敏感;对红霉素、利福平、阿莫西林、多黏菌素 B不敏感,其中对阿莫西林、多黏菌素B、利福平的抑菌圈直径为0(表3)。
表2 BH1206菌株的生理生化特征分析
Tab.2 Physiological and chem ical characteristics of BH1206 strain in this study
注:+表示阳性;-表示阴性;(+)为缓慢阳性反应 (超过24 h);(-)为缓慢阴性反应 (超过24 h);d表示11%~89%的菌株为阳性
Note:+represents positive;-represents negative;(+)represents slow positive reaction(over 24 h);(-)represents slow negative reaction(over24 h);d represent11%-89%of the positive strains
鉴定项目characteristics分离菌株BH1206 strain参考菌株[12-13] Yersinia ruckeri鉴定项目characteristics分离菌株BH1206 strain参考菌株[12-13] Yersinia ruckeri精氨酸arginine + -鸟氨酸ornithine + +赖氨酸lysine + (+)苯丙氨酸phenylalanine - -硫代硫酸钠sodium hyposulfite - -脲素urea - -色氨酸tryptophan - -明胶gelatin - +氧化酶oxidase - -吲哚indole - -甲基红methyl red + +葡萄糖发酵glucose fermentation + +葡糖糖产酸acid from glucose - (-)葡萄糖产气gas production of glucose + +甘露醇mannitol - -肌醇 inositol - -山梨醇sorbitol + -鼠李糖rhamnose - -蔗糖sucrose - -蜜二糖melibiose - -阿拉伯糖arabinose - -木糖xylose - -果糖fructose + +麦芽糖maltose + +纤维二糖cellobiose - -棉籽糖 raffinose - -海藻糖trehalose + +枸橼酸盐citrate - +氰化钾potassium cyanide - d水杨素salicin - -七叶苷esculin - -卫矛醇dulcitol + -
3 讨论
虹鳟肠炎红嘴病由肠杆菌科Enterobacteriaceae、耶尔森氏菌属Yersinia的鲁氏耶尔森菌Yersinia ruckeri感染引起,此病最早于1952年在美国发现,在1966年分别由Rucker和Ross从发病的虹鳟体内分离到该病原菌[14]。国外已有学者对虹鳟感染鲁氏耶尔森氏菌疫苗方面进行了研究[15-16],而中国尚未有虹鳟感染鲁氏耶尔森菌系统的报道。鲁氏耶尔森菌属于革兰阴性短杆菌,为冷水性鲑鳟鱼类的常见病原菌之一[17-18]。患病鱼临床症状表现为食欲减退,吻端红肿,有红色囊肿包裹肛门;解剖鱼体,肝脏充血发黑,脾脏肿大,肠壁充血,肠腔有血色脓状物。鲁氏耶尔森菌的感染传播机制目前尚不明确。
本研究中,从青海某冷水鱼养殖厂的患病虹鳟鱼肝脏和脾脏分离出一株BH1206菌株,对虹鳟有明显的致病性。人工感染试验表明,BH1206菌株可感染健康虹鳟,并且具有致病和致死性,人工感染症状与自然发病症状相一致,均表现为吻端出血、肛门红肿、肠壁出血等,从人工感染患病虹鳟中分离的细菌经鉴定与BH1206菌株在形态及特征、理化特性和 16S rRNA序列上一致,表明BH1206菌株为本研究中虹鳟肠炎红嘴病的致病菌,该结果也与科赫法则完全相符。根据该菌的形态学特征和理化特性初步确定为鲁氏耶尔森菌。从表2可以看出,由于其在精氨酸双水解酶、山梨醇、卫矛醇、明胶的利用上与标准鲁氏耶尔森菌株存在差异,也与Fan等[19]在斑点叉尾鮰体内分离的鲁氏耶尔森菌不同,只能做初步鉴定而不能进行准确的鉴定。本研究中分离的BH1206菌株其16S rRNA序列与GenBank中登录的鲁氏耶尔森菌16S rRNA一致性达到98%以上;基于该序列构建的系统发育树表明,BH1206菌株与鲁氏耶尔森菌聚成一支;Biolog系统试验结果表明,BH1206菌株与鲁氏耶尔森菌的相似值为0.617,按照Biolog系统读取的16~24 h相似值>0.50即可判定为系统给出的对应菌种。通过一系列的分子及理化试验结论,进一步确认BH1206菌株为鲁氏耶尔森菌。
表3 BH1206菌株的药敏试验结果
Tab.3 Antibiotic sensitivity test of strain BH1206
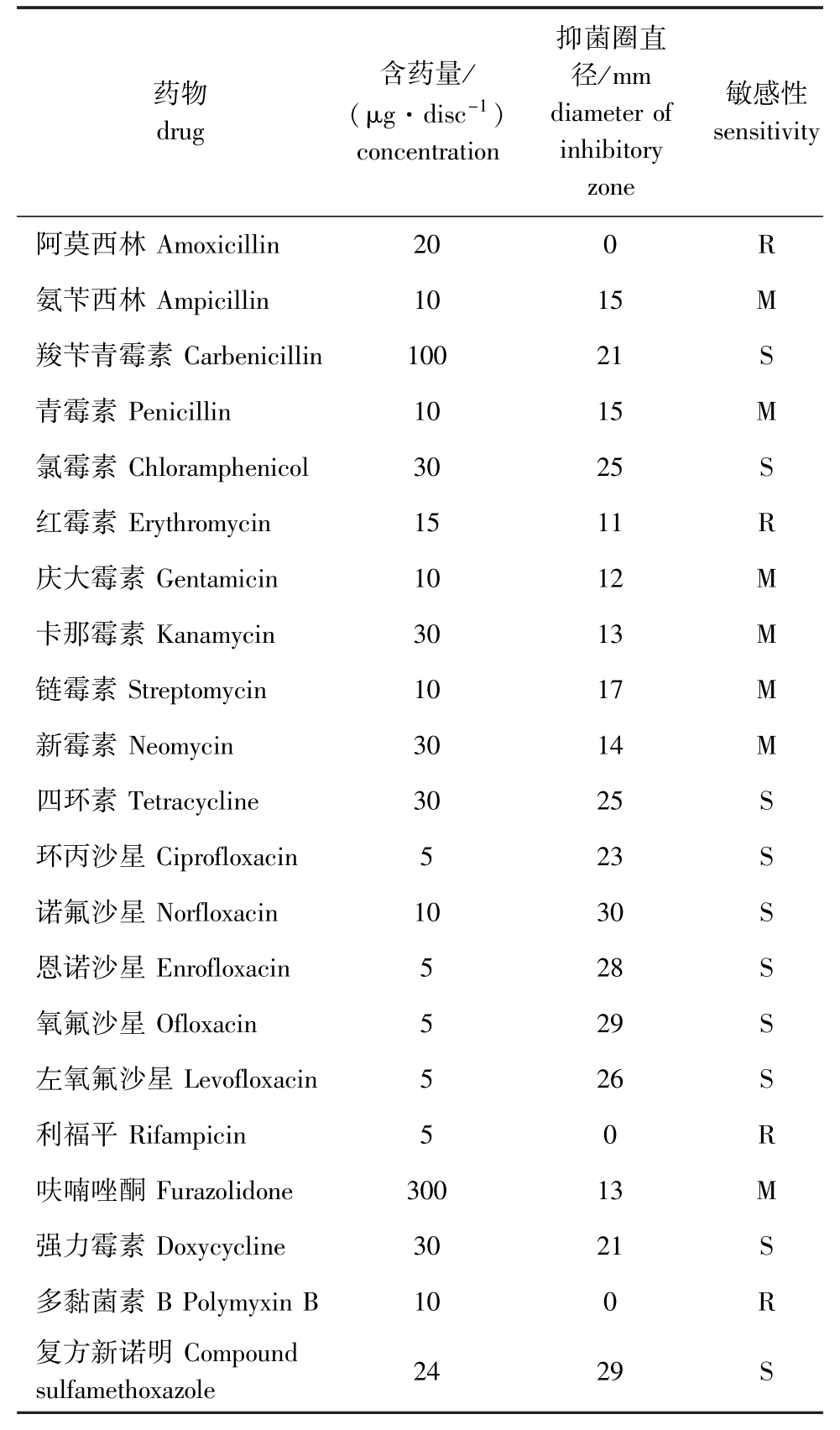
注:S表示高度敏感;M表示中度敏感;R表示不敏感
Note:S,high sensitive;M,medium sensitive;R,resistant
抑菌圈直药物 含药量/径/mm敏感性drug(μg·disc-1)diameter ofsensitivity concentrationinhibitory zone阿莫西林Amoxicillin 20 0 R氨苄西林Ampicillin 10 15 M羧苄青霉素Carbenicillin 100 21 S青霉素Penicillin 10 15 M氯霉素Chloramphenicol 30 25 S红霉素Erythromycin 15 11 R庆大霉素Gentamicin 10 12 M卡那霉素Kanamycin 30 13 M链霉素Streptomycin 10 17 M新霉素Neomycin 30 14 M四环素Tetracycline 30 25 S环丙沙星Ciprofloxacin 5 23 S诺氟沙星Norfloxacin 10 30 S恩诺沙星Enrofloxacin 5 28 S氧氟沙星Ofloxacin 5 29 S左氧氟沙星Levofloxacin 5 26 S利福平Rifampicin 5 0 R呋喃唑酮Furazolidone 300 13 M强力霉素Doxycycline 30 21 S多黏菌素B Polymyxin B 10 0 R复方新诺明Compound24 29 S sulfamethoxazole
虹鳟肉质鲜美、营养丰富,自从虹鳟被引入中国以来,便开始大量养殖,近年来人工养殖的虹鳟由于养殖密度变大、管理水平不高、水环境恶化等原因,造成其细菌性疾病愈发严重。自20世纪50年代,鲁氏耶尔森氏菌在美国的人工养殖虹鳟中被发现以来[20],在德国、法国、英国等欧洲各国,以及澳大利亚、中国均有所发现[21-25],根据流行病学研究,近几年虹鳟肠炎红嘴病频发,该病对虹鳟养殖业的危害逐渐加大。在虹鳟养殖过程中对该菌的感染要引起高度重视,采取一定的防治措施,有效控制该病的发生,减小该病对中国虹鳟养殖业的危害。本研究中,对鲁氏耶尔森菌生长特性进行了研究,对病原菌生理特性的进一步了解,有助于养殖生产的科学管理。本研究表明,该菌在15℃以下基本不生长,但随着温度的升高,该菌生长越加活跃,夏季高温时节为该菌暴发最为严重的时期。管标等[26]通过急性温度胁迫对虹鳟的研究表明,虹鳟受高温影响时内脏酶指标变化显著,养殖户应控制好夏季冷水鱼养殖温度。Thorsen等[27]报道,该细菌在含盐量为0~2%的水中至少能存活4个月,但在含盐量为3.5%的水中存活时间就明显减少,本研究表明,该菌在含盐量为3%内能生长,与上述文献相符合。班红琴等[28]通过对虹鳟的盐度驯化研究表明,虹鳟在高渗环境下能启动海水中渗透压的调节机制,提高对盐度的适应能力,可以尝试在对虹鳟养殖中提高盐度环境来降低细菌生长。本研究表明,该菌在pH值为6.5~7.5时生长状态最佳,因此,在冷水鱼虹鳟的养殖过程中要时刻注意水质及用具的消毒,杀灭水体中或用具上的鲁氏耶尔森氏菌,并且可以应用盐及适宜酸碱度来控制鲁氏耶尔森菌的生长,减少该菌所致鱼病的暴发。
本试验中感染BH1206菌株的病鱼出现的症状与鲁氏耶尔森菌感染鲟鱼的症状[18,29]有相似之处,但性腺溃烂不明显。感染鲁氏耶尔森菌BH1206株而发病的虹鳟内部脏器均有不同程度的充血现象,经过解剖可见体内脏器均有明显的异常表现,病理学检查发现,肝脏和脾脏细胞坏死,产生大量的炎症细胞,肠道组织极度萎缩变形,肾脏也有明显病变。
目前,中国控制水产养殖细菌疾病的主要方式仍然是利用抗生素,药敏试验结果表明,鲁氏耶尔森菌BH1206株对氯霉素、四环素、强力霉素等10种药物高度敏感,对氨苄西林、青霉素、庆大霉素、卡那霉素、链霉素、新霉素和呋喃唑酮7种药物中度敏感,而对红霉素、利福平、阿莫西林、多黏菌素B 4种药物具有耐药性。因此,对虹鳟肠炎红嘴病的防治应采用耐药性高的抗生素,科学用药,防治细菌性疾病对药物本身的耐药,以免导致防治失败以及造成药物残留。国外学者已有研发鲁氏耶尔森菌福尔马林灭活苗浸泡免疫虹鳟的成功案例[30],因此,可采用疫苗免疫虹鳟来预防和控制鲁氏耶尔森菌病的发生,而中国对控制虹鳟肠炎红嘴病的疫苗研发较少。通过本次研究,以期为虹鳟肠炎红嘴病的防治提供参考,并为该病的免疫防控奠定基础。
参考文献:
[1] Luo L,Cai X F,He C,etal.Immune response,stress resistance and bacterial challenge in juvenile rainbow trout Oncorhynchusmykiss fed diets containing chitosan-oligosaccharides[J].Current Zoology,2009,55(6):416-429.
[2] Kumari J,Sahoo P K.Non-specific immune response of healthy and immunocompromised Asian catfish(Clariasbatrachus)to several immunostimulants[J].Aquaculture,2006,255(1/4):133-141.
[3] Sakai M.Current research status of fish immunostimulants[J].Aquaculture,1999,172(1/2):63-92.
[4] 谢谊,周其椿,梁正其.1例虹鳟烂鳃病的细菌学诊断[J].贵州畜牧兽医,2013,37(2):66-68.
[5] 陈翠珍.爱德华氏菌及鱼类爱德华氏菌病[J].河北科技师范学院学报,2004,18(3):71-76.
[6] 张晓佩,龚晖,陈如敬,等.迟钝爱德华氏菌鞭毛蛋白的提取与分析[J].福建农业学报,2008,23(1):35-38.
[7] Gerhardt P G.Ceschia,vibriosis in rainbow trout,Salmo gairdneri Richardson,in fresh water in Northeastern,Italy[J].Fish Dis, 1982,5(2):125-130.
[8] Soltani M,Munday B,Carson J.Susceptibility of some freshwater species of fish to infection by Cytophaga johnsonae[J].Bulletin of the European Association of Fish Pathologists,1994,14(4):133-135.
[9] 丁雷,岳永生,宋憬愚.虹鳟皮肤溃烂病的病原菌研究[J].淡水渔业,2002,32(3):28-30.
[10] National Committee for Clinical Laboratory Standards.Performance Standards for Antimicrobial Disc Susceptibility Tests.Approved Standard NCCLS Publications M2-A5[M].USA:Villanova,PA,1993.
[11] Lane D J.16S/23S rRNA sequencing[M]//Stackebrandt E, Goodfellow M.Nucleic Acid Techniques in Bacterial Systematics.Chichester,UK:John Wiley&Son Ltd,1991:115-175.
[12] Davies R L,Frerichs G N.Morphological and biochemical differences among isolates of Yersinia ruckeri obtained from wide geographical areas[J].Journal of Fish Diseases,1989,12:357-365.
[13] Danley M L,Goodwin A E,Killian H S.Epizootics in farm-raised channel catfish,Ictalurus punctatus(Rafinesque),caused by the enteric redmouth bacterium Yersinia ruckeri[J].Journal of Fish Diseases,1999,22:451-456.
[14] 张晓君.鲁氏耶尔森氏菌及鱼类相应感染症状[J].河北科技师范学院学报,2004,18(3):77-80.
[15] Raida M K,Buchmann K.Bath vaccination of rainbow trout(Oncorhynchusmykiss Walbaum)against Yersinia ruckeri:effects of temperature on protection and gene expression[J].Vaccine, 2008,26(8):1050-1062.
[16] Raida M K,Buchmann K.Development of adaptive immunity in rainbow trout Oncorhynchusmykiss(Walbaum)surviving an infection with Yersinia ruckeri[J].Fish and Shellfish Immunol, 2008,25(5):533-541.
[17] Fouz B,Zarza C,Amaro C.First description of non-motile Yersinia ruckeri serovar I strains causing disease in rainbow trout,Oncorhynchusmykiss(Walbaum)cultured in Spain[J].Journal of Fish Diseases,2006,29:339-346.
[18] Tobback E,Decostere A,Hermans K,et al.Yersinia ruckeri infections in salmonid fish[J].Journal of Fish Diseases,2007,30: 257-268.
[19] Fan F L,Wang K Y,Geng Y,et al.Isolation,identification and phylogenetic analysis of Yersinia ruckeri in channel catfish Ictalurus punctatus[J].Oceanologia et Limnologia Sinica,2010,41 (6):862-868.
[20] Ross A J,Rucker R R,Ewing W H.Description of a bacterium associated with redmouth disease in rainbow trout(Salmo gairdneri)[J].Canadian Journal of Microbiology,1966,12:763-770.
[21] Llewellyn L C A.Bacterium with similarities to the redmouth bacterium and Serratia liquefaciens(Grimes and Hennerty)causing mortalities in hatchery reared salmonids in Australia[J].Journal of Fish Diseases,1980,3:29-39.
[22] Fuhrmann H,Bohm K H,Schlotfeldth H J.An outbreak of enteric redmouth disease in West Germany[J].Journal of Fish Diseases,1983,6:309-311.
[23] Lesel R,Lesel M,Gavini F,et al.Outbreak of enteric redmouth disease in rainbow trout,Salmo gairdneri Richardson,in France [J].Journal of Fish Diseases,1983,6:385-387.
[24] Roberts M S.A report of an epizootic in hatchery reared rainbow trout,Salmo gaindneri Richardson,at an English trout farm, caused by Yersinia ruckeni[J].Journal of Fish Diseases,1983, 6:551-552.
[25] Wobeser G.An outbreak of redmouth disease in rainbow trout (Salmo gairdneri)in Saskatchewan[J].Journal of the Fisheries Research Board of Canada,1973,30:571-575.
[26] 管标,温海深,刘群,等.急性温度胁迫对虹鳟肝脏代谢活性及生长相关基因表达的影响[J].大连海洋大学学报,2014,29(6):566-571.
[27] Thorsen B K,Enger O,Norland S,et al.Long term starvation survival of Yersinia ruckeri at different salinities studied by microscopical and flow cytometric methods[J].Applied and Environmental Microbiology,1992,58:1624-1628.
[28] 班红琴,吴垠,李阳,等.盐度驯化过程中虹鳟血清渗透压、激素水平及离子组成的变化[J].大连海洋大学学报,2010,25 (6):551-555.
[29] 杨移斌,夏永涛,郑卫东,等.鲟源鲁氏耶尔森氏菌的分离鉴定及药敏特性研究[J].水生生物学报,2013,37(2):393-398.
[30] Johnson K A,Flynn JK,Amend D F.Onsetof immunity in salmonid fry vaccinated by direct immersion in Vibrio anguillarum and Yersinia ruckeri bacterins[J].Journal of Fish Diseases,1982,5: 197-205.
Isolation,identification and grow th of pathogenic bacterium in enteric redmouth disease in rainbow trout Oncorhynchusmykiss
LIAN Hao-miao1,2,LU Tong-yan1,LIU Hong-bai1,YIN Jia-sheng1,ZHANG Hui2,LIShao-wu1,
(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.College of Animal Science and Technology,Northeast Agricultural University,Harbin 150030,China)
Abstract:A bacterial strain BH1206 was isolated from liver and spleen of rainbow trout Oncorhynchusmykiss diseased with enteric redmouth,and identified by artificial infection test,by a conventional biochemicalmethod,by an API 20E kit,by a Biolog identification system,and by amolecular sequencingmethod.The fish infected with BH1206 had clinical signs including punctuate haemorrhaging on the body surface,especially on the abdominal wall and rostral side.Different degree of hemorrhageswere observed in all visceral organs.Itwas found that the isolated strain was a Gram-negative bacterium,oxidase-negative aerobic non-fermented Bacillus.The physical and chemical characteristics and Biolog system analysis revealed that BH1206 was identified as Yersinia ruckeri.In the phylogenetic tree constructed by comparing the 16S rRNA sequence of the strain BH1206(GenBank accession number KJ850444)with other relative bacterial species in the GenBank,BH1206 and Yersinia ruckeri were clustered in a branch.The optimum growth of BH1206 was found under condition of pH 6.5-7.5,a salinity of0,and temperature 28-30℃.Antimicrobial susceptibility tests showed that BH1206 was highly susceptible to 11 kinds of drugs including ofloxacin,ciprofloxacin,norfloxacin,enrofloxacin,levofloxacin,chloramphenicol,tetracycline, doxycycline,tetracycline,and trimethoprim-sulfamethoxazole carbenicillin,while completely resistant to amoxicillin,rifampin,and polymyxin.The findings indicate that Yersinia ruckeri is the pathogen for enteric redmouth of rainbow trout and provide a reference for the disease prevention.
Key words:Oncorhynchusmykiss;Yersini ruckeri;16S rRNA;drug resistance
中图分类号:S941.42
文献标志码:A
收稿日期:2014-12-15
基金项目:“十二五”国家科技支撑计划项目 (2012BAD25B10);中国水产科学研究院基本科研业务费 (2014A06XK05)
作者简介:连浩淼 (1989—),女,硕士研究生。E-mail:15124534356@163.com
通信作者:李绍戊 (1982—),男,博士,副研究员。E-mail:swli_1982@163.com
DOI:10.16535/j.cnki.dlhyxb.2015.05.009
文章编号:2095-1388(2015)05-0498-07