高水温对杂交鲟主要免疫指标的影响
王静波,曹欢,王小亮,王姝,孟蝶,张文,徐立蒲
(北京市水产技术推广站,北京100021)
摘要:为揭示高水温对杂交鲟 (施氏鲟Acipenser schrencki♀×西伯利亚鲟Acipenser baerii♂)免疫指标的影响,以灭活的嗜水气单胞菌 (F-A.h)和传染性胰脏坏死病毒 (F-IPNV-sp)作为免疫原分别腹腔注射健康杂交鲟,观察18、23、28℃温度下杂交鲟血清红细胞及白细胞的数量,以及抗体水平及吞噬细胞免疫学指标的变化。结果表明:在不同水温条件下,杂交鲟血清红细胞和白细胞数量及红白细胞数量比例均无显著性差异 (P>0.05),各试验组红细胞数量约为白细胞数量的100倍;随着水温的升高,免疫血清中抗A.h凝集抗体效价和IPNV-sp中和效价均呈升高趋势,但各组均无显著性差异 (P>0.05);随着水温的升高,血液中的白细胞吞噬百分比 (PP)、吞噬指数 (PI)和调理指数 (OI)均呈先缓慢上升后下降的趋势,18℃和23℃组的PP、PI、OI均显著高于28℃组 (P<0.05),而18℃与23℃组间无显著性差异(P>0.05)。研究表明,高水温对杂交鲟非特异性免疫有显著的抑制作用。
关键词:杂交鲟;嗜水气单胞菌;传染性胰脏坏死病毒;免疫功能;高水温
鲟由于生长快和经济价值高,已成为中国重要的养殖品种。但近年来由于部分养殖区域水流量减少,夏季水温较高且持续时间长,养殖鲟各种疾病频发,严重影响鲟鱼产业的健康发展[1-2]。鱼类作为一种变温动物,各项生理机能直接受到水温的影响,水温过高或过低都会造成鱼类的应激反应,导致免疫力降低,诱发各种疾病[3-5]。目前,有关鱼类免疫力和温度关系的研究主要集中在适温范围内[6-9],但高水温对鱼类免疫力影响的研究报道较少。鲟属于亚冷水性鱼类,据有关报道,鲟最高生存温度为30℃,生长最高适温为25~26℃[10],当水温达28℃以上时鲟摄食与生长都会减缓或停止[11]。研究还发现,北京地区鲟养殖水温大多在18~22℃,但部分地区养殖水温在夏季高温时达27~28℃且持续一段时间,此时鲟的发病率和死亡率会明显增加,出现这种现象究竟是由于其生理功能还是免疫功能受影响所致,目前尚不清楚。本研究中,以杂交鲟 (施氏鲟Acipenser schrencki♀×西伯利亚鲟Acipenser baerii♂)为研究对象,测定在不同养殖水温条件下,当其受到灭活的嗜水气单胞菌Aeromonas hydrophila和传染性胰脏坏死病毒(infectious pancreatic necrosis virus,IPNV-sp)刺激后,主要免疫指标的变化情况,揭示高水温对鲟非特异性和特异性免疫指标的影响,旨在为提高鲟抗病能力、开展病害防控提供理论依据。
1 材料与方法
1.1 材料
试验用杂交鲟体长为 (16.9±2.0)cm,体质量为 (29.4±3.5)g,购自北京房山某渔场。
嗜水气单胞菌Aeromonas hydrophila和金黄色葡萄球菌Staphylococcusaureus均购自中国微生物菌种保藏中心 (北京)。传染性胰脏坏死病毒sp株(IPNV-sp)由中国检验检疫科学研究院江育林研究员馈赠。
1.2 方法
1.2.1 抗原的制备 将上述两种菌株在28℃恒温条件下,利用BHI培养基培养24 h。以4000 r/min离心20 min,收集菌体,以灭菌生理盐水清洗3次,加入终浓度为1%(体积分数,下同)的甲醛溶液,继而在25℃条件下灭活24 h。然后以4000 r/min离心20 min,重悬于灭菌生理盐水中,重复两次,并将终浓度调至1×108CFU/mL,4℃下保存备用。灭活的嗜水气单胞菌简称为F-A.h,灭活的金黄色葡萄球菌简称为F-S.a.。
将病毒株IPNV-sp接种到CHSE-214细胞中于20℃下培养,待细胞出现CPE完全后,冻融一次以释放病毒。将病毒悬液经8000 r/min离心30 min和24 000 r/min离心220 min后,重悬于灭菌生理盐水中,加入终浓度为0.5%的甲醛溶液。在37℃下灭活病毒24 h,然后用硫代硫酸钠中和,以8000 r/min离心30 min。收集上清,于4℃下保存备用。灭活的IPNV-sp简称为F-IPNV-sp。
1.2.2 试验鱼的饲养 将试验鱼暂养在0.5 m3自动循环水养殖系统中,溶解氧为6~8 mg/L,pH为7.2~8.0,水温分别控制在 (18±1)、(23±1)、(28±1)℃,期间每天投喂2次配合饲料。1周后正式开始试验。
1.2.3 免疫与采血 试验共设 (18±1)、 (23± 1)、(28±1)℃ 3个温度组,每个温度组均设对照组和免疫组,将对照组每尾鱼腹腔注射同体积的灭菌生理盐水,将免疫组每尾鱼腹腔分别注射0.3 mL F-A.h和F-IPNV-sp,每组设2个平行,每个平行放25尾试验鱼,共饲养4周。
分别于接种前和接种后第7、14、21、28天从试验鱼尾动脉取血。血样分为两份:一份加肝素,用于红细胞和白细胞计数;另一份按常规方法制备血清。
1.2.4 免疫指标的检测
(1)血细胞。红细胞和白细胞均用血球计数板计数,每个样品重复3次,结果以平均值计。
(2)血清抗体效价。血清中抗细菌抗体的效价用凝集试验,采用96孔血凝板依照常规方法进行测定[12]。血清中抗病毒抗体的滴度用中和试验,采用细胞培养板,使用CHSE-214细胞,在20℃下依照常规方法进行检测[13]。
(3)白细胞的吞噬和调理试验。试验结束后,取3个温度下对照组的杂交鲟抗凝血,经2000 r/min离心10 min后,吸取血浆与红细胞界面的白细胞层,用PBS(0.01 mol/L)重悬。每份样品取出2份细胞悬液 (每份200μL):一份加入100μL无血清1640(对照组);一份加入100μL抗FA.h凝集抗体效价最高的血清 (免疫组),再各加入40μL F-S.a.,然后置于25℃恒温下孵育,期间每10 min摇匀一次。1 h后以2000 r/min离心10 min,弃上清,细胞用100μL PBS(0.01 mol/L)重悬。按常规方法涂3张载玻片,用甲醇固定、Gimsa染色、油镜观察,按照常规方法测定白细胞的吞噬活性和调理指数[14]。
1.3 数据处理
试验数据均用平均值±标准差表示。利用SPSS 16.0软件对试验结果进行方差分析和多重比较,显著性水平设为0.05。
2 结果与分析
2.1 血细胞数量变化
杂交鲟血细胞计数结果见表1。从表1可以看出,随着水温的升高,各组红细胞和白细胞数量无显著性变化 (P>0.05)。另外,在3个温度下,杂交鲟红细胞数量约为白细胞数量的100倍 (78~105倍),未受到水温显著影响 (P>0.05)。
表1 不同温度下杂交鲟的血细胞数量
Tab.1 Number of blood cells in the hybrid sturgeon at different tem peratures
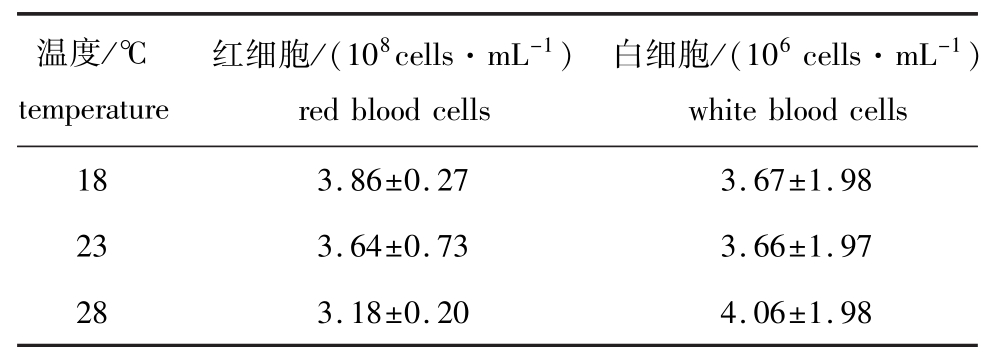
温度/℃temperature红细胞/(108cells·mL-1) red blood cells白细胞/(106cells·mL-1) white blood cells 18 3.86±0.27 3.67±1.98 23 3.64±0.73 3.66±1.97 28 3.18±0.20 4.06±1.98
2.2 高温对杂交鲟抗体水平的影响
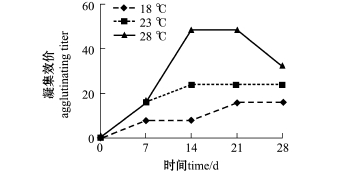
2.2.1 血清中抗A.h凝集效价 杂交鲟血清中抗A.h的抗体凝集效价如图1所示。从图1可见:随着水温的升高,血清中抗A.h的抗体凝集效价呈上升趋势,但各温度组间均无显著性差异 (P>0.05);18℃组和23℃组最高效价分别为1∶16和1∶24,而28℃组随免疫时间的延长,凝集效价呈先上升后下降的趋势,最高效价出现在免疫后第14天~第21天,抗体效价为1∶48。
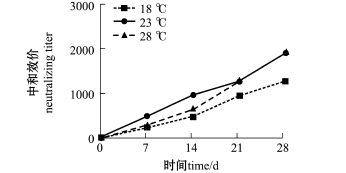
2.2.2 血清中抗IPNV-sp中和效价 杂交鲟血清中抗IPNV-sp中和效价如图2所示。从图2可见:随着时间的延长,各温度组血清中抗IPNV-sp中和效价均呈上升趋势,而且水温越高,最后的抗体中和滴度也越高;各组在一周后抗体效价均可达到1∶250以上,其中,18℃组在免疫后第28天时效价最高达1∶1280,而23℃和28℃组在免疫后第14天时就达到1∶1920的最高效价;但是各温度组间抗IPNV-sp中和效价无显著性差异 (P>0.05)。
2.3 高温对杂交鲟外周血白细胞吞噬能力的影响
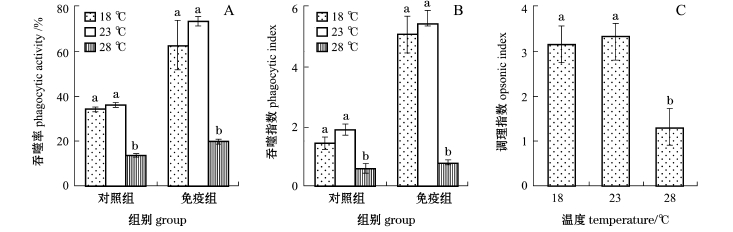
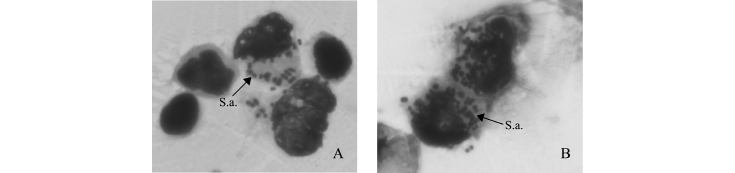
3种温度下杂交鲟外周血白细胞的PP、PI、OI变化如图3所示。从图3可见:随着水温的升高, PP、PI、OI整体上呈先缓慢上升后下降的趋势; 18℃和23℃组的PP、PI、OI均显著高于28℃组(P<0.05),而18℃与23℃组间无显著性差异(P>0.05)。同时,各温度组白细胞的吞噬试验结果发现,经具有高凝集效价免疫血清调理后,杂交鲟外周血白细胞具有更强的吞噬能力,每个白细胞能够吞噬更多F-S.a.(图4)。从图4还可以看到,大量的F-S.a.已经被吞噬到细胞质中,在细胞质外尚有少量F-S.a.也在调理素的趋附作用下向白细胞靠拢。
从以上结果可以看出,尽管高水温对杂交鲟血细胞数量没有显著影响,但高水温可降低杂交鲟白细胞的吞噬能力,导致其非特异性免疫能力下降,进而降低其抗病力,导致各种疾病的发生。
3 讨论
鱼类属于变温低等脊椎动物,具备特异性和非特异性免疫,能有效地保护鱼体免受病原侵袭[4]。病原微生物进入机体后,首先接触的是机体吞噬细胞系统,它不仅构成了鱼体内非特异性免疫应答的第一道防线,还可以消化、处理和传递抗原信息,也是特异性免疫应答的起点[15-17]。影响鱼体免疫功能的因素很多,如抗原、个体发育、环境因素等,其中影响最大的是环境因素中的温度[6-9]。能反映机体免疫能力的因素也有很多,如各种血细胞的数量和比例,抗体的产生时间和滴度,吞噬细胞数量和吞噬能力等。本研究结果显示:在不同水温下,红白细胞的数量和它们之间的比例基本保持不变;而血清中抗A.h凝集效价和抗IPNV-sp中和滴度却随温度的升高而上升,即便已经超过了杂交鲟的最适养殖温度,仍然一直保持上升的趋势,这就提示杂交鲟无论是对可溶性抗原 (病毒)还是对颗粒性抗原 (细菌)的特异性反应,都一直保持与温度呈正相关;而白细胞的吞噬能力,包括经过免疫血清调理后的吞噬能力,则随水温的上升呈先缓慢上升后下降的趋势,且18℃和23℃组显著高于28℃组。这与笔者近几年对北京地区养殖鲟流行病学调查结果相符,即当水温达到27~28℃及以上且持续一段时间以后,鲟患各种细菌性疾病的发病率和死亡率明显增加,提示非特异性免疫降低导致其抗病力降低,即非特异性反应可能在杂交鲟抗感染过程中起到主要作用,这与已报道的虹鳟Oncorhynchusmykiss[8]、大鲵 Andrias davidianus[12]和南方鲇Silurusmeridionalis[18]的研究结论相似。
抗体是由淋巴细胞产生的一类能与相应抗原特异性结合的具有免疫功能的球蛋白,抗体效价反映了鱼类特异性体液的免疫水平[19-20]。鱼类产生抗体的能力随温度的升高而增强的现象已有较多报道[13,21-26], 但有研究结果表明[19-20,27-28], 受免鱼的抗体效价与免疫保护率的高低往往并不一致,即可能存在 “无效免疫”。本研究中发现,尽管随着水温的升高,杂交鲟血清抗A.h凝集抗体效价和抗IPNV-sp中和效价均呈升高趋势,但试验鱼在水温高于28℃时仍然易感多病,推测特异性抗体对杂交鲟的抗病力没有起到增强作用,产生的抗体可能仅对抗原有反应,而对病原没有杀灭作用,即所谓 “无效免疫”。
另外,本研究中还发现,在不同水温条件下F-A.h免疫杂交鲟产生的抗体凝集效价较低 (最高值为1∶48),这可能是由于A.h是水体常见菌,对杂交鲟的抗原性较差,故不能刺激鱼体产生滴度足够高的体液免疫应答。而F-IPNV-sp免疫杂交鲟产生的抗体中和效价 (最高值为1∶1920)明显高于F-A.h免疫杂交鲟产生的抗体凝集效价,这可能是因为鱼体对IPNV具有较强的免疫反应,虽然有研究表明,IPNV免疫草鱼产生抗体中和效价最高可达1∶20 000[13],这种差异可能主要与鱼的种类有关。
综上所述,高水温对杂交鲟非特异性免疫有显著的抑制作用,这表明在高水温条件下杂交鲟非特异性免疫降低是导致其抗病力降低的主要原因。因此,在高温季节投喂免疫增强剂,以提高鲟鱼非特异性免疫力,或者通过物理方法降低水温,对鲟鱼病害的防控具有积极的作用。
参考文献:
[1] 王小亮,徐立蒲,曹欢,等.鲟致病性类志贺邻单胞菌的鉴定及药物敏感性[J].微生物学报,2013,53(7):723-729.
[2] 彭翔,夏磊,张洪玉,等.板蓝根对施氏鲟幼鱼抗氧化及免疫功能的影响[J].大连海洋大学学报,2013,28(6):573-577.
[3] 王文博,李爱华.环境胁迫对鱼类免疫系统影响的研究概况[J].水产学报,2002,26(4):368-374.
[4] 李亚南,王冀平,邵健忠,等.鱼类免疫应答中的温度效应研究[J].浙江大学学报:理学版,1999,26(3):87-91.
[5] 覃川杰,杨川,陈昌福.水温对鱼类免疫活动的影响[J].河南师范大学学报:自然科学版,2011,39(5):129-133.
[6] Engelsma M Y.Multiple acute temperature stress affects leucocyte populations and antibody responses in common carp,Cyprinus carpio L.[J].Fish and Shellfish Immunology,2003,15:397-410.
[7] Magnadóttir B.Humoral immune parameters in Atlantic cod(Gadusmorhua L.):I.The effect of environmental temperature[J]. Comparative Biochemistry and Physiology B,1999,122:173-180.
[8] Köllner B,Kotterba G.Temperature dependent activation of leucocyte populations of rainbow trout,Oncorhynchusmykiss,after intraperitoneal immunization with Aeromonas salmonicida[J].Fish and Shellfish Immunology,2002,12(1):35-48.
[9] 许治冲,刘晖,徐奇友,等.温度和饲料脂肪水平对松浦镜鲤免疫及抗氧化能力的影响[J].大连海洋大学学报,2012,27(5): 429-435.
[10] 刘焕亮,黄樟翰.中国水产养殖学[M].北京:科学出版社, 2008:321.
[11] Steven D M,Andrew L,William L S,et al.Species profile:pro-duction of sturgeon[M].Mississippi:Southern Regional Aquaculture Center,2002:7200.
[12] 杨星,刘文枝,肖汉兵,等.嗜水气单胞菌灭活疫苗免疫后大鲵外周血免疫指标的变化[J].中国水产科学,2014,21(3): 621-628.
[13] 江育林,李燕,于平.草鱼免疫应答的初步研究[J].水生生物学报,1991,15(4):321-326.
[14] 李静,陈昌福.草鱼肾脏吞噬细胞吞噬活性的研究[J].四川大学学报,1999,36(5):931-935.
[15] 唐玫,马广智,徐军.鱼类免疫学研究进展[J].免疫学杂志, 2002,18(3):122-127.
[16] 李华,张太娥,李强.复方中草药对大菱鲆非特异性免疫力的影响[J].大连海洋大学学报,2013,28(2):115-120.
[17] 黄小丽,邓永强,汪开毓,等.香菇多糖对幼建鲤肠道菌群数量及非特异性免疫指标的影响[J].大连海洋大学学报, 2013,28(4):329-333.
[18] 单红,张其中,刘强平,等.灭活菌苗免疫的南方鲇外周血液细胞免疫指标的变化[J].中国水产科学,2005,12(3):275-280.
[19] 张永安,聂品.鱼类体液免疫因子研究进展[J].水产学报, 2000,24(4):376-381.
[20] 闫茂仓,单乐州,陈少波,等.三种创伤弧菌免疫原的制备及其对黄姑鱼的免疫保护效果[J].动物学研究,2012,33(5): 503-509.
[21] 杨先乐,左文功.水温与草鱼免疫应答关系的研究[J].动物学报,1997,43(1):42-48.
[22] Alcorn SW,Murray A L.Effects of rearing temperature on immune functions in sockeye salmon,Oncorhynchus nerka[J].Fish and Shellfish Immunology,2002,12:304-334.
[23] Magnadóttir B,Jónsdóttir H,Helgason S.Immune parameters of immunized cod,Gadusmorhua L.[J].Fish and Shellfish Immunology,2001,11:75-89.
[24] Dominguez M,Takemura A,Tsuchiya M.Impact of different environmental factors on the circulating immunoglobulin levels in the Nile tilapia,Oreochromisniloticus[J].Aquaculture,2004,241(1/ 4):491-500.
[25] Le Morvan C,Deschaux P,Troutaud D.Effects and mechanism of environmental temperature on carp,Cyprinus carpio anti-DNP antibody response and non-specific cytotoxic cell activity:a kinetics study[J].Developmental and Comparative Immunology,1996, 20:331-340.
[26] Cecchini S,Saroglia M.Antibody response in sea bass,Dicentrarchus labrax L.in relation to water temperature and oxygenation [J].Aquaculture Research,2002,33:607-613.
[27] 陈昌福,李静,周文豪,等.翘嘴鳜细菌性败血症的免疫预防研究[J].华中农业大学学报,1996,15(5):475-479.
[28] 孟小亮,陈昌福,吴志新,等.嗜水气单胞菌3种疫苗对斑点叉尾鮰免疫原性比较研究[J].淡水渔业,2009,39(4):49-53.
Effects of high water temperature on immune response in hybrid sturgeon
WANG Jing-bo,CAO Huan,WANG Xiao-liang,WANG Shu,MENG Die,ZHANGWen,XU Li-pu
(Beijing Fisheries Technical Extension Station,Beijing100021,China)
Abstract:The numbers of red blood cell and white blood cell,antibody level and immune functions of phagocytes were observed in hybrid sturgeon(Amur sturgeon Acipenserschrencki♀×Siberian sturgeon Acipenserbaerii♂)injected intraperitioneally with formalin killed Aeromonas hydrophila(F-A.h)and IPNV-sp(F-IPNV-sp)and then cultured in 18℃,23℃ and 28℃,respectively,to insight into the effect of high water temperature on the immune response in the hybrid sturgeon.The results showed that therewas no significant difference in the numbers of red blood cells and white blood cells in the hybrid sturgeon at different temperatures(P>0.05),even though the number of red blood cellswas asmany as100 times as the white blood cells.The titers of antibodies and IPNV-sp were found to be increased slightly after the hybrid sturgeon was immunized with formalin killed Aeromonas hydrophila along with rising temperature(P>0.05).However,the phagocytic percentage(PP),phagocytic index (PI)and opsonic index(OI)of white blood cells in peripheral blood were increased slightly first and then decreased obviously at the warmer temperature.There was significant difference in PP,PIand OI in hybrid sturgeons cultured at18℃ and 23℃ compared to those at28℃ (P<0.05),without significant difference at18℃ and 23℃ (P>0.05).The findings indicated thatnon-specific immunity of the hybrid sturgeon wasmore inhibited athigh temperature,which is attributed to low disease resistance of the hybrid sturgeon at high temperature.
Key words:hybrid sturgeon;Aeromonas hydrophila;infectious pancreatic necrosis virus;immune function;high water temperature
中图分类号:S965.215
文献标志码:A
收稿日期:2014-12-22
基金项目:北京市鲟鱼、鲑鳟鱼创新团队 (SCGWZJ 20141104-3);北京市农业科技项目 (20140120)
作者简介:王静波 (1977—),女,硕士,高级工程师。E-mail:wjbo_2004@163.com
通信作者:徐立蒲 (1972—),男,博士,研究员。E-mail:bjybk@163.com
DOI:10.16535/j.cnki.dlhyxb.2015.05.006
文章编号:2095-1388(2015)05-0484-05