表1 试验所用引物[11]
Tab.1 Primers used in this experiment[11]
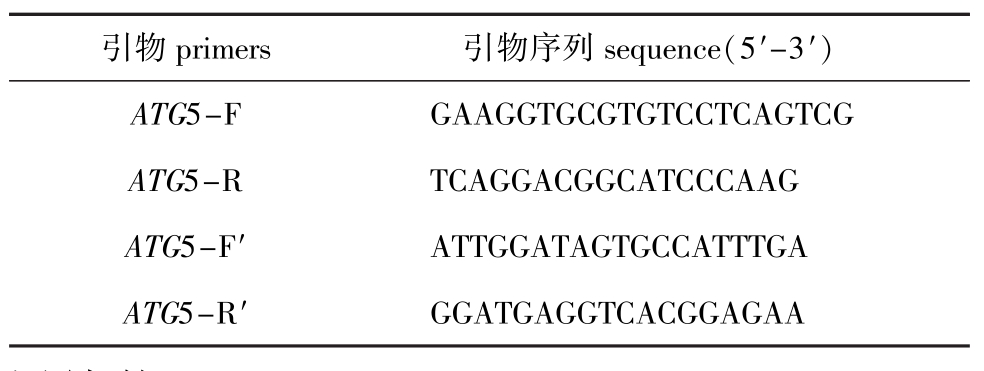
引物primers 引物序列sequence(5′-3′) ATG5-F GAAGGTGCGTGTCCTCAGTCG ATG5-R TCAGGACGGCATCCCAAG ATG5-F′ ATTGGATAGTGCCATTTGA ATG5-R′ GGATGAGGTCACGGAGAA
摘要:ATG5(Autophagy related gene 5)基因是一种自噬相关基因,是形成自噬体的重要基因,ATG5基因的表达对自噬调控的成熟有重要作用。本研究中通过克隆,首次得到太平洋鳕Gadusmacrocephalus ATG5 cDNA部分序列,该序列长为895 bp,含有完整的开放阅读框 (Open reading frame,ORF),编码275个氨基酸,其编码的蛋白质相对分子量约为32 200;经核苷酸序列比对发现,太平洋鳕ATG5核苷酸序列与半滑舌鳎Cynoglossus semilaevis、尼罗罗非鱼Oreochromis niloticus ATG5核苷酸序列的相似性均高达87.27%;利用太平洋鳕与其他物种ATG5核苷酸序列构建系统进化树,结果显示,ATG5核苷酸序列系统进化树反映的亲缘关系基本符合传统分类学观点;氨基酸序列分析结果显示,ATG5蛋白氨基酸序列具有较高的保守性;利用绝对荧光定量PCR方法对ATG5基因在太平洋鳕各组织中的转录水平进行检测,结果显示,肝、脾和肾中的表达量高于其他组织,鳃、肾、脾、脑、肝和肌肉各组织中的 ATG5 mRNA拷贝数分别为11.617 08、20.449 25、19.706 87、4.839 84、27.434 97、2.954 75 copies/ng。本研究结果将为进一步研究太平洋鳕细胞吞噬机制奠定基础,也为太平洋鳕的免疫机理和相关研究提供基础数据。
关键词:太平洋鳕;ATG5基因;克隆;绝对荧光定量;表达分析
自噬 (autophagy)是细胞内一项重要的降解机制,通过自噬可将胞内衰老蛋白质运送至溶酶体进行降解[1]。研究发现,自噬在神经退化性疾病、肿瘤、病原体感染过程中发挥很大的作用,并能对外源性底物 (如病毒)进行吞噬,运送至溶酶体将其溶解,在没有任何异常蛋白质存在时,失去了自噬作用也会导致疾病发生[2-3]。自噬体的形成主要由自噬基因 (autophagy-related gene,ATG)的产物ATG分子介导。Matsuura等于1997年发现了第一个ATG基因[4]。Mizushima等[5]首先鉴定出哺乳动物的自噬基因ATG5和ATG12。自噬体的形成主要通过ATG12-ATG5和ATG8-PE两个泛素样连接系统介导[6]。在酵母和哺乳动物细胞中去除ATG5能有效阻滞自噬,表明ATG5在自噬体形成过程中有重要作用[7-8]。目前关于ATG5基因的研究主要集中在哺乳动物,有关鱼类ATG5基因的研究报道较少,仅见斑马鱼Danio rerio、尼罗罗非鱼Oreochromis niloticus等,对鳕科鱼类未曾涉及。
太平洋鳕Gadusmacrocephalus又名大头鳕,隶属于鳕形目、鳕科、鳕属,属于冷水性鱼类,多生活于海洋底层和深海中下层。太平洋鳕分布于太平洋北部沿岸海域,从北太平洋西南部的黄海,经韩国至白令海峡和阿留申群岛一带沿海,中国太平洋鳕主要产于黄海,是世界重要海洋经济鱼类之一[9-10]。近年来,随着中国海洋捕捞业的发展,近海太平洋鳕的自然资源日益减少,人工繁殖技术问题亟待解决。
目前,本实验室研究人员在太平洋鳕人工繁育技术方面已取得突破,成功进行了人工繁育和周年饲养。但由于对太平洋鳕免疫系统作用机理尚不清楚,在实际生产中常遇到因病大量死亡的状况,因此,了解太平洋鳕免疫相关基因的作用特点及表达特性具有重要意义。本研究中,从已获得的太平洋鳕转录组信息中得到了ATG5部分基因信息,通过基因克隆,首次获得包含完整开放阅读框 (ORF)的太平洋鳕ATG5 cDNA序列,并用绝对荧光定量PCR方法研究了ATG5基因在不同组织中的表达水平,旨在为了解太平洋鳕的免疫功能提供理论依据,为工厂化养殖提供指导。
1.1 材料
试验鱼太平洋鳕采自大连市旅顺口区附近海域,捕取的野生成鱼共3尾 (2雌1雄),平均体质量为2.438 kg,均已性成熟。
LA Taq聚合酶、大肠杆菌 Escherichia coli DH5α菌株感受态细胞、pMDTM18-T载体、DNA酶I(无RNA酶)和反转录试剂盒 (PrimerScriptTMRT-PCR kit)购于大连TaKaRa生物公司;动物组织总RNA提取试剂盒 (DP431)购于天根生化科技有限公司;DNA凝胶回收试剂盒 (QIAquick Gel Extraction Kit)购于QIAGEN公司;质粒提取试剂盒 (EasyPure Plasmid MiniPrep Kit)、2×EasyTaq PCR superMix和Green Two-Step qRT-PCR Super-Mix试剂盒均购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 样品的制备 将试验鱼于10℃海水中暂养一周,无异常后进行解剖,分别取3尾鱼的鳃、肝、肾、肌肉、脾、脑组织各50 mg于超低温冰箱(-80℃)中保存待用,且每组设一个平行。
1.2.2 太平洋鳕各组织总RNA的提取及反转录对太平洋鳕各组织和仔鱼进行总RNA提取,提取方法参照动物组织总RNA提取试剂盒说明书。取4μL总RNA,用10 g/L琼脂糖凝胶进行电泳,取2μL总RNA,用微量核酸测定仪 (NV3000 Spectrophtometer)测定 RNA的 OD值,OD比值在1.9~2.1范围内的 RNA选为可用 RNA。按照PrimerScriptTMRT-PCR kit说明书,以10μL体系对500 ng总RNA进行反转录反应。
1.2.3 目的基因的扩增及序列测定 根据本实验室太平洋鳕转录组信息中已获得的ATG5基因部分cDNA序列设计引物,如表1所示,应用ATG5-F和ATG5-R引物进行PCR扩增。PCR反应程序: 95℃下预变性5 min;94℃变性30 s,58℃下退火30 s,72℃下延伸1 min,共进行35个循环;最后在72℃再延伸10 min。扩增产物以10 g/L琼脂糖凝胶电泳进行鉴定,经纯化后克隆至pMD18-T载体中,将该重组质粒命名为pMD18-Atg5,再转化至大肠杆菌DH5α中,将阳性克隆送至英潍捷基(上海)贸易有限公司测序。
1.2.4 基因序列的生物信息学分析 使用NCBI网站的 BLAST(http://blast.ncbi.nlm.nih.izov/ Blast.cta)工具对cDNA序列进行同源性比对和相似性分析;使用DNAMan 5.0和DNAssist 2.0软件对cDNA序列进行推导,得到氨基酸序列并推断其分子量;采用DNAMan 5.0软件进行氨基酸序列比对;使用Seaview软件,以邻位相连法构建系统进化树。
表1 试验所用引物[11]
Tab.1 Primers used in this experiment[11]

引物primers 引物序列sequence(5′-3′) ATG5-F GAAGGTGCGTGTCCTCAGTCG ATG5-R TCAGGACGGCATCCCAAG ATG5-F′ ATTGGATAGTGCCATTTGA ATG5-R′ GGATGAGGTCACGGAGAA
1.2.5 绝对荧光定量PCR检测ATG5基因在太平洋鳕各组织中的表达
(1)标准曲线的建立。以pMD18-Atg5为模板按照质粒提取试剂盒说明书提取质粒。用微量核酸测定仪测定质粒浓度及纯度,并依据公式[12]:![]() 计算出质粒的拷贝数。将标准质粒用双蒸水稀释成1010~102copies/μL 9个梯度,选取106、105、104、103、102等 5个梯度作为模板,以 ATG5-F′和ATG5-R′为特异引物 (表1),进行荧光定量PCR反应,每个反应设置3个重复。反应在7500 Real Time PCR System上进行,试验操作根据 Green Two-Step qRT-PCR SuperMix荧光定量PCR试剂盒说明书进行,反应体系为20μL。
计算出质粒的拷贝数。将标准质粒用双蒸水稀释成1010~102copies/μL 9个梯度,选取106、105、104、103、102等 5个梯度作为模板,以 ATG5-F′和ATG5-R′为特异引物 (表1),进行荧光定量PCR反应,每个反应设置3个重复。反应在7500 Real Time PCR System上进行,试验操作根据 Green Two-Step qRT-PCR SuperMix荧光定量PCR试剂盒说明书进行,反应体系为20μL。
反应程序为:95℃下预变性30 s;95℃下变性5 s,57℃下退火15 s,72℃下延伸10 s,共进行45个循环;55℃下反应30 s,每30 s升温0.5℃,共进行81个循环达到95℃。反应结束后对扩增曲线和熔解曲线进行分析,制作标准曲线。
(2)绝对荧光定量PCR。分别以太平洋鳕鳃、肝、肾、肌肉、脾和脑各组织的cDNA为未知样品模板,根据上述反应体系进行绝对荧光定量PCR。反应结束后根据标准曲线计算得到各组织中ATG5基因的精确拷贝数,并使用Excel 2010软件作图。
2.1 各组织总RNA的提取
提取各组织的总RNA后,进行10 g/L琼脂糖凝胶-TAE电泳鉴定,并用凝胶成像系统拍照。结果显示,本试验中扩增出了所需的特异性片段,条带清晰。所得RNA的OD值均在1.9~2.1之间,各组织中RNA的平均浓度为:鳃452.81 ng/μL,肌肉106.26 ng/μL,脾351.47 ng/μL,脑269.11 ng/μL,肝817.92 ng/μL,肾354.63 ng/μL。这表明,试验RNA提取结果良好,达到了预期效果。
2.2 ATG5 cDNA序列的克隆与分析
PCR扩增后,经测序和拼接,获得了ATG5基因部分 cDNA序列,长度为 895 bp,含有完整ORF,共编码275个氨基酸,编码的蛋白质相对分子量约为32 200。根据已获得的ATG5 cDNA序列,推导其对应的氨基酸序列如图1所示。

图1 太平洋鳕ATG5 cDNA序列及推导的氨基酸序列
Fig.1 Nucleotide sequence and deduced am ino acid sequence of ATG5 cDNA in Pacific cod Gadusmacrocephalus
注:灰色区域为推导的氨基酸序列;*为终止子
Note:Gray area shows the deduced amino acid sequence;*denotes the terminator
2.3 系统进化树
BlAST比对结果显示:太平洋鳕与尼罗罗非鱼和半滑舌鳎Cynoglossus semilaevis ATG5核苷酸序列相似性最高,均为87.27%,与人Homo sapiens和鼠Musmusculus的ATG5核苷酸序列相似性分别为78.55%和77.82%;与爪蟾Xenopus laevis ATG5核苷酸序列相似性最低,为68.95% (表2)。根据太平洋鳕及其他几种动物的ATG5核苷酸序列构建系统发育树,结果显示,太平洋鳕与红鳍东方鲀Takifugu rubripes、半滑舌鳎、亚马逊花鳉 Poecilia formosa、尼罗罗非鱼、红丽鱼Pundamilia nyererei、三刺鱼Gasterosteus aculeatus和斑马鱼等聚为一个分支,而爪蟾、鸡、猪、鼠、人聚为另一个分支(图2)。
2.4 物种间ATG5蛋白氨基酸序列的比对
利用DNAMan 5.0软件将太平洋鳕ATG5蛋白氨基酸序列与尼罗罗非鱼、红鳍东方鲀、斑马鱼、人和鼠ATG5蛋白氨基酸进行比对,结果显示,ATG5蛋白氨基酸序列的保守性比较强。太平洋鳕ATG5氨基酸序列中含有8个与尼罗罗非鱼、红鳍东方鲀、斑马鱼、人和鼠均不同的氨基酸位点。
表2 太平洋鳕与已知脊椎动物ATG5 cDNA序列的相似性比较
Tab.2 Homology analysis of ATG5 cDNA sequence between Pacific cod Gadusmacrocephalus and registered other vertebrates
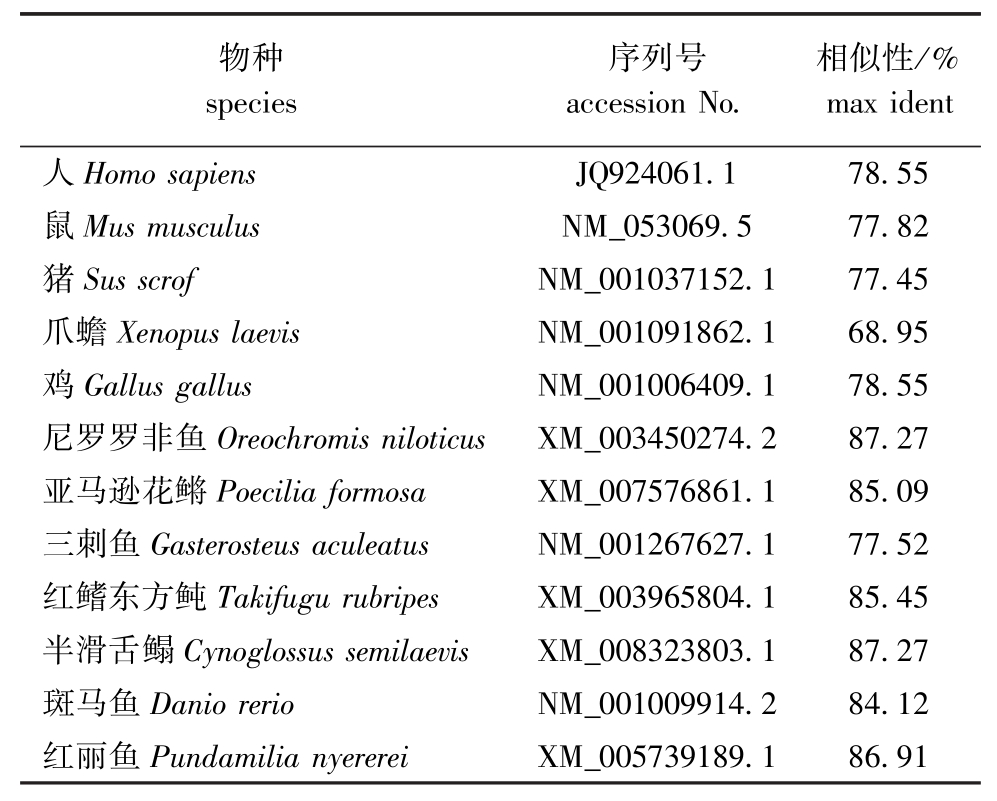
物种species序列号accession No.相似性/% max ident人Homo sapiens JQ924061.1 78.55鼠Musmusculus NM_053069.5 77.82猪Sus scrof NM_001037152.1 77.45爪蟾Xenopus laevis NM_001091862.1 68.95鸡Gallusgallus NM_001006409.1 78.55尼罗罗非鱼Oreochromis niloticus XM_003450274.2 87.27亚马逊花鳉Poecilia formosa XM_007576861.1 85.09三刺鱼Gasterosteusaculeatus NM_001267627.1 77.52红鳍东方鲀Takifugu rubripes XM_003965804.1 85.45半滑舌鳎Cynoglossus semilaevis XM_008323803.1 87.27斑马鱼Danio rerio NM_001009914.2 84.12红丽鱼Pundamilia nyererei XM_005739189.1 86.91
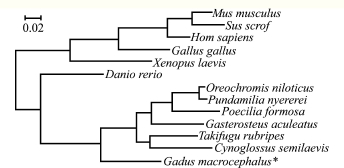
图2 基于脊椎动物ATG5核苷酸序列构建的系统进化树
Fig.2 Phylogenetic tree derived from multiple alignments of ATG5 nucleotide sequences from vertebrates
2.5 ATG5基因的组织表达
2.5.1 标准曲线的建立 多次重复的PCR产物熔解曲线分析表明,太平洋鳕ATG5基因在设计引物扩增下的溶解曲线呈较为锐利的单一峰,无引物二聚体或其他杂峰,扩增ATG5基因的熔解温度在85℃左右,且重复性较好,可以用于荧光实时定量分析ATG5基因的转录水平。图4所得的标准曲线为y=-2.8646x+31.389,其中y为CT值,x为起始的模板数量,回归系数R2=0.9979,这表明标准质粒在稀释的浓度范围内具有良好的线性关系。
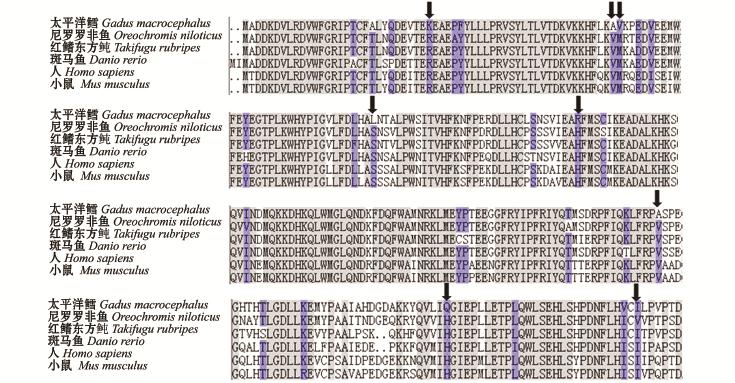
图3 物种间ATG5蛋白氨基酸序列的比较
Fig.3 The am ino acid sequences in multiple alignments of ATG5 protein among species
注:灰色区域代表氨基酸的保守区;黑色箭头代表太平洋鳕与其他动物均不同的氨基酸位点
Note:Gray area is the conservative districtof amino acid sequences;the black arrow is the differentamino acid sequences site between Gadusmacrocephalus and others
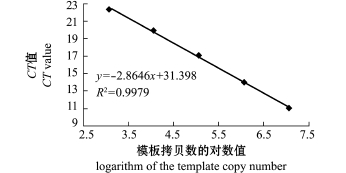
图4 ATG5基因的标准曲线
Fig.4 Standard curve of ATG5 gene
2.5.2 ATG5基因的组织表达 从图 5可见: ATG5基因的转录在太平洋鳕各组织中均有表达,其中在肝中表达量最多,显著高于其他各组织(P<0.05);在肾和脾中表达量次之,均显著高于鳃、脑和肌肉组织 (P<0.05);在脑和肌肉中表达量较少,显著低于其他各组织 (P<0.05)。
细胞自噬是指将细胞内双层膜结构包裹的受损物质运输到溶酶体进行降解的过程,与自噬相关的特异性基因统一命名为ATG[13]。其中ATG5蛋白能够通过共价键与ATG12和ATG16L相连接形成ATG16L-ATG12-ATG5复合物,参与自噬体的形成,在自噬过程中产生重要作用[14]。因此,对太平洋鳕ATG5基因的了解可以为日后的产业化养殖太平洋鳕的生长发育和疾病防治提供参考。
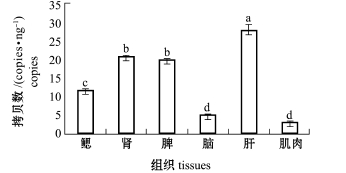
图5 ATG5基因在太平洋鳕各组织中的绝对定量表达
Fig.5 Absolute quantitative expression analysis of ATG5 gene in different tissues of Pacific cod Gadusmacrocephalus
注:标有不同小写字母者表示组间有显著性差异 (P<0.05)
Note:Themeans with different letters are significant differences at the 0.05 probability level
本研究中,首次在太平洋鳕中克隆得到了ATG5基因部分cDNA序列,包括完整的ORF,该序列长895 bp,编码275个氨基酸,所获得基因经NCBI中BLAST比较,其cDNA序列和其他物种具有较高的一致性,与尼罗罗非鱼和半滑舌鳎ATG5 cDNA相似性最高,均为87.27%;与人和鼠相似性分别为78.55%和77.82%;与爪蟾ATG5相似性最低,为68.95%,这些结果进一步确认了本研究中所获得的cDNA序列为太平洋鳕ATG5基因cDNA序列。氨基酸序列分析结果显示,该序列具有较高的保守性。系统进化发育树反映了相应物种亲缘关系的远近,太平洋鳕与其他鱼类聚为一支,人、鼠、猪、鸡、爪蛙聚为另一支 (图2),而太平洋鳕与其他鱼类均属于鱼纲,而人、鼠、猪属于哺乳纲,鸡属于鸟纲,爪蛙属于两栖纲,因此, ATG5核苷酸序列系统进化树反映的亲缘关系基本符合传统分类学观点。在鱼类分支中,太平洋鳕ATG5单独为一支,与其他鱼种亲缘关系较远,差异较大,可能是由于太平洋鳕的分类地位与其他鱼类的分类地位具有差异:太平洋鳕属于鳕形目、鳕科,与鲽形目 (半滑舌鳎)、鲈形目 (红丽鱼、尼罗罗非鱼)和鲀形目 (红旗东方鲀)的分类地位较接近,差异较小,与鲤形目 (斑马鱼)分类地位较远,差异较大。氨基酸序列比对结果显示 (图3),太平洋鳕ATG5蛋白氨基酸序列中存在8个特异位点,这可能是由于太平洋鳕属深海鱼类,多生活于冷水中,而尼罗罗非鱼、斑马鱼和红鳍东方鲀属于暖温性鱼类,因此,在长期进化过程中,这8个氨基酸位点发生了变异。
现阶段对于ATG5基因的研究主要集中在细胞[15-16]以及胚胎[17-19]和生长各阶段的表达[20], 对各组织中的差异表达研究较少。本试验中,利用绝对荧光定量方法探讨了ATG5基因在太平洋鳕成鱼各组织中的表达,并未采用现阶段常用的相对定量方法 (2-△△CT方法[21-22]),绝对荧光定量是比较准确可靠的表达定量方法,以每ng中RNA含有的拷贝数作为基准进行比较,可以避免不同组织间内参的表达量不稳定等问题,使定量结果更准确[23]。绝对荧光定量分析结果显示,ATG5基因在各组织的表达量由高到低依次为肝、肾、脾、鳃、脑、肌肉,各组织表达量差异显著。其中,ATG5在肝、脾、肾中的表达量最多,这与Pua等[24]推断的肝、脾中ATG5含量较多相一致,也与Song等[25]认为肾骨髓中的ATG5含量较多一致,这可能是因为肝、脾、肾是ATG5参与免疫的主要组织,故表达量较高;ATG5在肌肉中表达量最低,表明ATG5在肌肉中参与免疫发生较少;ATG5在脑中的表达量较少,这与Hu等[26]报道的ATG5基因在斑马鱼成鱼脑中表达量较高不同,这可能是随着鱼类的生长,ATG5的表达进行了转移;ATG5在鳃中也有表达,但表达量不多。这表明ATG5在太平洋鳕成鱼的免疫中参与位置广泛,但有集中表达的地方。
参考文献:
[1] Levine B,Klionsky D J.Development by self-digestion:molecular mechanisms and biological functions of autophagy[J].Dev Cell, 2004,6(4):463-477.
[2] Hara T,Nakamura K,MatsuiM,et al.Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice[J]. Nature,2006,441:885-889.
[3] 赵勇,栗文彬,师长宏.自噬相关基因Atg5的原核表达及多克隆抗体制备[J].生物技术通讯,2009,20(4):482-484.
[4] Klionsky D J.Autophagy from phenomenology tomolecular understanding in less than a decade[J].Nature Reviews Molecular Cell Biology,2007,8(11):931-937.
[5] Mizushima N,Sugita H,Yoshimori T,et al.A new protein conjugation system in human.The counterpart of the yeast Apg12p conjugation system essential for autophagy[J].Journal of Biological Chemistry,1998,273(51):33889-33892.
[6] Yang Y P,Liang ZQ,Gu Z L,etal.Molecularmechanism and regulation of autophagy[J].Acta Pharmacologica Sinica,2005,26 (12):1421-1434.
[7] Mizushima N,Yamamoto A,Hatano M,etal.Dissection of autophagosome formation using Apg5-deficient mouse embryonic stem cells[J].The Journal of Cell Biology,2001,152(4):657-668.
[8] 张保全,郭振辉,房巍,等.Calpain裂解Atg5决定中性粒细胞发生自噬还是凋亡,以及C5a在其中的可能作用[J].生物化学与生物物理进展,2008,35(12):1358-1363.
[9] 范瑞,姜志强,李雅娟.太平洋鳕染色体核型及银染分析[J].水生生物学报,2014,38(1):115-120.
[10] 姜志强,张志明,赵翀,等.太平洋鳕性腺发育及营养来源的初步研究[J].大连海洋大学学报,2012,27(4):315-320.
[11] Mao M G,Li X,Alejandro PM,etal.Transcriptomic analysis and biomarkers(Rag Iand Igu)for probing the immune system development in Pacific cod,Gadus macrocephalus[J].Fish and Shellfish Immunol,2015,44:622-632.
[12] 李丽,赵成萍,李宏,等.质粒制备绝对定量PCR标准曲线方法的建立[J].农业生物技术学报,2011,19(2):1157-1162.
[13] Chen N,Karantza V.Autophagy as a therapeutic target in cancer [J].Cancer Biology&Therapy,2011,11(2):157-168.
[14] 柳力月.SVCV感染EPC细胞诱导细胞自噬的分子机制及蛋白质组学研究[D].武汉:华中农业大学,2014.
[15] Peng JY,Zhang R,Cui Y T,et al.Atg5 regulates late endosome and lysosome biogenesis[J].Science China Life Sciences,2014, 57(1):59-68.
[16] Pyo JO,Jang M H,Kwon Y K,et al.Essential roles of Atg5 and FADD in autophagic cell death dissection of autophagic cell death into vacuole formation and cell death[J].Journal of Biological Chemistry,2005,280(21):20722-20729.
[17] Chae M,Rhee G S,Jang IS,et al.ATG5 expression induced by MDMA(ecstasy),interfereswith neuronal differentiation of neurblastoma cells[J].Molecules and Cells,2009,27(5):571-575.
[18] ShiM,Zhang T,Sun L,et al.Calpain,Atg5 and Bak play important roles in the crosstalk between apoptosis and autophagy induced by influx of extracellular calcium[J].Apoptosis,2013,18 (4):435-451.
[19] Lu JP,Liu X H,Feng X X,et al.An autophagy gene,MgATG5, is required for cell differentiation and pathogenesis in Magnaporthe oryzae[J].Current Genetics,2009,55(4):461-473.
[20] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the2(T)(-Delta Delta CT)method[J].Method,2001,25(4):402-408.
[21] 张吉宇,王彦荣,南志标.相对定量和绝对定量——以CsSAMDC基因表达分析为例[J].中国生物工程杂志,2009,29 (8):86-91.
[22] Bustin SA.Absolute quantification ofmRNA using real-time reverse transcription polymerase chain reaction assays[J].Journal of Molecular Endocrinology,2000,25(2):169-193.
[23] Ferrnandez JM F,Ortega A G,Cruz R R,et al.Molecular cloning and characterization of two novel autophagy-related genesbelonging to the ATG8 family from the cattle tick Rhopicephalus (Boophilus)microplus(Acari:lxodidae)[J].Experimental and Applied Acarology,2014,64(4):533-542.
[24] Pua H H,Dzhagalov l,Chuck M,etal.A critical role for the autophagy gene Atg5 in T cellsurvivaland proliferation[J].The Journal of Experimental Medicine,2007,204(1):25-31.
[25] Song H D,Sun X J,Deng M,etal.Hematopoietic gene expression profile in zebrafish kidneymarrow[J].Proceedings of the National Academy of Sciences of the United States of America,2004, 101:16240-16245.
[26] Hu Z,Zhang J,Zhang Q.Expression pattern and functionsofautophagy-related gene Atg5 in zebrafish organogenesis[J].Autophagy,2011,7(12):1514-1527.
Cloning and expression of ATG5 gene in Pacific cod Gadusmacrocephalus
Abstract:ATG5 as an abbreviation of autophagy related gene 5 is an importantgene for the formation of autophagosome,and plays a vital role in the maturation of autophagy regulation.In this study,a cDNA sequence of ATG5 was first cloned in Pacific cod Gadusmacrocephalus using gene cloning,and was found to be 895 bp encoding 275 amino acid residues with molecular weight of about32 200 in length with a whole open reading frame(ORF).The nucleotide sequence alignment showed that there was as high as similarity of87.27%in ATG5 among Pacific cod, Nile tilapia Oreochromis niloticus,and half-smooth tongue-sole Cynoglossus semilaev.The phylogenetic tree constructed by ATG5 nucleotide sequences of Pacific cod and some other animals reflected a genetic relationship which conformed to the viewpoint of traditional taxonomy.The amino acid sequence analysis revealed that ATG5 had high conservation.The expression of ATG5 in various tissues of Pacific cod using relative quantitative PCR and the absolute quantitative PCR showed that the higher expression levels of ATG5 mRNA were observed in liver,spleen and kidney than in other tissues,with 11.617 08 copies/ng in gill,20.449 25 copies/ng in kidney,19.706 87 copies/ ng in spleen,4.839 84 copies/ng in brain,27.434 97 copies/ng in liver,and 2.954 75 copies/ng inmuscle.The findings lay the foundation for further study of the phagocytosismechanism and provide basic data with understanding of immunemechanisms in Pacific cod.
Key words:Gadusmacrocephalus;ATG5 gene;cloning;absolute quantitative;expression analysis
中图分类号:S965.321
文献标志码:A
收稿日期:2014-12-12
基金项目:国家 “863”计划项目 (2012AA10A413);国家自然科学基金资助项目 (31302202);辽宁省教育厅科研项目 (L2013276):农业部海水增养殖重点实验室开放课题 (2014-MSENC-KF-12)
DOI:10.16535/j.cnki.dlhyxb.2015.05.005
文章编号:2095-1388(2015)05-0478-06