微藻油脂含量不同测定方法的比较研究
彭悦1,刘玉莹1,祁艳霞2,胡玉才1,付晚涛3
(1.大连海洋大学理学院,辽宁大连116023;2.大连海洋大学食品科学与工程学院,辽宁大连116023;3.大连海洋大学海洋科技与环境学院,辽宁大连116023)
摘要:为了对微藻油脂含量不同测定方法进行比较,以球等鞭金藻8701 Isochrysis galbana Parke 8701和小新月菱形藻Nitzschia closterium f.minutissima两种微藻为研究对象,采用溶剂提取法和苏丹黑B染色法对其油脂含量进行测定,建立了两种微藻油脂含量与苏丹黑染色后吸光度A645nm的线性回归方程,并应用于微藻油脂积累培养过程的快速测定,利用气相色谱法对两种微藻脂肪酸组成进行分析。结果表明:当提取溶剂为二氯甲烷和甲醇的混合溶剂 (二者的体积比为1∶2)时,油脂提取效果较好,得到球等鞭金藻8701和小新月菱形藻的油脂含量分别为22.99%和16.89%;采用苏丹黑B染色法测定的油脂含量基本和生物量大体一致,是一种可行的估测油脂含量的方法;气相色谱检测结果显示,两种微藻具有明显不同的脂肪酸组成特征,球等鞭金藻8701的饱和脂肪酸含量 (55.02%)较小新月菱形藻 (51.39%)高。研究表明,从两种微藻的油脂含量和脂肪酸组成来看,球等鞭金藻8701较小新月菱形藻更适用于作为生物柴油的原料。
关键词:微藻;油脂;苏丹黑B染色法;溶剂提取法;脂肪酸
生物质能作为一种来源广泛的可再生资源,对于解决日益严重的环境问题具有重要的作用。微藻因其具有高油脂产量的独特优势被视为新一代能够取代石化柴油的绿色可再生生物质能之一,以微藻为原料生产生物柴油,可以解决以油料和玉米生产燃料所带来的 “与粮争地、与人争粮”的问题。在可持续发展方面,微藻虽然具有高产、耐热、环境友好、生长周期短、可大规模生产等优势[1-9],但微藻产油过程中存在成本高和技术不完善等因素,严重影响了其商业化的发展[10]。
脂类不溶于水,易溶于有机溶剂,有机溶剂提取法是国内外广泛应用的微藻油脂提取技术。一般来说,所选用的有机溶剂应力求在提取过程中获得高出油率和高质量微藻油脂,同时尽量避免溶剂对人体的伤害。常用的提取溶剂主要有石油醚、己烷、丙酮、氯仿、乙醇和甲醇等,也可利用混合溶剂[11]。在有机溶剂提取方法中,氯仿-甲醇作为提取溶剂较为普遍,但氯仿毒性大,需要找到毒性低的有机溶剂代替。选择合适的溶剂虽然在一定程度上可降低成本,但微藻油脂萃取过程费时费力,并且需要耗用大量有机溶剂。因此,在进行大信息量的油脂测定时,需要一种快速、简便、准确的方法。林汝榕等[12]和金雪洁等[13]建立了用苏丹黑B染色对微藻油脂快速测定方法。苏丹黑B是一种价格低廉的染色剂,能与微藻细胞中的油脂成分有效结合,并且经其处理后微藻细胞的吸光度A645nm值与微藻油脂含量呈明显的线性相关性。
球等鞭金藻8701 Isochrysis galbana Parke 8701和小新月菱形藻Nitzschia closterium f.minutissima是中国北方具有代表性且含油量较高的两种微藻,目前尚未见有用苏丹黑B染色法对这两种藻类的应用研究。本研究中,对采用有机溶剂提取法和苏丹黑B染色法测定两种微藻油脂含量进行了比较研究,旨在比较这两种微藻制备生物柴油的潜力,为科学选取产油微藻原料提供基础资料。
1 材料与方法
1.1 材料
试验用微藻分别为球等鞭金藻8701和小新月菱形藻,取自近岸海洋环境科学与技术辽宁省高校重点实验室。
1.2 方法
1.2.1 藻种的培养和收集 球等鞭金藻8701和小新月菱形藻在圆柱形塑料光生物反应器 (直径220 mm,体积40 L)中进行培养,培养用水为黑石礁海域的海水,经过滤、煮沸消毒后使用。室内自然光照,室温为20~28℃,盐度为29~31,pH为7.8~8.8,充气培养,充气速度为1.5 m3/h。在微藻培养液中加入NaHCO3(0.02 mL/L)、NaNO3(0.05 mL/L)、NaH2PO4(0.01 mL/L)营养液和微量元素少许。初始接种密度约为 1.5×107cells/mL。
培养过程中,每天用血球计数板计数,培养7 d后收获。在收获的藻中加入0.3 g/L的絮凝剂(由近岸海洋环境科学与技术辽宁省高校重点实验室提供),静置分层,取沉淀,室温下用离心机(湖南湘仪实验室仪器开发有限公司)以4 000 r/min离心20 min。弃上清液,获得藻泥,将藻泥置于冰箱 (-20℃)中保存备用。
1.2.2 油脂含量的测定
(1)溶剂提取法。首先选用不同溶剂对小新月菱形藻的油脂含量进行提取,然后选出最优溶剂对球等鞭金藻8701进行提取,比较同一溶剂对两种微藻的提取效果。试验采用氯仿-甲醇-水 (体积比为1∶2∶0.8)、氯仿-甲醇(体积比为2∶1)、二氯甲烷-甲醇 (体积比为1∶2)和正己烷4种溶剂对微藻进行油脂提取,每种溶剂设3个平行组。
将收集的藻泥经真空冷冻干燥机 (上海比朗仪器有限公司)干燥后进行细胞破碎和油脂提取。首先将藻粉进行反复冻融处理,即在-20℃下冷冻5 min,40℃下水浴5 min,反复进行5次;取出藻粉进行研磨,取研磨后的藻粉100 mg,加入不同溶剂后利用超声波发生器 (无锡市科洁超声电子设备有限公司)进行超声粉碎处理;在室温下采用Thermo台式离心机 (Biofuge Primo R)以4000 r/min离心15 min,取上层液,反复萃取两次;合并上层萃取液于广口瓶中,于60℃数显恒温水浴锅 (国华电器有限公司)中用氮气吹干至恒重。试验前后广口瓶的质量之差即为油脂含量,并用下式计算油脂质量[15]:
油脂含量=(油脂质量/干藻质量)×100%。
(2)苏丹黑B染色法。采用苏丹黑B染色法测定球等鞭金藻8701和小新月菱形藻的油脂含量。利用上述传统溶剂提取方法获得的微藻油脂含量,换算出各个藻液密度下微藻细胞所含的油脂含量,绘制出吸光度与对应油脂含量之间的线性回归曲线,再利用拟合的线性回归方程计算同一种微藻的油脂含量。
具体方法:准确称取0.6 g苏丹黑B粉末 (阿拉丁,上海晶纯生化科技股份有限公司),溶于100 mL 95%(体积分数,下同)的乙醇中,混合均匀后在沸水中加热10 min,在4℃下以10 000 r/min离心20 min,取上清,用0.22μm滤膜过滤,配制成苏丹黑B染色液,于4℃下保存备用。
取一定量湿藻泥,用去离子水洗涤3次 (脱盐处理)。在烧杯中加入0.25 g脱盐的湿藻泥,再加入100 mL蒸馏水稀释,超声震荡使其充分混合均匀,然后取5 mL稀释后的藻液,按体积比为1∶2、1∶3、1∶4、1∶5、1∶10加入蒸馏水,稀释成5个藻液密度。从每个藻液密度取5 mL放入离心管中,加入5 mL HCl溶液 (1 mol/mL),充分混合后在管内加入0.4 mL苏丹黑B染色液,用漩涡振荡器 (南昌恒锐科技有限公司)充分混匀,在沸水中水浴20 min,冷却后于4℃下以10 000 r/ min离心10 min。吸出上层液体,下层沉淀用50%的乙醇洗涤3次,最后加入5 mL 70%的乙醇混匀,用TU1810紫外分光光度计 (北京普析通用仪器有限责任公司)在645 nm波长下测定其吸光度,比色皿光程为1 cm。建立微藻油脂含量与苏丹黑染色后吸光度A645nm的线性回归方程。
为了检验用苏丹黑B染色法计算出的微藻油脂含量的准确性,取一定量的待测藻液,按上述苏丹黑B染色法对稀释比例为1∶4和1∶8两个密度的藻液进行染色,在645 nm波长下测定其吸光度,将吸光度A645nm代入上述建立的线性回归方程中计算,求得微藻油脂含量。将该值与上述采用传统有机溶剂法获得的微藻油脂含量进行比较。
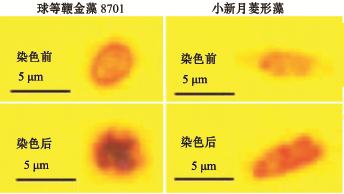
为了检验用苏丹黑B染色法对微藻培养过程中微藻油脂快速测定的应用,在两种微藻的培养过程中,利用上述苏丹黑B染色法对其不同培养阶段的油脂含量进行快速测定,绘制出不同培养阶段微藻生物量和油脂含量与对应培养时间的关系图。同时,在倒置荧光显微镜下对染色后两种微藻细胞进行胞内油脂脂滴观察并拍照。
1.2.3 脂肪酸的组成 采用气相色谱法 (Shimadzu 2014)对球等鞭金藻8701和小新月菱形藻的脂肪酸组成进行测定,先对藻样进行甲酯化处理,取25 mg的藻粉加入2 mL 2%的H2SO4-甲醇溶液,样品管中冲入氮气,将样品瓶放入80℃水浴中加热搅拌抽提1 h,样品瓶取出后再分别加入1.0 mL蒸馏水和1.0 mL正己烷,在旋涡混合器上震荡。用微量移液枪取出上层正己烷层放入另一微量玻璃瓶中,用氮气吹干,再加入100μL正己烷,于-20℃下封口保存备用。
气相色谱分析过程中,进样量为1μL,分流比为30∶1。色谱条件:FFAP柱为30 m×0.25 mm,膜厚0.50μm(大连中汇达科学仪器有限公司);进样口温度为250℃,检测器温度为280℃;程序升温,50℃下保留1 min,以25℃/min升到200℃,再以3℃/min升高到230℃,保留10 min;总运行时间27 min,载气为高纯氮气。通过样品保留时间与 37种脂肪酸甲酯标准品 (Supelco 37 Component FAMEmix,St.Louis,MO,USA)色谱图保留时间的比对,确定样品中脂肪酸甲酯的成分(即保留时间相同则为同一脂肪酸甲酯成分)。
1.3 数据处理
试验数据采用Excel软件进行处理,均以平均值±标准差表示。采用色谱工作站 (浙江大学N2000)进行色谱图分析,对各组分峰面积积分进行定量分析[13],用归一化法计算出脂肪酸各组分的相对含量 (占脂肪酸总量的百分比)。显著性水平设为0.05。
2 结果与分析
2.1 油脂含量的测定
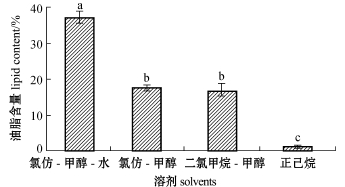
2.1.1 溶剂提取法 用氯仿-甲醇-水 (体积比为1∶2∶0.8)、氯仿-甲醇(体积比为2∶1)、二氯甲烷-甲醇 (体积比为1∶2)和正己烷4种溶剂提取小新月菱形藻油脂的含量如图1所示。从图1可见:用氯仿-甲醇-水提取的油脂含量最高(37.28%±1.55%),显著高于其他溶剂组 (P<0.05),但存在较多杂质;用氯仿-甲醇以及二氯甲烷-甲醇提取的油脂含量次之,分别为17.68%± 0.63%和16.89%±1.96%,且两组间无显著性差异 (P>0.05);用正己烷溶剂提取的油脂含量最低(1.23%±0.08%),显著低于其他溶剂组 (P<0.05)。
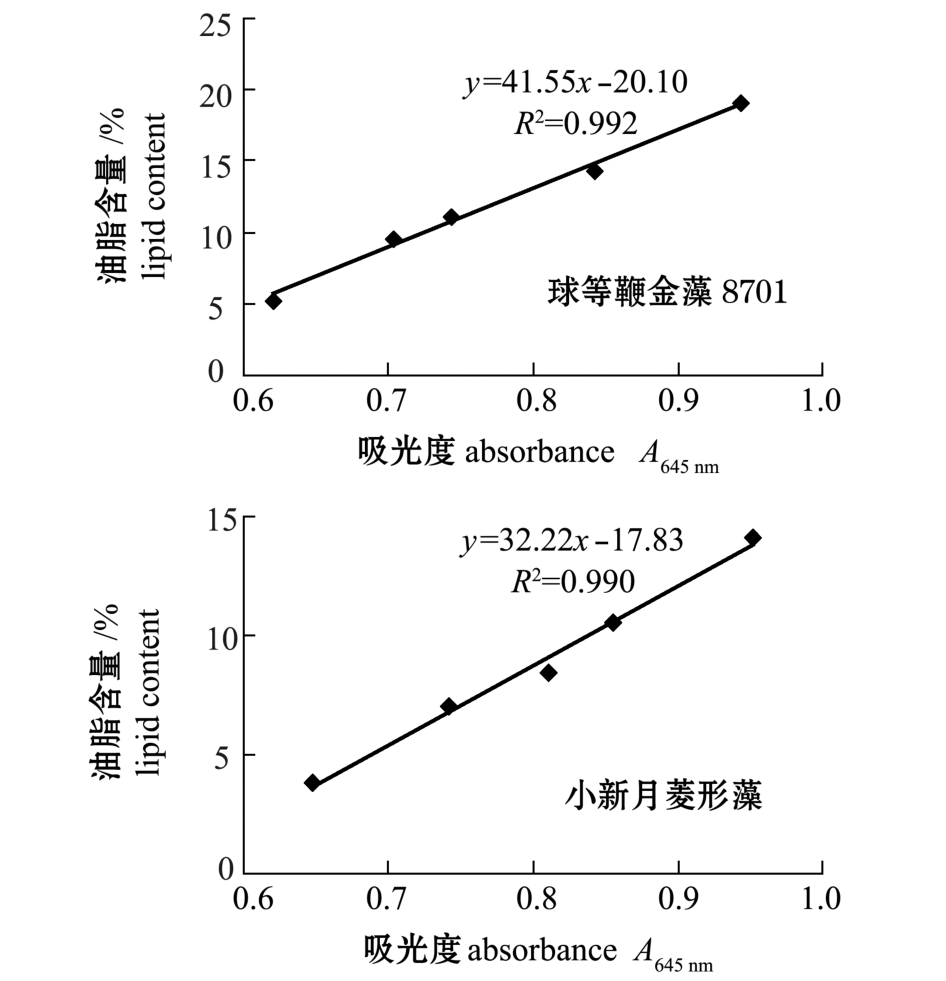
2.1.2 苏丹黑B染色法 将球等鞭金藻8701和小新月菱形藻经苏丹黑B染色处理后,建立两种微藻A645nm与油脂含量的关系如图2所示。从图2可以看出,不同吸光值的微藻油脂含量值大致都在回归直线上,A645nm与油脂含量的回归关系呈线性相关,球等鞭金藻8701和小新月菱形藻油脂含量的回归直线方程分别为 y=41.55x-20.10(R2= 0.992)和y=32.22x-17.83(R2=0.990)。
2.1.3 两种方法测定微藻油脂含量的比较 通过比较用溶剂提取法 (二氯甲烷-甲醇)测定的微藻油脂含量和由回归方程式计算出的微藻油脂含量,从而检验苏丹黑B染色法测定两种微藻油脂含量的准确度。结果显示,用这两种方法对两种微藻油脂含量的测定结果很接近,相对误差在10%范围内。由此可见,采用苏丹黑B染色方法可快速、方便、准确的测定微藻细胞油脂含量 (表1)。
表1 用苏丹黑B染色法和溶剂提取法测定油脂含量的比较
Tab.1 Comparison of the lipid concent extracted by Sudan black B staining and organic solvents
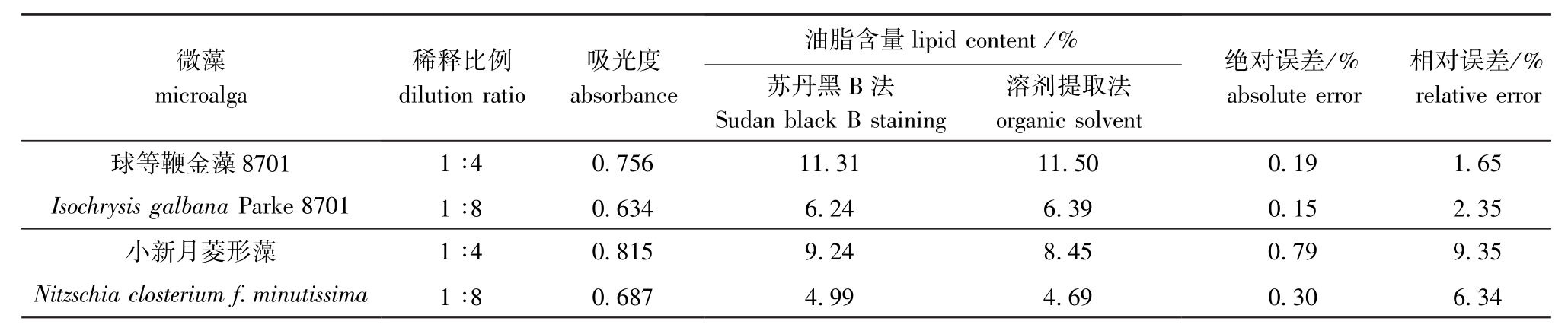
微藻microalga稀释比例dilution ratio吸光度absorbance油脂含量lipid content/%苏丹黑B法Sudan black B staining溶剂提取法organic solvent绝对误差/% absolute error相对误差/% relative error球等鞭金藻8701 Isochrysisgalbana Parke 8701 1∶4 0.756 11.31 11.50 0.19 1.65 1∶8 0.634 6.24 6.39 0.15 2.35小新月菱形藻Nitzschia closterium f.minutissima 1∶4 0.815 9.24 8.45 0.79 9.35 1∶8 0.687 4.99 4.69 0.30 6.34
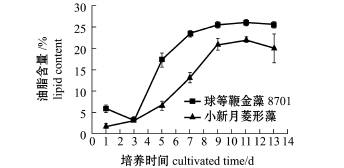
2.1.4 利用苏丹黑B染色法测定两种微藻油脂的积累过程 为了观察两种微藻的油脂积累情况,用2 L锥形瓶不充气培养,其他培养条件同上。图3和图4为球等鞭金藻8701和小新月菱形藻培养14 d内的生长曲线和用苏丹黑B染色法测定油脂含量的变化情况。的藻类对新的培养环境 (pH、光照)适应程度不同。
从图4可见:生长的前3 d,球等鞭金藻8701的油脂含量出现下降,而小新月菱形藻增长也较缓慢,原因可能是微藻处于快速生长期,胞内碳源用于满足生长的需要,生长量和含油量均较低;第3~9天时,两种微藻生物量增加的同时,油脂积累的能力越来越强,油脂含量增长速度较快;第9~11天,两种微藻的生物量和油脂含量均增长缓慢;第11~14天时,两种微藻的生物量和油脂含量均下降,原因可能是进入稳定期后,O2等代谢物累积以及部分细胞受到光照减少,细胞的光合作用降低,从而影响微藻的生长及藻细胞内三酰甘油的含量[13]。
图5为光学显微镜下观察到的两种微藻经苏丹黑B染色前后的细胞形态。由图5可以看出,两种微藻细胞中的油脂脂滴被染成了黑色,说明苏丹黑B染色溶液可以和微藻细胞中的油脂有效结合。
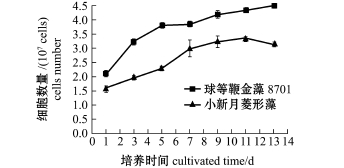
从图3可见:培养14 d时,球等鞭金藻8701从最初接种密度2.1×107cells/mL增大到4.3×107cells/mL,小新月菱形藻从1.6×107cells/mL增大到3.4×107cells/mL。球等鞭金藻8701和小新月菱形藻前11 d的生物量均在增加,球等鞭金藻8701的生物量在前5 d增长速度较快,而小新月菱形藻在第5~9天增长速度较快,原因可能是两种不同
2.2 微藻的脂肪酸组成
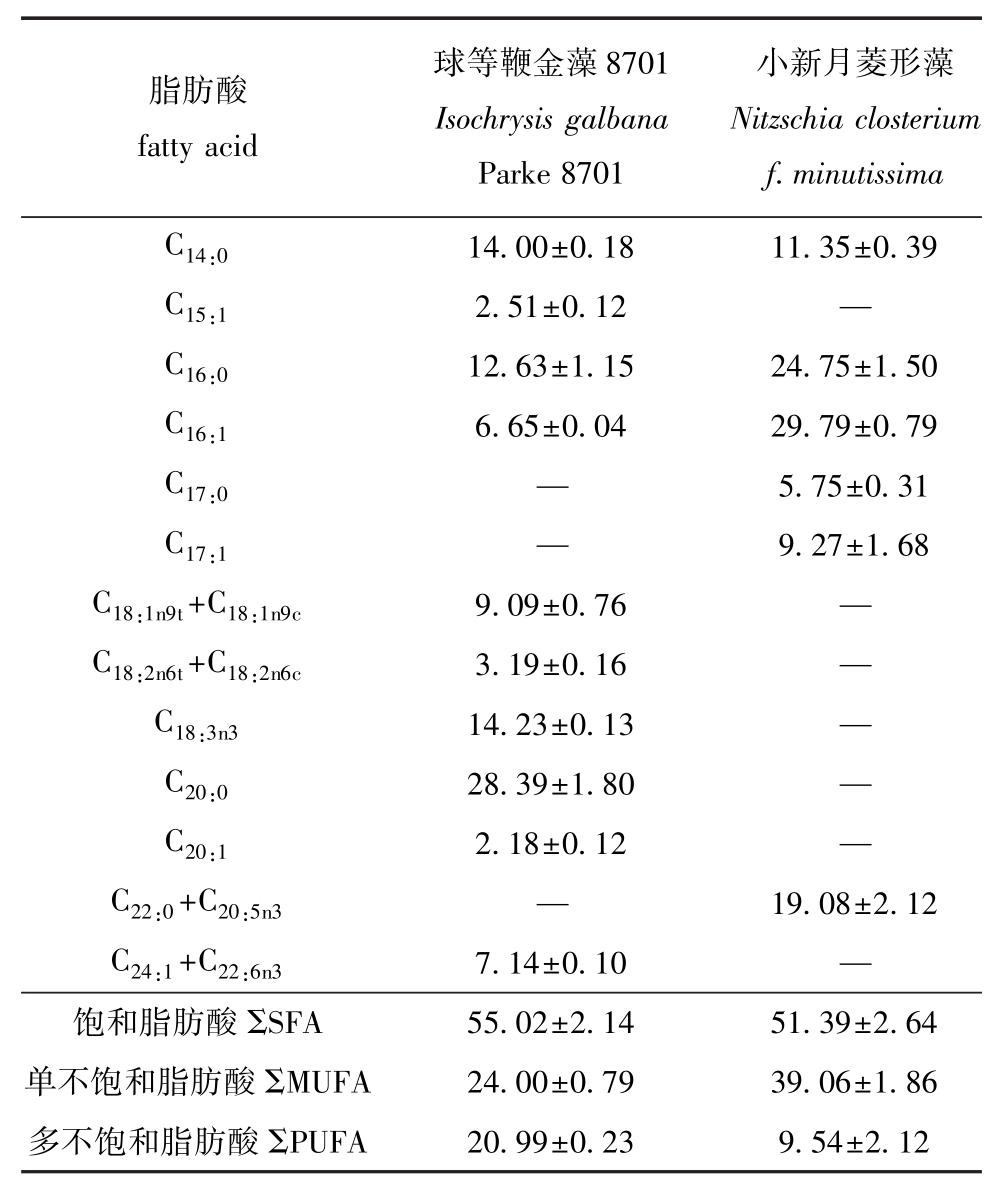
从表2可见,两种微藻脂肪酸组成及含量具有明显差异,其中,球等鞭金藻8701共检测出10种脂肪酸,而小新月菱形藻仅检测出6种。球等鞭金藻8701饱和脂肪酸含量略高于小新月菱形藻,单不饱和脂肪酸含量明显低于小新月菱形藻,而多不饱和脂肪酸含量则明显高于小新月菱形藻。
表2 两种微藻的脂肪酸组成
Tab.2 Fatty acid com positions of the two species of m icroalgae %
注:—示未检出
Note:—means undetected
脂肪酸fatty acid球等鞭金藻8701 Isochrysis galbana Parke 8701小新月菱形藻Nitzschia closterium f.minutissima C14:014.00±0.18 11.35±0.39 C15:1 2.51±0.12 —C16:0 12.63±1.15 24.75±1.50 C16:1 6.65±0.04 29.79±0.79 C17:0 — 5.75±0.31 C17:1 — 9.27±1.68 C18:1n9t+C18:1n9c 9.09±0.76 —C18:2n6t+C18:2n6c 3.19±0.16 —C18:3n3 14.23±0.13 —C20:0 28.39±1.80 —C20:1 2.18±0.12 —C22:0+C20:5n3 — 19.08±2.12 C24:1+C22:6n3 7.14±0.10 —饱和脂肪酸ΣSFA 55.02±2.14 51.39±2.64单不饱和脂肪酸ΣMUFA 24.00±0.79 39.06±1.86多不饱和脂肪酸ΣPUFA 20.99±0.23 9.54±2.12
3 讨论
3.1 两种方法提取和测定微藻油脂含量的比较
采用溶剂提取法提取微藻油脂含量的试验结果表明,选用氯仿-甲醇-水 (体积比1∶2∶0.8)作为提取溶剂时,由于易于引入水溶性杂质,误差较高;选用氯仿-甲醇 (体积比2∶1)作为提取溶剂时,由于氯仿毒性较大,对细胞具有较高的损伤性;选用二氯甲烷-甲醇 (体积比1∶2)作为提取溶剂时,得到的油脂提取率虽略低于氯仿-甲醇,但其具有毒性小、便于过滤等优势;选用正己烷作为提取溶剂时,油脂提取率偏低。根据本试验结果,确定较好的提取溶剂为二氯甲烷-甲醇 (体积比为1∶2)。为了比较同一溶剂对两种微藻油脂含量的提取效果,选用二氯甲烷-甲醇溶剂分别提取两种微藻的油脂含量,结果表明,球等鞭金藻8701和小新月菱形藻的油脂含量分别为22.99%和 16.89%。
采用苏丹黑B染色法对球等鞭金藻8701和小新月菱形藻的微藻油脂含量测定的结果表明,该方法适用于这两种微藻类且具有较高的准确度,对于任一待检湿藻样,只要测定其经苏丹黑B染色后的吸光值A645nm,代入相应的线性回归方程式,即可计算出微藻样品的油脂含量。采用苏丹黑B染色法,可以对不同的微藻种类以及不同培养条件(如光照、营养盐、pH等)下的微藻油脂含量进行快速频繁的测定,特别是对于大样品量微藻油脂含量的检测具有重要意义[9]。
3.2 两种微藻的脂肪酸组成
从表2可见,两种微藻的脂肪酸组成具有明显差异,其中在球等鞭金藻 8701中,C20:0、C14:0、C18:3n3、 C16:0、 C18:1n9t+C18:1n9c含量较高, 为主要脂肪酸, 而 C16:1、 C24:1+C22:6n3、 C18:2n6t+C18:2n6c、C15:1、C20:0含量较低, 在饱和脂肪酸中, C14、C16、C20含量较高,这一结果与蒋霞敏等[14]和卢丽娜等[15]报道的结果相近,不同之处可能是由不同品系和不同培养条件引起的微小变化造成的;在小新月菱形藻中,C16:1、 C16:0、 C22:0+C20:5n3含量较高,为主要脂肪酸,而C14:0、C17:0和 C17:1含量较低,在不饱和脂肪酸中,C18和C22含量较低,这一结果与蒋霞敏等[14]和王明清等[16]报道的结果相近。球等鞭金藻8701中的多不饱和脂肪酸较高,而小新月菱形藻的单不饱和脂肪酸较高。球等鞭金藻8701脂肪酸中C20:0含量最高 (28.39%),而小新月菱形藻中 C16:0、 C16:1含量较高 (24.75%、29.79%)。从本试验结果可以看出,球等鞭金藻8701和小新月菱形藻具有明显不同的脂肪酸组成特征。
以微藻作为原料提取生物柴油,应选择含饱和脂肪酸较高、不饱和脂肪酸较低的微藻种类。原因是不饱和脂肪酸氧化速率与双键数目和位置密切相关,如果微藻含有较多的不饱和脂肪酸会使最终制得的生物柴油的冷滤点和氧化稳定性降低[17],影响生物柴油的质量。从脂肪酸组成来看,球等鞭金藻8701的饱和脂肪酸含量 (55.02%)较小新月菱形藻 (51.39%)高,故球等鞭金藻8701更适用于作为生物柴油的原料。除了作为生物柴油的原料外,两种藻类含有的 EPA(C20:5n3)和 DHA (C22:6n3)是比较重要的多不饱和脂肪酸,在人体保健、水产养殖等领域也有重要的作用。
总之,利用溶剂提取法和苏丹黑B染色法对球等鞭金藻8701和小新月菱形藻油脂含量的测定研究,进一步验证了苏丹黑B染色法是一种快速方便的油脂测定方法。利用气相色谱法对球等鞭金藻8701和小新月菱形藻脂肪酸含量的检测结果表明,两种微藻具有明显不同的脂肪酸组成特征。从两种微藻的油脂含量和脂肪酸组成来看,球等鞭金藻8701较小新月菱形藻更适用于作为生物柴油的原料微藻。
参考文献:
[1] Bradley D W,Robert M W,Lance C S.Biodiesel production by simultaneous extraction and conversion of total lipids from microalgae,cyanobacteria,and wild mixed-cultures[J].Bioresource Technology,2011,102:2724-2730.
[2] Ayhan D,Fatih D.Importance of algae oil as a source of biodiesel [J].Energy Conversion and Management,2011,52:163-170.
[3] 孟春晓,高政权.微藻开发生物质能研究[J].安徽农业科学, 2007,35(31):9998-10000.
[4] 缪晓玲,吴庆余.藻类异养转化制备生物油燃料技术[J].可再生能源,2004(4):41-44.
[5] 曹春晖,孙世春,麦康森,等.30株海洋绿藻的总脂含量和脂肪酸组成[J].青岛海洋大学学报,2000,30(3):428-434.
[6] Krishnan V,Hemanathan K.Biodiesel production from freshwater algae[J].Energy Fuels,2009,23:5448-5453.
[7] RenéH W,Maria JB.An outlook on microalgae biofuels[J].Science,2010,329:796.
[8] Gerhard K,James A K.Comment on“biodiesel production from freshwater algae”[J].Energy Fuels,2010(24):3299-3300
[9] Teresa M M,Antonio AM,Nidia SC.Microalgae for biodiesel production and other applications:a review[J].Renewable and Sustainable Energy Reviews,2010(14):217-232.
[10] Gerhard K.Biodiesel:current trends and properties[J].Top Catal,2010,53:714-720.
[11] 秦昌蓉.富油微藻中油脂的提取及DHA富集纯化的研究[D].天津:天津大学,2010.
[12] 林汝榕,邢炳鹏,蔡文旋,等.苏丹黑B染色处理细胞技术在快速检测微藻油脂含量中的应用[J].台湾海峡,2011,30 (2):292-298.
[13] 金雪洁,巩三强,夏金兰,等.苏丹黑B染色法原位检测2株淡水小球藻胞内油脂累积[J].中南大学学报:自然科学版, 2014,45(8):2547-2552.
[14] 蒋霞敏,郑亦周.14种微藻总脂含量和脂肪酸组成研究[J].水生生物学报,2003,27(3):24-28.
[15] 卢丽娜,孙利芹,田焕玲,等.32株海洋微藻总脂含量及其脂肪酸组成的研究[J].中国油脂,2009,34(11):73-78.
[16] 王明清,迟晓元,秦松,等.海洋微藻总脂含量和脂肪酸组成的测定[J].中国油脂,2008,33(11):71-74.
[17] 黄雄超.微藻油脂的提取及制备生物柴油的研究[D].厦门:华侨大学,2012.
Com parison of detection methods of total lipid content in m icroalgae
PENG Yue1,LIU Yu-ying1,QIYan-xia2,HU Yu-cai1,FUWan-tao3
(1.College of Sciences,Dalian Ocean University,Dalian 116023,China;2.College of Food Science and Engineering,Dalian Ocean University, Dalian 116023,China;3.College of Marine Science and Environment,Dalian Ocean University,Dalian 116023,China)
Abstract:The total lipid contentswere analyzed bymethods of organic solvents and Sudan black B staining in two species ofmicroalgae,Isochrysis galbana Parke 8701 and Nitzschia closterium f.minutissima.linear regression equationswere established between lipid contents and absorbance at a wavelength of 645 nm.It was found thatmicroalgae cellswere stained with Sudan black B,and applied to rapid determination of themicroalgae oil accumulation rapidly.Fatty acid compositionswere also analyzed by gas chromatography(GC).The extraction of solvent dichloromethane/methanol(volume ratio=1∶2)revealed that there was total lipid content of 22.99%in Isochrysis galbana Parke 8701,and 16.89%in Nitzschia closterium f.minutissima.The total lipid was consistentwith the biomass by Sudan black B stainingmethod,indicating that Sudan black B stainingmethod is a feasiblemethod to estimate lipid content.There were significant differences in fatty acid compositions determined by GC in the twomicroalgae,with higher saturated fatty acid in Isochrysisgalbana Parke 8701(55.02%)than that in Nitzschia closterium f.minutissima(51.39%).The findings indicate that Isochrysisgalbana Parke 8701 ismore suitable as a feedstock for biodiesel in terms of total lipid content and fatty acid composition.
Key words:microalga;total lipid;Sudan black B stainingmethod;organic solventmethod;fatty acid
中图分类号:Q949.2
文献标志码:A
收稿日期:2015-01-21
基金项目:辽宁省海洋与渔业厅计划项目 (201215)
作者简介:彭悦 (1990—),女,硕士研究生。E-mail:375877091@qq.com
通信作者:胡玉才 (1965—),男,教授。E-mail:hyc@dlou.edu.cn
DOI:10.16535/j.cnki.dlhyxb.2015.05.001
文章编号:2095-1388(2015)05-0455-06