牙鲆体质量和形态性状异速生长的遗传分析
高会晓1,崔妍1,杜杰2,仇雪梅1,杨润清3,刘海金3,刘永新3
(1.大连海洋大学水产与生命学院,农业部北方海水增养殖重点实验室,辽宁大连116023;2.上海交通大学农业与生物学院,上海200240;3.中国水产科学研究院,北京100141)
摘要:为了对牙鲆Paralichthysolivaceus进行品种选育,运用联合异速生长尺度模型,对牙鲆多个部分体大小相对整体体大小的异速生长进行了遗传分析。结果表明:体长、头长、尾柄长、体高、尾柄高5个形态性状相对体质量的异速生长遗传力为0.251~0.755,除尾柄长和尾柄高的表型相关为正值外,其余性状的表型相关均为负值;而相对体长的异速生长中,除了尾柄高的遗传力很高 (0.871)外,大多数形态性状表现为中等遗传力,且这些异速生长尺度的遗传相关大多数为负值。本研究对牙鲆形态性状相对于体质量和体长的遗传参数分析结果可为牙鲆的品种选育提供一定的理论基础。
关键词:牙鲆;相对生长;异速生长;遗传参数;随机回归模型
牙鲆Paralichthysolivaceus俗称牙片、比目鱼、偏口,隶属于辐鳍鱼纲、鲽形目、鲽亚目、牙鲆科、牙鲆属,广泛分布于中国渤海、黄海、东海、南海,以及朝鲜、日本、俄国远东沿岸海区。牙鲆具有体型大、生长快、肉质鲜美、营养丰富等特点,是一种经济价值很高的海水增养殖鱼类[1-2]。牙鲆养殖从20世纪50年代开始,至90年代后得到快速发展,但由于近亲繁殖、近交累积,出现了种质退化、繁殖力下降等问题,阻碍了牙鲆养殖业的发展,为此,以重要的经济性状为目标,以遗传育种学理论和数量遗传学为依据,制定合理的牙鲆育种方案,才能培育出优良的养殖品种[3-4]。
生长可以分为绝对生长和相对生长,绝对生长是单位时间内的绝对增量,相对生长是单位时间内的增加量占整体增量的比值。在比较不同动物的生长速率时,绝对生长常受到限制,在此情况下用相对生长来表示就显得比较合理。因此,对鱼类体质量和形态性状相对生长的遗传分析越来越受到关注。佟雪红等[5]对20~40日龄牙鲆进行了绝对生长率和特定生长率的测定,发现体高是该时期影响体质量的主要性状,牙鲆变态期间和变态后的体质量、体长和体高虽然一直呈增长状态,但每天的增长幅度一直在下降。马境等[6]对施氏鲟 Acipenser schrenckii仔鱼发育的研究发现,仔鱼许多关键器官存在异速生长现象,如眼径、口宽、尾鳍长、胸鳍长在拐点 (2日龄、8~9日龄、10日龄、11日龄)之前快速生长,拐点之后生长速度减慢甚至近似等速生长。对于重复测量的生长和发育性状,早期的方法是用单变量动物模型分别对每个生长点进行分析,然后用多变量遗传分析来估计这些生长点的遗传力和遗传相关。但是如果测量的生长点太多或者没有测量每个生长点的所有个体,这种方法便不适用。随机回归模型不仅能灵活地估计任意点的遗传力以及它们之间的遗传相关,还能预测特定生长点的育种值,因此,也有学者用随机回归的方法对鱼类的生长进行了遗传分析[7-8]。
Snell[9]在1892年首次提到异速生长这个概念,之后D'arcy[10]在1917年,Huxley等[11]在1932年又对其进行了阐述。异速生长在自然界广泛存在,它旨在描述生物学性状、组织功能和体大小之间相对生长率的关系。由于有机体在物理学、几何学和功能上具有很大的相关性[12],所以异速生长涉及到生理学、形态学、发育学、解剖学、生活史、生态学、进化生物学等各个方面[13-15]。Huxley等[11]提出的简单异速方程,初步量化了异速生长尺度。作为简单异速生长方程的独立变量,生物性状和功能不仅包括部分体大小,还包括部分体形状、密度、体积、代谢速率等。为了分析多个部分体大小对整体体大小的异速生长尺度,Gao等[16]于2013年提出了联合异速生长尺度模型的概念,此模型适用于同时分析多个生物性状和相同或者相似的功能,以及多种因素对多个异速生长尺度的影响。
通过把简单异速生长尺度方程分解为混合线性模型的加性遗传效应[17-18]和QTL定位遗传模型的基因型效应[19-21],能对生物学性状和功能相对体大小的异速生长尺度进行遗传分析。本研究中,首先构建包含整体体大小和多个部分体大小的表型信息的最佳联合异速生长尺度模型;然后把最佳联合异速生长尺度模型作为一个子模型建立两个随机回归模型,用于多个异速生长尺度的遗传分析;最后把遗传模型应用于牙鲆不同生长时期多个体形态性状分别对体长和体质量的联合异速生长尺度分析。
1 材料与方法
1.1 材料
试验于2009年在河北省秦皇岛市中国水产科学研究院北戴河中心试验站进行,牙鲆亲鱼包含52个全同胞家系,其中30个父本,31个母本。
1.2 方法
1.2.1 试验设计 从每个家系取180尾鱼苗,分别饲养在有流动海水、规格为300cm×100cm×100 cm的矩形缸中。在0~25日龄时投喂轮虫,15~60日龄投喂卤虫,60日龄以后喂食干料粒。当鱼苗培养至180日龄时,从每个家系抽出100个个体进行 PTT标记 (PITtags,Trovan,Ltd,Germany)。用标签标记以后,把每个家系的鱼随机分配到室内规格为100m2的相同缸中,并喂以过量的标准化商业饲料。水温控制在15.4~22.3℃,每天从8:00~18:00光照10h。
本研究中测量了4939尾牙鲆的体质量、体长(L)、头长 (LH)、尾柄长 (LCP)、体高 (H)、尾柄高 (HCP)、全长 (LF)、尾鳍长 (LCF)等18个表型性状。测量前,用2-苯氧乙醇对每个个体进行麻醉。测量时,把试验鱼放入带尺子的浅水中,在同一高度照相形成电子相片,再用软件测量电子相片上鱼的尺寸,并根据比例还原为真实数据。共有15224个记录,分别为150、180、240、330、360、450、500、653日龄时的测量值。大多数性状在150、180、240、360、450、500、653日龄时有记录,但在150、180、240、360日龄时记录较多。试验材料和测量由北戴河实验中心提供。
从数据中集中剔除表型记录不完整和亲本未知的个体,且表型值被控制在一个性状的表型平均值左右、标准差的3倍以内。以此为依据对数据进行处理后,数据中性状测量完整的个体数为4939,总记录数为13413。对7个年龄组的体质量、体长、头长、尾柄长、体高和尾柄高6个性状的表型信息进行统计 (表1),从数据中可以得到一个包含30个父本、31个母本、5001个个体组成的系谱,用于牙鲆多个表型性状相对体质量或体长异速生长的遗传分析。
表1 牙鲆体质量和5个形态性状在不同日龄时的表型值
Tab.1 Body weights and phenotype values of the 5 morphological traits of Japanese flounder w ith various days old
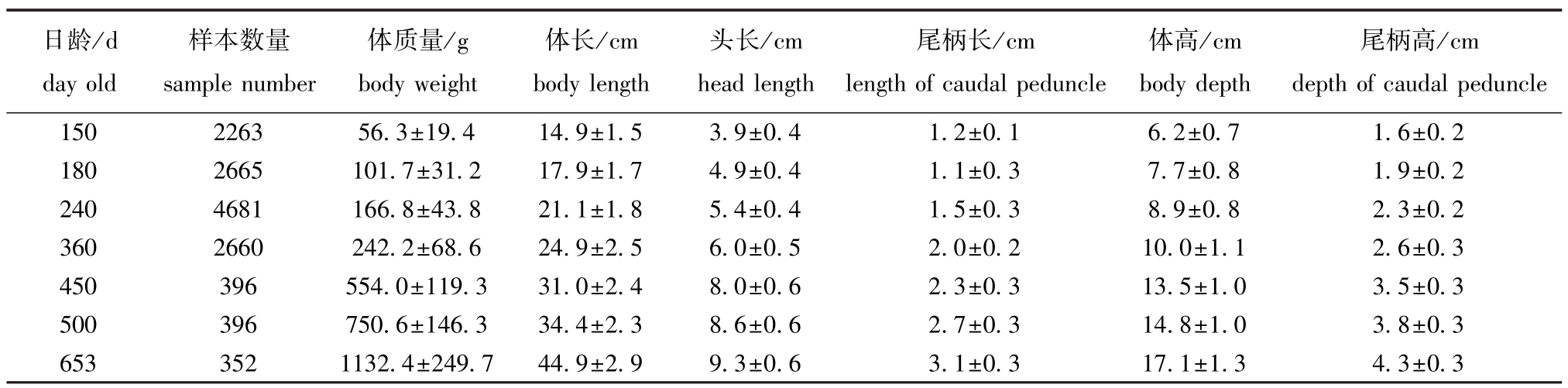
日龄/d day old尾柄高/cm depth of caudal peduncle 150 2263 56.3±19.4 14.9±1.5 3.9±0.4 1.2±0.1 6样本数量sample number体质量/g body weight体长/cm body length头长/cm head length尾柄长/cm length of caudal peduncle体高/cm body depth .2±0.7 1.6±0.2 180 2665 101.7±31.2 17.9±1.7 4.9±0.4 1.1±0.3 7.7±0.8 1.9±0.2 240 4681 166.8±43.8 21.1±1.8 5.4±0.4 1.5±0.3 8.9±0.8 2.3±0.2 360 2660 242.2±68.6 24.9±2.5 6.0±0.5 2.0±0.2 10.0±1.1 2.6±0.3 450 396 554.0±119.3 31.0±2.4 8.0±0.6 2.3±0.3 13.5±1.0 3.5±0.3 500 396 750.6±146.3 34.4±2.3 8.6±0.6 2.7±0.3 14.8±1.0 3.8±0.3 653 352 1132.4±249.7 44.9±2.9 9.3±0.6 3.1±0.3 17.1±1.3 4.3±0.3
1.2.2 联合异速生长尺度模型β Huxley等[11]提出的简单异速生长方程为xi=ayb,其中xi为要研究的性状属性值,y为某一物种的整体体大小,a为异速生长系数,b为异速生长指数。Gao等[16]提出的一个能同时估计多个部分体大小相对于整体体大小异速生长的联合异速生长尺度模型为
其中:β0为标准化常数;βi(i=1,2,…,m)为第i部分体大小相对于整体体大小的异速生长指数。对模型(1)的两边取自然对数后可使计算更方便,得到的方程为
1.2.3 多个异速生长的遗传分析 将整体体大小的自然对数形式用单个性状动物模型可表示为
其中:bj为第j个个体的固定效应;ai为第i个个体的加性遗传效应;xi为与bj相对应的单位矩阵;ei为服从正态分布的残余误差,其期望值为0,方差为σ2e。为了对多个部分体大小相对整体体大小的异速生长进行遗传分析,在模型(3)中,把固定效应和加性遗传效应镶嵌到模型(2)中,得到随机回归动物模型[22-24]为
其中:A为分子关系矩阵;G和P分别为加性遗传协方差矩阵和永久环境协方差矩阵,分别代表多个异速生长尺度中的加性遗传效应和永久环境效应。
1.3 数据处理
通过DMU软件计算得到加性遗传协方差矩阵和永久环境效应矩阵,第i部分体大小相对整体体大小异速生长的遗传力可用下式进行计算:
其中:σ^2a(i)和 σ^2p(i)分别为估计的异速生长尺度的加性遗传效应方差和永久环境效应方差,为G矩阵和P矩阵的对角元素。第i和j部分体大小相对整体体大小的异速生长的遗传相关可用下式计算:
其中:i,j=1,2,…,m;Cova(i,j)为G矩阵的第i行、第j列的非对角元素。
2 结果与分析
2.1 形态性状相对体质量的异速生长
在进行遗传分析之前,通过SAS软件对牙鲆所有的性状进行逐步回归分析。在测量的18个性状中,有5个性状 (体长x1、头长x2、尾柄长x3、体高x4、尾柄高x5)相对体质量y的异速生长显著。剔除异速生长指数不显著的性状后,建立了估计体质量与体长、头长、尾柄长、体高、尾柄高之间的最佳表型联合异速生长尺度模型为
当异速生长指数β>1时,表示该性状的生长速度慢于体质量;β<1时,表示该性状的生长速度快于体质量;β=1时,表示该性状与体质量等速生长[25]。从式(7)可知,除了体长x1的生长速度慢于体质量外,其他形态性状的生长速度均快于体质量。利用DMU软件对牙鲆这5个性状相对于体质量的异速生长性状进行分析,结果见表2。从表2可见:从左上到右下的斜对角线上的值为各个性状的估计遗传力,在相对体质量的异速生长中,除了体高表现为低遗传力 (0.251)外,其他形态性状的遗传力均表现为高遗传力;相对体质量的异速生长的形态性状之间的遗传相关在大小和方向上均表现出差异性;体高和体长两个性状表现出最大负遗传相关,为-0.695,表明与其他性状相比,这两个性状相对体质量的变化在遗传上最为密切,但是它们相对体质量的变化却表现相反;而体长和尾柄高之间的遗传相关最小 (0.029)。在相对体质量异速生长的表型相关中,除了尾柄长和尾柄高为正相关外,其他性状均为负值,这表明这些性状的表型相关是相反的;体高和体长性状具有最大表型负相关,为-0.704。
表2 5个形态性状相对体质量异速生长的估计遗传力、表型相关 (上三角)和遗传相关 (下三角)
Tab.2 Estimated heritabilities and phenotypic(upper triangle)and genetic(lower triangle)correlations in allometries of the 5 morphological traits to body weights
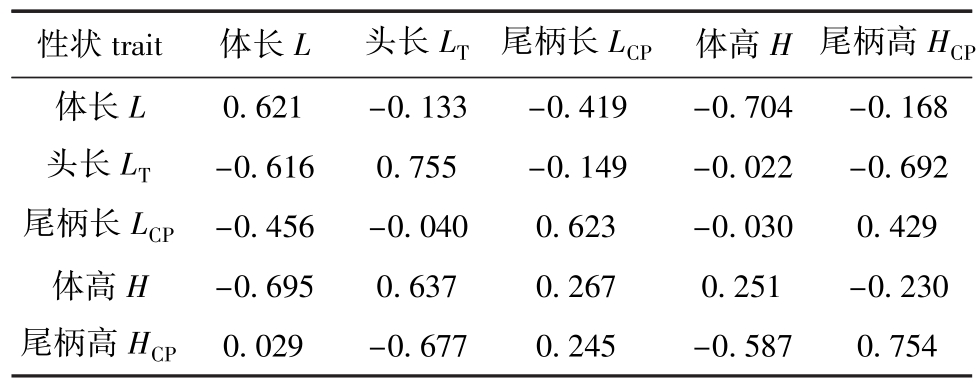
性状trait 体长L 头长LT 尾柄长LCP 体高H 尾柄高HCP0.621 -0.133 -0.419 -0.704 -0.168头长LT -0.616 0.755 -0.149 -0.022 -0.692尾柄长LCP -0.456 -0.040 0.623 -0.030 0.429体高H -0.695 0.637 0.267 0.251 -0.230尾柄高HCP体长L 0.029 -0.677 0.245 -0.587 0.754
2.2 形态性状相对体长的异速生长
通过对体长x1和17个表型性状进行逐步回归分析,得到头长x2、尾柄长x3、体高x4和尾柄高x54个形态性状相对体长的异速生长是显著的,建立估计体长与头长、尾柄长、体高、尾柄高之间的最佳表型联合异速生长尺度模型为
与体长相比,这4个形态性状的异速生长指数均较低。头长相对体长生长最快,体高次之,尾柄高相对体高的增长速度最慢。同样用DMU软件对这4个性状进行遗传分析,结果见表3。从表3可见:从左上到右下的斜对角线上的值亦是这4个性状的估计遗传力,尾柄高相对体长的异速生长的遗传力最高,为0.871,而其他性状相对体长的遗传力均表现为中等;尾柄长和体高的遗传相关表现较弱,为0.210,而其他性状相对体长的遗传相关均为负值;除了头长和尾柄高两个性状外,表型相关普遍高于遗传相关。
表3 4个形态性状相对体长异速生长的估计遗传力、表型相关 (上三角)和遗传相关 (下三角)
Tab.3 Estimated heritabilities and phenotypic(upper triangle)and genetic(lower triangle)correlations in allometries of the four morphological traits to body lengths
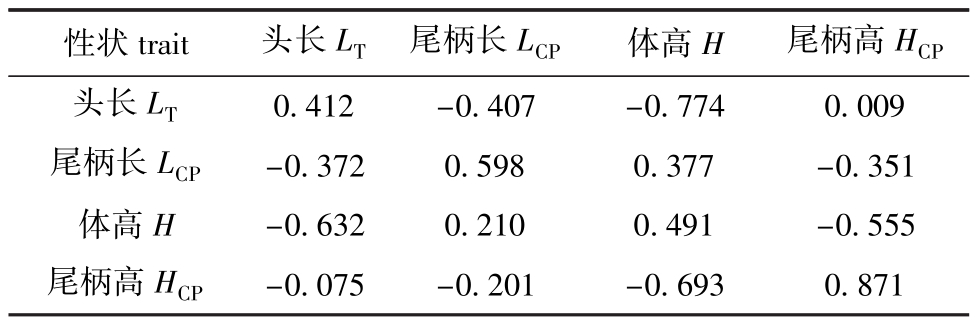
性状trait 头长LT 尾柄长LCP 体高H 尾柄高HCP0.412 -0.407 -0.774 0.009尾柄长LCP -0.372 0.598 0.377 -0.351体高H -0.632 0.210 0.491 -0.555尾柄高HCP头长LT-0.075 -0.201 -0.693 0.871
3 讨论
Huxley[11]提出的简单异速生长方程是对单一独立变量的简单回归分析。刘永新等[26]对牙鲆180、240、360日龄的体质量、体长、体高进行遗传分析时发现,这几个性状的遗传力均属中等,能够作为指标进行选择育种。宋洪建等[27]分别对大马哈鱼Oncorhynchusketa卵黄囊期仔鱼器官的异速生长指数进行单独估计,结果表明,在大麻哈鱼卵黄囊期,仔鱼的头部和尾部比躯干生长较快,头部的快速增长是为了形成有效的摄食器官以满足摄食的需求,其尾部的快速发育是为了避免被捕食。Baldauf等[28]比较了雌性带纹矛耙丽鱼Pelvicachro+ mistaeniatus的腹鳍、尾鳍、臀鳍、胸鳍和背鳍对体大小的异速生长,发现腹鳍与其他鳍相比具有显著差异,腹鳍是等速生长,而其他鳍相对于体大小是负异速生长。Zelditch等[29]对小虎鱼红腹水虎鱼Pygocentrusnattereri体型变化的个体发育研究表明,个体发育过程中体型的变化不只是简单大规模事件的统一,而是局部小规模性状变化相互作用的结果。吴水清等 研究斜带石斑鱼 Epinephelusco+ ioides(♀)×鞍带石斑鱼E.lanceolatus(♂)杂交子代仔、稚鱼的简单异速生长时也发现,有关摄食、感觉、运动等功能器官在早期得到优先发育。然而单独计算每个性状的异速生长指数没有考虑性状之间的相互影响,并不十分精确,而Gao等[16]的联合异速生长尺度模型是对多个独立变量进行的多元回归分析,考虑了各个性状的相关性,能更精确地估计每个性状相对整体大小的异速生长尺度。把联合异速生长尺度模型作为子模型,建立一个以整体大小的对数作为目标性状的随机回归模型,本研究在此基础上对牙鲆多个形态性状相对体质量或体长的异速生长进行了遗传分析。结果表明:在遗传力方面,只有体高相对体质量表现为低遗传力,其他性状均表现为高等或中等遗传力,说明大多数性状具有较好的遗传性能;相对体质量的异速生长中,体高和头长在表型和遗传上均表现为最大负相关,说明这两个性状的变化无论是在表型上还是在遗传上都是相反的;除了体长与尾柄高、头长与体高、尾柄长与体高这3对性状外,其他性状之间的遗传相关和表型相关都一致;在相对体长的生长中,只有头长与尾柄的遗传相关和表型相关符号相反。异速生长的遗传参数估计对于指导并改善牙鲆的表型性状和体质量具有重要意义,也将有助于对体质量遗传进化的相关体形进行选择。
参考文献:
[1] 王波,张朝晖,左言明,等.牙鲆属主要经济鱼类的生物学及养殖研究概况[J].海洋水产研究,2004,25(5):86-92.
[2] 陈松林,田永胜,徐田军,等.牙鲆抗病群体和家系的建立及其生长和抗病性能初步测定[J].水产学报,2008,32(5):665-673.
[3] 王志刚,刘旭东,刘寿堂,等.牙鲆家系耐热性状的初步研究[J].海洋湖沼通报,2014(1):101-108.
[4] 刘峰,陈松林,王磊,等.不同牙鲆群体遗传力和育种值分析[J].中国水产科学,2013,20(4):691-697.
[5] 佟雪红,葛宝明,王欢莉,等.牙鲆不同发育期形态性状与体重相关性分析[J].湖北农业科学,2014,53(4):863-865,870.
[6] 马境,章龙珍,庄平,等.施氏鲟仔鱼发育及异速生长模型[J].应用生态学报,2007,18(12):2875-2882.
[7] McKay L R,Schaeffer L R,McMillan I.Analysis of growth curves in rainbow trout using random regression[C].Montpellier:7th World Congress on Genetics Applied to Livestock Production, 2002:6-11.
[8] Rutten M JM,Komen H,Bovenhuis H.Longitudinal genetic analysis of Nile tilapia(Oreochromis niloticus L.)body weight using a random regressionmodel[J].Aquaculture,2005,246(1/4):101-113.
[9] Snell O.Die Abhängigkeit des Hirngewichtes von dem Körpergewicht und den geistigen Fähigkeiten[J].European Archives of Psychiatry and Clinical Neuroscience,1892,23(2):436-446.
[10] D'arcy W T.On growth and form[M].Cambridge:Cambridge U-niversity Press,1917.
[11] Huxley JS,Churchill FB.Problemsof relative growth[M].Baltimore:Johns Hopkins University Press,1932.
[12] LaBarbera M.Analyzing body size as a factor in ecology and evolution[J].Annual Review of Ecology and Systematics,1989,20: 97-117.
[13] Enquist B J,Niklas K J.Globalallocation rules for patternsof biomass partitioning in seed plants[J].Science,2002,295:1517-1520.
[14] Peters R H.The ecological implications of body size[M].Cambridge:Cambridge University Press,1986.
[15] West G B,Brown JH.The origin of allometric scaling laws in biology from genomes to ecosystems:towards a quantitative unifying theory of biological structure and organization[J].Journal of Experimental Biology,2005,208(9):1575-1592.
[16] Gao Huijiang,Liu Yongxin,Zhang Tingting,et al.Statisticalmodels for jointly analyzingmultiple allometries[J].Journal of Theoretical Biology,2013,318:205-209.
[17] Lande R.Quantitative genetic analysis ofmultivariate evolution, applied to brain:body size allometry[J].Evolution,1979,33 (1):402-416.
[18] McGuigan K,Nishimura N,Currey M,et al.Quantitative genetic variation in static allometry in the threespine stickleback[J]. Integrative and Comparative Biology,2010,50(6):1067-1080.
[19] Li Hongying,Huang Zhongwen,Gai Junyi,et al.A conceptual framework formapping quantitative trait loci regulating ontogenetic allometry[J].PLoSOne,2007,2(11):e1245.
[20] Wu R,Hou W.A hyperspacemodel to decipher the genetic architecture of developmental processes:allometrymeets ontogeny[J]. Genetics,2006,172(1):627-637.
[21] Wu R,Ma CX,Lou X Y,etal.Molecular dissection of allometry, ontogeny,and plasticity:a genomic view of developmental biology [J].Bio Science,2003,53(11):1041-1047.
[22] Meyer K,HillW G.Estimation of genetic and phenotypic covariance functions for longitudinal or“repeated”records by restricted maximum likelihood[J].Livestock Production Science,1997,47 (3):185-200.
[23] Schaeffer L R.Application of random regressionmodels in animal breeding[J].Livestock Production Science,2004,86(1):35-45.
[24] Henderson Jr C R.Analysis of covariance in the mixed model: higher-level,nonhomogeneous,and random regressions[J].Biometrics,1982,38:623-640.
[25] 吴水清,李加儿,区又君,等.斜带石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代仔、稚鱼的异速生长[J].中国水产科学, 2014,21(3):503-510.
[26] 刘永新,刘海金.应用动物模型对牙鲆不同日龄生长性状的遗传分析[J].大连水产学院学报,2009,24(S1):15-20.
[27] 宋洪建,刘伟,王继隆,等.大麻哈鱼卵黄囊期仔鱼异速生长及其生态学意义[J].水生生物学报,2013,37(2):329-335.
[28] Baldauf SA,Bakker TC,Herder F,etal.Malemate choice scales female ornamentallometry in a cichlid fish[J].BMC Evolutionary Biology,2010,10(1):301.
[29] Zelditch M L,Fink W L.Allometry and developmental integration of body growth in a piranha,Pygocentrus nattereri(Teleostei:Ostariophysi)[J].Journal of Morphology,1995,223(3):341-355.
Genetic analysis of allometry scallings of body weights and morphological traits in Japanese flounder Paralichthys olivaceus
GAO Hui-xiao1,CUIYan1,DU Jie2,QIU Xue-mei1,YANG Run-qing3,LIU Hai-jin3,LIU Yong-xin3
(1.College of Fisheries and Life Science,Key Laboratory ofMariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian O-cean University,Dalian 116023,China;2.School of Agriculture and Biology,Shanghai Jiaotong University,Shanghai200240,China;3.Chinese Academy of Fishery Sciences,Beijing 100141,China)
Abstract:Genetic analysis of relative growths ofmultiple bodymorphological traits to body weights or body lengths was conducted in Japanese flounder Paralichthys olivaceus by joint allometric scalingmodel for selective breeding of Japanese flounder.The results showed that heritability in relative growth of morphological traits including body length,head length,length of caudal peduncle,depth of caudal peduncle,and body depth to body weight was found to be changed from 0.251 to 0.755,positive value only between length of caudal peduncle and depth of caudal peduncle in phenotypic correlation,while negative value in other traits.The heritability wasmoderate and most genetic correlations among these allometry scalings were negative in body length allometry except for the maximal heritability(0.871)of caudal peduncle height.The findingsmay provide a theoretical basis for breeding in Japanese flounder.
Keywords:Paralichthys olivaceus;relative growth;allometry;genetic parameter;random regression model
中图分类号:S917.4
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2015.04.005
文章编号:2095-1388(2015)04-0369-05
收稿日期:2014-08-29
基金项目:国家公益性行业 (农业)科研专项 (2014B004,2014A04XK01);国家自然科学基金资助项目 (31201989)
作者简介:高会晓 (1988—),女,硕士研究生。E-mail:ghxxlyx@sina.com
通信作者:仇雪梅 (1964—),女,博士,教授。E-mail:xmqiu@dlou.edu.cn杨润清 (1966—),男,博士,教授。E-mail:runqingyang@sjtu.edu.cn



