图1 裸甲藻普通光学显微照片
Fig.1 Ordinary lightm icroscopic graphy of alga Gymnodinium sp.
摘要:为了探索池塘赤潮的有效防控措施,在温度为22~25℃的室内条件下,研究了两种有害藻类 (异冒藻Heterocapsa sp.、裸甲藻Gymnodinium sp.)对轮虫和中华绒螯蟹Eriocheir sinensis各发育期溞状幼体的毒性,并将中华绒螯蟹溞状幼体放入不同密度的有害藻中,观察有害藻对溞状幼体各个时期变态的影响。结果表明:当裸甲藻密度为2.000×105cells/mL时,Ⅰ、Ⅱ期溞状幼体的变态率仅有13.33%,裸甲藻对溞状幼体后期发育毒性不显著;在同样密度的异冒藻藻液中,Ⅰ期溞状幼体的变态率为11.67%;在两种藻对褶皱臂尾轮虫Brachionus plicatilis的影响以及不同密度轮虫对有害藻摄食效果的试验中,两种藻密度为1.728×105cells/mL时,轮虫96h内几乎不繁殖,当藻液密度为0.288×105cells/mL时,异冒藻和裸甲藻液中的轮虫数量在96h后分别增加到原来的5倍和8倍。研究表明,两种有害藻能够严重影响中华绒螯蟹溞状幼体早期的存活和发育,其饵料生物轮虫在较高密度情况下可以通过摄食的方式控制有害藻的数量。
关键词:褶皱臂尾轮虫;中华绒螯蟹幼体;异冒藻;裸甲藻
赤潮通常是指某些浮游植物、原生动物和其他微生物在水体中过度繁殖或聚集而使海水变色并造成危害的一种生态异常现象,尤其是有毒赤潮发生时,常伴有鱼、贝等大量死亡,赤潮已成为海湾或近海人工养殖的巨大威胁[1]。近年来,赤潮发生的频次和累计面积呈增长趋势,21世纪前10年的赤潮发生频次和规模是20世纪后50年的2倍多,其危害程度也日益增加。赤潮藻类主要有夜光藻Noctiluca scintillans、亚历山大藻Alexandrium、海洋卡盾藻 Chattonella marina、海洋原甲藻 Prorocen+ trum micans等,裸甲藻Gymnodinium sp.也是赤潮藻类的主要成分[2]。
海水池塘养殖业的兴起,使原本发生在海洋中的赤潮有了在池塘中出现的可能,并危害到了养殖动物[3-4],特别是随着养殖动物生态育苗模式在水产养殖业中的推广应用[5-7],这种现象发生得更为频繁,如中华绒螯蟹Eriocheirsinensis土池育苗时,伴随着单产的提高和池塘富营养化的加剧,赤潮发生的几率显著提高,蟹苗成活率受到了严重影响。近年来,笔者对蟹苗池、补水池、小球藻池、轮虫池等不同类型水体的观察发现,轮虫池塘中的裸甲藻赤潮发生率极低,这可能与轮虫摄食裸甲藻有关。本研究中,以两种有害藻与中华绒螯蟹溞状幼体、褶皱臂尾轮虫为试验对象,研究了四者的相互关系,以期探索池塘赤潮的有效防控措施。
1.1 材料
裸甲藻 (图1)由大连市国家海洋环境监测中心提供且尚未定种,使用f/2培养液培养。异冒藻Heterocapsa sp.(图2)采自盘锦光合蟹业有限公司三角洲分公司的海水沉淀池,在实验室里提纯并培养,培养液采用f/2营养盐配方,此藻种由国家海洋局第三海洋研究所的顾海峰教授帮助鉴定。褶皱臂尾轮虫Brachionus plicatilis用三角洲分公司轮虫培养池的休眠卵在盐度为26的海水中孵化获得。中华绒螯蟹Eriocheir sinensis H.Mlne-Edwards溞状幼体采自三角洲分公司河蟹育苗池。

图1 裸甲藻普通光学显微照片
Fig.1 Ordinary lightm icroscopic graphy of alga Gymnodinium sp.
图2 异冒藻电镜照片
Fig.2 Electronic m icroscopic graphy of alga Gymnodinium sp.
1.2 方法
1.2.1 裸甲藻对中华绒螯蟹溞状幼体变态的影响试验 设置2.000×105、1.000×105、0.500×105、0.250×105、0.125×105cells/mL5个裸甲藻密度组,同时以海水作为对照组,每个密度组设3个平行,试验在盛有300mL溶液的烧杯中进行,每个烧杯中放入20只蟹苗,试验按溞状幼体Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期分5次完成,记录并计算每期溞状幼体的变态率。
1.2.2 异冒藻对中华绒螯蟹溞状幼体变态的影响试验 试验分组及试验方法同 “1.2.1”节,试验按溞状幼体Ⅰ、Ⅱ期分2次完成,记录并计算每期溞状幼体的变态率。
1.2.3 不同初始密度的裸甲藻对轮虫生存和繁殖的影响试验 设置 1.728×105cells/mL(133.06 mg/L)、0.575×105cells/mL (44.28 mg/L)、0.288×105cells/mL(22.18mg/L)3个裸甲藻初始密度组,试验在略大于5mL的医用玻璃瓶中进行,每个密度组中做两种处理 (第一种加轮虫5个,另一种不加轮虫,作为裸甲藻生物量变化观察的对照),各加入 5mL藻液,以密度为 34.56×105cells/mL的蛋白核小球藻Chlorella pyrenoides和空白海水作为对照组。每个处理设3个平行,放入光照为2000lx的培养箱中,盐度为26,温度为 (20± 0.5)℃,试验共进行96h,试验开始后分别在12、24、48、72、96h取样观察,每次从每个处理组随机取3个小瓶,加碘液固定,在显微镜下观察并记录轮虫的存活数、挂卵量和裸甲藻数量。
裸甲藻的生物量是在显微镜下测量并计算一定数量的裸甲藻体积而换算得出的。
1.2.4 不同初始密度的异冒藻对轮虫生存和繁殖的影响试验 设置1.728×105cells/mL(103.68 mg/L)、0.575×105cells/mL (34.50 mg/L)、0.288×105cells/mL(17.28mg/L)3个异冒藻初始密度组,其密度 (数量)与裸甲藻一致 (通过浓缩和稀释方法配制),其他试验条件与方法同“1.2.3” 节。
1.2.5 轮虫摄食裸甲藻的试验 轮虫投放密度设置为0(对照)、7.5、15、30ind./mL,试验容器为500mL的烧杯,每个烧杯中放入500mL密度为0.288×105cells/mL的裸甲藻液,然后放入4种不同密度的轮虫,每个轮虫密度组设3个平行,试验共进行96h,试验开始后分别在24、48、72、96h取样,在显微镜下观察并记录轮虫的存活数和裸甲藻的数量。
1.2.6 轮虫摄食异冒藻的试验 轮虫投放密度设置为0(对照)、15、30、60ind./mL,试验容器为500mL的烧杯,每个烧杯放入500mL密度为0.72×104cells/mL的异冒藻液,其他试验条件与方法同 “1.2.5” 节。
1.3 数据处理
试验数据以平均值±标准差表示。用 SPSS 17.0软件进行单因素方差分析,用Duncan法进行多重比较,显著性水平设为0.05。
2.1 裸甲藻对中华绒螯蟹溞状幼体变态的影响
从表1可见:在试验浓度范围内,裸甲藻对Ⅰ、Ⅱ期溞状幼体有毒性作用,而对Ⅲ、Ⅳ、Ⅴ期溞状幼体毒性不显著;随着藻密度的升高,Ⅰ、Ⅱ期溞状幼体的变态率降低;当裸甲藻密度为2.000×105cells/mL时,Ⅰ、Ⅱ期溞状幼体的变态率均只有13.33%±7.64%,显著低于对照组及其他藻密度组 (P<0.05)。
表1 中华绒螯蟹各发育期溞状幼体在不同密度裸甲藻下的变态率
Tab.1 M etamorphosis rate of various developmental zoea of Chinesem itten handed crab Eriocheir sinensis under different concentrations of alga Gymnodinium sp.
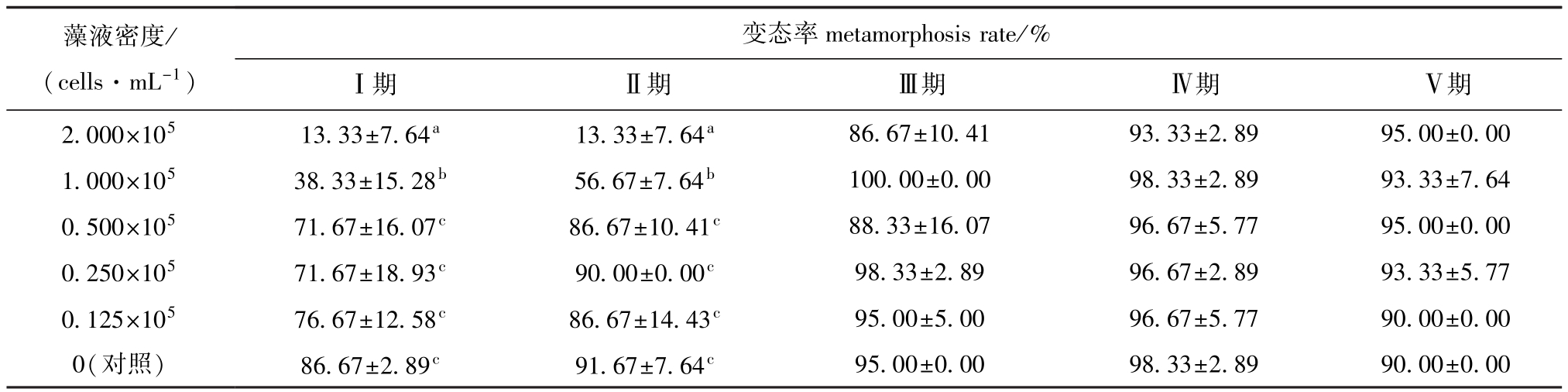
注:同列中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同
Note:Themeans with different letterswithin the same column are significant differences at the0.05 probability level,and themeanswith the same letters within the same column are not significant differences,et sequentia
藻液密度/ (cells·mL-1) metamorphosis rate/%Ⅰ期 Ⅱ期 Ⅲ期 Ⅳ期 Ⅴ期变态率2.000×105 13.33±7.64a 13.33±7.64a95.00±0.00 98.33±2.89 90.00±0.00 86.67±10.41 93.33±2.89 95.00±0.00 1.000×105 38.33±15.28b 56.67±7.64b 100.00±0.00 98.33±2.89 93.33±7.64 0.500×105 71.67±16.07c 86.67±10.41c 88.33±16.07 96.67±5.77 95.00±0.00 0.250×105 71.67±18.93c 90.00±0.00c 98.33±2.89 96.67±2.89 93.33±5.77 0.125×105 76.67±12.58c 86.67±14.43c 95.00±5.00 96.67±5.77 90.00±0.00 0(对照) 86.67±2.89c 91.67±7.64c
2.2 异冒藻对中华绒螯蟹溞状幼体变态的影响
从表2可见:异冒藻对Ⅰ、Ⅱ期溞状幼体的变态率有显著影响,随着异冒藻密度的增加,溞状幼体的变态率降低;当异冒藻密度为 2.000×105cells/mL时,Ⅰ、Ⅱ期溞状幼体的变态率分别为11.67%±7.64%、26.67%±17.56%,均显著低于对照组及其他藻密度组 (P<0.05);当异冒藻密度为0.500×105cells/mL及以下时,Ⅰ期溞状幼体的变态率与对照组无显著性差异 (P>0.05);当异冒藻密度为1.000×105cells/mL及以下时,Ⅱ期溞状幼体的变态率与对照组无显著性差异 (P>0.05)。
表2 中华绒螯蟹Ⅰ、Ⅱ期溞状幼体在不同密度异冒藻下的变态率
Tab.2 M etamorphosis rate in zoeaⅠand zoeaⅡof Chinese m itten handed crab Eriocheir sinensis under the different concentrations of alga Heterocapsa sp.
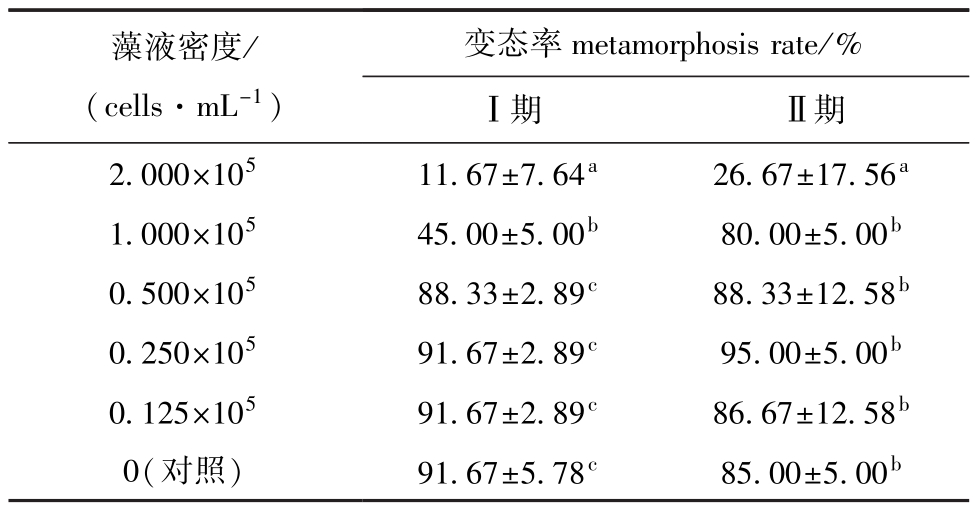
藻液密度/ (cells·mL-1)变态率metamorphosisrate/%Ⅰ期 Ⅱ期2.000×105 11.67±7.64a 26.67±17.56a1.000×105 45.00±5.00b 80.00±5.00b0.500×105 88.33±2.89c 88.33±12.58b0.250×105 91.67±2.89c 95.00±5.00b0.125×105 91.67±2.89c 86.67±12.58b0(对照) 91.67±5.78c 85.00±5.00b
2.3 不同密度裸甲藻对轮虫数量的影响
从表3可见:96h时,随着裸甲藻初始密度的增加,轮虫数量减少;低密度组轮虫数量最多,为(41.67±5.31)ind.,与空白组有显著性差异 (P<0.05);中密度组轮虫数量次之,为 (40.67± 17.67)ind.,与空白组有显著性差异 (P<0.05);高密度组轮虫数量最少,为 (4.67±2.89)ind.,与空白组无显著性差异 (P>0.05);以上各组轮虫数量均显著低于小球藻组 (P<0.05)。
表3 轮虫在不同密度裸甲藻下的数量变化
Tab.3 Quantity of rotifer Brachionus plicatilis under different densities of alga Gymnodinium sp. ind.
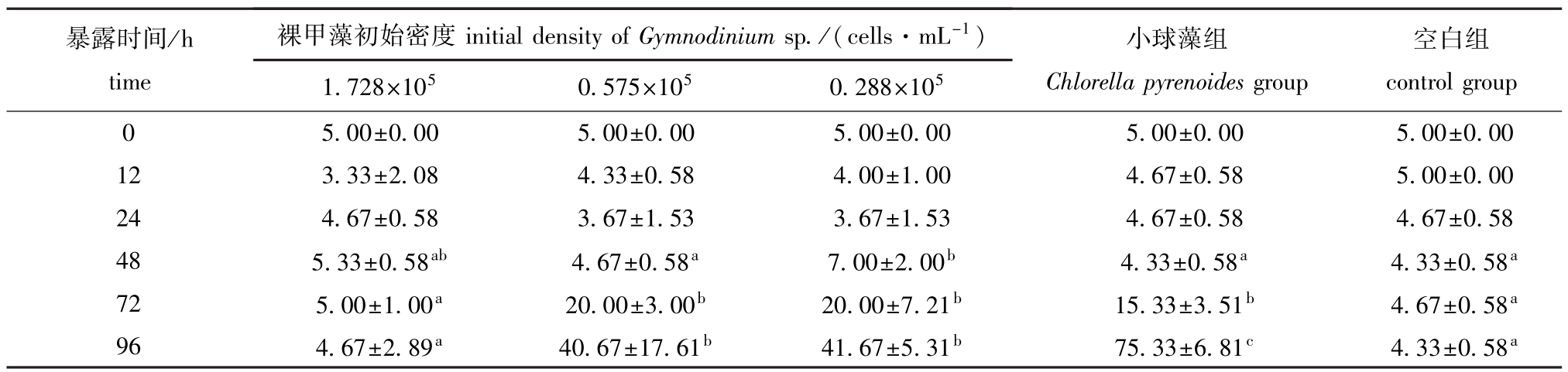
注:同行中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同
Note:Themeans with different letters within the same line are significant differences at the 0.05 probability level,and themeans with the same letters within the same line are not significant differences,et sequentia
暴露时间/h time裸甲藻初始密度initial density of Gymnodinium sp./(cells·mL-1)空白组00±0.00 12 3.33±2.08 4.33±0.58 4.00±1.00 4.67±0.58 5.00±0.00 24 4.67±0.58 3.67±1.53 3.67±1.53 4.67±0.58 4.67±0.58 48 5.33±0.58ab 4.67±0.58a 7.00±2.00b 4.33±0.58a 4.33±0.58a72 5.00±1.00a 20.00±3.00b 20.00±7.21b 15.33±3.51b 4.67±0.58a96 4.67±2.89a 40.67±17.61b 41.67±5.31b 75.33±6.81c 4.33±0.58 controlgroup 0 5.00±0.00 5.00±0.00 5.00±0.00 5.00±0.00 5. 1.728×105 0.575×105 0.288×105小球藻组Chlorella pyrenoides group a
2.4 不同密度异冒藻对轮虫数量的影响
从表4可见:96h时,随着异冒藻密度的增加,轮虫数量减少;低密度组轮虫数量最多,为(26.33±12.01)ind.,与空白组有显著性差异(P<0.05);中密度组轮虫数量次之,为(5.00±6.08)ind.,与空白组无显著性差异(P>0.05);高密度组轮虫全部死亡;以上各组轮虫数量均显著低于小球藻组(P<0.05)。
表4 轮虫在不同密度异冒藻下的数量变化
Tab.4 Quantity of rotifer Brachionus plicatilis under different densities of alga Heterocapsa sp. ind.
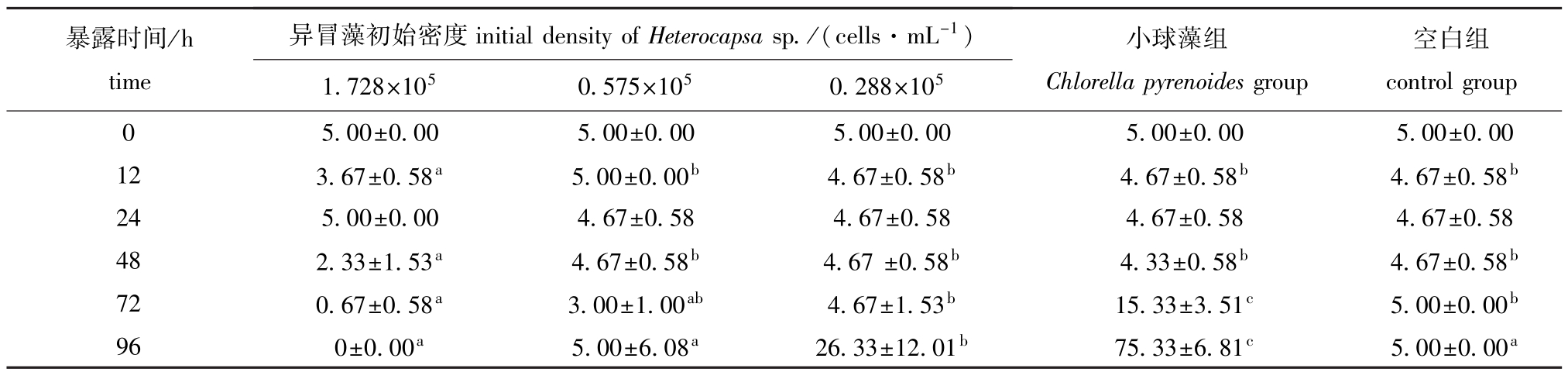
暴露时间/h time异冒藻初始密度initial density of Heterocapsa sp./(cells·mL-1)空白组00±0.00 12 3.67±0.58a 5.00±0.00b 4.67±0.58b 4.67±0.58b 4.67±0.58b24 5.00±0.00 4.67±0.58 4.67±0.58 4.67±0.58 4.67±0.58 48 2.33±1.53a 4.67±0.58b 4.67±0.58b 4.33±0.58b 4.67±0.58b72 0.67±0.58a 3.00±1.00ab 4.67±1.53b 15.33±3.51c 5.00±0.00b96 0±0.00a 5.00±6.08a 26.33±12.01b 75.33±6.81c 5.00±0.00 controlgroup 0 5.00±0.00 5.00±0.00 5.00±0.00 5.00±0.00 5. 1.728×105 0.575×105 0.288×105小球藻组Chlorella pyrenoides group a
2.5 不同密度裸甲藻对轮虫产卵量的影响
从表5可见:在中、高密度裸甲藻组中,轮虫的初次产卵时间、初次产卵量无显著性差异 (P>0.05),但小球藻组的初次产卵量明显高于其他各组 (P<0.05);96h时,随着裸甲藻初始密度的减小,轮虫产卵量增加,低密度组轮虫产卵量最多,为 (47.00±14.73)ind.,中密度组轮虫产卵量次之,为 (32.00±17.00)ind.,高密度组轮虫产卵量最少,为 (4.67±1.53)ind.,空白组产卵量为0,且中、低密度组的产卵量显著高于高密度组(P<0.05);24、72、96h时,以上各组轮虫产卵量均显著低于小球藻组 (P<0.05)。
表5 轮虫暴露在不同密度裸甲藻下的产卵量
Tab.5 Egg number of rotifer Brachionus plicatilis at different densities of alga Gymnodinium sp. ind.
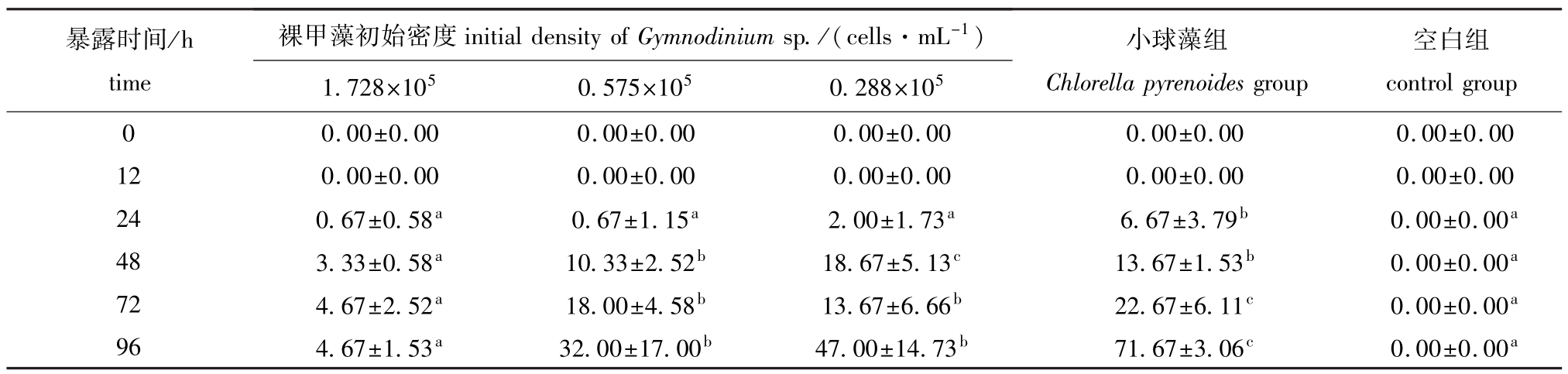
暴露时间/h time裸甲藻初始密度initialdensityofGymnodiniumsp./(cells·mL-1)空白组00±0.00 12 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 24 0.67±0.58a 0.67±1.15a 2.00±1.73a 6.67±3.79b 0.00±0.00a48 3.33±0.58a 10.33±2.52b 18.67±5.13c 13.67±1.53b 0.00±0.00a72 4.67±2.52a 18.00±4.58b 13.67±6.66b 22.67±6.11c 0.00±0.00a96 4.67±1.53a 32.00±17.00b 47.00±14.73b 71.67±3.06c 0.00±0.00 controlgroup 0 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0. 1.728×105 0.575×105 0.288×105小球藻组Chlorella pyrenoides group a
2.6 不同密度异冒藻对轮虫产卵量的影响
从表6可见:24h时,在不同密度异冒藻组中,轮虫的初次产卵时间和初次产卵量无显著差异(P>0.05),但小球藻组的初次产卵量明显高于其他各组 (P<0.05);随着异冒藻的初始密度的减小,轮虫产卵量增加,96h时,低密度组轮虫的产卵量最多,为 (7.67±4.93)ind.,中密度组轮虫产卵量次之,为 (2.67±2.08)ind.,高密度组轮虫产卵量为0;在各个时间段,以上各组轮虫产卵量均显著低于小球藻组 (P<0.05)。
表6 轮虫暴露在不同密度异冒藻下的产卵量
Tab.6 Egg number of rotifer Brachionus plicatilis at different densities of alga Heterocapsa sp. ind.
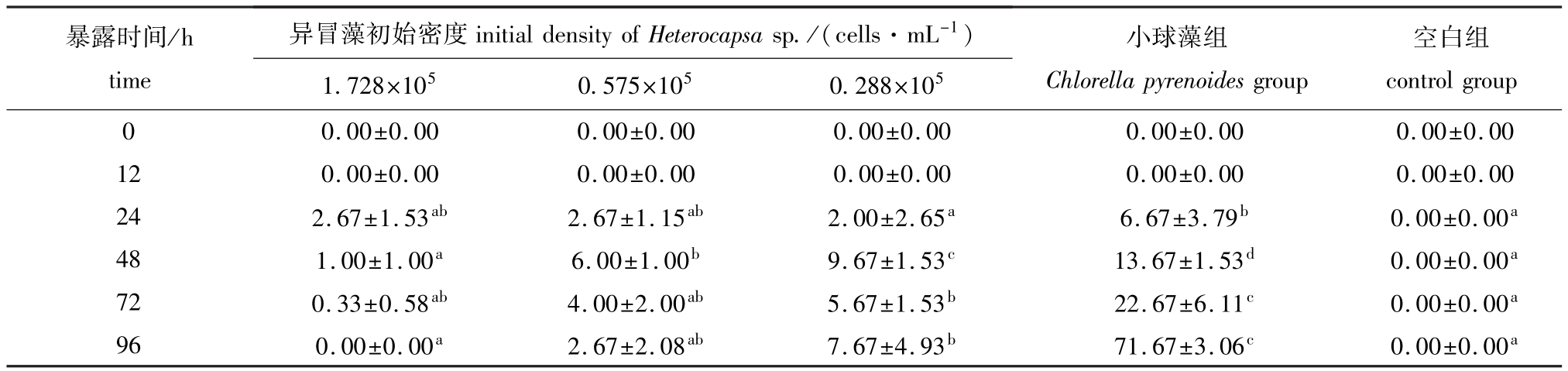
暴露时间/h time异冒藻初始密度initialdensityofHeterocapsasp./(cells·mL-1)空白组00±0.00 12 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 24 2.67±1.53ab 2.67±1.15ab 2.00±2.65a 6.67±3.79b 0.00±0.00a48 1.00±1.00a 6.00±1.00b 9.67±1.53c 13.67±1.53d 0.00±0.00a72 0.33±0.58ab 4.00±2.00ab 5.67±1.53b 22.67±6.11c 0.00±0.00a96 0.00±0.00a 2.67±2.08ab 7.67±4.93b 71.67±3.06c 0.00±0.00 controlgroup 0 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0. 1.728×105 0.575×105 0.288×105小球藻组Chlorella pyrenoides group a
2.7 不同轮虫培养密度下裸甲藻生物量的变化
从图3可见,各轮虫密度组与对照组相比,裸甲藻生物量均呈下降趋势,24h时下降最为明显,轮虫投放最小密度 (7.5ind./mL)时,裸甲藻生物量为2.87mg/L,与对照组 (生物量为16.64 mg/L)相比有显著性差异 (P<0.05)。
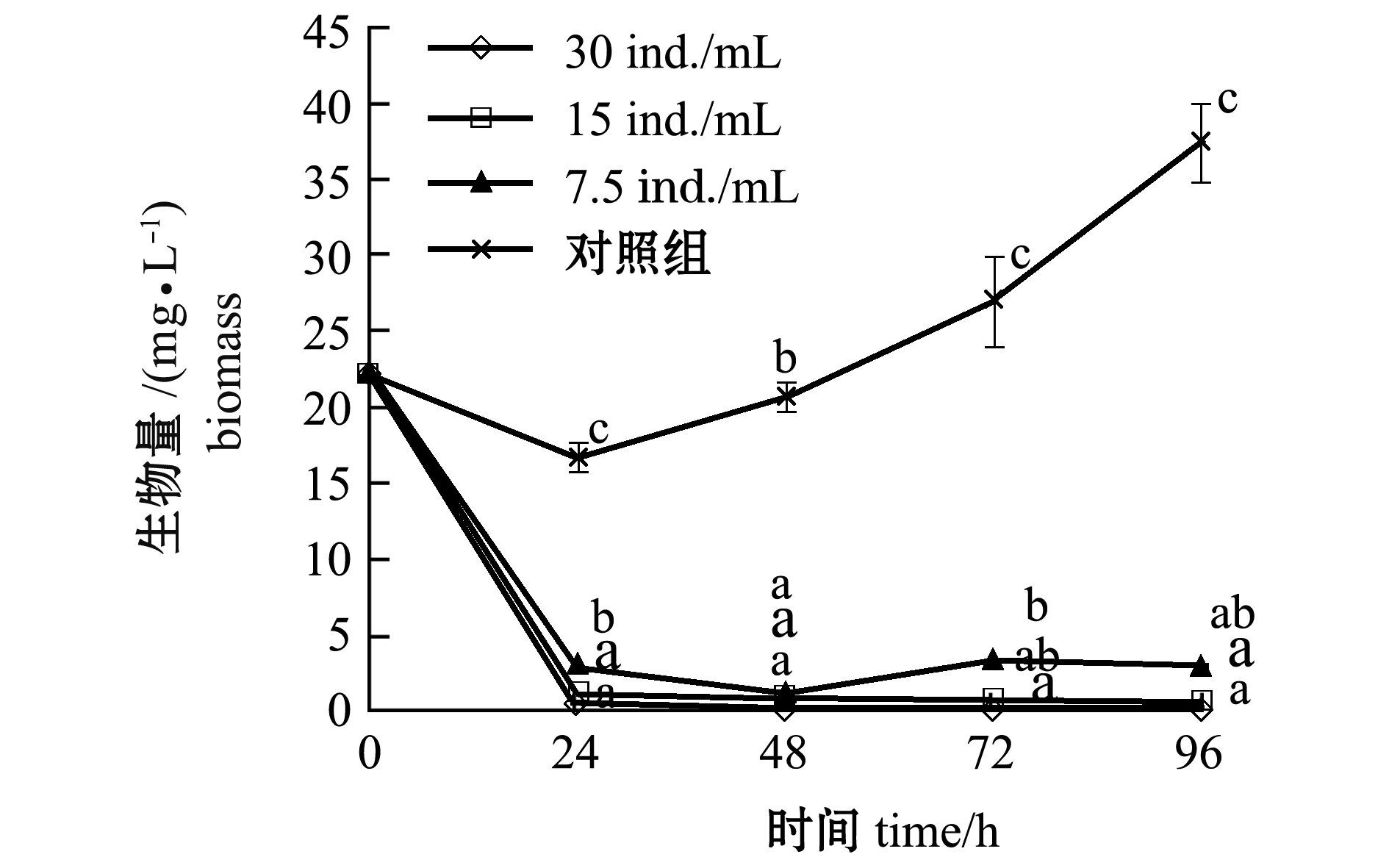
图3 不同轮虫培养密度下裸甲藻生物量的变化
Fig.3 Changes in biomass of alga Gymnodinium sp. under different rotifer culture densities
注:标有不同小写字母者表示相同时间下不同密度组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同
Note:Themeanswith different letterswithin the same time in different density group are significant differences at the 0.05 probability level,and themeans with the same letters are not significant differences,et sequentia
2.8 不同轮虫培养密度下异冒藻生物量的变化
从图4可见:轮虫投放密度为60ind./mL时,异冒藻生物量呈下降趋势,24h时,异冒藻生物量下降最快,由4.32mg/L减少到1.93mg/L,与对照组 (4.51mg/L)相比有显著性差异 (P<0.05),24h后其生物量缓慢下降;而其他轮虫密度组异冒藻的生物量整体呈上升趋势。
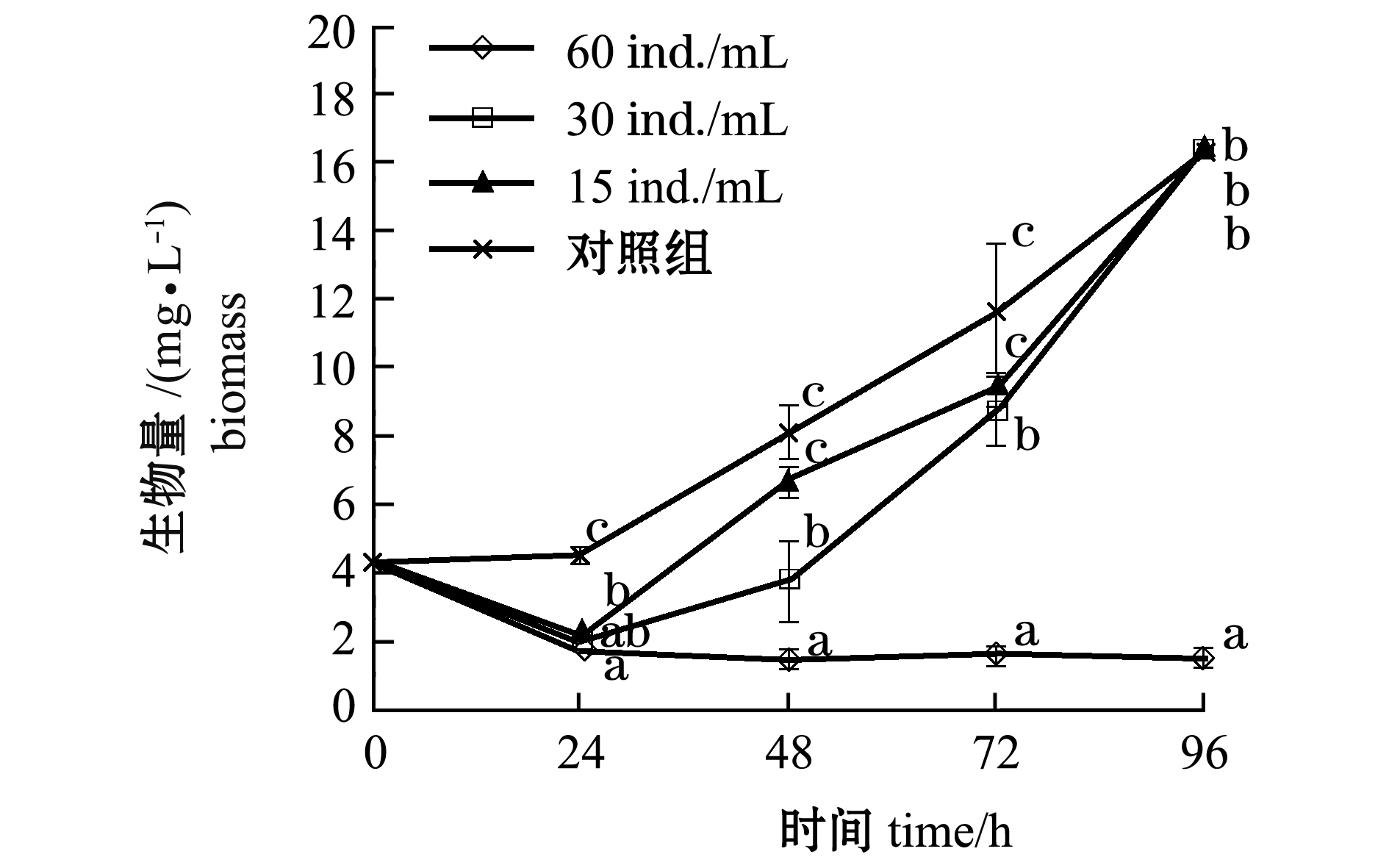
图4 不同轮虫培养密度下异冒藻生物量的变化
Fig.4 Changes in biomass of alga Heterocapsa sp.under different rotifer culture densities
3.1 有害藻对中华绒螯蟹溞状幼体存活及变态的影响
在养殖生产中,养殖池塘很容易引起有害藻爆发,从而危害养殖动物。2008年8月3日,三角洲分公司C16虾池 (4669m2)水色土黄,异冒藻生物量达到140mg/L,导致池中日本对虾大量死亡;2012年,三角洲分公司C区15#蟹苗池发生异冒藻赤潮,异冒藻生物量达到70mg/L,最后该池产量只有平均产量的1/4。本试验结果也表明,两种有害藻均对中华绒螯蟹溞状幼体的存活和变态有影响,且随着藻密度的增大,对溞状幼体的毒性也明显增强。有害藻毒素的来源可能是溞状幼体摄食了本身具有毒性的藻,也可能是藻分泌到水体中的胞外物质。裸甲藻的产毒机制非常复杂,其毒素可能来源于细胞内部或细胞表面,也可能是次生代谢物质[8]。宋娴丽等[9]研究赤潮异湾藻对牙鲆早期发育的影响时发现,赤潮异弯藻表面存在一层多糖类分子,这种多糖蛋白在鱼腮表面的累积导致鱼类死亡。有害赤潮藻毒素也可能是一种细胞分泌的胞外物质,它在细胞内合成并分泌于细胞表面或释放到水体中[10]。本试验结果表明,两种有害藻对中华绒螯蟹溞状幼体各个发育时期的变态率影响不同,在一定范围内,对Ⅰ、Ⅱ期溞状幼体有明显的毒害作用,而对Ⅲ、Ⅳ、Ⅴ期溞状幼体的毒害作用较小,这可能是由于Ⅰ、Ⅱ期溞状幼体个体小,抵抗力比较弱,而Ⅲ、Ⅳ、Ⅴ期溞状幼体个体变大,抵抗力也增强的原因,Zhao等[11]在研究不同发育阶段中华绒螯蟹对氨氮的耐受性时发现,随着溞状幼体的变态发育,幼体对氨氮的耐受性提高,这与本研究结果同理。
3.2 有害藻对轮虫生存和繁殖的影响
本试验结果表明,两种藻对轮虫的繁殖虽然都有影响,但是在藻浓度较低的情况下轮虫仍然可以挂卵并繁殖,摄食效果试验也证明,在有害藻密度较低时,可以通过足量密度的轮虫摄食来控制其生长。据报道,轮虫所摄食饵料的最大直径为22~30 μm,以15μm以下最为理想[12]。本试验中的两种藻粒径均小于15μm,在轮虫的可摄食范围内。当水体中有害藻的密度较小,其产生的毒素尚未危及轮虫生存时[10],轮虫可以通过摄食的方式抑制有害藻繁殖。谢志浩等[12]在研究塔玛亚历山大藻对褶皱臂尾轮虫生活史特征的影响中发现,在不同亚历山大藻密度下,褶皱臂尾轮虫维持了一定的种群增长。王丽平等[13]研究表明,东海原甲藻在密度为1×104~3×104cells/mL时,轮虫能够以其为食并进行生长繁殖。另外,也有利用其他饵料生物来摄食有害藻类的研究,如在低藻密度条件下,卤虫幼体能以双胞旋沟藻为食并维持其生命 ,孙雷等[15]也发现了桡足类刺尾纺锤水蚤摄食赤潮生物海洋原甲藻。在生产中笔者也曾经尝试用轮虫来防治有害藻,如2012年5月,三角洲分公司的3个苗池出现异冒藻,由于及时投放轮虫 (投放密度为1.3×104ind./L),异冒藻得到了有效控制。在中华绒螯蟹生态育苗前期,轮虫又是蟹苗的主要饵料,利用这一食物链关系将这种生物防控方法应用到生态蟹苗的实际生产中会取得很好的效果。
在本试验中还发现,当两种害藻密度 (数量)相同时,裸甲藻组的轮虫数量和产卵量均高于异冒藻组,而且裸甲藻个体较大,其生物量大于异冒藻,这充分说明了后者对轮虫的数量和产卵量影响较大,即生物量较小的异冒藻其毒性反而较大。这可能是不同种间的差异造成的。
参考文献:
[1]吴玉霖,周成旭.甲藻赤潮的海洋环境危害及其防治[J].海洋环境科学,1997,16(4):59-63.
[2]张青田.中国海域赤潮发生趋势的年际变化[J].中国环境监测,2013,29(45):98-102.
[3]徐永健,李德尚,王伟良,等.海水养殖池海洋原甲藻水华前后水化条件的变化[J].海洋湖沼通报,2000(1):41-46.
[4]林元烧.有毒甲藻——塔玛亚历山大藻在厦门地区虾塘引起赤潮[J].台湾海峡,1996,15(1):16-18.
[5]于建华,孙俭,王君军.刺参池塘生态育苗技术[J].水产科技情报,2013,40(1):11-14.
[6]吴旭干,成永旭,南天佐,等.土池低盐度水体河蟹生态育苗试验[J].淡水渔业,2006,36(6):49-53.
[7]谢玺,赵文.刺参养殖池塘围隔环境特征及生态育苗的初步研究[J].大连海洋大学学报,2013,28(6):589-596.
[8]宋伦,宋广军,王年斌,等.黄渤海贝毒机理及产毒藻类的研究现状[J].水产科学,2013,32(7):428-434.
[9]宋娴丽,孙耀,张前前,等.赤潮异弯藻对牙鲆早期发育的影响[J].海洋水产研究,2005,26(2):26-30.
[10]周文礼,肖慧,王悠,等.3种赤潮藻对褶皱臂尾轮虫的急性毒性效应[J].环境科学,2008,19(11):3148-3152.
[11] Zhao JH,Lam T J,Guo JY,et al.Acute toxicity of ammonia to the early stage-larvae and juveniles of Eriocheir sinensis H. Milne-Edwards,1853(Decapoda:Grapsidae)reared in the laboratory[J].Aquaculture Res,1997,28(7):517-525.
[12] 谢志浩,肖慧,蔡恒江,等.赤潮藻塔玛亚历山大藻对褶皱臂尾轮虫生活史特征的影响[J].应用生态学报,2007,18(12): 2865-2869.
[13] 王丽平,颜天,谭志军,等.塔玛亚历山大藻和东海原甲藻对褶皱臂尾轮虫种群数量的影响[J].应用生态学报,2003,14 (7):1151-1155.
[14] 吴霓,江涛,江天久,等.珠江口海域双胞旋沟藻赤潮对卤虫幼体、鱼苗和虾苗的急性毒性[J].水产学报,2013,37(9): 1325-1333.
[15] 孙雷,祀桑.桡足类刺尾纺锤水蚤(Acartia spinicauda)对赤潮生物海洋原甲藻(Prorocentrum micans)摄食的研究[J].盛南大学学报,1993,14(3):74-79.
Effects of two harm ful species algae on reproduction of rotifer Brachionus plicatilis and metamorphosis of zoea of Chinesem itten handed crab Eriocheir sinensis
Abstract:The toxicity and effects of two harmful species algae Heterocapsa sp.and Gymnodinium sp.on reproduction of rotifer Brachionus plicatilis and metamorphosis of zoea were studied in Chinesemitten handed crab Eriocheir sinensis at various developmental periods of the zoea at water temperature of 22-25℃.The results showed that there wasmetamorphosis rate of 13.33%in the zoeaⅠ and zoeaⅡ at Gymnodinium sp.density of 2.000×105cells/mL,without significant toxicity of Gymnodinium sp.to zoeaⅢafterwards.The zoea Ihadmetamorphosis rate of 11.67%at Heterocapsa sp.density of2.000×105cells/mL.No eggswere observed in the rotifer cultured at the two alga density of1.728×105cells/mLwithin 96 hours.At the two alga density of0.288×105cells/mL,however, there were as high 5 times and 8 times as the initial number of the rotifer within 96 hours.The findings indicated that the two algae impacted on survival and development of early zoea of Chinesemitten handed crab,and thathigher density rotifers controlled the growth of harmful algae by feeding.
Keywords:Brachionus plicatilis;larva of Eriocheir sinensis;Heterocapsa sp.;Gymnodinium sp.
中图分类号:S968
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2015.04.002
文章编号:2095-1388(2015)04-0351-06
收稿日期:2014-10-03
基金项目:国家 “863”计划项目 (2012AA10A409