肠道消化吸收相关因子对大黄鱼生长速度的影响
李英英1、2,陈曦2,李素一2,李盼1、2,李艳虹2,宋铁英2
(1.福建农林大学 动物科学学院,福建 福州 350002;2.福建省农科院生物技术研究所,福建 福州 350003)
摘要:为了分析大黄鱼Pseudosciaena croce在人工养殖过程中,常常出现同一批次鱼苗在相同养殖条件下个体差异明显、部分鱼生长速度缓慢的原因,试验选取福州市连江县某鱼场同一网箱内同一批次投放的鱼苗,根据个体大小分组,体质量为60~100 g的为生长正常组,体质量为10~40 g的为生长缓慢组,在相同养殖条件下饲喂300 d,试验结束时,采用消化酶活性检测、荧光定量PCR和石蜡组织切片3种方法,分别测定大黄鱼肠道的消化酶活性和菌群数量,观察肠道的组织形态学变化并进行对比分析。结果表明:两组鱼的各种消化酶活性均无显著性差异(P>0.05);在生长缓慢组鱼肠道内,酵母菌和弧菌等兼性厌氧菌数量高于生长正常组,且两组之间酵母菌数量有显著性差异(P<0.05);生长正常组鱼肠道绒毛密集、修长且完整,而生长缓慢组鱼肠道绒毛稀疏,有大量损伤,前肠上皮内淋巴细胞数量显著高于生长正常组(P<0.05)。研究表明,大黄鱼鱼群生长速度与肠道菌群及肠绒毛状态有关,而与肠道消化酶活性无关。
关键词: 大黄鱼;生长差异;肠道菌群;组织形态学
大黄鱼Pseudosciaena croce隶属于硬骨鱼纲Osteichthyes、鲈形目Perciformes、石首鱼科Sciaenida、黄鱼属Pseudosciaena,有较高的营养和药用价值[1],是福建省主要经济鱼类之一,全省年产量可达10万t [2]。随着近几年大黄鱼人工育苗技术的不断成熟,海水网箱养殖大黄鱼得到迅速发展。与此同时,饲料及营养问题已日益成为其进一步发展的限制性因素。
在生产中,常常出现同一批大黄鱼在鱼苗批次、饲喂条件、生活环境等相同的情况下,个体差异明显,部分鱼苗生长速度缓慢,甚至成为“僵苗”现象。因此,分析大黄鱼的消化和吸收特点,建立鱼体营养状态评价体系,可以为优化养殖结构,有针对性地研制营养全面、易于吸收的饲料提供依据。研究表明,鱼体消化系统中,肠道的菌群状况、消化酶活性和组织学变化对于研究营养物质代谢和鱼苗营养状态至关重要[3-4]。
本研究中,以上述指标作为评价依据,分析引起大黄鱼种群个体生长性状差异的原因,旨在为进一步对大黄鱼的营养学研究和临床指导提供数据支持。
1 材料与方法
1.1 材料
试验用大黄鱼采自福州市连江县下屿某近海网箱养殖鱼场,所有鱼取自同一个网箱,由同一批鱼苗在相同的饲养条件下养殖300 d,所用饲料为冰鲜料。
荧光定量PCR(qPCR)所用SYBR Premix Ex Taq(Tli RnaseH Plus)试剂购自宝生物工程(大连)有限公司,所用特异引物设计按各参考文献所述设计(表1),由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 样品的采集 将大黄鱼按照体质量大小分成两组:组1,10~40 g为生长缓慢组;组2,60~100 g为生长正常组。从每组各取15尾大黄鱼,保存于冰盒中带回实验室用于肠道主要菌群数量及消化酶活性的测定;另从每组各取5尾鱼,立即取其肠道,并将肠道分成前、中、后三段,用体积分数为4%的甲醛固定,用于组织形态学观察。
1.2.2 肠道主要菌群数量的荧光定量PCR测定 从两组各取8尾鱼,无菌条件下连同内容物一起将鱼肠道取出,准确称取含有内容物的肠道200 mg,冰上研磨,对所得样品按照粪便基因组DNA提取试剂盒(天根生化科技(北京)有限公司)说明书方法提取DNA,以实时荧光定量PCR(qPCR)法测定肠道细菌总量及9种鱼类肠道常见菌数量。
1.2.3 肠道消化酶活性的测定 从两组各取7尾鱼,无菌条件下取其肠道,称重后连同内容物一起冰上研磨,对所得样品分别按照BCA法蛋白定量、淀粉酶(AMS)、脂肪酶(LPS)、胰蛋白酶、碱性磷酸酶(AKP)(酶标法)测试盒(均为南京建成生物工程研究所),以及鱼亮氨酸氨肽酶(LAP)酶联免疫分析试剂盒(上海科兴生物科技有限公司)说明书方法测定其肠道各种消化酶活性。
1.2.4 肠道组织形态学观察 取用甲醛固定24 h的两组鱼前、中、后肠道,用常规方法制作石蜡切片(5 μm),H.E染色后用中性树胶封片,在Motic SFC-11显微镜下观察并拍照。
数据采集时每组选取5张切片,每张切片中随机选取5根完整的绒毛,测量其杯状细胞数量和上皮内淋巴细胞数量,细胞数量用每100 μm绒毛中的细胞个数来表示[15]。
1.3 数据处理
试验数据用平均值±标准差表示。采用SPSS 16.0软件对试验数据进行单因子方差分析(One-way ANOVA),若各处理组之间差异达到显著水平后,则进行LSD多重比较,显著性水平设为0.05。
2 结果与分析
2.1 两组大黄鱼肠道菌群数量
以荧光定量PCR法检测肠道细菌总量及9种鱼类肠道常见菌的数量水平,结果显示,两组大黄鱼肠道中大肠杆菌、弧菌、酵母菌、芽孢杆菌和乳酸杆菌为优势菌群。生物统计分析显示:两组鱼的酵母菌数量有显著性差异(P<0.05),其他菌均无显著性差异(P>0.05);两组大黄鱼的肠球菌、嗜水气单胞菌、链球菌和葡萄球菌4种菌群数量较少,检测结果为阴性(表2)。
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2 两组大黄鱼肠道消化酶活性
从表3可见,两组大黄鱼肠道淀粉酶、脂肪酶、胰蛋白酶和碱性磷酸酶活性均无显著性差异(P>0.05),亮氨酸氨肽酶含量为阴性。
2.3 两组大黄鱼肠道组织形态学
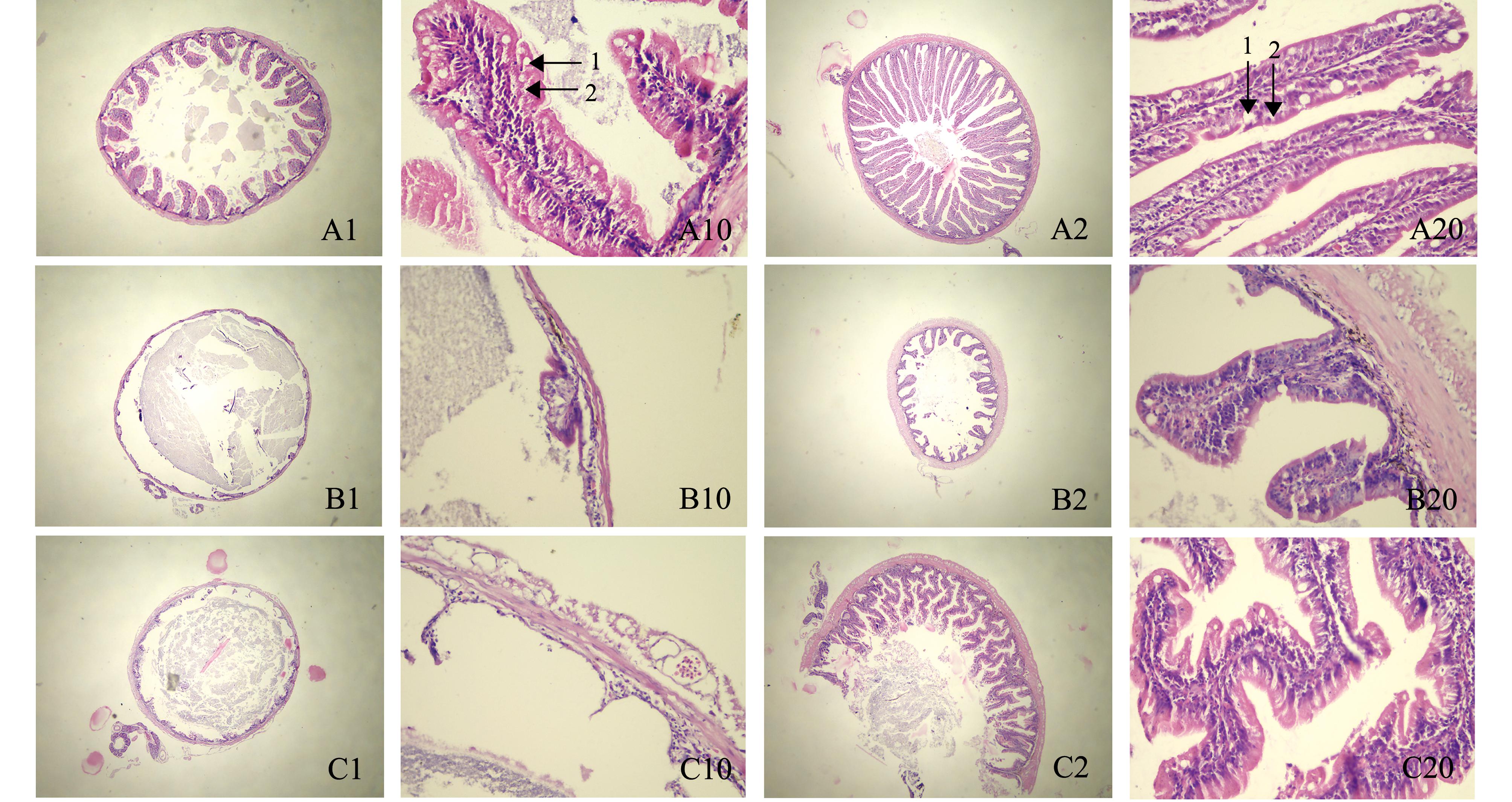
2.3.1 前肠 两组鱼前肠组织形态学观察显示,生长缓慢的组1中,大黄鱼的前肠绒毛稀疏、长度较短,且有损伤(图1-A1,图1-A10),而生长正常的组2,鱼的前肠绒毛纤长、紧密、排列整齐(图1-A2,图1-A20)。统计结果表明:两组大黄鱼前肠杯状细胞数量分别为(2.73±0.47)、(2.14±0.69)cells/100 μm,且组间无显著性差异(P>0.05);上皮内淋巴细胞数量分别为(8.07±1.48)、(3.13±0.88)cells/100 μm,且组间有显著性差异(P<0.05)。
2.3.2 中肠 组1鱼的中肠绒毛稀疏且很短,仅有很少的凸起,局部绒毛消失为平坦的肠管,有的部位肠管损伤严重,看不到完整绒毛(图1-B1,图1-B10);而组2鱼的中肠绒毛排列整齐,较为紧密,且完整度好(图1-B2,图1-B20)。由于组1肠道绒毛较少且损伤严重,该肠段上皮内淋巴细胞和杯状细胞数量无法统计。
2.3.3 后肠 组1鱼的后肠绒毛可看到大量损伤,有的样本中绒毛甚至严重脱落(图1-C1,图1-C10);而组2鱼的后肠绒毛生长状态良好,完整性好,数量较多,密度较大(图1-C2,图1-C20)。统计结果表明:两组大黄鱼后肠杯状细胞数量分别为(4.21±1.05)、(4.87±2.33)cells/100 μm,而上皮内淋巴细胞数量分别为(4.77±2.18)、(6.87±2.62)cells/100 μm,且组间均无显著性差异(P>0.05)。
3 讨论
3.1 两组大黄鱼肠道菌群数量的差异分析
肠道菌群的稳定存在是动物长期进化的结果,对机体免疫功能和营养吸收都有很重要的作用[16]。正常情况下,有益菌、条件致病菌和致病菌在体内是稳定存在的;当饵料或者生存环境发生改变时,会出现应激反应,肠道菌群出现大的波动,一些致病菌或者条件致病菌大量繁殖,影响机体健康,进而影响动物生长[17-18]。蒋长苗等[19]研究表明,患肠炎草鱼的肠道厌氧菌和需氧菌比例显著下降。本研究中,在对大黄鱼肠道菌群数量的检测时也发现,生长缓慢的组1鱼肠道内酵母菌和弧菌数量明显高于生长正常的组2,两组鱼之间酵母菌数量有显著性差异(P<0.05)。酵母菌属于机会致病菌,弧菌属于致病菌,两者都是兼性厌氧菌[20],组1鱼肠道内这两种菌的数量较高,意味着与组2相比,鱼肠道健康状况较差。由于两组鱼的鱼苗品质、生长条件等都相同。由此推测,造成该组鱼群生长缓慢的原因可能是在生长过程中鱼群遭受了一些应激,如饲料品质较差、生长环境改变等,其中一些鱼的免疫系统功能较强,可以很快地适应这些应激,而另一些鱼的免疫系统功能较弱,应激反应时肠道内一些致病菌和机会致病菌大量繁殖,影响了肠道菌群的正常平衡,进而影响了鱼肠道对食物的消化和吸收,导致鱼群生长缓慢。
3.2 两组大黄鱼肠道消化酶活性的差异分析
食物进入肠道后需要肠道消化酶的催化分解才能被机体吸收利用,因此,肠道消化酶活性也常被作为影响机体生长速率的指标之一[21-22]。在检测两组鱼的肠道消化酶活性时,亮氨酸氨肽酶活性检测结果为阴性,可能是因为该酶主要存在于血清中,而在消化道中存在量极少;两组鱼之间淀粉酶、脂肪酶、胰蛋白酶、碱性磷酸酶4种消化酶活性均无显著性差异(P>0.05)。由此推测,并不是由消化酶活性差异导致鱼群的生长受阻。
3.3 两组大黄鱼肠道形态的差异分析
鱼类对食物的消化吸收在整个肠道都有进行[18],一般鱼类肠道可分为前、中、后三段[23],前肠主要与消化吸收相关,中肠和后肠主要与免疫相关[24]。肠道对食物的消化吸收主要依赖于肠壁褶皱即绒毛[25],因此,可以从肠道的绒毛状态比较出两组鱼对食物的消化吸收能力[26]。
本研究中,通过对肠道切片显微观察发现,两组鱼肠道形态差异明显,生长正常的组2鱼肠壁完整,肌层较厚,绒毛修长且完整性好;而生长缓慢的组1鱼肠道肌层较薄,绒毛稀疏、较短,且有损伤,甚至在中肠仅能看到很少量的绒毛,很多部位绒毛消失,仅能看到平坦的肠腔,而且后肠肠壁严重损伤,大量绒毛脱落。上述结果表明,组2鱼肠道收缩蠕动能力更强[27],与食物的接触面积更大,能够更好地消化和吸收食物,对食物利用率更高。两组鱼间的显著差异还体现在前肠的上皮内淋巴细胞水平上,上皮内淋巴细胞数量的增加反映了组1鱼体前肠受外来刺激时出现的应激反应比组2强烈[28]。由此推测,造成鱼群生长缓慢的原因可能是在生长过程中如饲料品质[28-29]、饲料形态、投喂方式、生长环境[3]等因素对鱼体消化吸收系统造成应激,鱼体对这些应激的适应程度不同造成生长速度的差异。
参考文献:
[1] 吕峰,郑明锋,陆则坚.气调脱水技术对脱水大黄鱼品质影响的研究[J].农业工程学报,2004,20(6):190-193.
[2] 陈丽娇,郑明锋.大黄鱼海藻酸钠涂膜保鲜效果的研究[J].农业工程学报,2003,19(4):209-211.
[3] 王丽宏,叶元土,李爱琴,等.2种不同鱼类间生理生化指标及组织学观察的比较研究[J].饲料研究,2013(1):66-69.
[4] 魏广莲,徐刚春,顾若波,等.两种配合饲料对刀鲚幼鱼消化系统显微结构和功能的影响[J].大连海洋大学学报,2014,29(1):35-39.
[5] 赵兴青,杨柳燕,陈灿,等.基于不同引物的湖泊沉积物中细菌群落结构多样性的比较研究[J].南京大学学报:自然科学版,2008,44(3):289-296.
[6] 葛忠源,程安春,汪铭书,等.大肠杆菌属16S rDNA实时荧光定量PCR方法的建立及应用[J].中国兽医学报,2007,27(5):674-678.
[7] 刘泳.弧菌属16S核糖体RNA基因特异引物的设计优化及其在胶州湾海洋弧菌菌群结构分析中的应用[D].青岛:中国海洋大学,2005.
[8] Ke D J. Picard F, Martineau F,et al.Development of a PCR assay for rapid detection of enterococci[J].J Clin Microbiol,1999,37(11):3497-3503.
[9] Byun R,Nadkarni M A,Chhour K L.Quantitative analysis of diverse Lactobacillus species present in advanced dental caries[J]. J Clin Microbiol,2004,42(7):3128-3136.
[10] 耿佳靖,袁梁,鲁辛辛.18S rRNA基因序列分析在临床常见酵母样真菌鉴定中的应用[J].中华检验医学杂志,2009,32(6):644-648.
[11] Martineau F,Picard F J,Ke D,et al.Development of a PCR assay for identification of staphylococci at genus and species levels[J].J Clin Microbiol,2001,39(7):2541-2547.
[12] Gincym M,Yang J T,Lai C Y,et al.The occurrence of Bacillus species and their potential roles in fungus comb of Odontotermes formosanus (fungus growing black subterranean termite)[C]//Ecology of Soil Microorganisms:National Chung Hsing University,2011.
[13] Picard F J,Ke D,Boudreau D K,et al.Use of tuf sequences for genus-specific PCR detection and phylogenetic analysis of 28 streptococcal species[J].J Clin Microbiol,2004,42(8):3686-3695.
[14] 陈怀青,袁世山.嗜水气单胞菌HEC毒素基因的克隆及酶谱分析[J].中国兽医学报,1997,17(4):339-343.
[15] 黄峰,严安生,张桂蓉,等.大口鲇仔鱼消化道的组织学观察[J].华中农业大学学报,2000,19(1):59-63.
[16] 赵庆新,谭远德.鲤科鱼肠道菌分布及共生关系研究[J].中国预防兽医学报,2001,23(2):130-133.
[17] 温俊,孙笑非.水产动物肠道微生态调控研究进展[J].饲料研究,2009(9):68-70.
[18] 黄小丽,邓永强,汪开毓,等.香菇多糖对幼建鲤肠道菌群数量及非特异性免疫指标的影响[J].大连海洋大学学报,2013,28(4):29-33.
[19] 蒋长苗,鲍传和,马元山.草鱼肠道正常菌群与肠炎病原菌关系的初步研究[J].吉林农业大学学报,1992,14(l):55-58.
[20] 吕欣荣,肖克宇.鱼类肠道菌群的研究现状[J].江西水产科技,2008(2):12-18.
[21] Alvarez-Gonzalez C A,CervantesT M,Tovar R,et al.Development of digestive enzymes in California halibut Paralichthys californicus larvae[J].Fish Physiology and Biochemistry,2005,31:83-93.
[22] Comabella Y,Mendoza R,Aguilera C,et al.Digestive enzyme activity during early larval development of the Cuban gar Atractosteus tristoechus[J].Fish Physiology and Biochemistry,2006,32:147-157.
[23] 许宝红,王亚楠,肖调义,等.4种淡水经济鱼类消化系统的组织学比较[J].中国农学通报,2011,27(32):47-55.
[24] Press C M,Evensen Ø.The morphology of the immune system in teleost fishes[J].Fish and Shellfish Immunology,1999,9(4):309-318.
[25] 叶元土.长吻鮠和南方大口鲶胃肠道消化能力的研究[J].动物学研究,1997(3):305-313.
[26] 王子旭.锌硒互作对肉鸡肠黏膜结构及黏膜免疫相关细胞影响的研究[D].北京:中国农业大学,2003.
[27] Seiler C,Abrams J,Pack M.Characterization of zebrafish intestinal smooth muscle development using a novel sm22a-b promoter[J].Developmental Dynamics,2010,239:2806-2812.
[28] 孟庆显.海水养殖动物病害学[M].北京:中国农业出版社,1996:148.
[29] 雷霁霖.海水鱼类养殖理论与技术[M].北京:中国农业出版社,2005:813.
Influence of factors related to the intestinal digestion and absorption
on growth of cultured large yellow croaker Pseudosciaena crocea
LI Ying-ying1,2, CHEN Xi2, LI Su-yi2, LI Pan1,2, LI Yan-hong2, SONG Tie-ying2
(1.College of Animal Science, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 2.Institute of Biotechnology, Fujian Academy of Agricultural Science, Fuzhou 350003, China)
Abstract: The activities of digestive enzymes and bacterial account were investigated in intestine by enzyme analysis and by Quantitative Real-time PCR (qPCR), and the differences in intestinal morphology was histologically observed in large (body weight of 60-100 g) and small (body weight of 10-40 g) yellow croaker Pseudosciaena crocea sampled from 300 days old fishes cultured in cages in a farm in Lianjiang county, Fuzhou, to explore the reason why the same patch fish in the same cage showed different growth under the same condition. The results showed that no significant differences in the activities of digestive enzymes were found between the large and small large yellow croaker groups (P>0.05). However, the quantity of facultative anaerobic bacteria including Vibrio and Saccharomycetes cerevisiae was higher in the intestine in the smaller large yellow croaker group than that in the larger one group, significant differences in the quantity of S.cerevisiae between the two groups (P<0.05). Lower villus density was observed in the intestine of the smaller-sized fish group compared to the larger-sized one with dense, slender and integrity villus. There was significant more lymphocytes in the anterior intestine in the smaller-sized fish group than that in the larger-sized one(P<0.05). The findings demonstrated that the growth rate of the fish was correlated to the microbiology and the state of villus rather than the activities of digestive enzymes.
Key words: Pseudosciaena crocea; difference in growth; intestinal flora; histomorphology
通信作者: 宋铁英(1963—), 女, 研究员。E-mail:tieyingsong@163.com
作者简介: 李英英(1987—), 女, 硕士研究生。E-mail:liyingying80@126.com
基金项目: 国家“星火计划”项目(2013GA720004);“十二五”农村领域国家科技计划项目(2013BAD10B03-2)
收稿日期: 2014-07-17
中图分类号:S965.3
文献标志码:A
文章编号:2095-1388(2015)03-0271-05
DOI:10.16535/j.cnki.dlhyxb.2015.03.007